Координационная химия, 2021, T. 47, № 1, стр. 37-47
4-Фенил-5-(2-тиенилметил)-2,4-дигидро-3H-1,2,4-триазол-3-селон и 3,3'-ди[4-фенил-5-(2-тиенилметил)-4H-1,2,4-триазолил]диселенид: синтез, структура и биоцидные свойства
В. К. Османов 1, *, Е. В. Чипинский 1, Р. К. Аскеров 2, М. М. Гришина 3, В. Н. Хрусталев 3, 4, 5, А. С. Перегудов 6, А. О. Чижов 5, О. Н. Смирнова 7, А. В. Борисов 1
1 Нижегородский государственный технический университет им. Р.Е. Алексеева
Нижний Новгород, Россия
2 Бакинский государственный университет
Баку, Азербайджан
3 Российский университет дружбы народов
Москва, Россия
4 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
5 Институт органической химии им. Н.Д. Зелинского РАН
Москва, Россия
6 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
7 Национальный исследовательский Нижегородский государственный университет
им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: tantalovk@yandex.ru
Поступила в редакцию 11.03.2020
После доработки 29.04.2020
Принята к публикации 04.05.2020
Аннотация
Синтезировано три новых селенорганических соединения – N-фенил-2-(2-тиенилацетил)гидразинкарбоселеноамид (I), 4-фенил-5-(2-тиенилметил)-2,4-дигидро-3H-1,2,4-триазол-3-селон (II) и 3,3'-ди[4-фенил-5-(2-тиенилметил)-4H-1,2,4-триазолил] диселенид (III), два из которых (II) и (III) охарактеризованы методом РСА (CIF files CCDC № 1956602 (II) и 1956603 (III)). Соединение II кристаллизуется в моноклинной сингонии, пр. гр. P21/n, с двумя кристаллографически независимыми молекулами А и В, представляющими различные конформеры относительно вращения вокруг связи NTrz–CTrz–C(H2)–CTph, где Trz = триазол и Tph = тиофен (гош-А (51.4(3)°), и цис-B (4.2(4)°)). В кристалле соединения II молекулы А и В образуют цепочки вдоль кристаллографической оси a за счет прочных водородных связей N–H···Se. Далее цепочки связаны в трехмерный каркас посредством межмолекулярных невалентных взаимодействий Se···S (3.3857(11) Å). Диселенид III имеет типичную вследствие аномерного эффекта гош-конформацию заместителей при связи Se–Se (торсионный угол СSeSeС 83.5(4)°), стабилизированную слабой внутримолекулярной водородной связью С–H···π. В кристалле соединения III молекулы образуют цепочки вдоль кристаллографической оси b за счет межмолекулярных невалентных взаимодействий Se···π(C–C) 3.404(6) и 3.458(12), Se···Se 3.8975(11) и S···N (3.250(5) Å. Изучена бактерицидная и фунгицидная активность полученных соединений.
Селенсодержащие гетероциклические соединения вызывают значительный интерес ученых-химиков и фармацевтов благодаря наличию у них широкого спектра биологической активности, включающего противоопухолевые, кардиопротекторные, антибактериальные, фунгицидные и противовирусные эффекты [1–4]. Однако химия селенорганических соединений недостаточно развита по сравнению с химией сераорганических соединений из-за нестабильности многих Se-содержащих соединений [5] и отсутствия доступных реагентов – прекурсоров.
Изоселеноцианаты известны как универсальные строительные блоки для получения различных селеносодержащих гетероциклических селенорганических соединений, в частности производных 1,2,4-триазол-3-селона [6–8].
Известны различные производные 1,2,4-триазол-3-селонов, содержащие в зависимости от метода получения арильные, амино-, алкоксигруппы в положении 5 и арильные и ацильные заместители в положениях 1, 2 и 4 [9, 10]. Однако 1,2,4-триазол-3-селоны, имеющие в положениях 4 и 5 только алкильные, арильные и гетероарильные заместители, в отличие от аналогичных 1,2,4-триазол-3-тионов, до настоящего времени были почти не известны. Ранее синтез нескольких таких 1,2,4-триазол-3-селонов был описан в [11]. Диселениды, полученные на основе таких триазол-3-селонов в литературе вообще не описаны.
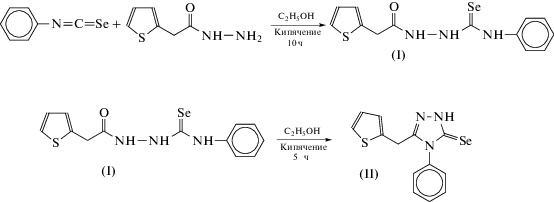
Мы провели реакцию фенилизоселеноцианата с гидразидом 2-тиофенуксусной кислоты в этаноле и получили по аналогии с работой [11] замещенный селеносемикарбазид (I), который при кипячении в 10%-ном водном растворе NaOH циклизовался в 1,2,4-триазол-3-селон (II).
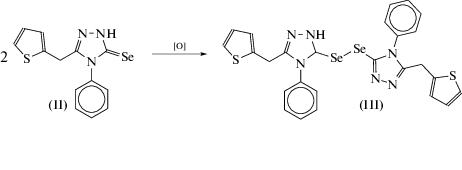
Соединение II в процессе перекристаллизации в кипящем этаноле частично окисляется до соответствующего диселенида III.
Строение полученных соединений доказано методами РСА, спектроскопии ЯМР 1H, 13С и 77Se, масс-спектрометрии высокого разрешения, данными элементного анализа. Проведена оценка бактерицидных и фунгицидных свойств полученных веществ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали реагенты NaOH, HCl, квалификации не ниже “х.ч.”, гидразид 2-тио-фенуксусной кислоты (Acros Organics, Бельгия) без дополнительной очистки. Используемый фенилизоселеноцианат получали по методике [12].
Температуру плавления (разложения) определяли в вакуумированных запаянных капиллярах (приводятся без поправки). ИК-спектры образцов в таблетках KBr (соотношение вещество : КBr = = 1 : 200) регистрировали на приборе Shimadzu IR Prestige-21 в области 4000–400 см–1. Спектры ЯМР 1H записывали на спектрометре Bruker Avance™ 500 с рабочей частотой 500 МГц в режиме внутренней стабилизации полярно-резонансной линии 2Н в CDCl3 при 20°С. Отнесение сигналов проводили с использованием градиентной 2D-спектроскопии – протон-протонной корреляции (GE-COSY), 1H–13C-корреляции (HSQC) и гетероядерной корреляции (НМВС). Химические сдвиги указаны в миллионных долях (м.д.) относительно тетраметилсилана в качестве внутреннего стандарта. Спектры ЯМР 13C записывали на спектрометре Bruker Avance™ 500, спектры ЯМР 77Se – на спектрометре Bruker Avance™ 500 (с рабочей частотой 125.72, 95.38 МГц соответственно). Масс-cпектры ИЭР ВР регистрировали на приборе Bruker micrOTOF II. Измерения выполняли на положительных ионах (напряжение на капилляре 4500 В). Диапазон сканирования (m/z) 50–3000, калибровка – внутренняя (Agilent Tuning Mix, Agilent), значения m/z приведены для наиболее интенсивного пика изотопного кластера. Вещества в виде растворов в ацетонитриле вводили с помощью шприца, скорость потока – 5 мкл/мин. Газ-распылитель – азот (4 л/мин), температура интерфейса 180°С.
Синтез N-фенил-2-(2-тиенилацетил)гидразинкарбоселеноамида (I). Раствор фенилизоселеноцианата (1.821 г, 10 ммоль) в этаноле (20 мл) добавляли к кипящему раствору гидразида 2-тио-фенуксусной кислоты (1.562 г, 20 ммоль) в этаноле (30 мл). Реакционную смесь выдерживали при температуре кипения в течение 10 ч и охлаждали до комнатной температуры. Выпавший осадок промывали этанолом, а затем диэтиловым эфиром. Выход светло-коричневого порошка 1.895 г (56%). Тпл = 144–145°С.
Масс-спектр ЭРИ ВР (m/z): найдено 340.0017; вычислено для [C13H13N3OSSe + H]+ 340.0020. ИК-спектр (ν, см–1): 3360, 3289 (NH), 1690 (C=O), 1593 (С–С, Ph), 694 (С–С, Tph). ЯМР 1H (DMSO-d6; 500 MГц; 298 K; δ, м.д.): 10.24, 10.07, 10.02 (3 уш.с., NH), [7.38 (м., 1H), 6.98 (д., 2H, J = 40.2 Гц) Tph], [7.37 (м., 4H), 7.23 (м., 1Н) Ph)], 3.76 (c., 2H, CH2Tph). ЯМР 13C (DMSO-d6; 125.72 MГц; 298 K; δ, м.д.): 179.34 (C=O), 169.28 (C=Se), 140.20 (1C, Ph), 136.70 (1C, Tph), 127.39 (2CH, Tph), 125.61 (1CH, Tph), 128.53, 127.07, 127.05, 126.44 (5CH, Ph), 34.91(CH2Трh). ЯМР 77Se (DMSO-d6; 95.38 MГц; 298 K; δ, м.д.): 183.4 (уш.с., ν1/2 = 85.2 Гц).
Синтез 4-фенил-5-(2-тиенилметил)-2,4-дигидро-3H-1,2,4-триазол-3-селона (II). К 100 мл 10%-ного водного раствора гидроксида натрия прибавляли I (1.692 г, 10 ммоль) и нагревали до кипения в течение 5 ч. После охлаждения до комнатной температуры реакционную смесь фильтровали от нерастворившихся частиц и по каплям при перемешивании добавляли 10%-ный раствор соляной кислоты до рН 3. Выпавший желто-коричневый осадок промывали водой и сушили на воздухе при комнатной температуре. Выход 1.258 г (79%). Полученное вещество кристаллизовали из 200 мл этанола при 0°С. Выход желто-зеленых кристаллов 0.685 г (43%). Тпл = 172–173°С.
Масс-спектр ЭРИ ВР (m/z): найдено 321.9911; вычислено для [C13H11N3SSe + H]+ 321.9923. ИК-спектр (ν, см–1): 3094 (NH), 1593 (Ph), 1570 (C=N), 699 (Tph). ЯМР 1H (DMSO-d6; 500 MГц; 298 K; δ, м.д.): 14.42 (уш.с., NH), [7.52 (м., 3H), 7.30 (м., 2H) Ph], [7.35 (д.д. 1H, J = 5.0, 1.0 Гц), 6.85 (д.д., J = 5.0, 3.5 1H), 6.63 (уш. д.д., 1H, J = 3.5, 1.0 Гц) Tph], 4.15 (с., 2H, CH2Tph). ЯМР 13C (DMSO-d6; 125.72 MГц; 298 K; δ, м.д.): 161.24 (C=Se), [152.75 (1С, Ph), 134.41, 130.14, 129.77, 128.71, 126.07 (5CН, Ph)], [136.39 (1С, Трh), 127.32, 127.30, 125.96 (3CН, Tph)], 26.40 (CH2Tph). ЯМР 77Se (DMSO-d6; 95.38 MГц; 298 K; δ, м.д.): 34.86 (уш.с. ν1/2 = 74.8 Гц).
3,3'-Ди[4-фенил-5-(2-тиенилметил)-4H-1,2,4-триазолил]диселенид (III). Маточный спиртовой раствор, полученный после кристаллизации II объемом 200 мл, упаривали до 50 мл и выдерживали при –20°С. Выпавший осадок III отфильтровывали и сушили при комнатной температуре. Выход желто-зеленых кристаллов 0.429 г (34.2%). Тпл = 140–142°С.
Масс-спектр ЭРИ ВР (m/z): найдено 640.9596; вычислено для [C26H20N6S2Se2 + H]+ 640.9591. ИК-спектр (ν, см–1): 1631, 1596, 1498, 1431, 697 (Tph). ЯМР 1H (DMSO-d6; 500 MГц; 298 K; δ, м.д.): [7.49 (м., 1Hпара), 7.40 (м., 2Hмета), 6.94 (д., 2Hорто, J = 7.5 Гц) Ph], [7.34 (д., 1H, J = 5.0 Гц), 6.85 (д.д., J = 5.0, 3.5 1H), 6.55 (д., 1H, J = 3.5 Гц) Tph], 4.21 (с., 2H, CH2Tph). ЯМР 13C (DMSO-d6; 125.72 MГц; 298 K; δ, м.д.): 155.47 (C, Trz), 142.50 (C–Se), [137.60, 127.26, 125.85 (3CH, Tph), 126.87 (1C, Tph)], [133.75 (C, Ph.), 130.16мета, 129.70пара, 128.18орто (5CH, Ph)], 26.07 (CH2Tph). ЯМР 77Se (DMSO-d6; 95.38 MГц; 298 K; δ, м.д.): 379.35 (уш.с. ν1/2 = 25.4 Гц).
РСА. Кристаллы, пригодные для рентгеноструктурных исследований, получали перекристаллизацией II и III из этанола. Эксперимент проведен на синхротронной станции “БЕЛОК” в НИЦ “Курчатовский институт” (λ = 0.96990 Å, детектор Rayonix SX165 CCD, φ-сканирование) [13]. Обработка экспериментальных данных проведена с помощью программы iMOSFLM, являющейся подпрограммой комплекса CCP4 [14]. Структуры решены прямым методом и уточнены полноматричным МНК по $F_{{hkl}}^{{\text{2}}}$ в анизотропном приближении для неводородных атомов. Тиофеновые циклы в соединении II (молекулы А и В) и один из тиофеновых циклов в III разупорядочены по двум позициям каждый с заселенностями 90 : 10 и 75 : 25 (II) и 70 : 30 (III) соответственно. Атомы водорода аминогрупп в II выявлены объективно в разностных Фурье-синтезах и уточнены изотропно с фиксированными параметрами смещения (Uизо(H) = 1.2Uэкв(N)). Положения остальных атомов водорода в II и III рассчитаны геометрически и включены в уточнение с фиксированными позиционными параметрами (модель “наездника”) и изотропными параметрами смещения (Uизо(H) = 1.2 Uизо(C)). Учет поглощения рентгеновского излучения проведен, соответственно, с использованием программных пакетов Scala [15]. Все расчеты по уточнению кристаллических структур проведены с использованием комплекса программ SHELXTL [16]. Кристаллографические данные и параметры рентгеноструктурных экспериментов приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения для соединений II и III
| Параметры | Значение | |
|---|---|---|
| II | III | |
| Брутто-формула | C13H11N3SSe | C26H20N6S2Se2 |
| М | 320.27 | 638.52 |
| Температура, K | 100 | 100 |
| Размеры кристалла, мм | 0.16 × 0.10 × 0.10 | 0.25 × 0.20 × 0.10 |
| Сингония | Моноклинная | Триклинная |
| Пр. гр. | P21/n | P1 |
| a, Å | 9.6850(8) | 9.2390(19) |
| b, Å | 18.444(2) | 11.316(2) |
| c, Å | 14.8771 | 13.877(3) |
| α, град | 90 | 75.919(11) |
| β, град | 91.262(6) | 78.807(13) |
| γ, град | 90 | 68.137(12) |
| V, Å3 | 2656.9(5) | 1297.4(5) |
| Z | 8 | 2 |
| ρ(выч.), г/см3 | 1.601 | 1.635 |
| µ, мм–1 | 3.889 | 3.982 |
| F(000) | 1280 | 636 |
| Область сбора данных по θ, град | 31 | 31 |
| Измерено отражений | 21 112 | 17 313 |
| Независимых отражений | 5929 | 5832 |
| Число уточняемых параметров | 344 | 332 |
| R1 (I > 2σ(I)) | 0.0401 | 0.0624 |
| wR2 (все данные) | 0.0998 | 0.1524 |
| GOОF | 1.047 | 1.003 |
| Tmin; Tmax | 0.540; 0.660 | 0.390; 0.630 |
| Остаточная электронная плотность (Δρmin/Δρmax), e Å–3 | –0.659/0.873 | –0.814/2.879 |
Структуры депонированы в Кембриджском банке структурных данных (CCDC № 1956602 (II) и 1956603 (III); ccdc.cam.ac.uk/getstructures).
Методы микробиологических исследований. Бактерицидность I, II оценивали по отношению к бактериям: грамположительному штамму Staphylococcus a-ureus и грамотрицательному штамму Escherichia co-li. Соединения помещали в чашки Петри в лунки в агаризованной среде МПА (D = 5 мм) и инокулировали бактериальной суспензией, приготовленной в физрастворе (1 × 108 кл./мл). Инкубирование проводили в термостате при 37°С в течение 24 ч.
Для оценки фунгицидных свойств соединений I, II использовали смешанную культуру (ассоциация) грибов: Aspergillus niger; Aspergillus terreus; Aspergillus oryzae; Chaetomium globosum; Paecilomyces variotii; Penicillium funiculosum; Penicillium chrysogenum; Penicillium cyclopium; Trichoderma viride, которая широко применяется в стандартных методах испытаний для тестирования устойчивости промышленных материалов к биоповреждениям.
Составы помещали в чашки Петри в лунки в агаризованной среде Чапека–Докса. Испытания к ассоциации (смеси) тест-культур проводили в течение 14 сут при температуре ±29°С и влажности более 90%.
О степени бактерицидности или фунгицидности судили по величине зоны ингибирования роста тест-культур, образующейся вокруг лунок с исследуемым соединением.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Мы предприняли попытку синтезировать 1,2,4-триазол-3-селон (II) в условиях, описанных в [11]. На первом этапе в реакции фенилизоселеноцианата с гидразидом 2-тиофенуксусной кислоты в этаноле был получен по аналогии с работой [11] замещенный селеносемикарбазид (I). Однако получить соответствующий II в условиях, описанных в [11], нам не удалось. Кипячение соединения I в этаноле или метаноле в течение 10 ч не привело к образованию II даже в следовых количествах. Поэтому для получения II мы провели циклизацию полученного селенокарбазида кипячением в 10%-ном водном растворе NaOH, в течение 5 ч. Известно, что данный метод широко используется для получения аналогичных 1,2,4-триазол-3-тионов.
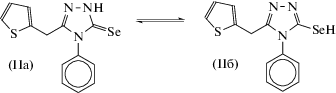
Известно, что гетероциклические тиолы и селенолы могут существовать как в тионовой или селоновой, так и в тиольной или селенольной формах [17]. Однако более устойчивой для них является тионовая или селоновая формы (IIa) [17, 18]. В спектре ПМР полученного соединения II, снятого в ДМСО-d6, имеется уширенный синглет в области 14.38 м.д., отвечающий сигналу NH-группы соединения IIa. Уширение сигнала, вероятно, обусловлено быстрыми обменными процессами между двумя таутомерными формами соединений. В спектре ЯМР 77Se соединения II также наблюдается значительное уширение сигнала. Его ширина на половине высоты сигнала (ν1/2), равна 74.8 Гц, что также можно объяснить обменными процессами между двумя таутомерными формами.
В спектре ЯМР 1Н L1 для протонов NH-групп также наблюдается значительное уширение сигналов. В спектре ЯМР 77Se ν1/2 = 85.2 Гц. Это можно объяснить как быстрыми обменными процессами в таутомерных формах HN–С=О ↔ N=C–OH и HN–С=Se ↔ N=C–SeH, так и затрудненным вращением молекулы из-за частичной двоесвязанности атомов С и N в амидном и селеноамидном фрагментах.
Строение селона II подтверждается результатами рентгеноструктурных исследований. В асимметрической части кристаллической ячейки соединения II содержатся две кристаллографически независимые молекулы А и B, представляющие различные конформеры относительно вращения вокруг связи NТrz–CТrz–C(H2)–CTph, где Trz = триазол и Tph = тиофен (гош-А (51.4(3)°) и транс-B (–176.0(2)°)). В остальном молекулы А и В имеют идентичное строение (рис. 1), поэтому при обсуждении структуры соединения II приводятся геометрические характеристики только молекулы А.
Рис. 1.
Молекулярное строение соединения II (А и В). Штриховой линией показана межмолекулярная водородная связь N–H···Se.
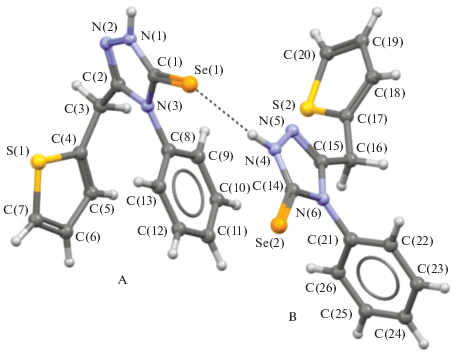
Соединение II включает три цикла – триазольный (А), фенильнй (В) и тиофеновый (С). Фенильные циклы (В) в молекулах А и В почти перпендикулярны триазольным циклам (А) (торсионные углы C(1)N(3)C(8)C(13) и C(14)N(6)C(21)C(26) равны 66.9(3)° и 104.1(3)° соответственно). В молекуле В тиофеновый цикл (С) располагается почти перпендикулярно к обеим плоскостям (А) и (С), тогда как в молекуле А плоскости циклов (С) почти параллельны плоскости фенильного кольца (В) и перпендикулярны плоскости триазольного кольца (А).
Углы между плоскостями (А), (В) и (С) следующие: в молекуле А – А/В 63.90(10)°, А/С 81.08(11)°, В/С 26.72(10)°; в молекуле В – А/В 76.09(10)°, А/С 89.18(13)°, В/С 50.75(11)°.
Вследствие стерических причин валентные углы C(2)C(3)C(4) и C(15)C(16)C(17) в молекулах А и В увеличены по сравнению с идеальным тетраэдрическим значением 109.5° и равны 112.9(2)° и 113.7(2)° соответственно.
Длины связей A: N(1)–N(2) 1.377(3), N(1)–C(1) 1.325(3), N(3)–C(1) 1.368(3), N(3)–C(2) 1.383(3) Å и В: N(4)–N(5) 1.376(3), N(4)–C(14) 1.325(3), N(6)–C(14) 1.366(3), N(6)–C(15) 1.377(3) Å в селенотриазольном фрагменте соответствуют одинарному характеру, тогда как связи A: Se(1)=С(1) 1.847(3), N(2)=C(2) 1.305(3) Å и B: Se(2)=C(14) 1.845(3), N(5)=C(15) 1.298(3) Å двойные, и их длины близки соответствующим расстояниям в родственных 1,2,4-триазол-3-селонах (табл. 2) [11, 19].
Таблица 2.
Избранные значения длин связей, валентных и торсионных углов в соединении II
| Связь | d, Å | Валентный угол | ω, град | ||
|---|---|---|---|---|---|
| A | B | A | B | ||
| Se(1)–C(1) | 1.847(3) | 1.845(3) | N(1)C(1)Se(1) | 126.94(2) | 126.55(2) |
| N(1)–C(1) | 1.325(3) | 1.325(3) | N(3)C(1)Se(1) | 128.8(2) | 129.4(2) |
| N(1)–N(2) | 1.377(3) | 1.376(3) | C(2)N(2)N(1) | 103.6(2) | 103.5(2) |
| N(2)–C(2) | 1.305(3) | 1.298(3) | C(1)N(3)C(2) | 107.4(2) | 107.4(2) |
| N(3)–C(1) | 1.368(3) | 1.366(3) | C(2)C(3)C(4) | 112.9(2) | 113.7(2) |
| N(3)–C(2) | 1.383(3) | 1.377(3) | C(1)N(3)C(8) | 127.1(2) | 127.0(2) |
| N(3)–C(8) | 1.441(3) | 1.440(3) | C(2)N(3)C(8) | 125.4(2) | 125.6(2) |
| C(2)–C(3) | 1.492(3) | 1.494(3) | N(3)C(2)C(3) | 124.8(2) | 122.0(2) |
| C(3)–C(4) | 1.504(3) | 1.470(3) | N(2)C(2)N(3) | 111.0(2) | 111.4(2) |
| C(4)–C(5) | 1.358(2) | 1.387(4) | Торсионный угол | γ, град | |
| C(5)–C(6) | 1.422(2) | 1.388(4) | A | B | |
| C(6)–C(7) | 1.360(2) | 1.380(5) | C(2)C(3)C(4)C(5) | 15.7(9) | 106.6(7) |
| S(1)–C(4) | 1.715(2) | 1.685(2) | C(2)C(3)C(4)S(1) | 52.3(3) | –91.8(3) |
| S(1)–C(7) | 1.716(2) | 1.732(2) | C(1)N(3)C(8)C(13) | 66.9(3) | 104.1(3) |
| C(2)N(3)C(8)C(9) | 62.0(3) | 103.5(3) | |||
Следует отметить, что полученное в [11] соединение близко по строению селону II. Однако, по словам авторов [11], из-за плохого качества кристаллов данные РСА оказались неудовлетворительными и геометрические параметры не обсуждались.
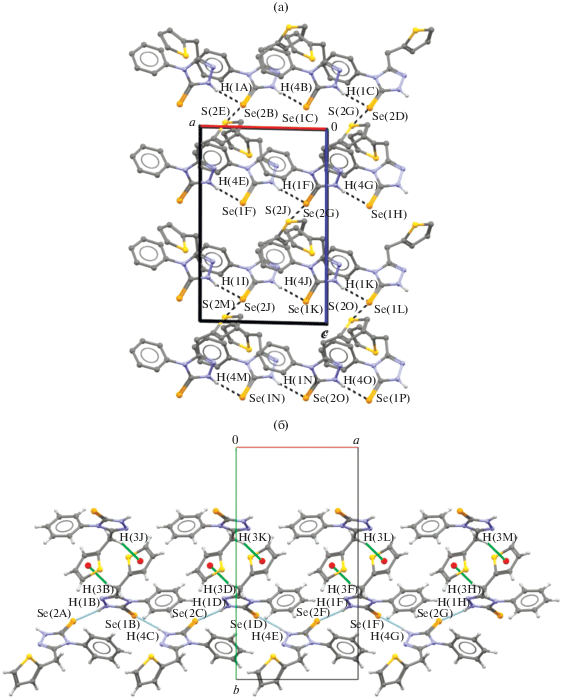
В кристалле соединения II молекулы А и В образуют цепочки вдоль кристаллографической оси a за счет прочных водородных связей N–H···Se (N(4)–H(4)···Se(1) (x, y, z), N–H 0.88(3), H···Se 2.50(3) Å, угол N–H···Se 170(3)°, N(1)–H(1)···Se(2) (1 + x, y, z), N–H 0.90(3), H···Se 2.51(3) Å, угол N–H···Se 167(3)°). Далее цепочки связаны в трехмерный каркас посредством межмолекулярных невалентных взаимодействий Se···S (3.3857(11) Å, сумма ван-дер-ваальсовых радиусов атомов селена и серы равна 3.80 Å [20, 21] (рис. 2а)) и слабых водородных связей типа С–H···π между атомами водорода метиленовых групп и тиофеновыми циклами (CTph = центр тиофенового кольца) (расстояния H(3A)···CTph, С(7)···H(3A) и C(6)···H(3A) составляют 2.63, 2.84 и 2.90 Å соответственно) [22] (рис. 2б).
Рис. 2.
Фрагмент кристаллической структуры II в проекции на плоскость: a0c (a), ab0 (б). Штриховыми линиями показаны водородные связи N–Н···Se и невалентные взаимодействия Se···S (а) и межмолекулярные водородные связи N–H···Se и С–H···π (б).
По данным спектра ЯМР 1H, осажденный из водного раствора II не содержит других продуктов. Однако было установлено, что в процессе перекристаллизации II в кипящем этаноле происходит частичное его превращение в диселенид III. Кроме того, наблюдается выпадение элементарного селена.
Образование III, вероятно, протекает в процессе окисления селона II кислородом воздуха при повышенной температуре. В пользу этого предположения говорит результат специально проведенного опыта по кипячению II в абсолютном этаноле в cреде аргона. В этом случае, по данным спектроскопии ЯМР 1H, через 5 ч образование даже следовых количеств III не происходит.
Известно, что многие диселениды в процессе образования склонны элиминировать селен, образуя соответствующие селениды. Однако образование селенида в нашем случае не происходит. Выделение элементарного селена, вероятно, происходит в процессе разложения селона II, что приводит к существенному уменьшению выхода соединения II после перекристаллизации из этанола. Подобные процессы разложения и окислительной димеризации 5-амино-4-фенил-2,4-дигидро-3H-1,2,4-триазол-3-селона были описаны в [9].
Помимо триазолдиселенида, содержащего аминогруппы в положении 5 и фенильные группы в положении 4, описанного в [9], известны триазолдиселениды с незамещенной NH-группой в положении 4 [23–25]. Однако триазолдиселениды, содержащие в положении 4 и 5 алкильные, арильные заместители, до настоящей работы были не известны.
Соединение III является диселенидом и состоит из двух триазольных фрагментов соединения II, связанных между собой через диселенидный мостик –Se–Se– (рис. 3).
Рис. 3.
Молекулярное строение соединения III. Штриховой линией показана слабая внутримолекулярная водородная связь С–H···π.
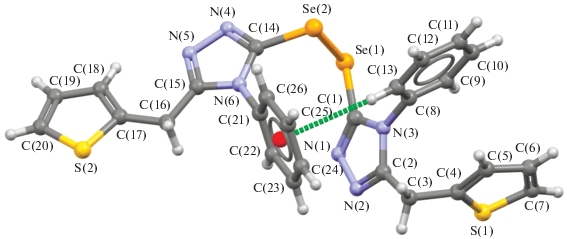
Вследствие аномерного эффекта диселенид III имеет типичную гош-конформацию заместителей при связи Se–Se (торсионный угол СSeSeС равен 83.5(4)°), стабилизированную слабой внутримолекулярной водородной связью С(13)–H(13)···π(C(24)–C(25)) (расстояния H(13)···С(24) и H(13)···С(25) равны 2.90 и 3.06 Å соответственно). Фенильные заместители скручены относительно триазольных циклов (углы между плоскостями составляют 78.33° и 72.92° соответственно) и расположены практически перпендикулярно друг другу (двугранный угол равен 94.5(2)°).
В одном из органических фрагментов тиофеновый цикл почти копланарен триазольному циклу (угол между плоскостями составляет 13.6(2)°), в то время как в другом тиофеновый цикл развернут относительно триазольного цикла на угол 83.8(2)°.
Длина связи Se–Se в соединении III составляет 2.3461(8) Å и находится в ряду соответствующих расстояний в родственных диселенидах (табл. 3).
Таблица 3.
Избранные длины связей, значение валентных и торсионных углов в соединении III
| Связь | d, Å | Валентный угол | ω, град |
|---|---|---|---|
| Se(1)–Se(2) | 2.346(8) | C(1)Se(1)Se(2) | 100.03(15) |
| Se(1)–C(1) | 1.888(5) | C(14)Se(2)Se(1) | 97.37(14) |
| Se(2)–C(14) | 1.898(5) | N(1)C(1)Se(1) | 123.8(4) |
| N(1)–N(2) | 1.390(6) | N(4)C(14)Se(2) | 124.4(4) |
| N(1)–C(1) | 1.318(6) | C(2)C(3)C(4) | 112.3(4) |
| N(2)–C(2) | 1.325(6) | C(15)C(16)C(17) | 116.2(4) |
| N(3)–C(1) | 1.377(6) | C(1)N(1)N(2) | 107.0(4) |
| N(3)–C(2) | 1.358(6) | C(2)N(2)N(1) | 107.5(4) |
| C(2)–C(3) | 1.488(7) | C(2)N(3)C(1) | 105.3(4) |
| C(3)–C(4) | 1.512(7) | C(14)N(4)N(5) | 106.5(4) |
| N(3)–C(8) | 1.445(6) | C(15)N(5)N(4) | 107.6(4) |
| N(4)–N(5) | 1.396(6) | C(14)N(6)C(15) | 104.8(4) |
| N(4)–C(14) | 1.306(6) | N(5)C(15)N(6) | 109.6(4) |
| N(5)–C(15) | 1.328(6) | Торсионный угол | γ, град |
| N(6)–C(14) | 1.366(6) | C(1)Se(1)Se(2)C(14) | –83.5(2) |
| N(6)–C(15) | 1.370(6) | C(2)C(3)C(4)C(5) | 15.7(9) |
| N(6)–C(21) | 1.442(6) | C(15)C(16)C(17)C(18) | 106.6(7) |
| C(15)–C(16) | 1.489(7) | C(1)N(3)C(8)C(13) | 104.6(6) |
| C(16)–C(17) | 1.517(6) | C(14)N(6)C(21)C(26) | 70.9(7) |
Длины связей в селенотриазольных фрагментах молекулы III Se(1)–C(1) 1.888(5), N(3)–C(1) 1.377(6), N(3)–C(2) 1.358(6), N(1)–N(2) 1.390(6), Se(2)–C(14) 2.3462(8), N(6)–C(14) 1.366(6), N(6)–C(15) 1.370(6), N(4)–N(5) 1.396(6) Å соответствуют одинарному характеру, тогда как связи N(1)=C(1) 1.318(6), N(2)=C(2) 1.325(6), N(4)=C(14) 1.306(6), N(5)=C(15) 1.328(6) Å двойные (табл. 3).
В кристалле соединения III молекулы образуют цепочки вдоль кристаллографической оси b за счет межмолекулярных невалентных взаимодействий Se···π(C–C) (3.404(6), 3.458(12) и 3.335(9)), Se···Se (3.8975(11)) и S···N (3.250(5) Å) (суммы ван-дер-ваальсовых радиусов атомов селена и углерода, двух атомов селена и атомов серы и азота равны 3.75, 4.00 и 3.30 Å соответственно [20, 21] (рис. 4а).
Рис. 4.
Фрагмент кристаллической упаковки соединения III в проекции на плоскость: b0c (а), а0c (б). Для наглядности атомы водорода, не участвующие в межмолекулярных водородных связях, удалены. Пунктирными линиями показаны контакты Se···C, Se···Se, S···N (а) и водородные связи С–H···π (б).
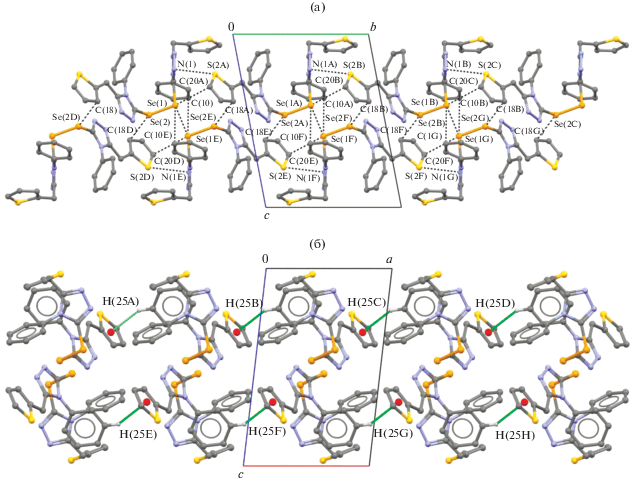
При более детальном изучении кристаллической упаковки было обнаружено, что между молекулами III атомы водорода H(25) фенильного фрагмента располагаются практически с небольшим смещением напротив центра тиофенового цикла. Расстояние от атома водорода H(25A) фенильного фрагмента к центру тиофенового цикла составляет 2.63 Å. Кратчайшее расстояние C···H между атомами С(17)···H(25) 2.90 Å и C(19)···H(25) 2.90 Å указывают на существование слабых водородных связей типа С–H···π [22], которые связывают молекулы III в цепочки вдоль кристаллографической оси а (рис. 4б).
Результаты проведенных испытаний соединений I–III на антимикробные свойства представлены в табл. 4, 5.
Таблица 4.
Исследование бактерицидного действия соединений I–III
| Соединение | Staphylococcus aureus | Escherichia coli | ||
|---|---|---|---|---|
| D зоны ингибирования роста, мм (без учета диаметра лунки) |
характеристика бактерицидности препарата | D зоны ингибирования роста, мм (без учета диаметра лунки) |
характеристика бактерицидности препарата |
|
| I | 8 | Слабобактерициден | 4 | Небактерициден |
| II | 10 | Бактерициден | 10 | Бактерициден |
| III | 6 | Слабобактерициден | 0 | Небактерициден |
Таблица 5.
Исследование фунгицидного действия соединений I–III
| Соединение | D зоны ингибирования роста, мм без учета диаметра лунки |
Характеристика фунгицидности |
|---|---|---|
| I | 16 | Фунгициден |
| II | 10 | Фунгициден |
| III | Зона ингибирования отсутствует | Нефунгициден |
Из полученных результатов видно, что соединение II обладает как бактерицидным, так и фунгицидным действием по отношению ко всем используемым тест-культурам микроорганизмов. Соединение I проявило более сильные, чем у соединения II, фунгицидные свойства и слабобактерицидные по отношению к Staphylococcus aureus и Escherichia coli. Соединение III обладает самым низким антимикробным действием (нефунгицидно и небактерицидно) и проявило лишь слабобактерицидные свойства относительно культуры Staphylococcus aureus.
Современные промышленные биоцидные препараты применяются в концентрациях от 0.05 до 3%. Полученные в нашей работе соединения I и II в концентрации 1% сопоставимы с ними по биоцидной активности.
Таким образом, в работе синтезированы и охарактеризованы методами спектроскопии ЯМР, масс-спектрометрии высокого разрешения и РСА три новых селенорганических соединения – N-фенил-2-(2-тиенилацетил)гидразинкарбоселеноамид (I), 4-фенил-5-(2-тиенилметил)-2,4-дигидро-3H-1,2,4-триазол-3-селон (II) и 3,3'-ди[4-фенил-5-(2-тиенилметил)-4H-1,2,4-триазолил]диселенид (III). Выявлено, что селенотриазол II как в кристалле, так и в растворе существует в форме селона (расстояние C=Se в кристалле равно 1.847(3) и 1.845(3) Å для двух кристаллографически независимых молекул). Диселенид III в кристалле имеет вследствие аномерного эффекта гош-конформацию заместителей при связи Se–Se, стабилизированную слабой внутримолекулярной водородной связью С–H···π. Изучена антимикробная активность полученных соединений. Установлено, что соединения I и II обладают бактерицидной и фунгицидной активностью.
Список литературы
Banerjee B., Koketsu M. // Coord. Chem. Rev. 2017. V. 339. P. 104.
Zhang S., Wang Z., Hu Z. et al. // Chem. Med. Chem. 2017. V. 12. № 3. P. 235.
Álvarez-Pérez M., Ali W., Marć M.A. et al. // Molecules. 2018. V. 23. P. 628.
Miao Q., Xu J., Lin A., et al. // Curr. Med. Chem. 2018. V. 25. № 17. P. 2009.
Ninomiya M., Garud D.R., Koketsu M. // Coord. Chem. Rev. 2011. V. 255. P. 2968.
Garud D.R., Koketsu M., Ishihara H. // Molecules. 2007. V. 12 P. 504.
Heimgartner H., Zhou Y., Plamen K. et al. // Phosphorus, Sulfur, Silicon Relat. Elem. 2008. V. 183. P. 840.
Karabanovich G., Roh J., Padelkova Z. et al. // Tetrahedron. 2013. V. 69. P. 8798.
Sommen G.L., Linden A., Heimgartner H. // Helv. Chim. Acta. 2007. V. 90. P. 641.
Favero F., Sommen G.L., Linden A., Heimgartner H. // Heterocycles. 2006. V. 67. P. 749.
Pieczonka A.M., Ciepielowski K., Cebulska Z. et al. // Helv. Chim. Acta. 2013. V. 96. P. 397.
Zakrzewski J., Huras B., Kiełczewska A. // Synthesis. 2016. V. 48. P. 85.
Lazarenko V.A., Dorovatovskii P.V., Zubavichus Y.V. et al. // Crystals. 2017. V. 7. № 11. P. 325.
Battye T.G.G., Kontogiannis L., Johnson O. et al. // Acta Crystallogr. D. 2011. V. 67. P. 271.
Evans P. // Acta Crystallogr. D. 2006. V. 2. P. 72.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Штефан E.Д., Введенский В.Ю. // Успехи химии. 1995. V. 65. P. 326.
Akkurt M., Ozturk S., Servi S. et al. // Acta Crystallog. E. 2004. V. 60. P. 1507.
Fleischhauera J., Beckerta R., Horniga D. et al. // Z. Naturforsch. B. 2008. V. 63. P. 415.
Bondi A. // J. Phys. Chem. 1964. V. 68. P. 441.
Rowland R.S., Taylor R. // J. Phys. Chem. 1996. V. 100. P. 7384.
Christoph J. // Dalton Trans. 2000. P. 3885.
Piccotti E. Patent DE 2148633. 1972.
Brown J.C., Fry D.J., Keogh P.J. Patent DE 2162856. 1972.
Dyke J.M. Patent DE 2331220. 1974.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия