Координационная химия, 2021, T. 47, № 3, стр. 159-168
Структурообразующая роль катионов щелочных металлов при формировании комплексов хрома(III) с анионами циклопропан-1,1-дикарбоновой кислоты
Е. С. Бажина 1, *, М. А. Шмелев 1, М. А. Кискин 1, И. Л. Еременко 1, 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: evgenia-VO@mail.ru
Поступила в редакцию 19.10.2020
После доработки 22.10.2020
Принята к публикации 23.10.2020
Аннотация
С целью изучения процессов химической сборки координационных полимеров с ионами Cr3+ и щелочных металлов исследовано взаимодействие Cr(NO3)3 · 9H2O с калиевой, натриевой и литиевой солями циклопропан-1,1-дикарбоновой кислоты (H2Cpdc) в соотношении 1 : 3. Установлено, что природа щелочного металла, вводимого в реакцию, оказывает влияние на состав и строение образующихся соединений. В реакции Cr(NO3)3 · 9H2O и K2(Cpdc) формируется 3D-полимерный комплекс [KCr(Cpdc)2(H2O)2]n (I), образованный бисхелатными анионными фрагментами [Cr(Cpdc)2(H2O)2]–. Использование Na2(Cpdc) и Li2(Cpdc) в аналогичных условиях приводит к образованию 3D-полимеров [Na4Cr(Cpdc)3(H2O)6(NO3)]n (II) и {[Li8Cr2(Cpdc)8(H2O)5] · H2O}n (III) соответственно, содержащих трисхелатные анионные фрагменты [Cr(Cpdc)3]3–. Отличительной особенностью соединения III является наличие в его структуре фрагментов {Li(Cpdc)}–, в которых анион Cp-dc2– образует шестичленный хелатный цикл с ионом Li+. Кристаллические структуры соединений I–III установлены методом РСА (CIF files CCDC № 2031258 (I), 2031260 (II), 2031261 (III)).
Интенсивные исследования последнего десятилетия в области химии замещенных малоновых кислот (H2R1R2Мal) позволили выявить их широкие координационные возможности для конструирования полиядерных соединений и координационных полимеров разнообразного строения с различными сочетаниями атомов металлов (s–d, d–d ', d–f) и установить закономерности изменения кристаллической структуры и физико-химических свойств в зависимости от природы исходных соединений металлов, условий синтеза и растворителей или геометрических характеристик заместителя в малонат-анионе [1–6]. В частности, на примере соединений оксованадия(IV), формирующего с анионами R1R2Мal2– бисхелатный анионный “блок” {VO(R1R2Мal)2}2–, было показано, что увеличение размера заместителя при переходе от циклопропан-1,1-дикарбоновой кислоты (H2Cpdc) к бутилмалоновой (H2BuМal) способствует понижению размерности полимерной структуры и образованию соединений слоистого или цепочечного строения [7, 8]. Анионы Cpdc2–, содержащие жесткий циклопропановый фрагмент, при синтезе координационных полимеров меди(II) c катионами щелочноземельных металлов, напротив, способствуют формированию 3D-каркасных пористых структур [9], а в случае гомометаллических комплексов 3d-переходных металлов и лантанидов – соединений 2D-полимерного строения [10–13].
Катионы щелочных и щелочноземельных металлов, вводимые в реакцию в составе соли дикарбоновой кислоты, также способны играть структурообразующую роль как при формировании новых s–3d-молекул, так и в процессе роста кристаллов, влияя на упаковку и пространственную архитектуру возникающей системы. За счет образования ионных связей M–O с металлсодержащими бисмалонатными фрагментами ионы s-элементов участвуют в самоорганизации супрамолекулярной структуры соединения в кристалле. Ионный радиус катиона щелочного металла, который, как правило, больше радиусов 3d-элементов, зачастую оказывает влияние на тип и размерность структуры. Например, катионы лития вследствие малого радиуса (r(M+), Å: Li (0.68), Na (0.98), K (1.33)), близкого к радиусу двухзарядных катионов 3d-металлов и Cr3+ (0.64 Å) [14], способствуют формированию в малонатных системах соединений молекулярного строения, в то время как катионы натрия и калия образуют, в зависимости от геометрии заместителя, слоистые или каркасные структуры [4]. Известны многочисленные примеры направляемой катионами щелочных металлов самоорганизации супрамолекулярных архитектур и полиядерных комплексов в системах с другими полифункциональными лигандами [15–27].
Как было показано ранее, при взаимодействии хрома(III) с малонат-анионами возможно формирование не только бисхелатных [Cr(Mal)2(H2O)2]–, но и трисхелатных фрагментов [Cr(Mal)3]3–, а также биядерных гидроксокарбоксилатных анионов [Cr2(OH)2(Mal)4]4– [28–35], что в сочетании со стерическими эффектами заместителей в малонатном лиганде и варьированием условий синтеза позволяет увеличить разнообразие формирующихся структур [36, 37].
В настоящей работе исследовано взаимодействие нитрата хрома(III) с солями циклопропан-1,1-дикарбоновой кислоты (M2Cpdc, M = K, Na, Li) в соотношении 1 : 3 в водной среде. Изучено влияние природы щелочного металла на состав и кристаллическую структуру формирующихся комплексов хрома(III) с анионами Cpdc2–.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез новых соединений выполняли на воздухе с использованием дистиллированной воды, Cr(NO3)3 · 9H2O (99%, Acros Organics), КОН (99+%), NaOH (99+%), LiOH · H2O (99+%) H2Cpdc (97%, Sigma Aldrich). ИК-спектры соединений регистрировали в интервале частот 4000–400 см–1 на ИК-спектрофотометре с Фурье-преобразованием Spectrum 65 (PerkinElmer), оборудованном приставкой Quest ATR Accessory (Specac), методом нарушенного полного внутреннего отражения (НПВО). Элементный анализ выполняли на CHNS-анализаторе EuroЕА 3000 (EuroVector).
Синтез [KCr(Сpdc)2(H2O)2]n (I). К раствору Cr(NO3)3 · 9H2O (0.15 г, 0.37 ммоль) в 10 мл дистиллированной воды при 90°C добавляли раствор K2Cpdc, полученный взаимодействием H2Cpdc (0.146 г, 1.11 ммоль) и KOH (0.125 г, 2.22 ммоль) в 20 мл воды при 90°C. Реакционную смесь перемешивали в течение 4 ч при 90°C и выдерживали полученный раствор сине-зеленого цвета при медленном испарении (Т = 22°C) в течение 2 мес. Кристаллы малинового цвета, пригодные для РСА, отделяли от маточного раствора фильтрованием, промывали водой (Т = 5°C) и сушили на воздухе. Выход соединения I 0.085 г (59.2% в расчете на Cr(NO3)3 · 9H2O).
ИК-спектр (НПВО; ν, см–1): 3146 ср.ш ν(O–H), 3027 сл, 2826 ср.ш, 1577 с νas(СОО–), 1560 с, 1435 ср, 1412 ср, 1383 с νs(СОО–), 1237 с, 1209 ср, 1193 ср, 1088 ср, 1042 сл, 988 сл, 975 сл, 937 с, 868 с, 817 ср, 795 ср, 770 с, 756 с, 738 с, 660 с, 555 с, 524 с, 470 с, 430 сл.
Синтез [Na4Cr(Cpdc)3(H2O)6(NO3)]n (II). К раствору Cr(NO3)3 · 9H2O (0.15 г, 0.37 ммоль) в 10 мл дистиллированной воды при 90°C добавляли раствор Na2Cpdc, полученный взаимодействием H2Cpdc (0.146 г, 1.11 ммоль) и NaOH (0.090 г, 2.22 ммоль) в 25 мл воды при 90°C. Реакционную смесь перемешивали в течение 3 ч при 90°C и выдерживали полученный раствор зеленого цвета при медленном испарении (Т = 22°C) в течение 1 мес. Кристаллы темно-синего цвета, пригодные для РСА, отделяли от маточного раствора фильтрованием и сушили на воздухе. Выход соединения II 0.100 г (38.3% в расчете на Cr(NO3)3 · 9H2O).
ИК-спектр (НПВО; ν, см–1): 3385 ср.ш. ν(O–H), 3039 о. сл, 1678 сл, 1578 с νas(СОО–), 1422 с, 1390 с νs(СОО–), 1348 с, 1237 с, 1208 ср, 1082 ср, 1060 о. сл, 992 о. сл, 979 о. сл, 933 с, 869 с, 826 сл, 807 сл, 792 сл, 769 ср, 757 ср, 740 с, 687 ср, 591 ср, 553 с, 515 с, 463 с.
Синтез {[Li8Cr2(Cpdc)8(H2O)5] · H2O}n (III). К раствору Cr(NO3)3 · 9H2O (0.15 г, 0.37 ммоль) в 10 мл дистиллированной воды при 90°C добавляли раствор Li2Cpdc, полученный взаимодействием H2Cpdc (0.146 г, 1.11 ммоль) и LiOH · H2O (0.094 г, 2.22 ммоль) в 25 мл воды при 90°C. Реакционную смесь перемешивали в течение 3 ч при 90°C, выдерживали при 22°C в течение 1 мес. и отфильтровывали раствор зеленого цвета от мелкодисперсного зеленого осадка. Полученный фильтрат выдерживали при медленном испарении (Т = 22°C) в течение 2 мес. Кристаллы темно-синего цвета, пригодные для РСА, отделяли от маточного раствора фильтрованием и сушили на воздухе. Выход соединения III 0.054 г (23.6% в расчете на Cr(NO3)3 · 9H2O).
ИК-спектр (НПВО; ν, см–1): 3458 ср. ш ν(O–H), 3394 ср. ш ν(O–H), 3124 о. сл, 3022 о. сл, 1558 с νas(СОО–), 1435 с, 1400 с νs(СОО–), 1243 с, 1214 с, 1082 ср, 1045 сл, 978 ср, 944 с, 871 с, 811 ср, 801 ср, 754 с, 555 с, 487 с.
РСА монокристаллов I–III выполнен на дифрактометре Bruker SMART APEX II, оборудованном CCD-детектором (MoKα, λ = 0.71073 Å, графитовый монохроматор) [38]. Введена полуэмпирическая поправка на поглощение по программе SADABS [39]. Атомы водорода при атомах углерода органических лигандов и молекул воды генерированы геометрически и уточнены в модели “наездника”. Атомы водорода OH-групп в структурах I и II локализованы из разностных Фурье-синтезов, в структуре III – генерированы геометрически и уточнены в модели “наездника”. Расчеты проведены по комплексу программ SHELX-2018 [40] с использованием Olex 2 1.3 [41]. В структуре II атом Na(1) разупорядочен по двум положениям (Na(1A) и Na(1B)) с равными заселенностями 0.5. В структуре III атом Li(1) имеет заселенность 0.5, молекулы воды O(10) и O(17) разупорядочены по двум положениям (O(10A), O(10B) и O(17A), O(17B) соответственно) с заселенностями 0.5. Кристаллографические параметры и детали уточнения структур I–III приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I–III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| Брутто-формула | C10H12O10KCr | C15H22N4O21NaCr | C35H35O38Li8Cr2 |
| М | 383.30 | 696.29 | 2446.30 |
| Т, K | 150 | 296 | 273 |
| Сингония | Тригональная | Тригональная | Моноклинная |
| Пр. гр. | R$\bar {3}$c | P3121 | С2/m |
| a, Å | 12.7944(3) | 9.5533(7) | 27.30(4) |
| b, Å | 12.7944(3) | 9.5533(7) | 14.87(2) |
| c, Å | 42.9765(10) | 24.9257(16) | 13.97(2) |
| α, град | 90 | 90 | 90 |
| β, град | 90 | 90 | 117.76(4) |
| γ, град | 120 | 120 | 90 |
| V, Å3 | 6092.6(3) | 1970.1(4) | 5020(13) |
| Z | 18 | 3 | 2 |
| ρ(выч.), г см–3 | 1.880 | 1.761 | 1.618 |
| μ, мм–3 | 1.205 | 0.599 | 0.545 |
| θmin–θmax, град | 2.64–26.39 | 2.46–27.77 | 2.59–27.10 |
| F(000) | 3510 | 1065 | 2484 |
| Tmin/Tmax | 0.577/0.745 | 0.887/0.970 | 0.332/0.746 |
| Интервалы индексов отражений | –15 ≤ h ≤ 15, –12 ≤ k ≤ 15, –53 ≤ l ≤ 53 |
–8 ≤ h ≤ 11, –8 ≤ k ≤ 11, –28 ≤ l ≤ 30 |
–30 ≤ h ≤ 30, –16 ≤ k ≤ 16, –15 ≤ l ≤ 15 |
| Измерено отражений | 12 872 | 9623 | 12190 |
| Независимых отражений | 1382 | 2584 | 3826 |
| Rint | 0.0260 | 0.0531 | 0.0953 |
| Отражений с I > 2σ(I) | 1325 | 2229 | 2594 |
| GООF | 1.062 | 1.057 | 1.025 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0281, wR2 = 0.0831 | R1 = 0.0562, wR2 = 0.1438 | R1 = 0.1079, wR2 = 0.2645 |
| R-факторы по всем отражениям | R1 = 0.0292, wR2 = 0.0842 | R1 = 0.0657, wR2 = 0.1506 | R1 = 0.1519, wR2 = 0.2999 |
| Остаточная электронная плотность (Δρmin/Δρmax), e/Å3 | –0.835/0.404 | –0.478/0.710 | –1.405/ 3.311 |
Структурные данные депонированы в Кембриджском центре кристаллографических данных (ССDС № 2031258 (I), 2031260 (II), 2031261 (III); deposit@ccdc.cam.ac.uk; www: http://www.ccdc.cam. ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Взаимодействие Cr(NO3)3 · 9H2O с K2Сpdc (получен реакцией H2Cpdc и KOH в водном растворе) в мольном соотношении 1 : 3 в водном растворе при 90°C привело к образованию малиновых кристаллов соединения [KCr(Сpdc)2(H2O)2]n (I). Замена K2Сpdc на Na2Сpdc в тех же условиях позволила выделить темно-синие кристаллы [Na4Cr(Cpdc)3-(H2O)6(NO3)]n (II), в то время как использование Li2Сpdc в аналогичной реакции приводило к кристаллизации соединения {[Li8Cr2(Cpdc)8(H2O)5] · · H2O}n (III).
Структура I образована моноядерными анионными фрагментами [Cr(Сpdc)2(H2O)2]–, в составе которых атом Cr(1) находится в октаэдрическом окружении, координируя два хелатных дианиона Cpdc2– и две монодентатные молекулы воды (рис. 1). Четыре атома O карбоксилатных лигандов находятся в экваториальной плоскости полиэдра и образуют близкие по длине связи Cr–O (табл. 2), а атомы O молекул воды занимают аксиальные позиции октаэдра (Cr–O(H2O) 1.9930(13) Å). Отметим, что формирование бисхелатного аниона [Cr(R1R2Mal)2(H2O)2]– ранее также наблюдалось в соединении K–Cr(III) с анионами Cbdc2–, кристаллизующемся в среде этанола. Однако данное соединение в кристалле имело не 3D-, а 2D-полимерную структуру, что можно объяснить стерическим эффектом более объемного циклобутанового фрагмента в малонат-анионе [37].
Рис. 1.
Строение моноядерных анионов [Cr(Cpdc)2-(H2O)2]– и их связывание атомами калия в структуре I (атомы водорода циклопропановых фрагментов не показаны). Коды симметрии: a 0.66667 – x, 0.33333 – y, 1.33333 – z.
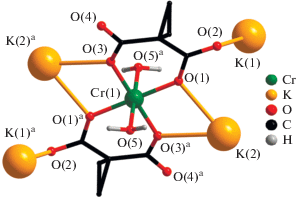
Таблица 2.
Основные длины связей (d) и углы (ω) в структурах I–III
| Связь | d, Å | ||
|---|---|---|---|
| I (M = K) | II (M = Na) | III (M = Li) | |
| Cr–O (Cpdc) | 1.9365(12)–1.9534(12) | 1.949(3)–1.956(3) | 1.948(6)–1.980(6) |
| M–O (Cpdc) | 2.7138(13)–2.7983(12) | 2.261(4)–2.468(7) | 1.87(4)–2.58(2) |
| M–O (H2O) | 2.215(8)–2.78(1) | 1.88(3)–2.446(11) | |
| Угол | ω, град | ||
| OCrO (смежные) | 87.81(6)–92.19(6) | 88.64(15)–92.2(2) | 86.4(3)–95.8(3) |
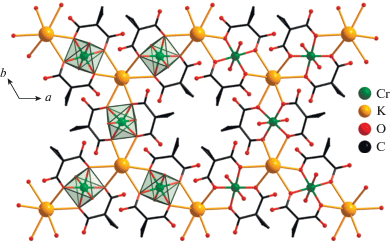
В структуре I находятся два типа кристаллографически независимых атомов K (K(1) и K(2)). Атомы K(2) образуют связи с атомами O карбоксилатных лигандов, участвующими в хелатировании Cr(1), и связывают фрагменты [Cr(Сpdc)2(H2O)2]– в полимерные слои (Cr(1)···K(2) ~ 3.723 Å) (рис. 2, табл. 2). Кратчайшее расстояние Cr···Cr в слое равно 6.3966 Å. Полимерные слои, в свою очередь, за счет координации не участвующих в хелатировании атомов O карбоксильных групп атомами калия K(1) объединены в 3D-полимерную структуру (рис. 3), в которой каждый фрагмент [Cr(Сpdc)2(H2O)2]– окружен четырьмя катионами калия. Окружение атомов калия сформировано исключительно атомами O карбоксильных групп, а молекулы воды, присутствующие в структуре I, координированы только к атомам Cr. Кристаллическая структура I дополнительно стабилизируется за счет образования водородных связей между атомами H молекул воды и атомами O карбоксильных групп соседних фрагментов [Cr(Сpdc)2(H2O)2]– в полимерном слое, а также между атомами H циклопропановых фрагментов и атомами O молекул воды соседних полимерных слоев (табл. 3).
Рис. 3.
Фрагмент 3D-полимерной структуры соединения I (циклопропановые фрагменты анионов кислоты и атомы водорода не показаны).
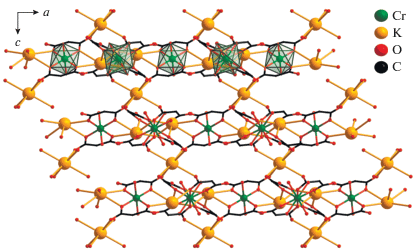
Таблица 3.
Геометрические параметры водородных связей в структурах I–III*
| D–H···A | Расстояние, Å | Угол D–H···A, град |
||
|---|---|---|---|---|
| D–H | H···A | D···A | ||
| I | ||||
| O(5)–H(1a)···O(4)i | 0.74 | 1.85 | 2.5822(18) | 169 |
| O(5)–H(1b)···O(2)ii | 0.90 | 1.81 | 2.706(2) | 175 |
| C(5)–H(5a)···O(5)iii | 0.99 | 2.56 | 3.530(3) | 165 |
| II | ||||
| O(2w)–H(2wa)···O(1N) | 0.70 | 2.32 | 2.940(10) | 148 |
| O(2w)–H(2wb)···O(3)i | 0.82 | 2.02 | 2.837(5) | 171 |
| O(3w)–H(3wa)···O(5)ii | 0.85 | 2.01 | 2.856(6) | 173 |
| O(3w)–H(3wb)···O(1N) | 0.85 | 2.40 | 2.997(9) | 128 |
| O(3w)–H(3wb)···O(3w)iii | 0.85 | 2.60 | 3.045(9) | 114 |
| O(1w)–H(1wa)···O(2N)iv | 0.85 | 1.95 | 2.794(11) | 177 |
| O(1w)–H(1wb)···O(2) | 0.85 | 2.33 | 2.924(6) | 127 |
| O(1w)–H(1wb)···O(5) | 0.85 | 2.45 | 3.251(7) | 157 |
| III | ||||
| O(7w)–H(7wa)···O(4)i | 0.85 | 2.09 | 2.865(16) | 151 |
| O(7w)–H(7wb)···O(4)ii | 0.85 | 2.30 | 2.865(16) | 125 |
| O(11w)–H(11a)···O(10B) | 0.86 | 2.54 | 3.21(3) | 135 |
| O(12w)–H(12a)···O(7)iii | 0.85 | 2.07 | 2.904(12) | 167 |
| O(12w)–H(12b)···O(8w)iv | 0.85 | 2.05 | 2.83(3) | 153 |
| C(13)–H(13a)···O(16)v | 0.97 | 2.40 | 3.334(14) | 161 |
* Коды симметрии: i 2/3 + x – y, 1/3 + x, 4/3 – z; ii –1/3 + y, 1/3 – x + y, 4/3 – z; iii 2/3 – x + y, 1/3 + y, –1/6 + z (I). i –x, 1 + y, z; iiy, 1 + x, 1 – z; iiiy, x, 1 – z; ivx, 1 + y, z (II). i 1 – x, y, 1 – z; ii 1 – x, 1 – y, 1 – z; iii 1/2 – x, –1/2 + y, 1 – z; iv 1/2 – x, 1/2 + y, 1 – z; v 1/2 – x, 1/2 + y, 2 – z (III).
В структуре II атомы Cr(1) формируют трисхелатные анионные фрагменты [Cr(Cpdc)3]3–, располагающиеся на оси второго порядка. Атом хрома координирует шесть атомов О трех хелатных анионов Cpdc2–, формирующих октаэдрическое окружение металлоцентра с близкими значениями длин связей Cr–O и углов OCrO (рис. 4, табл. 2). В структуре II присутствуют два типа кристаллографически независимых атомов натрия (Na(1) и Na(2)). Атом Na(1) разупорядочен по двум положениям (Na(1A) и Na(1B)) с заселенностью 0.5. Атом Na(2) связан с соседними атомами металла (Na(1A) и Na(1B)) мостиковыми молекулами воды (O(1w), O(2w), O(3w)) и атомами кислорода карбоксильных групп (O(1), O(4)) с формированием зигзагообразных 1D-полимерных цепочек в плоскости ab (расстояния Na(1A)···Na(2) 3.028(6), 3.184(6) Å, Na(1B)···Na(2) 3.302(6), 3.545(7) Å). Атомы натрия Na(1A) и Na(1B) достраивают свое окружение координацией атома кислорода (O(1N)) мостикового аниона ${\text{NO}}_{{\text{3}}}^{--},$ связывая полимерные цепочки в катионный слой $\{ {\text{N}}{{{\text{a}}}_{{\text{4}}}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{{\text{6}}}}({\text{N}}{{{\text{O}}}_{{\text{3}}}})\} _{n}^{{{\text{3}}n + }}$ (Na···O(NO3) 2.161(11), 3.193(13) Å) (рис. 5). В кристалле II атомы Na координируют атомы O карбоксильных групп фрагментов {Cr(Сpdc)3} (каждый фрагмент {Cr(Cpdc)3} окружен десятью атомами Na), которые связывают катионные слои $\{ {\text{N}}{{{\text{a}}}_{{\text{4}}}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{{\text{6}}}}({\text{N}}{{{\text{O}}}_{{\text{3}}}})\} _{n}^{{{\text{3}}n + }}$ в каркасную структуру (Cr···Cr 9.553(7) Å, Cr···Na 4.821–6.341 Å) (рис. 6). Структура комплекса II дополнительно стабилизирована обширной сетью внутримолекулярных водородных связей, в образовании которых принимают участие молекулы воды, атомы кислорода карбоксильных групп и нитрат-анионов (табл. 3).
Рис. 4.
Строение анионного фрагмента [Cr(Cpdc)3]3– и его связывание с атомами натрия в структуре II (атомы водорода не показаны). Коды симметрии: a ‒x, –x + y, 1.33333 – z; b 1 + x, y, z; c –x, –1 – x + y, 1.33333 – z; d 1 – y, 1 + x – y, 0.33333 + z.
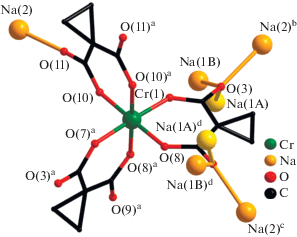
Рис. 5.
Формирование катионных слоев $\{ {\text{N}}{{{\text{a}}}_{{\text{4}}}}{{({{{\text{H}}}_{{\text{2}}}}{\text{O}})}_{{\text{6}}}}({\text{N}}{{{\text{O}}}_{{\text{3}}}})\} _{n}^{{{\text{3}}n + }}$ в структуре II. Синей пунктирной линией показаны водородные связи.
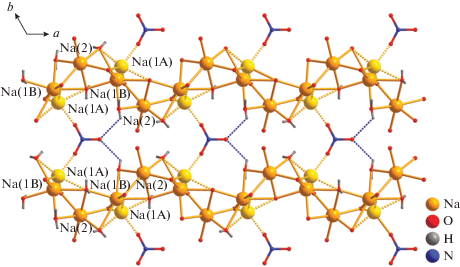
Рис. 6.
Фрагмент 3D-полимерной структуры соединения II (циклопропановые фрагменты анионов кислоты и атомы водорода молекул воды не показаны).
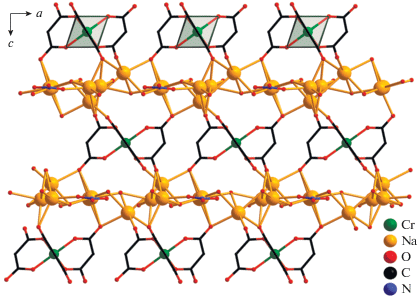
Структура III, подобно II, образована моноядерными анионными фрагментами [Cr(Cpdc)3]3–, в которых атом Cr(1) координирует три хелатных дианиона Cpdc2– и находится в октаэдрическом координационном окружении (рис. 7, табл. 2). В структуре III определено десять кристаллографически независимых атомов лития (рис. 7), которые формируют “слои”, содержащие два типа цепочек: {Li(4)···Li(10)···Li(1)···Li(2)···Li(1)···Li(10)}, состоящие из семи атомов лития, и полимерные {···Li(6)···Li(5)···Li(6)···(Li(9),Li(8), Li(7))···Li(3)–(Li(9), Li(8), Li(7))···}n (рис. 8). В цепочке первого типа два атома Li(1) (имеет заселенность 0.5) связаны с центральным Li(2) мостиковыми молекулами воды O(1w) и O(10A) (имеет заселенность 0.5) (Li(1)···Li(2) 3.08(4) Å). Каждый атом Li(1) связан с Li(10) за счет мостиковых молекул воды O(10B) (имеет заселенность 0.5) и O(17A) (имеет заселенность 0.5), а каждый атом Li(10) – с Li(4) за счет атомов O(6) карбоксильных групп хромсодержащих фрагментов [Cr(Cpdc)3]3– (Li(1)···Li(10) 3.68(3), Li(10)···Li(4) 2.58(3) Å). “Центральный” атом Li(2) дополнительно координирует одну (O(2w)), а “концевые” Li(4) – две монодентатные молекулы воды (O(7w) и O(8w)) (рис. 7 и 8). В цепочке второго типа атом Li(9) координирует один анион Cpdc2–, формирующий с атомом металла шестичленный хелатный цикл. Ранее такой тип координации малонатного аниона наблюдался в структуре диметилмалонатного комплекса Li(I)‒-Co(II) [42]. Фрагмент {Li(9)(Cpdc)}– далее за счет карбоксилатных атомов O аниона Cpdc2– связывает еще три атома лития, Li(8), Li(7) и Li(6), каждый из которых образует связи с двумя фрагментами [Cr(Cpdc)3]3– соседних слоев (Li(6)···Li(9) 3.67(5), Li(7)···Li(9) 5.91(5), Li(8)···Li(9) 3.33(4) Å). Связывание Li(9) в цепочке с Li(3) осуществляется за счет координации атомов O(2) карбоксилат-анионов (Li(3)···Li(9) 2.64(4) Å). Атомы Li(5) и Li(6) связаны между собой одной мостиковой молекулой воды (O(10w)) и атомами O(19) карбоксильных групп фрагментов [Cr(Cpdc)3]3–, принадлежащих соседним слоям (Li(5)···Li(6) 2.63(2) Å). Атомы Li(7) и Li(8) дополнительно координируют по одной молекуле воды (O(11w) и O(9w) соответственно) (рис. 7 и 8). Все типы атомов лития, кроме Li(2), участвуют в связывании фрагментов [Cr(Сpdc)3]3– между собой за счет координации атомов O карбоксильных групп, не участвующих в хелатировании атома Cr(1) (O(2), O(4), O(6), O(8), O(12) и O(19)). В формирующейся таким образом 3D-полимерной структуре слои из катионов лития чередуются со слоями анионных фрагментов [Cr(Cpdc)3]3– (рис. 9). Кратчайшее расстояние Cr···Cr в пределах такого слоя равно 7.33 Å, между соседними слоями – 7.184 Å. Структура комплекса III дополнительно стабилизирована сетью водородных связей, в образовании которых принимают участие сольватные молекулы воды O(12w), координированные к атомам Li(4) и Li(7) молекулы воды O(7w), O(8w) и O(11w) и карбоксилатные атомы O (табл. 3).
Рис. 7.
Элементарный фрагмент полимерной структуры III: строение анионного фрагмента [Cr(Cpdc)3]3– и его связывание с неэквивалентными атомами лития (циклопропановые фрагменты анионов кислоты и атомы водорода молекул воды не показаны).
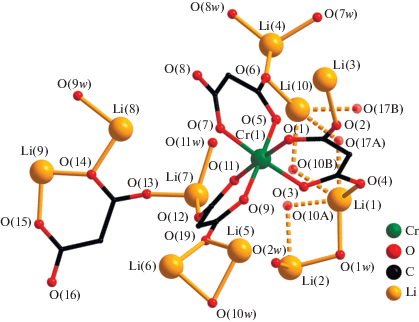
Рис. 8.
Фрагмент слоя, образованного атомами лития, в структуре III (циклопропановые фрагменты анионов кислоты и атомы водорода не показаны).
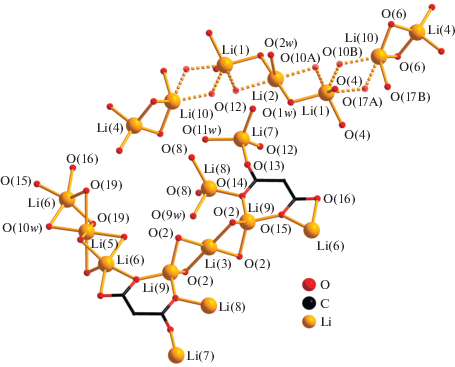
Рис. 9.
Фрагмент каркасной структуры III, образованной слоями взаимосвязанных атомов лития и анионными фрагментами [Cr(Cpdc)3]3– (циклопропановые фрагменты анионов кислоты и атомы водорода не показаны).
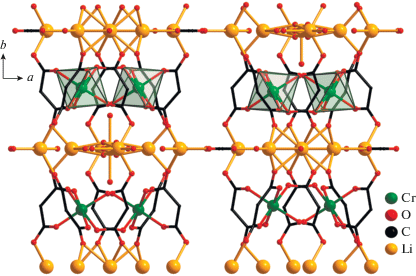
Таким образом, в ряду синтезированных и структурно охарактеризованных соединений M(I)−Cr(III) с анионами Cpdc2– (M(I) = Li, Na, K) природа щелочного металла оказывает влияние на состав и организацию полимерной структуры в кристалле и при этом не влияет на ее размерность – все три соединения имеют 3D-полимерное строение. В случае катионов K+ (соединение I), несмотря на достаточное для формирования комплекса [Cr(Cpdc)3]3– количество карбоксилат-анионов в реакционной системе (соотношение Cr : Cpdc2– = 1 : 3), формируется фрагмент [Cr(Cpdc)2(H2O)2]–, содержащий только два аниона кислоты. В системах с катионами Na+ и Li+ (соединения II и III) происходит образование трисхелатного анионного “блока” [Cr(Cpdc)3]3–, однако в случае Na+ в формировании полимерной структуры в кристалле дополнительно участвуют анионы ${\text{NO}}_{{\text{3}}}^{--},$ а в случае Li+ – анионные фрагменты {Li(Cpdc)}–, в которых анион дикарбоновой кислоты образует шестичленный хелатный цикл с ионом Li+. Кроме того, кристаллические структуры II и III имеют схожую послойную организацию – в них слои связанных межу собой катионов Na+ или Li+ чередуются со слоями, образованными фрагментами [Cr(Cpdc)3]3–. В отличие от них, слои каркасной структуры I образованы анионными фрагментами [Cr(Cpdc)2(H2O)2]–, связанными между собой катионами K+.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Guo M.-L., Wang F.-Q. // Acta Crystallogr. C. 2010. V. 66. P. m184.
Gil-Hernández B., Gili P., Pasán J. et al. // CrystEngComm. 2012. V. 14. P. 4289.
Gil-Hernández B., Calahorro A.J., Gili P., Sanchiz J. // Dalton Trans. 2017. V. 46. P. 5260.
Бажина Е.С., Гоголева Н.В., Зорина-Тихонова Е.Н. и др. // Журн. структур. химии. 2019. Т. 60. № 6. С. 893 (Bazhina E.S., Gogoleva N.V., Zorina-Tikhonova E.N. et al. // J. Struct. Chem. 2019. V. 60. P. 855).
Bazhina E.S., Gogoleva N.V., Aleksandrov G.G. et al. // Chem. Select. 2018. P. 13765.
Bazhina E.S., Aleksandrov G.G., Kiskin M.A. et al. // Eur. J. Inorg. Chem. 2018. P. 5075.
Бажина Е.С., Никифорова М.Е., Александров Г.Г. и др. // Изв. АН. Сер. хим. 2011. № 5. С. 779 (Bazhina E.S., Nikiforova M.E., Aleksandrov G.G. et al. // Russ. Chem. Bull. (Int. Ed.). 2011. V. 60. P. 797).
Бажина Е.С., Александров Г.Г., Сидоров А.А., Еременко И.Л. // Коорд. химия. 2015. Т. 41. № 11. С. 657 (Bazhina E.S., Aleksandrov G.G., Sidorov A.A., Eremenko I.L. // Russ. J. Coord. Chem. 2015. V. 41. P. 730). https://doi.org/10.1134/S1070328415110019
Dobrokhotova Zh.V., Gogoleva N.V., Zorina-Tikhonova E.N. et al. // Eur. J. Inorg. Chem. 2015. P. 3116.
Schwarz T., Petri A., Schilling J., Lentz A. // Acta Crystallogr. C. 1998. V. 54. P. 1104.
Petri A., Schwarz T., Schilling J., Lentz A. // Acta Crystallogr. C. 1999. V. 55. P. 1247.
Song T.-Q., Dong J., Gao H.-L., Cui J.-Zh. // Inorg. Chim. Acta. 2017. V. 466. P. 393.
Song T.-Q., Dong J., Yang A.-F. et al. // Inorg. Chem. 2018. V. 57. P. 3144.
Рабинович В.А., Хавин З.Я. Краткий химический справочник. Л.: Химия, 1978. С. 22.
Aromì G., Bell A.R., Helliwell M. et al. // Chem. Eur. J. 2003. V. 9. P. 3024.
Klausmeyer K.K., Wilson S.R., Rauchfuss T.B. // J. Am. Chem. Soc. 1999. V. 121. P. 2705.
Du M., Bu X.-H., Guo Y.-M., Ribas J. // Chem. Eur. J. 2004. V. 10. P. 1345.
Фурсова Е.Ю., Кузнецова О.В., Романенко Г.В. и др. // Изв. АН. Сер. хим. 2006. № 11. С. 1863 (Fursova E.Yu., Kuznetsova O.V., Romanenko G.V., Ovcharenko V.I. // Russ. Chem. Bull. (Int. Ed.). 2006. V. 55. P. 1933).
Khanra S., Helliwell M., Tuna F. et al. // Dalton Trans. 2009. P. 6166.
Leong W.L., Vittal J.J. // New J. Chem. 2010. V. 34. P. 2145.
Hazra A., Gupta S., Roy S. et al. // Polyhedron. 2011. V. 30. P. 187.
Dobrokhotova Zh., Emelina A., Sidorov A. et al. // Polyhedron. 2011. V. 30. P. 132.
Gupta S., Kirillova M.V., Guedes da Silva M.F.C. et al. // Inorg. Chem. 2013. V. 52. P. 8601.
González-Riopedre G., Bermejo M.R., Fernández-García M.I. et al. // Inorg. Chem. 2015. V. 54. P. 2512.
Beyer A., von Gernler M.S., Pflock S. et al. // Eur. J. Inorg. Chem. 2018. V. 2018. P. 765.
Jiang Y., Wang T., Bai M., Jiang J. // Dyes and Pigments. 2018. V. 157. P. 133.
Луценко И.А., Кискин М.А., Александров Г.Г. и др. // Изв. АН. Сер. хим. 2018. № 3. С. 449 (Lutsenko I.A., Kiskin M.A., Alexandrov G.G. et al. // Russ. Chem. Bull. (Int. Ed.). 2018. V. 67. P. 449).
Butler K.R., Snow M.R. // Dalton Trans. 1976. P. 251.
Scaringe R.P., Hatfield W.E., Hodgson D.J. // Inorg. Chem. 1977. V. 16. P. 1600.
Lethbridge J.W. // Dalton Trans. 1980. P. 2039.
Radanovic D.J., Trifunovic S.R., Grujic S.A. et al. // Inorg. Chim. Acta. 1989. V. 157. P. 33.
Hernandez-Molina M., Lorenzo-Luis P.A., Ruiz-Perez C. et al. // Inorg. Chim. Acta. 2001. V. 313. P. 87.
Lemmer M., Lerner H.-W., Bolte M. // Acta Crystallogr. E. 2002. V. 58. P. m447.
Ghosh D., Powell D.R., Van Horn J.D. // Acta Crystallogr. E. 2004. V. 60. P. m764.
Delgado F.S., Sanchiz J., Lopez T. et al. // CrystEngComm. 2010. V. 12. P. 2711.
Bazhina E.S., Kiskin M.A., Korlyukov A.A. et al. // Eur. J. Inorg. Chem. 2020.
Бажина Е.С., Шмелев М.А., Корлюков А.А. и др. // Коорд. химия. 2021. Т. 47. № 2. С. 69 (Bazhina E.S., Shmelev M.A., Korlyukov A.A. et al. // Russ. J. Coord. Chem. 2021. V. 47. P. 105). https://doi.org/10.1134/S1070328421020019
SMART (control) and SAINT (integration) Software. Version 5.0. Madison (WI, USA): Bruker AXS, Inc., 1997.
Sheldrik G.M. SADABS. Program for Scanning and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 2004.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Zorina-Tikhonova E.N., Gogoleva N.V., Sidorov A.A. et al. // Eur. J. Inorg. Chem. 2017. P. 1396.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия