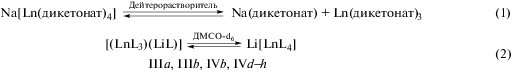Координационная химия, 2021, T. 47, № 4, стр. 245-260
Функционализированный трифторметилсодержащий β-дикетонат лития в синтезе редкоземельных гомо- и гетероядерных комплексов
Ю. С. Кудякова 1, П. А. Слепухин 1, И. Н. Ганебных 1, Я. В. Бургарт 1, В. И. Салоутин 1, Д. Н. Бажин 1, *
1 Институт органического синтеза им. И.Я. Постовского УрО РАН
Екатеринбург, Россия
* E-mail: dnbazhin@gmail.com
Поступила в редакцию 12.09.2020
После доработки 27.10.2020
Принята к публикации 29.10.2020
Аннотация
Взаимодействие функционализированного CF3-β-дикетоната лития (LiL) с солями трехвалентных редкоземельных металлов в среде метанола приводит к гомобиядерным и гетероби(три)ядерным комплексам в зависимости от природы переходного металла и аниона (хлориды, нитраты, ацетаты). В случае лантана(III) и церия(III) выделены гомолептические комплексы состава [(LnL3)2] (CIF files CCDC № 2031097 (Ia), 2031102 (Ib)). В реакции LiL с нитратом празеодима(III) получена новая триметаллическая структура [(LiPrL3)(LiL)(NO3)(H2O)2] (CIF file CCDC № 2031103 (II)), а замена на его хлорид дает [(PrL3)(LiL)(H2O)] (CIF file CCDC № 2031104 (IIIa)). Независимо от природы аниона соли в ряду от неодима(III) до иттербия(III), а также иттрия(III) наблюдается формирование Ln-Li β-дикетонатов состава [(LnL3)(LiL)(solv)] (solv = H2O, MeOH), структура которых охарактеризованa методом РСА (CIF files CCDC 2031099 (IIIb), 2031100 (IIIc), 2031098 (IVa), 2031096 (IVc), 2031094 (IVf), 2031101 (IVg), 2031095 (IVh)). С помощью ЯМР 19F спектроскопии исследовано равновесие дикетонатных изомерных форм в растворе дейтерированного диметилсульфоксида, а методом масс-спектрометрии установлен качественный состав полиядерных комплексов.
β-Дикетоны являются уникальной платформой для создания металлорганических структур [1–4]. Образование координационных соединений на их основе с большинством элементов Периодической системы открывает путь в создании новых перспективных материалов, обладающих разнообразным спектром физико-химических свойств, таких как люминесцентные [5–11], магнитные [12–16], каталитические [17]. Синтез как моно-, так и полиядерных гомо(гетеро-)металлических β-дикетонатов является принципиальным этапом для дальнейшего получении оксидных материалов с заданным стехиометрическим соотношением элементов [18–24].
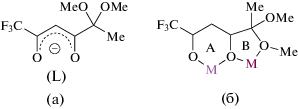
Ранее мы разработали подход к функционализированному трифторсодержащему дикетонату лития (LiL), на основе которого были синтезированы гетеробиметаллические биядерные комплексы [(LnL3)(LiL)(MeOH)], [(LnL3)(LiL)(H2O)] (Ln = Eu, Tb, Dy) [25], [LiLnL4(H2O)](CH3CN) (Ln = Eu, Tb) [26], M[TbL4] (M = Na, K, Cs) [27], (CuL2)(Pb(Hfa)2) [28], в том числе обладающие перспективными (механо)люминесцентными, магнитными свойствами. Наличие метоксигрупп в α-положении к дикарбонильному фрагменту расширяет координационные возможности дикетонат-аниона в получении биметаллических комплексов, что продемонстрированно с помощью типов координации (A и В). Структура используемого β-дикетонат-аниона L (схема 1 а) и реализуемые им координационные возможности (схема 1 б).
Схема 1 .
Под действием сильных кислот Льюиса дикетонат лития LiL образует фурановое производное [29] – удобный строительный блок для получения различных гетероциклических систем, включая биоактивные [30–34].
В настоящей работе мы исследовали возможности функционализированного β-дикетоната лития LiL в получении гомо(гетеро-)металлических комплексов в зависимости от природы иона редкоземельного металла и неорганического аниона.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом новых комплексов, выполняли на воздухе с использованием коммерческих реактивов (LaCl3 · 6H2O, La(NO3)3 · 6H2O, CeCl3 · 6H2O, PrCl3 · 6H2O, Pr(NO3)3 · 6H2O, NdCl3 · 6H2O, SmCl3 · 6H2O, Gd(NO3)3 · 6H2O, HoCl3 · 6H2O, Ho(OAc)3 · 6H2O, ErCl3 · 6H2O, YbCl3 · 6H2O (для всех чистота не ниже 99.9%), метанол (99%, Alfa Aesar). Трифторметилсодержащий β-дикетонат лития LiL синтезирован согласно [30]. Дикетонаты [(LnL3)(LiL)-(MeOH)] (IVb, IVd, IVe) полученны согласно [25].
ИК-спектры соединений регистрировали на ИК-Фурье спектрометре PerkinElmer Spectrum One в интервале 400–4000 см–1 с использованием приставки диффузного отражения для твердых веществ. Элементный анализ выполняли на автоматическом анализаторе PerkinElmer PE 2400 Series II. Спектры ЯМР 19F (376 МГц) регистрировали на спектрометре Bruker DRX-500 (500 МГц) с C6F6 в качестве внутреннего стандарта (δF = = ‒162.9 м.д. относительно CFCl3).
Масс-спектры комплексов записывали для их растворов в метаноле в режиме регистрации положительных ионов в диапазоне масс 50–2800 Да на квадрупольно-времяпролетном масс-спектрометре высокого разрешения MaXis Impact HD (Bruker Daltonics) с установленным стандартным источником электрораспылительной ионизации при шприцевом вводе на скорости потока 180 мкл/ч в модифицированном методе Tune_pos_standard. Калибровка шкалы масс – внешняя по стандартной смеси G1969-85000 (Agilent Technologies). Сбор и обработка данных проведена в программном пакете (Bruker) версии 1.7 и Compass DataAnalysis версии 4.2 (Bruker). Значение рассчитанной массы иона приводится на основании точных масс наиболее распространенных изотопов атомов, входящих в состав иона, тогда как ожидаемая масса получена на основании симуляционного масс-спектра, исходя из приборного разрешения с помощью программного обеспечения масс-спектрометра.
Синтез комплексов (I–IV) (общая методика). К β-дикетонату лития LiL (2 ммоль) в 15 мл метанола добавляли соль лантанида (0.5 ммоль). Полученную суспензию нагревали до кипения и выдерживали до образования прозрачного раствора, после чего охлаждали до комнатной температуры, пропускали через слой Celite® 545. Медленное упаривание растворителя приводило к образованию кристаллов комплекса IV. В случае соединений I–III кристаллы получали перекристаллизацией из этанола.
Выход 220 мг (53%). Бесцветные кристаллы.
ИК-спектр (DRA; ν, см–1): 3000, 2951, 2843 ν(C–H), 1682, 1632 ν(C=O), 1451, 1437 νas(CH3), 1246–1139 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 88.1. ESI-MS: найдено 1647.1456 для C48H60O24F18LiLa2 ([La2LiL6]+), рассчитано 1647.1469, ожидаемое 1647.1470
.Выход 178 мг (43%). Желтые кристаллы.
ИК-спектр (DRA; ν, см–1): 3001, 2949, 2844 ν(C–H), 1680, 1633 ν(C=O), 1453, 1436 νas(CH3), 1238–1142 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 89.5.
ESI-MS: найдено 1649.1454 для C48H60O24F18LiCe2 ([Ce2LiL6]+), рассчитано 1649.1450, ожидаемое 1659.1451.
| Найдено, %: | С 33.91; | H 3.65; | N 1.05. |
| Для C32H44NO21F12Li2Pr (II) | |||
| вычислено, %: | С 33.09; | H 3.82; | N 1.21. |
Выход 464 мг (80%). Бесцветные кристаллы.
ИК-спектр (DRA; ν, см–1): 3585–3493 ν(O–H), 2994–2845 ν(C–H), 1639 ν(C=O), 1488–1428 νas(CH3), 1249–1140 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 87.7, 91.9 (в соотношении 1 : 1.3). ESI-MS: найдено 1063.1507 для C32H40O16F12Li2Pr ([PrLi2L4]+), рассчитано 1063.1516, ожидаемое 1063.1517.
Выход 356 мг (66%). Голубые кристаллы.
ИК-спектр (DRA; ν, см–1): 3580–3496 ν(O–H), 2993–2844 ν(C–H), 1636 ν(C=O), 1486–1424 νas(CH3), 1244–1139 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 88.0, 90.5, 91.6 (в соотношении 1 : 0.4 : 5.8). ESI-MS: найдено 1063.1502 для C32H40O16F12Li2Pr ([PrLiL4]+), рассчитано 1063.1516, ожидаемое 1063.1517.
Выход 210 мг (39%). Голубые кристаллы.
ИК-спектр (DRA; ν, см–1): 3585–3494 ν(O–H), 2989–2846 ν(C–H), 1636 ν(C=O), 1481–1422 νas(CH3), 1242–1140 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 87.8, 89.9, 90.5 (в соотношении 1 : 0.25 : 3). ESI-MS: найдено 1064.1503 для C32H42O17F12Li2Nd ([NdLi2L4]+), рассчитано 1064.1517, ожидаемое 1064.1519.
Выход 256 мг (50%). Бесцветные кристаллы.
ИК-спектр (DRA; ν, см–1): 3587–3496 ν(O–H), 2993–2848 ν(C–H), 1637 ν(C=O), 1483–1419 νas(CH3), 1240–1137 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 87.8, 87.9 (в соотношении 1 : 0.23). ESI-MS: найдено 1011.1498 для C32H40O16F12Li2Y ([YLi2L4]+), рассчитано 1011.1498, ожидаемое 1011.1499.
ИК-спектр (DRA; ν, см–1): 3539–3489 ν(O–H), 3002–2840 ν(C–H), 1632 ν(C=O), 1463–1436 νas(CH3), 1189–1143 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 87.7, 88.1 (в соотношении 1 : 2.9). ESI-MS: найдено 1074.1636 для C32H40O16F12Li2Sm ([SmLi2L4]+), рассчитано 1074.1637, ожидаемое 1074.1639
.ИК-спектр (DRA; ν, см–1): 3694, 3395 ν(O–H), 2949, 2841 ν(C–H), 1634 ν(C=O), 1519, 1473, 1435 νas(CH3), 1187, 1139 ν(C–F). Спектр ЯМР 19F (δ, м.д., (CD3)2SO): 84.2, 84.9, 87.8 (в соотношении 7 : 1 : 3). ESI-MS: найдено 1075.1646 для C32H40O16F12Li2Eu ([EuLi2L4]+), рассчитано 1075.1652, ожидаемое 1076.1656.
Выход 312 мг (57%). Бесцветные кристаллы.
ИК-спектр (DRA; ν, см–1): 3695 ν(O–H), 2997–2841 ν(C–H), 1635 ν(C=O), 1475–1436 νas(CH3), 1188–1136 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 75.9–86.3, 87.7 (в соотношении 1.3 : 1). ESI-MS: найдено 1080.1694 для C32H40O16F12Li2Gd ([GdLi2L4]+), рассчитано 1080.1680, ожидаемое 1080.1690.
ИК-спектр (DRA; ν, см–1): 3695, 3387 ν(O–H), 2950, 2841 ν(C–H), 1635 ν(C=O), 1519, 1476 s, 1437 νas(CH3), 1188, 1141 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 87.8, 111.5, 117.7 (в соотношении 3 : 1 : 9). ESI-MS: найдено 1081.1685 для C32H40O16F12Li2Tb ([TbLi2L4]+), рассчитано 1081.1693, ожидаемое 1081.1694.
ИК-спектр (DRA; ν, см–1): 3695, 3383 ν(O–H), 2949, 2841 ν(C–H), 1635 ν(C=O), 1518, 1476 s, 1435 νas(CH3), 1186, 1139 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 87.7, 106.1, 120.2 (в соотношении 2 : 1 : 6). ESI-MS: найдено 1086.1736 для C32H40O16F12Li2Dy ([DyLi2L4]+), рассчитано 1086.1731, ожидаемое 1086.1741.
Выход 410 мг (74%). Бесцветные кристаллы.
ИК-спектр (DRA; ν, см–1): 3695 ν(O–H), 2996–2841 ν(C–H), 1634 ν(C=O), 1477–1436 νas(CH3), 1185–1137 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 87.7, 96.2, 102.1 (в соотношении 1 : 0.5 : 2.1). ESI-MS: найдено 1087.1735 для C32H40O16F12Li2Ho [HoLi2L4]+, рассчитано 1087.1743, ожидаемое 1087.1744.
Выход 423 мг (76%). Бесцветные кристаллы.
ИК-спектр (DRA; ν, см–1): 3692 ν(O–H), 2995–2840 ν(C–H), 1635 ν(C=O), 1474–1435 νas(CH3), 1183–1138 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 71.5, 72.6, 87.7 (в соотношении 1 : 0.3 : 0.4). ESI-MS: найдено 1088.1704 для C32H40O16F12Li2Er ([ErLi2L4]+), рассчитано 1088.1742, ожидаемое 1088.1745.
Выход 413 мг (74%). Бесцветные кристаллы.
ИК-спектр (DRA; ν, см–1): 3636 ν(O–H), 2997–2841 ν(C–H), 1639 ν(C=O), 1479–1437 νas(CH3), 1202–1133 ν(C–F). Спектр ЯМР 19F ((CD3)2SO; δ, м.д.): 78.6, 81.1, 87.8 (в соотношении 1 : 0.3 : 0.5). ESI-MS: найдено 1096.1824 для C32H40O16F12Li2Yb ([YbLi2L4]+), рассчитано 1096.1828, ожидаемое 1096.1835.
РСА. Кристаллографические данные для монокристаллов комплексов I–IV получены на автоматическом четырехкружном дифрактометре с CCD-детектором Xcalibur 3 по стандартной процедуре (МоKα-излучение, графитовый монохроматор, ω-сканирование с шагом 1° при Т = 295(2) К). Введена эмпирическая поправка на поглощение. Структура определена прямым статистическим методом и уточнена полноматричным МНК по F 2 в анизотропном приближении для всех неводородных атомов. Атомы водорода помещены в геометрически рассчитанные положения и уточнены в модели “наездника” Все расчеты проведены в программной оболочке Olex [35] c использованием программного пакета SHELX [36]. Форма координационных полиэдров [LnOx] рассчитана с помощью программы SHAPE [37, 38]. Кристаллографические данные и параметры и детали уточнения структур для I–IV приведены в табл. 1.
Таблица 1.
Основные кристаллографические характеристики и параметры рентгеноструктурного эксперимента для комплексов I–IV
| Параметр | Значение | |||||
| Ia | Ib | II | IIIa | IIIb | IIIc | |
| Брутто-формула | C48H60O24F18La2 | C48H60O24F18Ce2 | C32H44NO21F12Li2Pr | C32H42O17F12LiPr | C32H42O17F12LiNd | C32H42O17F12LiY |
| M | 1640.78 | 1643.20 | 1161.47 | 1074.51 | 1077.84 | 1022.51 |
| Температура, K | 295(2) | |||||
| Сингония | Моноклинная | |||||
| Пр. гр. | P21/c | C2/c | P21/c | P21/c | P21/c | |
| Параметры ячейки: | ||||||
| a, Å | 13.3363(6) | 13.3713(4) | 39.816(2) | 17.0662(6) | 17.0444(8) | 17.1022(13) |
| b, Å | 21.0621(11) | 21.1070(8) | 12.6508(6) | 12.0958(5) | 12.0918(7) | 11.9268(7) |
| c, Å | 24.0099(11) | 24.0242(10) | 24.3826(13) | 22.5016(10) | 22.4600(12) | 22.110(2) |
| β, град | 101.507(4) | 101.643(4) | 125.243(5) | 94.515(3) | 94.352(5) | 94.052(8) |
| V, Å3 | 6608.6(5) | 6640.8(4) | 10030.4(11) | 4630.6(3) | 4615.6(4) | 4498.5(6) |
| Z | 4 | 4 | 8 | 4 | 4 | 4 |
| ρ(выч.), г см–3 | 1.649 | 1.644 | 1.5381 | 1.5412 | 1.551 | 1.510 |
| μ, мм–1 | 1.398 | 1.476 | 1.086 | 1.163 | 1.236 | 1.411 |
| Размер кристалла, мм | 0.43 × 0.31 × 0.26 | 0.45 × 0.37 × 0.29 | 0.35 × 0.30 × 0.25 | 0.48 × 0.39 × 0.26 | 0.42 × 0.33 × 0.25 | 0.43 × 0.36 × 0.29 |
| θmin–θmax, град | 3.42–30.92 | 3.42–30.89 | 3.52–26.37 | 3.49–30.87 | 3.49–30.93 | 3.53–27.10 |
| F(000) | 3264 | 3272 | 4675.3662 | 2161.5076 | 2164 | 2080 |
| Rint | 0.0530 | 0.0631 | 0.0792 | 0.0486 | 0.0447 | 0.0627 |
| Интервалы индексов отражений | –17 ≤ h ≤ 17 –24 ≤ k ≤ 29 –32 ≤ l ≤ 34 | –18 ≤ h ≤ 19 –30 ≤ k ≤ 29 –33 ≤ l ≤ 31 | –49 ≤ h ≤ 49 –15 ≤ k ≤ 15 –30 ≤ l ≤ 30 | –22 ≤ h ≤ 23 –17 ≤ k ≤ 15 –31 ≤ l ≤ 18 | –23 ≤ h ≤ 20 –17 ≤ k ≤ 16 –30 ≤ l ≤ 31 | –21 ≤ h ≤ 21 –9 ≤ k ≤ 15 –28 ≤ l ≤ 28 |
| Измерено отражений | 44 263 | 44 623 | 30 223 | 32 354 | 32 059 | 27 912 |
| Независимых отражений | 17 871 | 17 557 | 10 230 | 12 560 | 12 417 | 9802 |
| Число отражений с I > 2σ(I) | 10 014 | 9717 | 6882 | 7481 | 7945 | 5614 |
| GOOF | 1.012 | 1.002 | 1.019292 | 1.085404 | 1.027 | 1.008 |
| R-факторы | R1 = 0.0603 | R1 = 0.0594 | R1 = 0.0510 | R1 = 0.0666 | R1 = 0.00578 | R1 = 0.0558 |
| по F 2 > 2σ(F 2) | wR2 = 0.1429 | wR2 = 0.1360 | wR2 = 0.1579 | wR2 = 0.1112 | ||
| R-факторы по всем | R1 = 0.1194 | R1 = 0.1185 | R1 = 0.0834 | R1 = 0.1132 | R1 = 0.0987 | R1 = 0.1216 |
| отражениям | wR2 = 0.1925 | wR2 = 0.1917 | wR2 = 0.1368 | wR2 = 0.2471 | wR2 = 0.2089 | wR2 = 0.1439 |
| Остаточная электронная плотность (max/min), e/Å3 | 1.305/–1.734 | 1.531/–1.854 | 0.964225/–1.172986 | 1.459/–1.925 | 1.069/–1.790 | 0.738/–0.508 |
| Параметр | Значение | |||||
| IVa | IVc | IVf | IVg | IVh | ||
| Брутто-формула | C33H44F12O17LiSm | C33H44O17F12LiGd | C33H44O17F12LiHo | C33H44O17F12LiEr | C33H44O17F12LiYb | |
| M | 1097.97 | 1104.87 | 1112.55 | 1114.88 | 1120.66 | |
| Температура, K | 295(2) | |||||
| Сингония | Моноклинная | |||||
| Пр. гр. | Pn | |||||
| Параметры ячейки: | ||||||
| a, Å | 12.3045(4) | 12.2645(5) | 12.3093(4) | 12.3233(7) | 12.2414(5) | |
| b, Å | 12.2281(3) | 12.2046(6) | 12.1904(3) | 12.2192(6) | 12.1590(4) | |
| c, Å | 15.9129(5) | 15.8864(7) | 15.8189(4) | 15.8767(9) | 15.8128(4) | |
| β, град | 94.840(3) | 94.702(4) | 94.475(3) | 94.374(5) | 94.475(3) | |
| V, Å3 | 2385.72(12) | 2369.93(18) | 2366.47(12) | 2383.8(2) | 2346.45(13) | |
| Z | 2 | 2 | 2 | 2 | 2 | |
| ρ(выч.), г см–3 | 1.528 | 1.548 | 1.561 | 1.553 | 1.586 | |
| μ, мм–1 | 1.340 | 1.509 | 1.782 | 1.869 | 2.104 | |
| Размер кристалла, мм | 0.44 × 0.38 × 0.27 | 0.35 × 0.30 × 0.25 | 0.44 × 0.38 × 0.31 | 0.44 × 0.39 × 0.31 | 0.41 × 0.36 × 0.32 | |
| θmin–θmax, град | 3.571–30.803 | 2.11–30.90 | 2.58–29.44 | 2.58–29.44 | 3.599–30.903 | |
| F(000) | 1102 | 1106 | 1112 | 1114 | 1118 | |
| Rint | 0.0418 | 0.0254 | 0.0387 | 0.0456 | 0.0403 | |
| Интервалы индексов отражений | –17 ≤ h ≤ 16 –17 ≤ k ≤ 17 –22 ≤ l ≤ 20 | –17 ≤ h ≤ 14 –8 ≤ k ≤ 17 –18 ≤ l ≤ 21 | –16 ≤ h ≤ 15 –16 ≤ k ≤ 16 –21 ≤ l ≤ 21 | –17 ≤ h ≤ 16 –17 ≤ k ≤ 9 –21 ≤ l ≤ 21 | –17 ≤ h ≤ 17 –16 ≤ k ≤ 17 –13 ≤ l ≤ 22 | |
| Измерено отражений | 31 117 | 12 931 | 28 710 | 15 810 | 19 345 | |
| Независимых отражений | 11 804 | 8011 | 10 471 | 9220 | 7970 | |
| Число отражений с I > 2σ(I) | 9522 | 6991 | 9621 | 7020 | 6329 | |
| GOOF | 1.025 | 1.004 | 1.010 | 1.030 | 1.043 | |
| R-факторы | R1 = 0.0475 | R1 = 0.0385 | R1 = 0.0336 | R1 = 0.0539 | R1 = 0.0467 | |
| по F2 > 2σ(F2) | wR2 = 0.1254 | wR2 = 0.0960 | wR2 = 0.0882 | wR2 = 0.1372 | wR2 = 0.1242 | |
| R-факторы по всем | R1 = 0.0661 | R1 = 0.0479 | R1 = 0.0385 | R1 = 0.0780 | R1 = 0.0651 | |
| отражениям | wR2 = 0.1585 | wR2 = 0.0960 | wR2 = 0.0951 | wR2 = 0.1742 | wR2 = 0.1572 | |
| Остаточная электронная плотность (max/min), e/Å3 | 1.193/–1.546 | 0.816/–0.722 | 1.509/–0.935 | 1.646/–2.414 | 1.315/–1.558 | |
Координаты атомов и другие параметры структур I–IV депонированы в Кембриджском банке структурных данных (№ 2031097 (Ia), 2031102 (Ib), 2031103 (II); 2031104 (IIIa), 2031099 (IIIb), 2031100 (IIIc), 2031098 (IVa), 2031096 (IVc), 2031094 (IVf), 2031101 (IVg), 2031095 (IVh); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При использовании редкоземельных металлов в реакции с CF3-β-дикетонатом лития LiL были получены разнообразные гетерометаллические структуры в зависимости от природы иона металла, а в некоторых случаях и от природы аниона (табл. 2). Для хлоридов и нитратов лантана(III) и церия(III) в реакциях с LiL результатом взаимодействия являются гомолептические комплексы состава [(LnL3)2] (Ia, Ib, cхема 2). В реакциях LiL с солями празеодима(III) выделены два типа дикетонатов: [(LiPrL3)(LiL)(NO3)(H2O)2] (II) и [(PrL3)(LiL)-(H2O)] (IIIa) в зависимости от природы используемого аниона (cхема 2).
Таблица 2.
Основные геометрические характеристики серии гетерометаллических Ln-Li дикетонатов
| Состав комплекса | Расстояние, Å | Геометрия [LnOn]* | Литература | |||
|---|---|---|---|---|---|---|
| Ln–O | Ln–μ2-O | Ln···Ln | Ln···Li* | |||
| [(LaL3)2] (Ia) | 2.421–2.800 | 2.561–2.759 | 3.807 10.039 |
JSPC-10 | ||
| [(CeL3)2] (Ib) | 2.417–2.804 | 2.547–2.725 | 3.785 10.104 |
JSPC-10 | ||
| [(LiPrL3)(LiL)(NO3)(H2O)2] (II) | 2.438–2.468 | 2.497–2.709 | 10.219 | 3.570 3.639 |
JSPC-10 | |
| [(PrL3)(LiL)(H2O)] (IIIa) | 2.399–2.559 | 2.419–2.457 | 9.610 | 3.564 | TDD-8 | |
| [(NdL3)(LiL)(H2O)] (IIIb) | 2.392–2.554 | 2.404–2.448 | 9.618 | 3.536 | TDD-8 | |
| [(YL3)(LiL)(H2O)] (IIIc) | 2.302–2.480 | 2.305–2.376 | 9.630 | 3.469 | TDD-8 | |
| [(SmL3)(LiL)(MeOH)] (IVa) | 2.351–2.556 | 2.384–2.443 | 10.557 | 3.505 | TDD-8 | |
| [(EuL3)(LiL)(MeOH)] | 2.334–2.533 | 2.362–2.426 | 10.527 | 3.498 | TDD-8 | 25 |
| [(EuL3)(LiL)(H2O)] | 2.346–2.523 | 2.361–2.412 | 9.613 | 3.508 | TDD-8 | 25 |
| [LiEuL4(H2O)](CH3CN) | 2.352–2.389 | 2.420–2.461 | 9.560 | 3.568 | BTPR-8 | 26 |
| [(GdL3)(LiL)(MeOH)] (IVc) | 2.322–2.529 | 2.361–2.411 | 10.564 | 3.479 | TDD-8 | |
| [(TbL3)(LiL)(MeOH)] | 2.306–2.505 | 2.350–2.404 | 10.552 | 3.471 | TDD-8 | 25 |
| [(TbL3)(LiL)(H2O)] | 2.320–2.503 | 2.330–2.389 | 9.923 | 3.494 | TDD-8 | 25 |
| [LiTbL4(H2O)](CH3CN) | 2.344–2.368 | 2.398–2.448 | 9.545 | 3.535 | BTPR-8 | 26 |
| [(DyL3)(LiL)(MeOH)] | 2.298–2.504 | 2.340–2.395 | 10.615 | 3.452 | TDD-8 | 25 |
| [(DyL3)(LiL)(H2O)] | 2.311–2.496 | 2.321–2.383 | 9.633 | 3.482 | TDD-8 | 25 |
| [(HoL3)(LiL)(MeOH)] (IVf) | 2.289–2.489 | 2.322–2.381 | 10.597 | 3.455 | TDD-8 | |
| [(ErL3)(LiL)(MeOH)] (IVg) | 2.298–2.501 | 2.300–2.355 | 10.643 | 3.457 | TDD-8 | |
| [(YbL3)(LiL)(MeOH)] (IVh) | 2.270–2.476 | 2.260–2.350 | 10.591 | 3.439 | TDD-8 | |
Схема 2.
Установлено, что взаимодействие солей трехвалентных металлов (хлоридов, нитратов или ацетатов) в ряду от неодима(III) до иттербия(III) приводит к структурам [(PrL3)(LiL)(solv)] (IIIb, IVa, IVc, IVf–IVh) (Ln = Nd, Sm, Hd, Ho, Er, Yb) (cхема 2), аналогичных описанным ранее биметаллическим дикетонатам Ln-Li (IVb, IVd, IVe) (Ln = Tb(III), Eu(III), Dy(III)) [24]. При этом с подавляющим большинством используемых лантанидов образуются гетероядерные комплексы IVa–IVh с молекулой МеОН в качестве солиганда, и только в комплексе IIIb иона Nd(III), имеющего соизмеримый ионный радиус с ионом Pr(III), в состав входит молекула воды. Из ряда редкоземельных металлов (РЗМ) хлорид иттрия(III) дает комплекс [(YL3)(LiL)(H2O)] (IIIc) аналогично основному ряду лантанидов от празеодима до иттербия.
Во всех синтезированных комплексах с ионами РЗМ наблюдается образование Ln(III) трис-дикетонатного фрагмента. Дальнейшее насыщение координационных возможностей иона металла зависит от его радиуса.
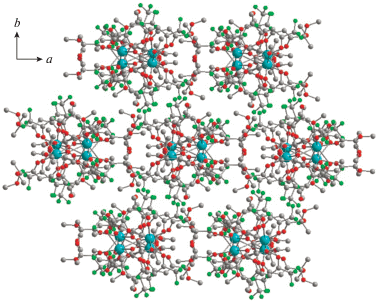
В случае комплексов Ia и Ib (лантана(III) и церия(III)), имеющих самые большие ионные радиусы среди трехвалентных ионов РЗМ, два трис-дикетонатных фрагмента образуют нейтральную биядерную структуру Ia, Ib без включения дополнительных солигандов (рис. 1а). По данным РСА, атомы кислорода метоксизаместителя и карбонильной группы, смежной с ацетальным фрагментом лиганда (тип координации B, схема 1б), выступают в качестве мостиковых гетероатомов между двумя ионами Ln(III) (рис. 1б). В каждом трис-дикетонатном фрагменте одна из молекул лиганда образует шестичленный металлоцикл посредством моды A (рис. 1в). В отличие от биядерных комплексов [Ln(Dpm)3]2, полученных на основе дипивалоилметана с семикоординированными ионами лантанидов [21, 39, 40], в соединениях Ia, Ib координационное окружение ионов 4f-металла включает десять атомов кислорода лигандов. Два полиэдра [LnO10] имеют общую грань из четырех мостиковых атомов кислорода дикетонатов и наиболее близко описываются геометрией клинокороны (табл. 2, рис. 2а). Внутримолекулярное расстояние Ln…Ln составляет 3.8066(4) и 3.7853(4) Å для комплексов Ia и Ib соответственно. Для сравнения аналогичный параметр La…La для комплекса [La(Dpm)3]2 равен 4.1028(5) Å [34]. Таким образом, вовлечение дополнительных координационных атомов кислорода метоксигрупп лиганда приводит к уменьшению расстояния между атомами лантанидов. Диапазон длин связей Ln…O в трис-дикетонатном фрагменте составляет 2.4214…2.8001 Å, что сопоставимо со значениями, регистрируемыми для связей лантанида с мостиковыми атомами кислорода и находящимися в интервале 2.5607…2.7293 Å. В кристаллической упаковке соединений Ia, Ib биметаллические остовы молекул ориентируются вдоль оси а (рис. 3).
Рис. 1.
Молекулярное строение комплексов Ia (Ln = La) и Ib (Ln = Ce) (атомы водорода не показаны) (a); организация биметаллического остова c участием двух дикетонат-анионов с мостиковыми атомами кислорода (б); два дикетоната, не участвующих в дополнительной координации (в).
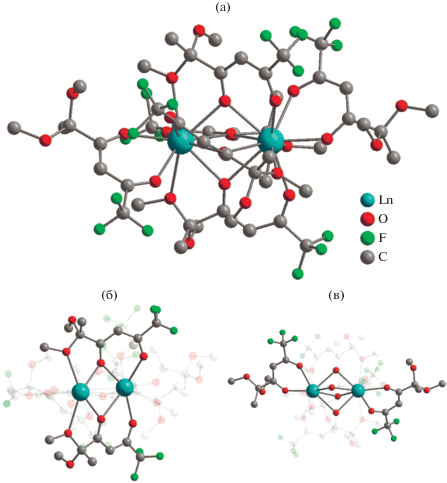
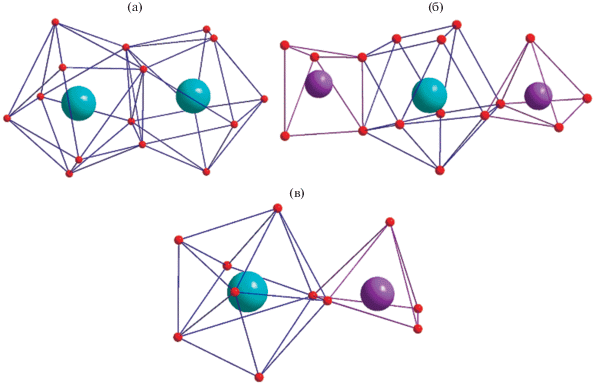
Рис. 2.
Геометрии координационных полиэдров LnOx (х = 8, 10) и LiO5 у гомолептических комплексов состава Ia, Ib (а), триметаллического дикетоната II (б), биядерных соединений IIIa–IIIc, IVa–IVh (в).
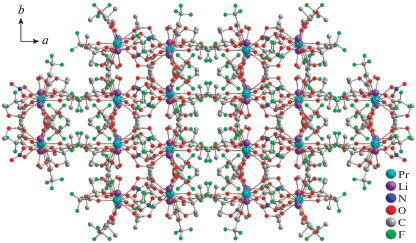
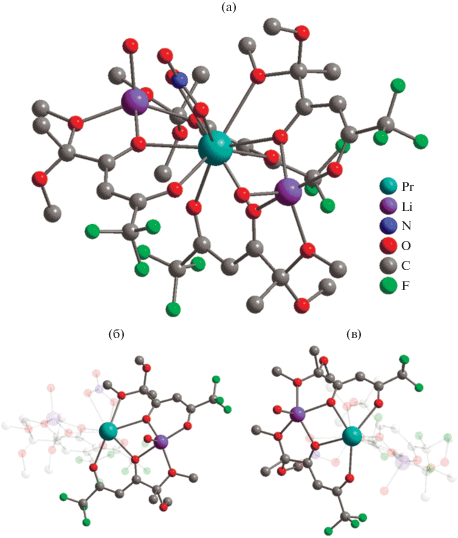
Комплекс II имеет более сложное строение по данным РСА. Триметаллическая структура соединения II, содержащая десятикоординированный ион празеодима(III) и два атома лития, образована за счет координации четырех дикетонат-анионов (рис. 4а). Один из лигандов трис-дикетонатного фрагмента участвует в хелатировании атома лития исходной молекулы LiL (рис. 4б). Насыщение координационного окружения иона празеодима(III) в II достигается за счет нитрат-аниона, трех дикетонат-анионов (тип координации А, рис. 4в), одной метоксигруппы и мостикового атома кислорода дикарбонильного фрагмента LiL (тип координации B, рис. 4б). Необычная структура комплекса II включает второй ион лития, координация которого также происходит за счет четырех атомов кислорода двух дикетонатных молекул (метоксигрупп и кислорода дикетонатного фрагмента, тип координации B) (рис. 4в). Расстояние между атомом празеодима(III) и атомом лития LiL составляет 3.5704(137) Å (рис. 4б), большее значение (3.6388(173) Å) достигается для второй пары Pr(III)-Li(I) (рис. 4в). Два иона лития в комплексе II дополнительно координируются молекулами воды. Геометрия координационного полиэдра вокруг иона празеодима(III) схожа с найденной для комплексов Ia, Ib и соответствует клинокороне (табл. 2, рис. 2б). В кристаллической упаковке соединения II триметаллические остовы молекул ориентируются вдоль оси с (рис. 5).
Рис. 4.
Молекулярная структура комплекса II (атомы водорода не показаны) (а); организация биядерного Pr-Li фрагмента с участием лигандов из трис-дикетонатного фрагмента (б); организация биядерного Pr-Li фрагмента с участием лиганда из трис-дикетонатного фрагмента и LiL (в).
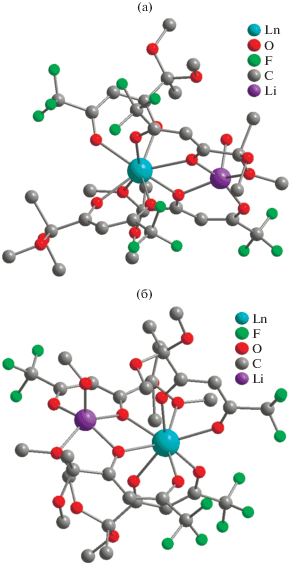
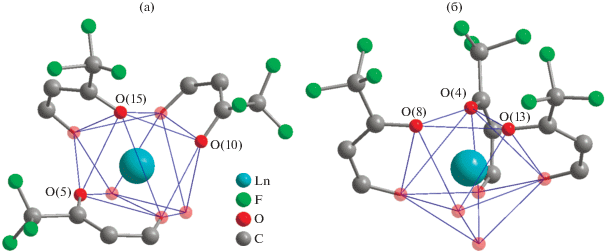
По данным РСА, биядерные гетерометаллические комплексы [(LnL3)(LiL)(solv)] (IIIa–IIIc, IVa–IVh) – нейтральные β-дикетонаты и кристаллизуются в пространственных группах P21/c и Pn моноклинной системы соответственно (табл. 1; рис. 6). В случае соединений на основе празеодима(III), неодима(III) и иттрия(III) наиболее подходящим растворителем для кристаллизации оказался этанол. В ряду от Sm(III) до Yb(III) успешный рост кристаллов IVa–IVh наблюдался при использовании метанола. В комплексах IIIa–IIIc, IVa–IVh атом Ln(III) восьмикоординирован за счет кислородов трех дикетонат-анионов (тип координации А), а также за счет метоксигруппы и мостикового атома кислорода дикетоната лития (тип координации B) (аналогично рис. 4б). Атом лития достраивает свое координационное окружение до [LiO5] за счет атомов кислорода двух дикетонатов (тип координации А и B), а также молекулы растворителя. Для соединений IIIa–IIIc в качестве солиганда при атоме лития выступает молекула воды, в случае соединений IVa–IVh – метанол.
Комплексы IIIa–IIIc и IVa–IVh имеют схожую геометрию полиэдра [LnO8], соответствующую тригональному додекаэдру (табл. 2, рис. 2в). Однако эти два типа комплексов отличаются между собой расположением дикетонат-анионов, формирующих координационное окружение [LnO8]. В случае продуктов IIIa–IIIc атомы кислорода (O(5), O(10), O(15)) дикарбонильного фрагмента, смежные с трифторметильным заместителем лигандов, располагаются в вершинах двух соседних ребер [LnO8] (рис. 7a). В отличие от этого у соединений IVa–IVh схожие атомы кислорода (O(4), O(8), O(13)) занимают одну из граней полиэдра, а три молекулы лиганда из Ln(III) трис-дикетонатного фрагмента находятся в цис-положении по отношению друг к другу (рис. 7б). Имея различные по природе заместители в дикарбонильном фрагменте лиганда, их расположение вокруг иона лантанида влияет на кристаллическое поле металла и приводит к изменениям физико-химических свойств комплексов. В подтверждение этого значения времени жизни послесвечения для [(LnL3)(LiL)(MeOH)] превосходило соответствующие комплексы [(LnL3)(LiL)(H2O)] (Eu(III), Tb(III), Dy(III) [25].
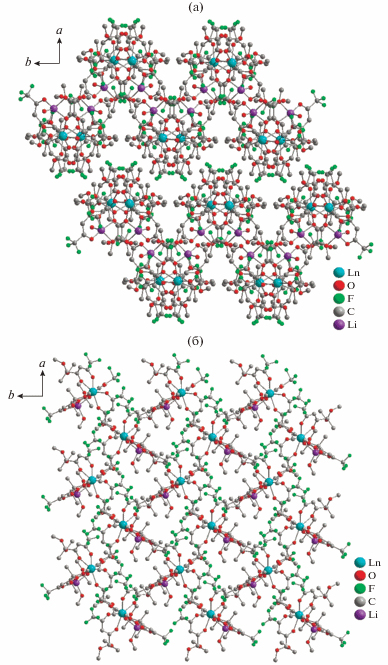
Соединения IIIa–IIIc и IVa–IVh имеют различную кристаллическую упаковку (рис. 8). Молекула воды в комплексах IIIa–IIIc участвуют в образовании межмолекулярных водородных связей, что приводит к сближению [LiO5]-полиэдров молекул и формированию зигзагообразных цепочек вдоль оси b (рис. 8). В комплексах IIIa–IIIc наблюдается меньшее межмолекулярное расстояние Ln…Ln по сравнению с IVa–IVh (табл. 2).
Рис. 8.
Кристаллическая упаковка комплексов III (a) и IV (б) вдоль оси с (атомы водорода не показаны).
Ранее было показано, что исследование лантанидных дикетонатов методом спектроскопии ЯМР 19F дает важную информацию о составе и структуре комплексов в растворе [23, 41–43]. Ранее для Ln(III) тетракис-дикетонатов натрия предполагалось равновесие, в котором участвуют три типа металлосодержащих дикетонатов согласно схеме 3 (уравнение 1) [23, 41, 42]. Другой возможностью является сосуществование в растворе двух изомерных форм тетракис-дикетоната [43].
Схема 3 .
Установлено, что для гомолептических биядерных дикетонатов Ia, Ib, содержащих только ионы лантанидов, наблюдаются уширенные синглетные сигналы CF3-группы в диапазоне δF = = 88–89 м.д., которые можно отнести к Ln(III) связанным трис-дикетонатным фрагментам. При этом химические сдвиги атомов фтора для этих соединений смещены в слабое поле относительно значения исходного LiL, равного δF = 87.7 м.д. согласно [30].
Во всех спектрах ЯМР 19F соединений II–IV присутствует литий дикетонатный фрагмент (LiL) при δF ≈ 87.7 м.д., который в отличие от спектра соли LiL имеет уширенный вид, что свидетельствует о сохранении координации молекулы дикетоната лития с лантанидным фрагментом в растворе. Различие комплексов II–IV заключается в наборе сигналов, соответствующих CF3-группам дикетонатных остатков, координированных с Ln(III). Примечательно, что спектры ЯМР 19F дикетонатов би- и триметаллических дикетонатов Pr(III) II, IIIa различаются набором сигналов атомов фтора и значениями химических сдвигов. В случае соединения II регистрируется фрагмент [PrL3] при δF ≈ 91.9 м.д., тогда как для IIIа наблюдается два сигнала при δF = 90.5 и 91.6 м.д., которые можно отнести к трис- и тетракис-формам [PrL3] и [PrL4] соответственно, присутствующих в растворе. Аналогично комплексу II в спектрах соединений IIIс, IVa, IVc наблюдается один сигнал CF3-групп, соответствующий трис-формам [LnL3]. Тогда как дикетонаты [(LnL3)(LiL)(solv)] (IIIa, IIIb, IVb, IVd–IVh) содержат трис-форму [LnL3] и тетракис-форму [LnL4]. Атомы фтора CF3-групп дикетонатов IIIa–IIIc, IVa–IVc, связанных с ионами от Pr(III) до Gd(III), включая иттрий(III), резонируют в более сильном поле при δF ≈ 84–91 м.д. по сравнению с сигналами группы комплексов Tb(III)–Ho(III) (IVd–IVg), которые регистрируются в более слабом поле и находятся в диапазоне значений δF ≈ 96–120 м.д. Отметим, что атомы фтора комплекса IVc, отвечающие CF3-группе лиганда, координирующегося с ионом гадолиния(III), дают уширенный сигнал в несколько м.д. На основании полученных данных можно сделать вывод о равновесии двух форм большинства литий-лантанидных комплексов III, IV (cхема 3, уравнение 2).
Масс-спектры всех комплексов имеют сложный характер и представлены несколькими ионными кортежами в виде катионов, где помимо обычных протонированных, аммониевых, натриевых и калиевых форм важное место занимает β‑дикетонат лития (C8H10F3LiO4). Последний присутствует в масс-спектрах всех соединений собственными кортежами катионов в области низких масс [nM + Kat]+ (n = 1–4), из которых наиболее интенсивен ион лития +241.0846 Да, а также наблюдается во всем масс-спектре в виде разницы масс между различными пиками в 234.069 Да. В масс-спектрах можно выделить два типа кортежей наблюдаемых ионов: [LnL4]+ и $[{\text{Ln}}{{{\text{L}}}_{{\text{3}}}}]_{{\text{2}}}^{ + },$ которые дополнительно сопровождаются ионами, соответствующими потере либо присоединению лиганда и необходимым изменением количества протонов. Например, [LnL3]+ и [(LnL3)2 + L]+ и [(LaL3)2 – L]+. Можно также отметить ионы, полученные как результат потери молекул метанола. Наличие частиц NO3 или молекул воды и метанола в составе комплексов II–IV на общий вид масс-спектров, которые записывают для растворов в метаноле, не влияет.
Для соединений I сигналы ионов второго типа $[{\text{Ln}}{{{\text{L}}}_{{\text{3}}}}]_{{\text{2}}}^{ + }$ слабые или отсутствуют. Масс-спектры соединений II–IV качественно похожи, при этом ионы второго типа могут быть как интенсивными, так и умеренно выраженными. Для празеодима получены два типа комплексов: соединения II и IIIa. Масс-спектр соединения IIIa (с меньшим стехиометрическим количеством лития), содержит существенно больше интенсивных пиков, но включает в себя все интенсивные пики масс-спектра соединения II.
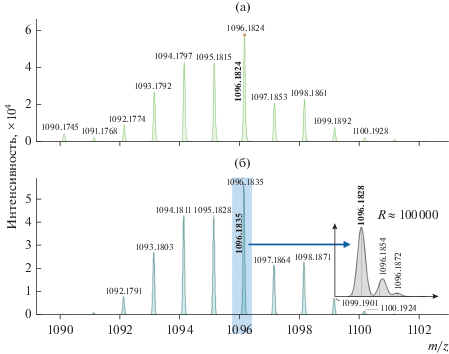
Следует также заметить, что в силу недостаточной разрешающей способности использованного масс-спектрометра (до 40 000) для ряда соединений не достигается полное разрешение пиков в требуемой области. Это происходит вследствие того, что ряд полиизотопных элементов, например гадолиний или иттербий, имеют широкое распределение по массам изотопов, а также из-за большого количества лития в образце. В результате масс-спектрометр фиксирует не индивидуальные моноизотопные ионы, а сигнал-суперпозицию наложений нескольких разноизотопных ионов, отличающихся по массе от моноизотопных на 0.1–1.0 мДа в зависимости от атома металла. Поэтому экспериментально полученные значения масс ионов (рис. 9а) сравнивали не со значением масс моноизотопных ионов, а с расчетными значениями, полученными в результате симуляционных расчетов при заданном приборном разрешении (рис. 9б).
Рис. 9.
Вид экспериментального масс-спектра IVh (разрешение R ≈ 17 000) (а), симуляция масс-спектра соединения IVh с расчетной (при разрешении R ≈ 17 000) и ожидаемой (R ≈ 100 000) массой молекулярного иона (б).
В данной работе показано, что результатом взаимодействия функционализированного CF3-β-дикетоната лития с солями трехвалентных редкоземельных металлов в среде метанола являются гомо- и гетероядерные лантанидные β-дикетонаты в зависимости от радиуса иона металла. Для лантана и церия выделены гомолептические комплексы [LnL3] (Ia, Ib), содержащие два иона переходного металла. В случае празеодима выделены два типа комплексов II и IIIa, что определяется природой аниона соли. В комплексах Ia, Ib и II ионы лантанидов десятикоординированны, тогда как для бигетероядерных [(LnL3)(LiL)(solv)] (II-Ia–IIIc, IVa–IVh) – восьмикоординированы. На основании рентгеноструктурных данных установлено, что наличие ацетальной группы в структуре лиганда определяет координацию лиганда с ионами лития и редкоземельных металлов и способствует формированию дискретных структур би(три)металлических комплексов.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Brock A.J., Clegg J.K., Li F., Lindoy L.F. // Coord. Chem. Rev. 2018. V. 375. P. 106.
Vigato P.A., Peruzzo V., Tamburini S. // Coord. Chem. Rev. 2009. V. 253. P. 1099.
Condorelli G.G., Malandrino G., Fragala I.L. // Coord. Chem. Rev. 2007. V. 251. P. 1931.
Binnemans K. // Chem. Rev. 2009. V. 109. P. 4283.
Kudyakova Y.S., Bazhin D.N., Burgart Y.V., Saloutin V.I. // Mendeleev Comm. 2016. V. 26. P. 54.
Пугачев Д.Е., Кострюкова Т.С., Ивановская Н.Г. Лямин А.И. и др. // Журн. общ. химии. 2019. Т. 89. С. 779 (Pugachyov D.E., Kostryukova T.S., Ivanovs-kaya N.G. et al. // Russ. J. Gen. Chem. 2019. V. 89. P. 965).
Metlina D.A., Metlin M.T., Ambrozevich S.A., Taydakov I.V. et al. // J. Lumin. 2018. V. 203. P. 546.
Метлин М.Т., Амброзевич С.С., Красносельский А.Г. и др. // Изв. АН. Сер. хим. 2016. Т. 65. С. 1784 (Metlin M.T., Ambrozevich S.A., Krasnosel’sky S.S. et al. // Russ. Chem. Bull. 2016. V. 65. P. 1784).
Тайдаков И.В., Аветисов Р.И., Дацкевич Н.П. // Коорд. химия. 2019. Т. 45. С. 763 (Taydakov I.V., Avetisov R.I., Datskevich N.P. // Russ. J. Coord. Chem. 2019. V. 45. P. 883). https://doi.org/10.1134/S0132344X1910077
Bukvetskii B.V., Mirochnik A., Zhikhareva P.A. // Luminescence. 2017. V. 27. P. 773.
Bukvetskii B.V., Shishov A., Mirochnik A.G. // Luminescence. 2016. V. 31. P. 1329.
Фокин С.В., Овчаренко В.И., Романенко Е.В. и др. // Изв. АН. Сер. хим. 2011. Т. 60 С. 798 (Fokin S.V., Ovcharenko V.I., Romanenko G.V. et al. // Russ. Chem. Bull. 2011. V. 60. P. 816).
Стариков А.Г., Цатурян А.А., Старикова А.А. и др. // Изв. АН. Сер. хим. 2018. Т. 67. С. 1182 (Starikov A.G., Tsaturyan А.А., Starikova А.А. et al. // Russ. Chem. Bull. 2018. V. 67. P. 1182).
Артюхова Н.А., Романенко Г.В., Летягин Г.А. и др. // Изв. АН. Сер. хим. 2019. Т. 68. С. 732 (Artiukhova N.A., Romanenko G.V., Letyagin G.A. et al. // Russ. Chem. Bull. 2019. V. 68. P. 732).
Кузнецова О.В., Фурсова Е.Н., Летягин Г.А. и др. // Изв. АН. Сер. хим. 2018. Т. 67. С. 1202 (Kuznetsova O.V., Fursova E.Yu., Letyagin G.A. et al. // Russ. Chem. Bull. 2018. V. 67. P. 1202).
Кузнецова О.В., Романенко Г.В., Богомяков А.С. и др. // Коорд. химия. 2020. Т. 46. С. 451 (Kuznetsova O.V., Romanenko G.V., Bogomyakov A.S. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 521). https://doi.org/10.31857/S0132344X20070038
Zhang T., Pan J., Duan J. et al. // ChemCatChem. 2019. V. 11. P. 5778.
Urkasym kyzy S., Krisyuk V.V., Turgambaeva A.E. et al. // J. Struct. Chem. 2019. V. 60. P. 1635.
Peddagopu N., Rossi P., Bonaccorso C. et al. // Dalton Trans. 2020. V. 49. P. 1002.
Turgambaeva A.E., Krisyuk V.V., Baidina I.A. et al. // J. Struct. Chem. 2017. V. 58. P. 1530.
Urkasym kyzy S., Shen H., Mosyagina S.A. et al. // J. Struct. Chem. 2018. V. 59. P. 433.
Lieberman C.M., Filatov A.S., Wei Z. et al. // Chem. Sci. 2015. V. 6. P. 2835.
Barry M.C., Wei Z., He T. et al. // J. Am. Chem. Soc. 2016. V. 138. P. 8883.
Wei Z., Han H., Filatov A.S., Dikarev E.V. // Chem. Sci. 2014. V. 5. P. 813.
Bazhin D.N., Kudyakova Y.S., Bogomyakov A.S. et al. // Inorg. Chem. Front. 2019. V. 6. P. 40.
Кудякова Ю.С., Слепухин П.А., Валова М.С. и др. // Коорд. химия. 2020. Т. 46. С. 485 (Kudyakova Y.S., Slepukhin P.A., Valova M.S. et al. // Russ. J. Coord. Chem. 2020. V. 46. P. 48). https://doi.org/10.31857/S0132344X20070026
Kudyakova Y.S., Slepukhin P.A., Valova M.S. et al. // Eur. J. Inorg. Chem. 2020. V. 2020. P. 523.
Krisyuk V.V., Urkasym Kyzy S., Rybalova T.V. et al. // J. Coord. Chem. 2018. V. 71. P. 2194.
Bazhin D.N., Kudyakova Y.S., Burgart Y.V., Saloutin V.I. // Russ. Chem. Bull. 2018. V. 68. P. 497.
Bazhin D.N., Chizhov D.L., Röschenthaler G.-V. et al. // Tetrahedron Lett. 2014. V. 55. P. 5714.
Bazhin D.N., Kudyakova Y.S., Röschenthaler G.-V. et al. // Eur. J. Org. Chem. 2015. P. 6306.
Kudyakova Y.S., Onoprienko A.Y., Slepukhin P.A. et al. // Chem. Heterocycl. Comp. 2019. V. 55. P. 517.
Bazhin D.N., Kudyakova Y.S., Onoprienko A.Y. et al. // Chem. Heterocycl. Compd. 2017. V. 53. P. 1324.
Bazhin D.N., Kudyakova Yu.S., Slepukhin P.A. et al. // Mend. Commun. 2018. V. 28. P. 202.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Casanova D., Llunell M., Alemany P., Alvarez S. // Chem. Eur. J. 2005. V. 11. P. 1479.
Llunell M., Casanova D., Cirera J. et al. SHAPE. Version 2.1. Barcelona, 2013.
YuiKhan L., Mosyagina S.A., Stabnikov P.A. et al. // J. Struct. Chem. 2017. V. 58. P. 843.
Shen H., Berezin A.S., Antonova O.V. et al. // J. Struct. Chem. 2018. V. 59. P. 676.
Lin Y., Zou F., Wan S. et al. // Dalton Trans. 2012. V. 41. P. 6696.
Di Pietro S., Di Bari L. // Inorg. Chem. 2012. V. 51. P. 12007.
Monteiro B., Outis M., Cruz H., Leal J.P. // Chem. Commun. 2017. V. 53. P. 850.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия