Координационная химия, 2021, T. 47, № 5, стр. 307-316
Синтез и кристаллическая структура новых фторотрифторацетатометаллатов калия: Kn[M3(µ3-F)(CF3COO)6L3]L' (M = Co, Ni; L = CF3COO–, CF3COOH, H2O; L' = CF3COOH, H2O; n = 1, 2)
Т. Ю. Глазунова 1, *, Д. С. Терещенко 1, М. Е. Бузоверов 1, Е. В. Карпова 1, Э. Х. Лермонтова 2
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: ctpayc@mail.ru
Поступила в редакцию 03.07.2020
После доработки 22.09.2020
Принята к публикации 28.09.2020
Аннотация
Синтезированы и кристаллографически изучены четыре новых представителя семейства фторотрифторацетатометаллатов калия: K2[Co3(µ3-F)(CF3COO)6(CF3COO)(CF3COOH)2] · CF3COOH (I), K[Co3(µ3-F)(CF3COO)6(H2O)3] · H2O · 2CF3COOH (II), K[Ni3(µ3-F)(CF3COO)6(H2O)3] · H2O · · 2CF3COOH (III) и K2[Ni3(µ3-F)(CF3COO)6(CF3COOH)3][Ni3(µ3-F)(CF3COO)6(CF3COOH)2(H2O)] · · CF3COOH (IV). Во всех изученных структурах присутствуют трехъядерные треугольные комплексные анионы [M3(µ3-F)(CF3COO)6(L)3]n– (M = Ni, Co; L = CF3COO–, CF3COOH, H2O; n = 1, 2), сходные по своему строению с изученными ранее фторотрифторацетатометаллатами щелочных металлов и аммония. В центре треугольника из атомов Ni(II) или Co(II) находится µ3-мостиковый атом F. Шесть мостиковых трифторацетатных групп, располагающихся над и под плоскостью треугольника [M3F], попарно связывают атомы металла. Атомы кислорода лигандов L дополняют координационное окружение атомов M до октаэдрического. Показана возможность реализации у комплексного аниона [M3(µ3-F)(CF3COO)6L3] заряда –2. Последовательная замена аксиальных молекул трифторуксусной кислоты на воду приводит к изменению типа структуры от цепочечной (IV) до слоистой (II, III) и, далее, объемной сетки (I). Молекулярное строение комплексов I–IV установлено с помощью РСА (CIF files CCDC № 2010760 (I), 2010761 (II), 2010762 (III) и 2010763(IV)).
В настоящий момент одним из актуальных аспектов развития неорганической химии является направленный синтез веществ и материалов с заданными свойствами, в частности дизайн кристаллических структур комплексных соединений. Решение данной задачи открывает возможность направленно создавать новые материалы путем моделирования кристаллической структуры с целью тонкой настройки физических свойств вещества на нано-уровне.
Координационные соединения на основе трифторацетатов d-элементов, содержащие бесконечные цепочки или слои с треугольным мотивом размещения катионов металла, предоставляют новую платформу для изучения низкоразмерного магнетизма [1], а полиядерные карбоксилатные комплексы Co(II) и Ni(II) могут стать интересными объектами для изучения спин-спиновых обменных взаимодействий между парамагнитными ионами [2].
Низкоразмерные и фрустрированные магнитные системы, в которых установление дальнего магнитного порядка невозможно из-за геометрических особенностей обменных взаимодействий, являются в настоящий момент одними из самых обсуждаемых и многообещающих объектов химии и физики конденсированного состояния [3].
Данная работа продолжает исследования в области фторотрифторацетатометаллатов переходных металлов, где до настоящей работы описано всего 15 соединений [4–6] общей формулы [M3(µ3-F)- (CF3COO)6(CF3COOH)3]– (M = Mn–Ni), представлен единственный пример отличного по своему составу комплекса Na[Zn3(µ3-F)(CF3COO)6(H2O)3]- (H2O)4.34, содержащего молекулы воды в качестве аксиальных лигандов [6].
Единственная кристаллографическая систематизация ряда фторотрифторацетатометаллатов щелочных металлов, аммония и нитрозония общей формулы M'[M3(µ3-F)(CF3COO)6(L)3], где М' = Li–Cs, NH4, NO; M = Mn, Fe, Co, Ni, Zn; L = CF3COO–, CF3COOH, H2O представлена в обзоре [6].
Фторотрифторацетатометаллаты p-элементов представлены единственным примером – (PyH)4-[Mg3(μ3-F)(CF3COO)6(OCH3)2(Py)](OCH3) [7].
Структурный фрагмент M3(μ3-F) в кристаллических структурах других карбоксилатов представлен единичными примерами. Описаны гетерометаллические комплексы состава [Ni2Cr(μ3-F)(O2CtBu)6L3] (L = HO2CBut, C5H5N, (4-CH3)C5H4N)) [8], а также комплексы Cd [9], Co и Ni [10], относящиеся к металл-органическим каркасным материалам (MOF).
В настоящей работе синтетический подход, разработанный ранее для синтеза фторотрифтор-ацетатометаллатов переходных металлов [4–6], был модифицирован для получения новых соединений. Показана возможность изменения состава и, как следствие, кристаллического строения комплексов за счет варьирования условий синтеза. Обсуждается также строение треугольных трехъядерных анионов, координационное окружение катионов щелочного металла и особенности упаковки анионов и катионов в указанных структурах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реагентов использовали КНF2, P4O10, CF3COOH (все “х. ч.”) и Co(CF3COO)2 · · 4H2O, Ni(CF3COO)2 · 4H2O, синтезированные по методике [6].
В основе синтеза комплексов I–IV лежит хорошо отработанная нами методика получения фторотрифторацетатометаллатов щелочных металлов. Горячие насыщенные растворы тетрагидратов трифторацетатов кобальта или никеля и фторида щелочного металла в трифторуксусной кислоте (мольное соотношение 3 : 1) сливают и оставляют для кристаллизации в вакуум-эксикаторе над P4O10. Выпадающий сразу поле сливания растворов аморфный осадок, вероятно, фторида 3d-металла, перекристаллизовывается в течение недели в хорошо сформированные кристаллы фторотрифторацетатометаллатов щелочных металлов [6].
Синтез K2[Co3(µ3-F)(CF3COO)6(CF3COO)- (CF3COOH)2] · CF3COOH (I). Раствор 0.073г (0.94 ммоль) KHF2 в 5 мл CF3COOH добавляли к раствору 1.000 г (2.81 ммоль) Co(CF3COO)2 · 4H2O в 10 мл CF3COOH при перемешивании. Образовавшийся осадок отфильтровывали через бумажный фильтр “синяя лента”. Маточный раствор оставляли для кристаллизации в вакуум-эксикаторе над фосфорным ангидридом P4O10 при комнатной температуре, эксикатор вакуумировали примерно раз в 3 сут. В результате полного удаления жидкой фазы в течение 10–15 сут получили неустойчивые на воздухе красные хорошо сформированные кристаллы.
Встречный синтез (0.146 г (1.87 ммоль) KHF2, 1.000 г (2.81 ммоль) Co(CF3COO)2 · 4H2O, 20 мл CF3COOH) позволяет выделить соединение I в качестве единственного продукта реакции.
Синтез K[Co3(µ3-F)(CF3COO)6(H2O)3] · H2O · · 2CF3COOH (II), K[Ni3(µ3-F)(CF3COO)6(H2O)3] · · H2O · 2CF3COOH (III) и K2[Ni3(µ3-F)(CF3COO)6-(CF3COOH)3][Ni3(µ3-F)(CF3COO)6(CF3COOH)2-(H2O)] · CF3COOH (IV). Раствор 0.073 г (0.94 ммоль) KHF2 в 5 мл CF3COOH добавляли к раствору 1.000 г (2.81 ммоль) Co(CF3COO)2 · 4H2O или Ni(CF3COO)2 · 4H2O в 10 мл CF3COOH при нагревании до 80°С. Для получения соединений II и III реакционную смесь выдерживали при температуре 80°С в течение 2 ч. Далее, во всех случаях (II–IV) раствор оставляли для кристаллизации в вакуум-эксикаторе над P4O10 при комнатной температуре, эксикатор вакуумировали примерно раз в сутки. В течение 24–48 ч во всех случаях наблюдали кристаллизацию неустойчивых на воздухе соединений. Полное удаление жидкой фазы происходило в течение 5–10 сут.
Рентгенофазовый анализ (РФА) проводили на дифрактометре ДРОН3-М (CuKα1-излучение, Ge-монохроматор). Ввиду неустойчивости полученных соединений на воздухе, образцы готовили в герметичном боксе в атмосфере сухого азота и помещали под полистирольную пленку. Обработку дифрактограмм и индицирование полученных при интегрировании пиков проводили с помощью программы STOE WinXPOW. Идентификацию фаз проводили с помощью базы данных PC PDF [11].
Гигроскопичные кристаллы отбирали под слоем вазелинового масла под поляризационным микроскопом и быстро (менее чем за 1 мин) переносили их на дифрактометр, где обеспечивали их охлаждение потоком сухого газообразного азота.
РСА. Сбор рентгенодифракционных данных для кристаллов проведен на автоматических дифрактометрах Bruker SMART APEX II при температуре 150 К (для II и IV), 100 К (для III) и на дифрактометре Enraf-Nonius CAD4 при температуре 123 К (для I) с использованием MoKα-излучения (λ = 0.71073 A, графитовый монохроматор). Учет поглощения введен по измерениям интенсивностей эквивалентных отражений [12]. Структуры расшифрованы прямым методом и уточнены полноматричным анизотропным МНК по F 2 для всех неводородных атомов (SHELXTL-Plus [13]). Атомы водорода были помещены в рассчитанные позиции и уточнены с использованием схемы “наездника”. В случае комплекса IV молекулы растворителя разупорядочены и не могут быть адекватно смоделированы, поэтому при расшифровке этой структуры использована процедура SQUEESE программы PLATON [14]. Кристаллографические данные, детали эксперимента и уточнения структур I–IV приведены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения структур для I–IV
| Параметр | Значение | |||
|---|---|---|---|---|
| I | II | III | IV | |
| Брутто-формула | C20H3O20F31K2Co3 | C16H10O20F25KCo3 | C16H10O20F25KNi3 | C36H8O37F56K2Ni6 (+растворитель) |
| М | 1407.21 | 1213.13 | 1212.47 | 2526.88 |
| Размер кристалла, мм | 0.25 × 0.20 × 0.15 | 0.24 × 0.15 × 0.08 | 0.10 × 0.08 × 0.06 | 0.18 × 0.11 × 0.06 |
| Сингония | Моноклинная | Моноклинная | Моноклинная | Триклинная |
| Пр. гр. | P21/n | P21/n | P21/n | P1 |
| Параметры ячейки: | ||||
| a, Å | 15.196(2) | 13.1069(3) | 13.0239(6) | 13.9177(8) |
| b, Å | 17.942(2) | 13.9789(2) | 13.9153(6) | 17.1389(9) |
| c, Å | 16.492(2) | 20.9794(3) | 20.8055(8) | 18.7737(10) |
| α, град | 90 | 90 | 90 | 78.246(2) |
| β, град | 99.53(2) | 100.5980(10) | 100.423(2) | 86.370(2) |
| γ, град | 90 | 90 | 90 | 80.643(2) |
| V, Å3 | 4434.3(10) | 3778.28(12) | 3708.4(3) | 4323.8(4) |
| Z | 4 | 4 | 4 | 2 |
| ρ(выч.), г/см3 | 2.108 | 2.133 | 2.172 | 1.941 |
| μ(MoKα), мм−1 | 1.498 | 1.610 | 1.822 | 1.574 |
| F(000) | 2724 | 2364 | 2376 | 2460 |
| Область θ, град | 1.135–24.990 | 2.241–29.753 | 2.161–26.595 | 2.217–29.649 |
| Интервалы индексов | –3 ≤ h ≤ 18, –1 ≤ k ≤ 21, –19 ≤ l ≤ 19 |
–17 ≤ h ≤ 17, –18 ≤ k ≤ 18, –27 ≤ l ≤ 27 |
–16 ≤ h ≤ 16, –17 ≤ k ≤ 17, –25 ≤ l ≤ 26 |
–17 ≤ h ≤ 17, –21 ≤ k ≤ 21, –23 ≤ l ≤ 23 |
| Всего отражений | 16 286 | 46 384 | 42 931 | 64 982 |
| Независимых отражений (Rint) |
7791 (0.0539) | 9118 (0.0517) | 8092 (0.0967) | 16 952 (0.1472) |
| Количество уточняемых параметров | 718 | 689 | 653 | 1370 |
| R1 по I > 2σ(I) | 0.0752 | 0.0507 | 0.0688 | 0.0818 |
| wR2 (все данные) | 0.1960 | 0.0890 | 0.1230 | 0.1958 |
| GOOF | 1.067 | 1.099 | 1.061 | 0.935 |
| Δρmin/Δρmax, e/Å3 | –1.371/1.923 | –0.810/0.972 | –1.145/0.932 | –1.043/0.901 |
Структурные данные синтезированных комплексов депонированы в Кембриджской структурной базе данных (№ 2010760 (I), 2010761 (II), 2010762 (III) и 2010763 (IV); deposit@ccdc.cam.ac.uk; www: http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез фторотрифторацетатометаллатов общей формулы M'[M3(µ3-F)(CF3COO)6(L)3] (М' = = Li–Cs, NH4; M = Mn, Fe, Co, Ni, Zn; L = = CF3COO, CF3COOH, H2O) описан ранее в [4–6]. Первые трехъядерные фторотрифторацетатометаллаты нитрозония NO[Ni3(μ3-F)(CF3COO)6- (CF3COOH)3] и NO[Co3(μ3-F)(CF3COO)6(CF3COOH)3] получены случайно без добавления фторидов щелочных металлов при использовании трифторуксусной кислоты, содержащей ~0.05 мас. % HF в качестве примеси [4]. Позднее мы синтезировали и структурно изучили более 15 представителей семейства фторотрифторацетатометаллатов [6].
При рассмотрении ряда ближайших структурных аналогов фторотрифтороацетатометаллатов ряда щелочных металлов было показано влияние щелочного металла на формирование структуры. Чем больше радиус катиона, тем больше возможностей формирования водородных связей в структуре за счет включения сольватных молекул растворителя. Это было ранее показано на примере катионов Cs+, которые могут формировать соединения различного строения в зависимости от условий синтеза [5, 6].
Чем меньше радиус катиона, тем большим оказывается вклад σ-связей. Таким образом, соединения, содержащие Na и тем более Li, формируют структуру, в которой катион координирует по три атома кислорода соседних комплексных анионов, образуя 1D-полимерные структуры [6]. Благодаря увеличению радиуса катиона при переходе к K создается ситуация, когда окружение щелочного металла составляют не только атомы кислорода и фтора комплексных анионов, но и атомы кислорода сольватных лигандов. В этом случае (как будет показано ниже) за счет введения различных лигандов, не изменяющих природу соединения, формируются разные структурные типы, посредством реализующейся в каждом случае системы водородных связей. Получение каждого соединения возможно при неукоснительном соблюдении условий синтеза.
В представленной работе впервые осуществлен синтез и структурно изучен комплекс I, заряд комплексного аниона которого равен –2. Во внешней сфере комплекса присутствуют два атома калия. Возможность реализации двухзарядного комплексного аниона [M3(µ3-F)(CF3COO)6L3]2– показана впервые и дополнительно свидетельствует об устойчивости трехъядерного фторокарбоксилатного структурного фрагмента.
Отличие состава соединения I от номинального объясняется изменением состава реакционной смеси в процессе синтеза. В качестве исходного соединения использован гидродифторид калия KHF2. Концентрация ионов F– в реакционной смеси превышала концентрацию K+ в 2 раза, при этом поддерживалось соотношение K : Co : F = 1 : 3 : 2. Удаление из реакционной смеси мелкодисперсного осадка CoF2, выпадающего на первой стадии синтеза, привело к увеличению отношения К : Co и, как следствие, к образованию соединения I, в котором на один комплексный анион приходится два катиона щелочного металла. Данное предположение подтверждает встречный синтез, позволяющий выделить из раствора соединение I с соотношением K : Co : F = 2 : 3 : 1.
Соединения II и III получены из растворов, концентрирование которых проходило не только в эксикаторе над P2O5, но и посредством предварительного частичного выпаривания при 80°С. Создавались условия, приводящие к обеднению реакционной смеси, в первую очередь, трифторуксусной кислотой, а уже затем удалению из реакционной среды воды. В описанных ранее экспериментальных методиках получения фторотрифторацетатов щелочных металлов [5, 6] применяли только концентрирование растворов в эксикаторе над P2O5, при этом удается выделить соединения общей формулы K[M3(µ3-F)(CF3COO)6(CF3COOH)3], не содержащие в своем составе молекул воды [5]. Перемена условий синтеза и кристаллизации соединений в обоих случаях приводит к получению изоструктурных соединений II и III. Принципиальная возможность замены аксиальных лигандов в комплексных анионах [M3(µ3-F)(CF3COO)6-(CF3COOH)3] ↔ [M3(µ3-F)(CF3COO)6(H2O)3] показана впервые, что дополнительно свидетельствует об устойчивости каркаса [M3(µ3-F)].
Дополнительным подтверждением устойчивости трехъядерного остова [М3(µ3-F)(CF3COO)6L3] служит соединение IV, в котором сосуществуют комплексные анионы [Ni3(µ3-F)(CF3COO)6(CF3COOH)3]– и [Ni3(µ3-F)(CF3COO)6(CF3COOH)2(H2O)]–, аксиальные позиции атомов 3d-металла заняты как молекулами трифторуксусной кислоты, так и молекулами воды. Факт существования соединения IV показывает наличие в реакционной среде постоянно существующего равновесия [М3(µ3-F)- (CF3COO)6(CF3COOH)3]– ↔ [М3(µ3-F)(CF3COO)6-(CF3COOH)3–n(H2O)n]– и способствует выделению каждого из равновесных продуктов в зависимости от условий синтеза.
Кристаллические структуры I–IV образованы катионами калия и комплексными трехъядерными анионами: [Со3(µ3-F)(CF3COO)6(CF3COO)- (CF3COOH)2]2– в случае I, [М3(µ3-F)(CF3COO)6-(H2O)3]– (М = Co, Ni) – II, III и [Ni3(µ3-F)- (CF3COO)6(CF3COOH)2L]– (L = CF3COOH и H2O) – IV, схожими по своему строению с ранее описанными фторотрифторацетатометалатными анионами [4–6]. Атом фтора планарно координирует три атома 3d-металла, находящихся в вершинах искаженного (I) или практически правильного (II, III) треугольника. Расстояния М–F составляют от 2.004 до 2.040 Å (средн. 2.023 Å) для структуры I, в II, III длины связей М–F различаются значительно меньше и лежат в интервале от 2.0184(18) до 2.0298(17) Å (средн. 2.025 Å) для структуры II и от 1.991(3) до 2.007(3) Å (средн. 1.996 Å) для III, что связано с одинаковым координационным окружением. В структуре IV расстояния М–F составляют от 1.979(8) до 1.991(8) Å (средн. 1.986 Å) для аниона [Ni3(µ3-F)(CF3COO)6- (CF3COOH)3]– и от 1.973(7) до 2.002(8) Å (средн. 1.989 Å) для аниона [Ni3(µ3-F)(CF3COO)6- (CF3COOH)2(H2O)]–. В данном случае также наблюдается увеличениe диапазона расстояний М–F при замене одной аксиальной молекулы трифторуксусной кислоты на молекулу воды. Во всех структурах I–IV по обе стороны плоскости треугольника расположены по три мостиковые трифторацетатные группы, попарно связывающие атомы 3d-металла.
В структуре I (рис. 1а) координационное окружение атомов Со(1) и Со(2) дополняют до искаженно октаэдрического карбонильные атомы кислорода молекул трифторуксусной кислоты. В случае атома Со(3) роль аксиального лиганда выполняет трифторацетат-ион. Дополнительным подтверждением наличия в аксиальном положении атома Со(3) карбоксильного атома кислорода аниона трифторуксусной кислоты являются структурные характеристики. Длина связи Со–Оакс для Со(3) минимальна, длина связи Со–F, наоборот, принимает максимальное значение. Углы Со(1)F(1)Со(3) и Со(2)F(1)Со(3) равны между собой и составляют 121.9°, тогда как угол Со(1)F(1)Со(2) равен 116.2°. Карбоксильные группы, находящиеся в аксиальных положениях атомов Со(1) и Со(2) расположены с одной стороны от плоскости треугольника Со(1)…Со(2)…Со(3) и развернуты соответственно в сторону атомов кислорода О(1) и О(20) мостиковых трифторацетатных групп, с которыми участвуют в образовании водородных связей (расстояния О(10А)…О(1), О(10В)…О(1), О(12А)…О(20) и О(12В)…О(20) составляют, соответственно, 2.65(2), 2.64(2), 2.588(15) и 2.577(12) Å). Карбоксилатная группа, находящаяся в аксиальном положении атома Со(3) расположена по другую сторону треугольника Со(1)…Со(2)…Со(3) и развернута в сторону атома К(2) (расстояние О(18)…К(2) составляет 2.662(6), расстояние О(18) до ближайшего атома кислорода мостиковой трифторацетатной группы составляет более 3.5 Å).
Рис. 1.
Фрагменты кристаллической структуры I: комплексный анион [Со3(µ3-F)(CF3COO)6-(CF3COO)(CF3COOH)2]2– (а); их объединение в димеры (б); слои, расположенные параллельно плоскости {–1, 0, 0} (в). Атомы фтора трифторацетатных групп не показаны.
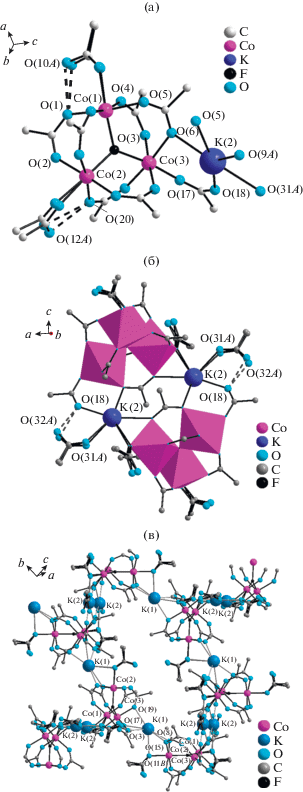
Комплексные анионы в структуре I объединены в димеры за счет взаимодействия атомов кислорода О(5), О(6) и О(9) мостиковых трифторацетатных групп и атомов кислорода О(18) аксиальных трифторацетатных групп с атомами калия K(2) (рис. 1б). Также в окружении K(2) присутствует карбонильный атом кислорода O(31) разупорядоченной молекулы трифторуксусной кислоты, гидроксильный атом кислорода О(32), которой принимает участие в образовании водородной связи с атомом О(18) аксиальной трифторацетатной группы.
Димеры в структуре I объединены в слои, расположенные параллельно плоскости {–1, 0, 0}, посредством атома калия K(1), координирующего атомы кислорода О(3), О(8), О(15), О(19) мостиковых трифторацетатных групп, а также карбонильные атомы кислорода О(11) аксиальной молекулы трифторуксусной кислоты и О(17) аксиальной трифторацетатной группы (рис. 1в).
В структурах соединений II и III система водородных связей, образованная сольватными молекулами воды и трифторуксусной кислоты, приводит к формированию слоев, при этом цепочки за счет координации атомов калия с атомами кислорода соседних треугольных комплексных анионов не образуются.
Атомы 3d-металлов, входящих в комплексные анионы изоструктурных соединений II и III характеризуются одинаковым координационным окружением. Октаэдрическое окружение составляют тридентатный атом фтора, четыре атома кислорода бидентатных трифторацетатных групп и атом кислорода молекулы воды. Различие в длинах связей атомов М с атомами кислорода и фтора ближайшего окружения обусловлено только образованием водородных связей в структурах и катионом калия.
Наличие в составе соединений II, III молекул воды в аксиальных позициях атомов металла трехъядерного комплексного аниона обеспечивает большой набор разнообразных типов водородных связей в этих структурах (рис. 2а). Во-первых, аксиальные молекулы воды участвуют в образовании системы водородных связей с соседними комплексными анионами. Так, Н(21А) и Н(21В) аксиальной молекулы воды координационного окружения М(1) принимают участие в образовании двух водородных связей с атомами кислорода бидентатных трифторацетатных групп О(2) и О(4) из координационного окружения М(3) соседнего трехъярного аниона, а атомы водорода Н(22А) и Н(22В) аксиальной молекулы воды из окружения М(2) образуют водородные связи с атомами кислорода бидентатных трифторацетатных групп О(10) и О(7) координационного окружения М(2) другого трехъядерного аниона.
Рис. 2.
Фрагмент кристаллической структуры II: система водородных связей, приводящая к формированию слоев (а); координационное окружение атома K (б). Атомы фтора трифторацетатных групп не показаны (а).
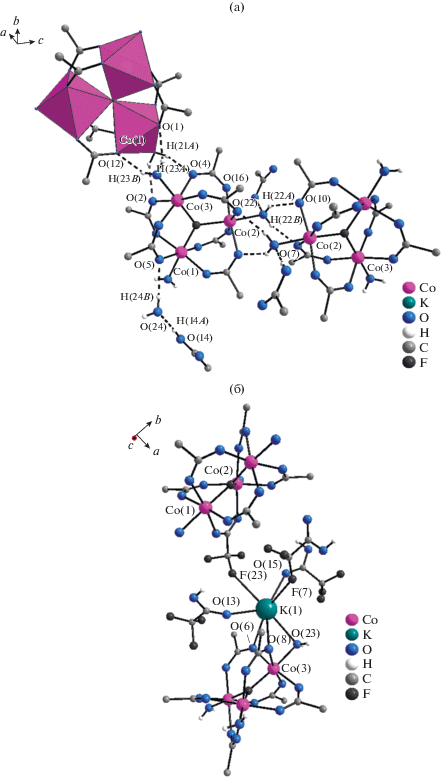
Кроме этого, в образовании водородных связей структур II, III задействованы некоординированные молекулы воды и трифторуксусной кислоты. Атом кислорода О(22) аксиальной молекулы воды из окружения М(2) образует водородную связь О(22)…Н(16)–О(16) с гидроксильным атомом водорода сольватной молекулы трифторуксусной кислоты. Атом кислорода О(5) бидентатной трифторацетатной группы из окружения М(1) образует водородную связь О(5)…Н(24В)–О(24) с сольватной молекулой воды, атом кислорода которой, в свою очередь, образует водородную связь О(24)…Н(14А)– О(14) со второй сольватной молекулой трифторуксусной кислоты.
Посредством системы водородных связей каждый трехъядерный анион в структурах II, III связан с тремя соседними анионами, что приводит к образованию отрицательно заряженных слоев, расположенных параллельно плоскости {1, 0, 1}.
Располагаясь между отрицательно заряженными слоями атомы K связывают слои в трехмерную структуру. В координационное окружение атома K(1) входят атомы кислорода О(6) и О(8) бидентатных трифторацетатных групп (из октаэдра М(3)), атом кислорода О(23) аксиальной молекулы воды (М(3)), карбонильные атомы кислорода О(13) и О(15) сольватных молекул трифторуксусной кислоты и два атома фтора трифторметильных групп, образуя таким образом одношапочную тригональную призму (рис. 2б).
В соединении IV мы можем наблюдать слоистую структуру, переходную между классическими цепочечными, описанными в литературе для соединений M'[М3(µ3-F)(CF3COO)6(CF3COOH)3] [4–6], в состав которых не входят молекулы воды, и трехмерными II, III.
В структуре IV координационное окружение атомов Ni дополняется до искаженно октаэдрического карбонильными атомами кислорода аксиальных молекул трифторуксусной кислоты и атомом кислорода молекулы воды. Так, в анионе [Ni3(µ3-F)(CF3COO)6(CF3COOH)3]– молекулы трифторуксусной кислоты располагаются по разные стороны от плоскости треугольника {Ni3}, одна из молекул разупорядочена. Гидроксильные атомы кислорода всех трех молекул трифторуксусной кислоты участвуют в образовании водородных связей с атомами кислорода бидентатных трифторацетатных групп этого комплексного аниона. В анионе [Ni3(µ3-F)(CF3COO)6(CF3COOH)2(Н2О)]– две разупорядоченные молекулы трифторуксусной кислоты, расположенные по одной стороне треугольника {Ni3}, участвуют в образовании внутримолекулярных водородных связей.
Чередующиеся комплексные анионы образуют цепочки за счет взаимодействия в одном случае атомов кислорода O(10), О(13), О(20), О(23) мостиковых трифторацетатных групп, карбонильного атома кислорода О(25) аксиальной молекулы трифторуксусной кислоты и атома кислорода О(40) аксиальной молекулы воды с атомами калия K(1) аналогично тому, что мы наблюдаем в соединениях II и III, и в другом случае – атомов кислорода О(6), О(11), О(15), О(28) мостиковых трифторацетатных групп и карбонильных атомов кислорода О(17), О(33) аксиальных молекул трифторуксусной кислоты с атомами калия K(2), подобно описанным в литературе фторотрифторацетатометаллатам [1]. В координационное окружение атома K(2) также входит карбонильный атом кислорода О(29) сольватной молекулы трифторуксусной кислоты (рис. 3, 4).
Рис. 3.
Фрагмент кристаллической структуры IV. Формирование цепочек посредством взаимодействия атома K(2) с атомами кислорода бидентатных трифторацетатных групп.
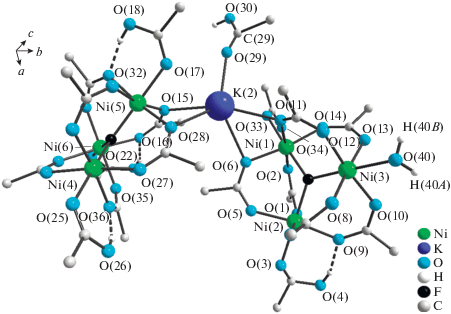
Рис. 4.
Фрагмент кристаллической структуры IV. Объединение цепочек в слои посредством системы водородных связей, образованных атомами водорода молекул воды и атомами кислорода мостиковых трифторацетатных групп соседнего комплексного аниона.
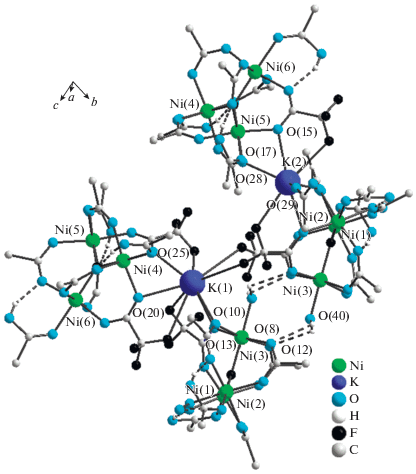
Атомы водорода молекулы воды образуют две водородные связи с атомами кислорода мостиковых трифторацетатных групп соседнего комплексного аниона O(40)–(40A)…O(8) и O(40)–H(40B)…O(12), связывая образующие структуру цепочки в слои (рис. 4). При этом в координационное окружение атома K(1) входят атомы фтора трифторметильной группы трифторацетатного бидентатного аниона соседней цепочки.
Необходимо отметить, что именно за счет образования в соединении IV слоистой структуры можно считать данный пример промежуточным между описанными в литературе цепочечными фторотрифторацетатометаллатами [4–6] и трехмерными структурами соединений II и III.
Решающее влияние на структуру полученных фторотрифторацетатометаллатов, очевидно, оказывают водородные взаимодействия, роль которых увеличивается с увеличением доли молекул воды в структуре.
Таким образом, синтезировано и структурно изучено четыре новых представителя фторотрифторацетатометаллатов калия: соединение K2[Co3(µ3-F)(CF3COO)6(CF3COO)(CF3COOH)2] · · CF3COOH (I) – первый пример фторотрифтор-ацетатометаллата, в котором реализуется заряд комплексного аниона –2; впервые синтезированы и структурно изучены гидраты фторотрифтор-ацетатомеллатов – изоструктурные соединения K[М3(µ3-F)(CF3COO)6(H2O)3] · H2O · 2CF3COOH (М = Co (II), Ni (III)); соединение K2[Ni3(µ3-F)(CF3COO)6(CF3COOH)3][Ni3(µ3-F)(CF3COO)6- (CF3COOH)2(H2O)] · CF3COOH (IV) сочетает в своем составе типичный комплексный анион фторотрифторацетатоникелатов щелочных металлов [Ni3(µ3-F)(CF3COO)6(CF3COOH)3]– и комплексный анион, в котором одна молекула трифторуксусной кислоты заменена на молекулу воды [Ni3(µ3-F)(CF3COO)6(CF3COOH)2(H2O)]–. Показано, что введение молекул воды в состав комплексов не только не разрушает треугольный каркас М3(µ3-F), но и позволяет моделировать тип структуры, переходя от 1D- к 2D- и далее к 3D-структурам.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Chapon L.C., Radaelli P.G., Zheng H., Mitchell J.F. // Phys. Rev. B. 2006. V. 74. P. 172401.
Chetan Nayak, Steven H. Simon, Ady Stern et al. // Rev. Mod. Phys. 2008. V. 80. P. 1083. https://doi.org/10.1103/RevModPhys.80.1083
Danilovich I.L., Volkova O.S., Vasiliev A.N. // Low Temp. Phys. 2017. V. 43. P. 529.
Терещенко Д.С., Морозов И.В., Болталин А.И. и др. // Журн. неорган. химии. 2004. Т. 49. № 6. С. 919 (Tereshchenko D.S., Morozov I.V., Boltalin A.I. et al. // Russ. J. Inorg. Chem. 2004. V. 49. № 6. P. 836).
Терещенко Д.С., Морозов И.В., Болталин А.И. и др. // Кристаллография. 2013. Т. 58. № 1. С. 79.
Морозов И.В., Карпова Е.В., Глазунова Т.Ю. и др. // Коорд. химия. 2016. Т. 42. № 10. С. 609 (Morozov I.V., Karpova E.V., Glazunova T.Yu. et al. // Russ. J. Coord. Chem. 2016. V. 42. № 10. P. 647). https://doi.org/10.1134/S107032841610002X
Noack J., Fritz C., Flügel C. et al. // Dalton Trans. 2013. V. 42. I. 16. P. 5706.
Walsh J.P.S., Meadows S.B., Ghirri A. et al. // Inorg. Chem. 2015. V. 54. № 24. P. 12019.
Xie Z.-L., Feng M.-L., Tan B., Huang X.-Y. // Cryst-EngComm. 2012. I. 14. P. 4894.
Aulakh D., Islamoglu T., Bagundes V.F. et al. // Chem. Mater. 2018. V. 30. P. 8332.
PCPDFWIN. Version 1.30. August 1997. JCPDS-ICDD.
Sheldrick G.M. SADABS. Program for Scaling and Correction of Area Detector Data. Göttingen (Germany): Univ. of Göttingen, 1997.
Sheldrick G.M. // Acta. Crystallogr. A. 2008. V. 64. № 1. P. 112.
Spek A.L. // Acta. Crystallogr. C. 2015. V. 71. P. 9.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


