Координационная химия, 2021, T. 47, № 5, стр. 263-274
Комплексы магния и никеля с бис-п-иминохиноновым редокс-активным лигандом
И. Н. Мещерякова 1, О. Ю. Трофимова 1, Н. О. Дружков 1, К. И. Пашанова 1, И. А. Якушев 2, 3, П. В. Дороватовский 3, М. Н. Хризанфоров 4, Ю. Г. Будникова 4, Р. Р. Айсин 5, А. В. Пискунов 1, *
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
3 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
4 Институт органической и физической химии им. А.Е. Арбузова КазНЦ РАН
Казань, Россия
5 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: pial@iomc.ras.ru
Поступила в редакцию 27.11.2020
После доработки 21.12.2020
Принята к публикации 23.12.2020
Аннотация
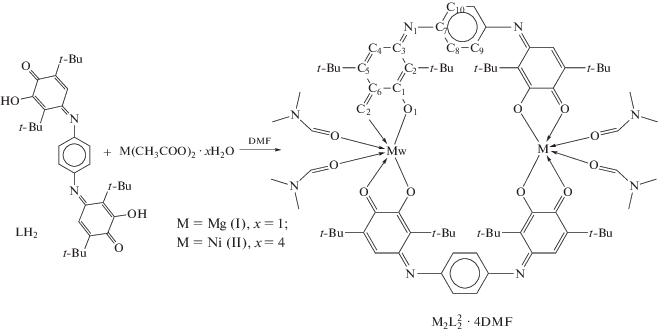
По реакции ацетатов магния и никеля с дитопным редокс-активным лигандом гидрокси-пара-иминохинонового типа в растворе DMF получены труднораствоpимые в большинстве органических растворителей димерные комплексы состава ${\text{M}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{2}^{2}$ · 4DMF (I) и ${\text{N}}{{{\text{i}}}_{{\text{2}}}}{\text{L}}_{2}^{2}$ · 4DMF (II) (L = дианион 4,4'-(1,4-фенилен-бис(азанелилиден))бис(3,6-ди-трет-бутил-2-гидроксициклогекса-2,5-диен-1-она). Молекулярная и кристаллическая структура синтезированных соединений установлена при помощи рентгеноструктурных исследований (CIF files CCDC № 2045665 (I) и 2045666 (II · 3DMF)). Термическая стабильность изучена методом термогравиметрии. По данным твердофазной электрохимии подтвержден редокс-активный характер органического мостикового лиганда в димерных комплексах ${\text{M}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{2}^{2}$ · 4DMF и ${\text{N}}{{{\text{i}}}_{{\text{2}}}}{\text{L}}_{2}^{2}$ · · 4DMF.
Одной из интенсивно развивающихся и весьма перспективных областей в современной координационной химии является направление, связанное с построением соединений на основе ди-, три- и политопных лигандов. Использование таких лигандных систем в синтезе новых металл-органических производных позволяет получать полиядерные как гомо-, так и гетерометаллические комплексы [1–5], металл-органические координационные полимеры (МОКП) [6–9] и металл-органические клетки [10–12]. Наличие в подобных структурах редокс-активных органических фрагментов открывает широкие перспективы для практического применения полученных соединений, так как для них характерно проявление таких явлений, как валентная таутомерия и спин-кроссовер [9, 13–15].
В качестве редокс-активных мостиковых лигандов в создании полиядерных производных и МОКП часто используются дважды депротонированный 2,5-дигидроксипарахинон и его аналоги с различными заместителями в 3,6-положениях хиноидного кольца [7–9, 16]. На основе данного типа анилатных лигандов получены биядерные комплексы различных металлов [1, 2, 4, 17], а также линейные [18–21], сетчатые [22–26] и каркасные [27–30] металл-органические координационные полимеры, обладающие уникальными каталитическими, сорбционными, магнитными и люминисцентными свойствами. Для расширения круга свойств, которыми могут обладать материалы, получены гетерометаллические [3, 31–35] и смешанолигандные [36–38] МОКП.
Увеличение спектра применяемых органических лигандов существенным образом расширяет возможность варьирования структурных и функциональных свойств как мономерных, так и полимерных координационных соединений, а поиск новых редокс-активных лигандов для направленного дизайна металл-органических производных представляет важную задачу современной координационной химии.
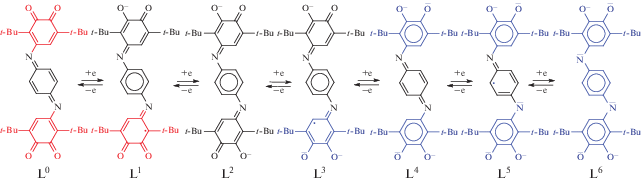
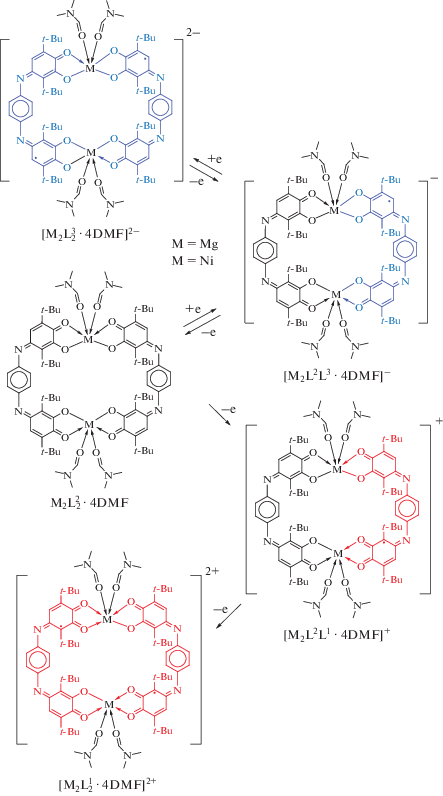
Одними из перспективных дитопных лигандов для синтеза новых биядерных производных и МОКП является ближайший аналог анилатных лигандов, содержащий расширенную π-систему – 4,4'-(1,4-фенилен-бис(азанелилиден))бис(3,6-ди-трет-бутил-2-гидроксициклогекса-2,5-диен-1-он (L2H2) [5, 39]. Данный лиганд представляет собой бис-п-иминобензохинон, в котором иминохиноновые фрагменты соединены через атомы азота п-фениленовым мостиком. Будучи связанным в комплекс с металлом, лиганд способен потенциально существовать в семи различных редокс состояниях (схема 1 ).
Схема 1 .
В настоящем исследовании синтезированы и изучены димерные производные двухвалентных металлов (Mg и Ni) на основе L2H2. Строение полученных соединений установлено различными физико-химическими методами, а молекулярные и кристаллические структуры комплексов подтверждены методом РСА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе применяли коммерческие реактивы: N,N'-диметилформамид (DMF), п-фенилендиамин, Mg(CH3COO)2 · H2O и Ni(CH3COO)2 · 4H2O. Лиганд L2H2 синтезировали согласно известной методике [39]. ИК-спектры в диапазоне 400–4000 см–1 снимали на ИК-Фурье-спектрометре ФСМ-1201 (суспензии в вазелиновом масле; кюветы KBr). Электронные спектры поглощения (ЭСП) в диапазоне 200–1000 нм регистрировали на спектрометре Varian Cary 50 (суспензии в вазелиновом масле). Элементный анализ выполняли на приборе Elementar Vario El cube. Исследования методами дифференциальной сканирующей калориметрии (ДСК) и термогравиметрического анализа (ТГА) проводили на синхронном термическом анализаторе Shimadzu DTG-60H.
Синтез димерных комплексов ${\mathbf{M}}{{{\mathbf{g}}}_{{\mathbf{2}}}}{\mathbf{L}}_{{\mathbf{2}}}^{{\mathbf{2}}}$ · 4DMF (I) и ${\mathbf{N}}{{{\mathbf{i}}}_{{\mathbf{2}}}}{\mathbf{L}}_{{\mathbf{2}}}^{{\mathbf{2}}}$ · 4DMF (II). По реакции прямого взаимодействия ацетатов металлов (Mg и Ni) (0.04 ммоль) с L2H2 (0.04 ммоль) в 5 мл DMF при нагревании в течение 20 мин до 120°С с последующим медленным охлаждением до комнатной температуры выделяли труднорастворимые в большинстве органических растворителей темные мелкокристаллические продукты I и II. Полученные производные собирали на фильтре Шотта и сушили на воздухе.
Комплекс I: темно-синие мелкие кристаллы, выход 70%.
ИК-спектр (ваз. масло; ν, см–1): 1691 с, 1674 с, 1661 с, 1623 с, 1599 с, 1546 с, 1421 с, 1403 с, 1358 с, 1342 с, 1315 с, 1263 ср, 1222 ср, 1107 с, 1066 с, 1010 ср, 949 ср, 927 ср, 910 с, 864 с, 699 ср, 686 с, 671 ср, 652 ср, 630 ср, 620 с, 603 с, 577 с, 537 с.
ЭСП (ваз. масло; λ, нм): 300, 335, 615.
Комплекс II: темно-синие мелкие кристаллы, выход 78%.
Кристаллическая ячейка производного никеля содержит некоординированный DMF в расчете 3 молекулы растворителя на один димер Ni2${\text{L}}_{2}^{2}$ · · 4DMF. Однако, согласно данным элементного анализа, выделенный мелкокристаллический продукт, хорошо высушенный на воздухе, не содержит сольватного растворителя.
ИК-спектр (ваз. масло; ν, см–1): 1676 с, 1655 с, 1587 с, 1541 ср, 1484 ср, 1387 с, 1358 с, 1347 с, 1317 с, 1267 с, 1221 с, 1105 с, 1069 с, 951 ср, 925 ср, 914 ср, 894 ср, 852 с, 733 ср, 684 с, 649 с, 618 ср, 549 с.
ЭСП (ваз. масло; λ, нм): 300, 330, 620, 710.
РСА комплексов I и II · 3DMF получены на рентгеновском пучке станции “Белок” Курчатовского центра синхротронного излучения в Национальном исследовательском центре “Курчатовский институт” (Москва, Российская Федерация) в режиме φ-сканирования с использованием CCD детектора Rayonix SX165 при 100 K [40]. Первичное индексирование, уточнение параметров элементарной ячейки и интегрирование отражений, а также поправкa на поглощение интенсивности рефлексов произведены с использованием программного пакета XDS [41]. Структуры расшифрованы прямыми методами и уточнены полноматричным методом наименьших квадратов по F 2 в анизотропном приближении для неводородных атомов, кроме разупорядоченной молекулы DMF в соединении II, уточненной в изотропном приближении с использованием идеализованной молекулярной геометрии [42]. Атомы водорода помещены в рассчитанные положения и уточнены в модели “наездника” с Uiso(H) = 1.5Ueq(C) для атомов водорода метильных групп и 1.2Ueq(C) для остальных атомов водорода. Для структур I и II · · 3DMF координаты атомов, тепловые параметры и заселенность позиций уточнены без дополнительных ограничений модели, за исключением атомов углерода метильных групп в разупорядоченной по двум положениям (соотношение заселенностей 0.558 : 0.442) трет-бутильной группе. Атомы углерода метильных групп уточнены с наложением ограничений на длины связей C–C в случае структуры I, для II · 3DMF также применены ограничения по длинам связей и параметрам тепловых колебаний атомов карбонильной группы в полностью разупорядоченной молекуле DMF (соотношение заселенностей 0.521 : 0.479). Расчеты выполнены с помощью программного пакета SHELXTL [43] в среде визуализации и обработки структурных данных OLEX2 [44].
Кристаллографические данные для соединений I и II · 3DMF депонированы в Кембриджском банке структурных данных (CCDC № 2045665 и 2045666 соответственно; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Квантово-химические расчеты выполняли с использованием программного пакета Gaussian09 [45] методом теории функционала плотности (DFT) с применением функционала B3LYP [46] и стандартного базисного набора 6-31(d) для всех атомов.
Электрохимические измерения проводили на электрохимическом анализаторе BASiEpsilonE2P (США) с программным обеспечением Epsilon-EC-USB-V200. Использовали обычную трехэлектродную систему с электродом из углеродной пасты (УПЭ) для порошковых образцов в качестве рабочего электрода, электрод Ag/AgCl (0.01 M) использовали в качестве электрода сравнения, а платиновую проволоку – в качестве противоэлектрода. В качестве фонового электролита для определения вольтамперных характеристик использовали 0.1 М Et4NBF4. Ацетонитрил перегоняли над P2O5 и KMnO4, затем над молекулярными ситами. После очистки растворитель хранили в атмосфере сухого аргона. Используемый в качестве фоновой соли Et4NBF4 перекристаллизовывали из этанола и сушили в вакууме при 100°C в течение 2 сут. Для исследования порошковых образцов использовали модифицированный рабочий электрод УПЭ. Изготовление УПЭ: порошок графита и соль фосфония (додецил (три-трет-бутил)тетрафторборат фосфония) в соотношении 90 : 10 (мас.) перемешивали в ступке до получения однородной массы [47–50]. Модифицированный электрод изготовляли аналогичным образом за исключением того, что около 5% графитового порошка заменяли исследуемым комплексом (I или II). Часть полученной пасты плотно набивали в полость (диаметром 3 мм) тефлонового держателя.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В ходе взаимодействия ацетатов двухвалентных металлов (Mg и Ni) с L2H2 в растворе DMF получены димерные комплексы состава ${{{\text{M}}}_{{\text{2}}}}{\text{L}}_{2}^{2}$ · · 4DMF (М = Mg, Ni) (схема 2 ). Реакция протекает при нагревании до 120°С в течение 20 мин. Более длительное нагревание реакционной смеси приводит к деградации органического лиганда в результате гидролиза иминных связей C=N. Мелкокристаллические продукты, полученные в результате протекания реакции, формируются при медленном остывании реакционной смеси до комнатной температуры. Образующиеся осадки целевого продукта темно-синего, практически черного цвета после сушки на воздухе являются аналитически чистыми. Полученные соединения устойчивы к кислороду и влаге воздуха.
Состав и строение соединений I и II подтверждены данными ИК-спектроскопии и элементного анализа. В ИК-спектре комплексов наблюдается сильная полоса поглощения при ~1670 см–1, отвечающая колебаниям карбонильной связи DMF, а также набор полос в интервале 1580–1660 см–1, характеризующих валентные колебания в системе сопряженных связей C=O, C=N в C=C пара-иминохиноновых лигандах [51, 52].
Схема 2 .
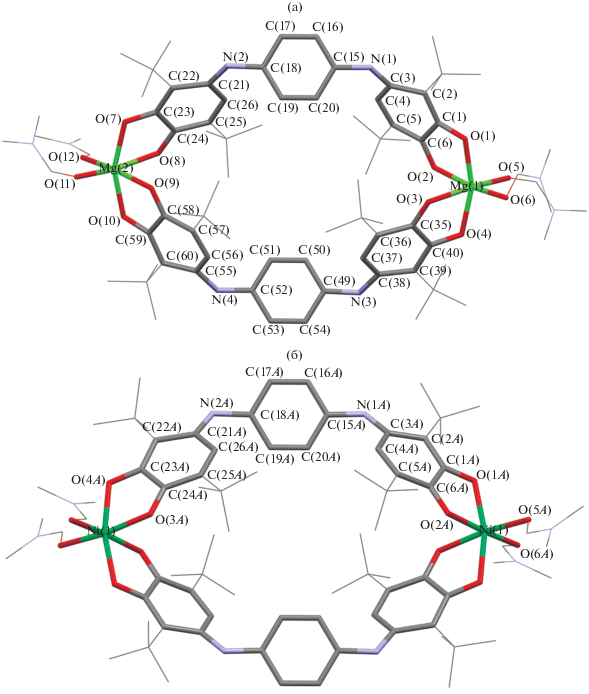
Молекулярные структуры ${\text{M}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{2}^{2}$ · 4DMF (I) и ${\text{N}}{{{\text{i}}}_{{\text{2}}}}{\text{L}}_{2}^{2}$ · 4DMF (II) приведены на рис. 1. Кристаллографические данные и параметры рентгеноструктурных экспериментов комплексов I и II приведены в табл. 1, значения избранных длин связей – в табл. 2. Для упрощения описания структурных характеристик I и II мы рассчитали средние значения длин связей в однотипных фрагментах молекул. В табл. 3 указаны усредненные длины связей (Å) в комплексах I и II, нумерация атомов для усредненных значений приведена на схеме 1 . Следует отметить, что в элементарной ячейке комплекса никеля II содержится три сольватных молекулы DMF в расчете на один димер ${\text{N}}{{{\text{i}}}_{{\text{2}}}}{\text{L}}_{{\text{2}}}^{{\text{2}}}$ · 4DMF.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I и II · 3DMF
| Комплекс | I | II · 3DMF |
|---|---|---|
| T, К | 100(2) | 100(2) |
| Сингония | Орторомбическая | Триклинная |
| Пр. гр. | Pca21 | P1 |
| а, Å | 36.105(7) | 10.129(4) |
| b, Å | 10.346(2) | 20.9590(16) |
| c, Å | 22.330(5) | 23.2340(14) |
| α, град | 90 | 79.894(13) |
| β, град | 90 | 88.06(3) |
| γ, град | 90 | 78.356(6) |
| V, Å3 | 8341(3) | 4756.0(19) |
| Z | 4 | 2 |
| ρ(выч.), Мг/м3 | 1.136 | 1.197 |
| µ, мм–1 | 0.116 | 0.615 |
| θ, град | 1.618–29.695 | 1.124–29.000 |
| Число наблюдаемых отражений | 98 702 | 66 048 |
| Число независимых отражений | 16 983 | 18 098 |
| Rint | 0.0955 | 0.1309 |
| S(F 2) | 1.013 | 1.027 |
| R1/wR2 (I > 2σ(I)) | 0.0482/0.1099 | 0.0673/0.1638 |
| R1/wR2 (по всем параметрам) | 0.0705/0.1229 | 0.1141/0.1907 |
| Δρmax/Δρmin, e Å–3 | 0.425/–0.321 | 0.518/–0.481 |
Таблица 2.
Избранные длины связей (Å) в комплексах I и II · 3DMF
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| I | |||
| Mg(1)–O(4) | 2.001(3) | C(4)–C(5) | 1.337(6) |
| Mg(1)–O(5) | 2.013(3) | C(5)–C(6) | 1.463(5) |
| Mg(1)–O(1) | 2.018(3) | C(15)–C(20) | 1.399(5) |
| Mg(1)–O(6) | 2.053(3) | C(15)–C(16) | 1.402(5) |
| Mg(1)–O(2) | 2.117(3) | C(16)–C(17) | 1.384(5) |
| Mg(1)–O(3) | 2.167(3) | C(17)–C(18) | 1.408(5) |
| Mg(2)–O(11) | 1.986(3) | C(18)–C(19) | 1.395(5) |
| Mg(2)–O(10) | 2.008(3) | C(19)–C(20) | 1.384(5) |
| Mg(2)–O(7) | 2.028(3) | C(21)–C(22) | 1.451(5) |
| Mg(2)–O(12) | 2.042(3) | C(21)–C(26) | 1.482(5) |
| Mg(2)–O(9) | 2.139(3) | C(22)–C(23) | 1.385(6) |
| Mg(2)–O(8) | 2.178(3) | C(23)–C(24) | 1.497(5) |
| O(1)–C(1) | 1.297(4) | C(24)–C(25) | 1.465(5) |
| O(2)–C(6) | 1.248(4) | C(25)–C(26) | 1.343(6) |
| O(3)–C(35) | 1.246(5) | C(35)–C(36) | 1.463(5) |
| O(4)–C(40) | 1.295(4) | C(35)–C(40) | 1.506(5) |
| O(7)–C(23) | 1.299(4) | C(36)–C(37) | 1.343(6) |
| O(8)–C(24) | 1.245(5) | C(37)–C(38) | 1.477(5) |
| O(9)–C(58) | 1.239(4) | C(38)–C(39) | 1.450(5) |
| O(10)–C(59) | 1.291(4) | C(39)–C(40) | 1.385(5) |
| N(1)–C(3) | 1.302(5) | C(49)–C(54) | 1.407(5) |
| N(1)–C(15) | 1.407(5) | C(49)–C(50) | 1.409(5) |
| N(2)–C(21) | 1.304(5) | C(50)–C(51) | 1.376(5) |
| N(2)–C(18) | 1.402(5) | C(51)–C(52) | 1.403(5) |
| N(3)–C(38) | 1.317(5) | C(52)–C(53) | 1.404(5) |
| N(3)–C(49) | 1.390(5) | C(53)–C(54) | 1.377(5) |
| N(4)–C(55) | 1.315(5) | C(55)–C(60) | 1.449(5) |
| N(4)–C(52) | 1.399(5) | C(55)–C(56) | 1.480(5) |
| C(1)–C(2) | 1.387(5) | C(56)–C(57) | 1.341(5) |
| C(1)–C(6) | 1.497(5) | C(57)–C(58) | 1.469(5) |
| C(2)–C(3) | 1.448(5) | C(58)–C(59) | 1.508(5) |
| C(3)–C(4) | 1.489(5) | C(59)–C(60) | 1.388(5) |
| Связь | d, Å | Связь | d, Å |
| II · 3DMF | |||
| Ni(1)–O(1A) | 2.012(2) | C(2A)–C(3A) | 1.463(5) |
| Ni(1)–O(2A) | 2.079(2) | C(3A)–C(4A) | 1.482(5) |
| Ni(1)–O(3A) | 2.075(3) | C(4A)–C(5A) | 1.340(5) |
| Ni(1)–O(4A) | 2.021(2) | C(5A)–C(6A) | 1.472(5) |
| Ni(1)–O(6A) | 2.061(3) | C(15A)–C(16A) | 1.400(5) |
| Ni(1)–O(5A) | 2.063(3) | C(15A)–C(20A) | 1.403(5) |
| O(1A)–C(1A) | 1.310(4) | C(16A)–C(17A) | 1.381(5) |
| O(2A)–C(6A) | 1.247(4) | C(17A)–C(18A) | 1.409(5) |
| O(3A)–C(24A) | 1.244(4) | C(18A)–C(19A) | 1.397(5) |
| O(4A)–C(23A) | 1.295(4) | C(19A)–C(20A) | 1.386(5) |
| N(1A)–C(3A) | 1.304(5) | C(21A)–C(22A) | 1.469(5) |
| N(1A)–C(15A) | 1.401(4) | C(21A)–C(26A) | 1.470(5) |
| N(2A)–C(21A) | 1.309(5) | C(22A)–C(23A) | 1.397(5) |
| N(2A)–C(18A) | 1.404(4) | C(23A)–C(24A) | 1.510(5) |
| C(1A)–C(2A) | 1.385(5) | C(24A)–C(25A) | 1.463(5) |
| C(1A)–C(6A) | 1.495(5) | C(25A)–C(26A) | 1.338(5) |
Таблица 3.
Усредненные длины связей (Å) в комплексах I и II · 3DMF
| Связь | I | II · 3DMF |
|---|---|---|
| M–O1 | 2.01 | 2.01 |
| M–O2 | 2.15 | 2.08 |
| O1–C1 | 1.30 | 1.30 |
| O2–C6 | 1.25 | 1.25 |
| N1–C3 | 1.31 | 1.31 |
| N1–C7 | 1.40 | 1.40 |
| C1–C2 | 1.38 | 1.39 |
| C1–C6 | 1.50 | 1.50 |
| C2–C3 | 1.45 | 1.46 |
| C3–C4 | 1.48 | 1.48 |
| C4–C5 | 1.34 | 1.34 |
| C5–C6 | 1.46 | 1.47 |
| C7–C8 | 1.40 | 1.40 |
| C7–C10 | 1.40 | 1.40 |
| C8–C9 | 1.38 | 1.38 |
Соединение I кристаллизуется в орторомбической пространственной группе Pca21, молекула ${\text{M}}{{{\text{g}}}_{{\text{2}}}}{\text{L}}_{2}^{2}$ · 4DMF несимметрична и находится в общем положении. Димерное производное II · 3DMF кристаллизуется в триклинной пространственной группе $P\bar {1}$. В независимой части кристаллической ячейки соединения содержится три сольватных молекулы DMF и две кристаллографически независимых молекулы комплекса ${\text{N}}{{{\text{i}}}_{{\text{2}}}}{\text{L}}_{2}^{2}$ · 4 DMF, каждая из которых расположена на центре симметрии. Геометрические параметры обеих молекул ${\text{N}}{{{\text{i}}}_{{\text{2}}}}{\text{L}}_{2}^{2}$ · 4DMF близки между собой, поэтому в табл. 2 приведены параметры лишь одной из них.
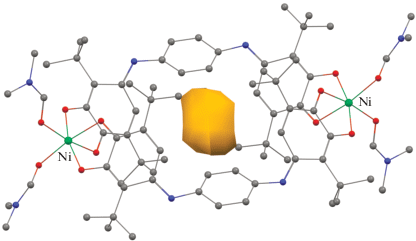
Общее построение димерных комплексов остается неизменным для обоих металлов. Два дитопных пара-иминохиноновых лиганда двумя скобкамисвязывают катионы металлов, образуя с ними хелатные пятичленные металлоциклы MOCCO (M = Mg, Ni) и формируя таким образом металл-органическую клетку. При этом атом металла значительно отклонен от плоскостей OCCO на расстояние 0.285(6)–0.699(5) Å в соединении магния и 0.556(5)–0.566(5) Å в соединении никеля. Значения диэдральных углов между плоскостями о-иминохиноновых фрагментов, координированных на один атом металла, составляют 51.39(6)°–52.28(6)° и 49.07(6)°–49.12(6)° для комплексов I и II · 3DMF соответственно. Двугранный угол между плоскостями пара-фениленовых мостиков составляет лишь 1.0(2)° в комплексе I, в производном II · 3DMF эти плоскости полностью параллельны. Отметим, что сами пара-фениленовые фрагменты значительно удалены друг от друга в рамках одной молекулы – расстояния между центрами колец составляет 9.143(2) Å в I и 8.832(4)–9.119(4) Å в II · 3DMF. Атомы металлов разнесены более чем на 14 Å в обоих комплексах, что формирует полость внутри металл-органической клетки с диаметром ~3.5 Å, принципиально доступную для малых молекул (pис. 2).
Упаковка молекул в кристалле комплексов I и II · 3DMF определяется большим числом межмолекулярных контактов между атомами кислорода п-хиноидных лигандов, а также молекул DMF и водородами трет-бутильных заместителей и N‑метильных групп DMF. Кроме того, в соединении I имеет место контакт С–Н…π-арен между N‑метильной группой DMF и ароматическим пара-фениленовым кольцом другой молекулы (расстояние С–π-арен центроид 3.410(6) Å). Вероятно, наличие большого числа межмолекулярных контактов и обуслoвливает низкую растворимость полученных соединений в большинстве органических растворителей.
Координационное окружение каждого из катионов магния и никеля в димерных комплексах I и II · 3DMF соответственно, представляет собой искаженный октаэдр, по вершинам которого расположены четыре атома кислорода двух пара-иминохиноновых лигандов и два атома кислорода координированных молекул DMF. Необходимо отметить, что длины связей M–O в хелатных циклах ожидаемо различаются между собой. Длины связей M–O1 (~2.01 Å для обоих соединений, см. табл. 3) меньше суммы ковалентных радиусов соответствующих элементов (2.18 и 2.11 Å для I и II · · 3DMF соответственно) [53], что хорошо согласуется с ковалентным связыванием. Координационная связь металла с карбонильным атомом кислородa органического п-иминохинонового лиганда M–O2 (2.15 Å для I и 2.08 Å для II · 3DMF) в среднем на 0.14 и 0.07 Å длиннее, чем ковалентные M–O1 в производных магния и никеля соответственно. Наблюдаемая разница существенно меньше, чем в соединениях олова(IV) (0.4 Å) на основе монотопного аналога лиганда L2H2 [54], что свидетельствует о значительной делокализации заряда в хелатных циклах.
В димерных производных I и II · 3DMF сохраняется п-иминохиноновая структура исходного лиганда L2H2 [5]. Связи С1–С2 и С4–С5 (табл. 3), имеющие длину в интервале от 1.34 до 1.39 Å соответственно, могут быть охарактеризованы как двойные, в то время как С1–С6, С2–С3, С3–С4 и С5–С6 лежат в интервале значений от 1.45 до 1.50 Å. Координация органического лиганда на атом металла приводит лишь к незначительным изменениям в распределении длин связей в исходном бис-п-иминобензохиноне, связанным с делокализацией отрицательного заряда в п-иминохиноновом фрагменте органического лиганда. Так, происходит укорочение связи С1–О1 (1.30 Å для обоих комплексов) по сравнению со связью C–OH в исходном лиганде (1.352(2) Å) и удлинение связи С2–О2 (1.25 Å для обоих комплексов) в сравнении с L2H2 (C=O 1.230(2) Å). Cвязи C–C п‑фениленового мостика в I и II · 3DMF выравнены (1.38–1.40 Å) (табл. 3), что соответствует его ароматической природе.
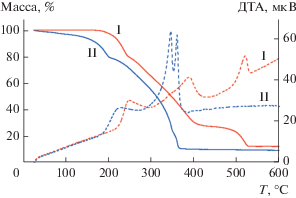
Термическая стабильность димерных производных I и II была оценена методами ТГА и ДСК (рис. 3), согласно данным которых, для I в температурном интервале 170–250°С происходит декоординация четырех молекул DMF с атомов магния; при этом потеря массы составляет 20%. Дальнейшее нагревание приводит к деструкции и полному разложению комплекса I. Исходя из данных ТГА соединение II начинает разложение до 100°С и демонстрирует постепенную потерю массы (~4%) при нагревании до 130°С вследствие удаления окклюдированного растворителя из образца. Декоординация четырех молекул DMF с атомов никеля происходит в температурном интервале 130–200°С, наблюдаемая потеря массы при этом составляет ~18%. Дальнейшее нагревание приводит к разложению производного никеля.
Низкая растворимость соединений I и II не позволила зарегистрировать ЭСП в растворе. Спектры поглощения в УФ-видимом диапазоне исследуемых димерных комплексов магния и никеля, снятые в минеральном масле, представлены на рис. 4 и показывают интенсивные полосы при 300 и 330–335 нм, а также широкие полосы поглощения при λ > 620 нм. Полученные данные находятся в хорошем соответствие с результатами квантово-химических расчетов, которые были выполнены для соединения I в экспериментальной геометрии на уровне B3LYP/6-31(d). Граничные орбитали комплекса I (рис. 5) состоят только из орбиталей лиганда. НСМО и НСМО+1 локализованы преимущественно на акцепторных пара-хиноидных фрагментах, в то время как ВЗМО и ВЗМО-1 делокализованы по всей системе сопряженных двойных связей дитопного лиганда через пара-фениленовый мостик. Внутри- и межлигандный перенос электрона ВЗМО–НСМО определяет длинноволновую полосу поглощения в ЭСП соединения I, а разницы в энергиях граничных орбиталей (1.9–2 эВ) хорошо согласуются с широкой полосой поглощения, наблюдаемой в экспериментальном спектре. Важно отметить, что комплексообразование приводит к значительному батохромнoму сдвигу полосы переноса заряда для лиганда бис-пара-иминохинона L2H2 [5], который составляет 140 нм, причем этот сдвиг весьма чувствителен к природе комплексообразователя. Так, в присутствии слабой кислоты Льюиса – катиона алкилртути – он достигал лишь 40 нм [5]. Катионы магния(II) и никеля(II) способствуют возникновению более сильного отрицательного заряда на лиганде и тем самым сближают между собой его граничные орбитали.
Окислительно-восстановительные свойства соединений I и II в твердом виде были изучены методом циклической вольтамперометрии (ЦВА) с использованием модифицированных углеродно-пастовых электродов. На рис. 6 показаны соответствующие циклические вольтамперограммы. Потенциалы окислительно-восстановительных процессов для комплексов I и II приведены в табл. 4.
Рис. 6.
ЦВА-восстановления (а) и ЦВА-окисления (б) и их полудифференцированные формы для комплексов I и II. CPE, CH3CN, 10–1 M Bu4NBF4. Потенциал относ. Ag/AgCl.
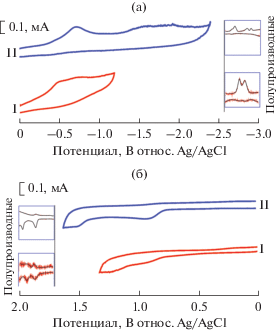
Таблица 4.
Данные потенциалов для комплексов I и II. Значения представлены относительно Ag/AgCl
| Окисление | ||||
| $^{1}E_{{\text{p}}}^{{\text{a}}},$ В | $^{2}E_{{\text{p}}}^{{\text{a}}},$ В | |||
| I | 0.95 | 1.21 | ||
| II | 0.90 | 1.51 | ||
| Восстановление | ||||
| $^{1}E_{{\text{p}}}^{{\text{к}}},$ В | $^{2}E_{{\text{p}}}^{{\text{к}}},$ В | $^{3}E_{{\text{p}}}^{{\text{к}}},$ В | $^{4}E_{{\text{p}}}^{{\text{к}}},$ В | |
| I | –0.54 | –0.71 | ||
| II | –0.52 | –0.70 | –1.58 | –1.94 |
Потенциалы первых пиков восстановления и окисления для обоих исследуемых комплексов I и II близки (табл. 4), причем процессы переноса электронов в условиях ЦВА необратимы. Близость потенциалов первых стадий присоединения и отрыва электрона для производных редокс-активного Ni(II) и редокс-неактивного Mg(II) подтверждает лигандо-центрированный характер наблюдаемых процессов (схема 3 ). Пики при более высоких потенциалах восстановления никелевого комплекса II, не наблюдаемые для соединения магния I, должны относиться к переносам электрона на ионы никеля.
Таким образом, в ходе проделанной работы синтезированы металл-органические клетки, построенные на основе двухвалентных катионов магния и никеля и редокс-активного дитопного лиганда пара-иминохинонового типа. Рентгеноструктурное исследование молекулярной и кристаллической структуры соединений показало наличие полостей внутри образующихся клеток. Методом твердотельной электрохимии продемонстрировано редокс-активное поведение лигандного остова полученных комплексов.
Схема 3 .
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Min K.S., DiPasquale A., Rheingold A.L. et al. // Inorg. Chem. Com. 2007. V. 46. P. 1048.
Min K.S., DiPasquale A.G., Rheingold A.L. et al. // J. Am. Chem. Soc. 2009. V. 131. P. 6229.
Kanegawa S., Shiota Y., Kang S. et al. // J. Am. Chem. Soc. 2016. V. 138. P. 14170.
Simonson A.N., Kareis C.M., Ovanesyan N.S. et al. // Polyhedron. 2018. V. 139. P. 215.
Дружков Н.О., Мещерякова И.Н., Черкасов А.В. и др. // Изв. АН. Сер. хим. 2020. С. 49 (Druzhkov N.O., Meshcheryakova I.N., Cherkasov A.V., Piskunov A.V. // Russ. Chem. Bull. 2020. V. 69. P. 49).
Espallargas G.M., Coronado E. // Chem. Soc. Rev. 2018. V. 47. P. 533.
D’Alessandro D.M. // Chem. Commun. 2016. V. 52. P. 8957.
Kitagawa S., Kawata S. // Coord. Chem. Rev. 2002. V. 224. P. 11.
Mercuri M.L., Congiu F., Concas G. et al. // Magnetochemistry. 2017. V. 3. P. 1.
Castilla A.M., Ramsay W.J., Nitschke J.R. // Acc. Chem. Res. 2014. V. 47. P. 2063.
Schmidt A., Casini A., Kühn F.E. // Coord. Chem. Rev. 2014. V. 275. P. 19.
Bloch W.M., Clever G.H. // Chem. Commun. 2017. V. 53. P. 8506.
Darago L.E., Aubrey M.L., Yu C.J. et al. // J. Am. Chem. Soc. 2015. V. 137. P. 15703.
Jeon I.-R., Negru B., Duyne R.P.V. et al. // J. Am. Chem. Soc. 2015. V. 137. № 50. P. 15699.
Chen J., Sekine Y., Komatsumaru Y. et al. // Angew. Chem. Int. Ed. 2018. V. 57. P. 12043.
Benmansour S., Gómez-García C.J. // Gen. Chem. 2020. V. 6. P. 190033.
Benmansour S., López-Martínez G., Canet-Ferrer J. et al. // Magnetochemistry. 2016. V. 2. P. 1.
Chang C.-H., Li A.-C., Popovs I. et al. // J. Mater. Chem. A. 2019. V. 7. P. 23770.
DeGayner J.A., Wang K., Harris T.D. // J. Am. Chem. Soc. 2018. V. 140. P. 6550.
Abrahams B.F., Dharma A.D., Dyett B. et al. // Dalton Trans. 2016. V. 45. P. 1339.
Morikawa S., Yamada T., Kitagawa H. // Chem. Lett. 2009. V. 38. P. 654.
Kharitonov A.D., Trofimova O.Y., Meshcheryakova I.N. et al. // CrystEngComm. 2020. V. 22. P. 4675.
Liu L., DeGayner J.A., Sun L. et al. // Chem. Sci. 2019. V. 10. P. 4652.
Kingsbury C.J., Abrahams B.F., Auckett J.E. et al. // Chem. Eur. J. 2019. V. 25. P. 5222.
Gómez-Claramunt P., Benmansour S., Hernández-Paredes A. et al. // Magnetochemistry. 2018. V. 4. P. 6.
Kingsbury C.J., Abrahams B.F., D’Alessandro D.M. et al. // Cryst. Growth Des. 2017. V. 17. P. 1465.
Abrahams B.F., Hudson T.A., McCormick L.J. et al. // Cryst. Growth Des. 2011. V. 11. P. 2717.
Bondaruk K., Hua C. // Cryst. Growth Des. 2019. V. 19. P. 3338.
Murase R., Abrahams B.F., D’Alessandro D.M. et al. // Inorg. Chem. 2017. V. 56. P. 9025.
Benmansour S., Vallés-García C., Gómez-Claramunt P. et al. // Inorg. Chem. 2015. V. 54. P. 410.
Martínez-Hernández C., Gómez-Claramunt P., Benmansour S. et al. // Dalton Trans. 2019. V. 48. P. 13212.
Martínez-Hernández C., Benmansour S., Gómez-García C.J. // Polyhedron. 2019. V. 170. P. 122.
Hernández-Paredes A., Cerezo-Navarrete C., Gómez-García C.J. et al. // Polyhedron. 2019. V. 170. P. 476.
Atzori M., Benmansour S., Espallargas G.M. et al. // -Inorg. Chem. 2013. V. 52. P. 10031.
Abhervé A., Clemente-León M., Coronado E. et al. // I-norg. Chem. 2014. V. 53. P. 12014.
Sahadevan S.A., Monni N., Oggianu M. et al. // ACS Appl. Nano Mater. 2020. V. 3. P. 94.
Atzori M., Pop F. Auban-Senzier P., et al. // Inorg. Chem. 2015. V. 54. P. 3643.
Kabir M.K., Kawahara M., Kumagai H. et al. // Polyhedron. 2001. V. 20. P. 1417.
Абакумов Г.А., Черкасов В.К., Кочерова Т.Н. и др. // Изв. АН. Сер. хим. 2006. С. 1151 (Abakumov G.A., Cherkasov V.K., Kocherova T.N. et al. // Russ. Chem. Bull. (Int. Ed.). 2006. V. 55. P. 1195).
Svetogorov R.D., Dorovatovskii P.V., Lazarenko V.A. // Cryst. Res. Technol. 2020. V. 55. P. 1900184.
Kabsch W. // Acta Crystallogr. D. 2010. V. 66. P. 125.
Guzei I.A. // J. Appl. Crystallogr. 2014. V. 47. P. 806.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Wallingford (CT, USA): Gaussian, Inc., 2013.
Becke A.D. // J. Chern. Phys. 1993. V. 93. P. 1372.
Khrizanforov M.N., Arkhipova D.M., Shekurov R.P. et al. // J. Solid State Electrochem. 2015. V. 19. P. 2883.
Kataeva O., Khrizanforov M., Budnikova Y. et al. // Cryst. Growth Des. 2016. V. 16. P. 331.
Khrizanforov M N., Fedorenko S.V., Strekalova S.O. et al. // Dalton Trans. 2016. V. 45. P. 11976.
Khrizanforov M.N., Shekurov R.P., Ermolaev V.V. et al. // Phosphorus Sulfur Silicon Relat. Elem. 2016. V. 191. P. 1611.
Пискунов А.В., Мещерякова И.Н., Фукин Г.К., и др. // Коорд. химия. 2014. Т. 40. С. 205 (Piskunov A.V., Meshcheryakova I.N., Fukin G.K. et al. // Russ. J. Coord. Chem. 2014. V. 40. № 4. P. 205). https://doi.org/10.1134/S1070328414040083
Хамалетдинова Н.М., Мещерякова И.Н., Пискунов А.В. и др. // Журн. cтруктур. химии. 2015. Т. 56. № 2. С. 249 (Khamaletdinova N.M., Meshcheryakova I.N., Piskunov A.V. et al. // J. Struct. Chem. 2015. V. 56. P. 233).
Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. С. 3015 (Batsanov S.S. // Russ. J. Inorg. Chem. 1991. V. 36. P. 1694).
Пискунов А.В., Мещерякова И.Н., Фукин Г.К. и др. // Коорд. химия. 2017. Т. 43. № 12. С. 718 (Pis-kunov A.V., Meshcheryakova I.N., Fukin G.K. et al. // Russ. J. Coord. Chem. 2017. V. 43. P. 816). https://doi.org/10.1134/S1070328417120077
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия