Координационная химия, 2021, T. 47, № 5, стр. 288-292
Синтез и строение комплексов рутения и никеля c цимантренкарбоновой кислотой
С. С. Шаповалов 1, *, И. В. Скабицкий 1
1 Институт общей и неорганический химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: schss@yandex.ru
Поступила в редакцию 06.05.2020
После доработки 28.09.2020
Принята к публикации 10.11.2020
Аннотация
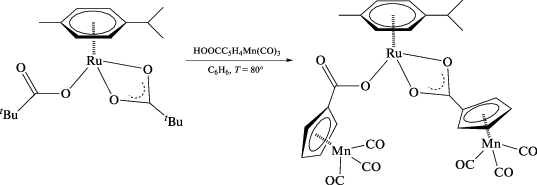
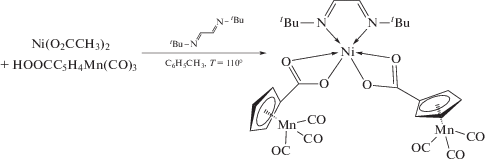
Получен гетерометаллический комплекс (L1)Ru(κ2-O2CC5H4)Mn(CO)3(O2CC5H4)Mn(CO)3) (I) (L1 = пивалатныый лиганд) взаимодействием комплекса рутения(II) (L1)Ru(κ2-O2CCMe3)(O2CCMe3) c цимантренкарбоновой кислотой (HO2CC5H4)Mn(CO)3. Последовательное взаимодействие ацетата никеля с цимантренкарбоновой кислотой и диимином 1,4-ди-трет-бутил-1,4-диазабутадиеном-1,3 приводит к образованию комплекса (L2)Ni(κ2-O2CC5H4Mn(CO)3)2 (II) (L2 = tBu–N=CH–CH=N–tBu). Комплексы I, II идентифицированы по данным элементного и рентгеноструктурного анализов (СIF files CCDC № 2001354 (I), 2001355 (II)).
Исследования химии карбоксилатов переходных металлов связаны с их каталитическими [1] и антикоррозионными свойствами [2], а также с возможностью соединения с молекулой ДНК [3]. Высокой каталитической активностью в реакциях дегидрирования, С–С сочетания и метатезиса олефинов обладают карбоксилатные комплексы рутения [4–9], карбоксилаты никеля реже используются в гомогенном катализе [10] и чаще в качестве прекурсоров для гетерогенного катализа [11–13].
Один из способов получения гетерометаллических комплексов – использование металлсодержащих карбоксилатных лигандов [14–18]. Комплексы никеля на основе цимантренкарбоновой кислоты ранее были получены с координированным ацетонитрилом, метанолом [19] и трифенилфосфином [20].
В настоящей работе предложены подходы к синтезу металлсодержащих карбоксилатов никеля(II) и рутения(II) на основе цимантренкарбоновой кислоты, которая может выступать в качестве ИК-метки за счет карбонильных групп при атоме марганца, со стерически загруженными лигандами: 4-изопропил-1-метилбензолом (MeC6${\text{H}}_{{\text{4}}}^{i}$Pr, L1) и 1,4-ди-трет-бутил-1,4-диазабутадиеном-1,3 (tBu–N=CH–CH=N–tBu, L2). Известно, что производные диазадиена могут выступать в качестве мостикового или редокс-активного хелатирующего лиганда [21]. В данном исследовании использован диазадиен L2 с трет-бутильными заместителями в качестве хелатирующего лиганда, обеспечивающего экранирование металлоцентра. При синтезе комплексов не используются основания или соли серебра, что позволяет избежать образования побочных продуктов, возникающих при деструкции цимантренильного фрагмента [22].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все реакции и операции выделения продуктов проводили в атмосфере аргона и в абсолютизированных растворителях (бензол, метанол, гексан, толуол). Исходный комплекс (MeC6H4iPr)Ru(OOCtBu)2 и лиганд L2 получали по методике [9] и [23] соответственно. Для химического анализа использовали CHNS-анализатор ЕА3000 фирмы EuroVector. ИК-спектры снимали на ИК-Фурье-спектрометре Bruker Alpha с приставкой Platinum ATR для получения спектров нарушенного полного внутреннего отражения (НПВО).
Синтез (MeC6H4iPr)Ru(κ2-O2CC5H4)Mn(CO)3- (O2CC5H4)Mn(CO)3) (I). Раствор 100 мг (0.23 ммоль) (MeC6H4iPr)Ru(OOCtBu)2 и 113 мг (0.46 ммоль) цимантренкарбоновой кислоты в 20 мл бензола кипятили в течение 3 ч. Растворитель удаляли в вакууме, твердый остаток растирали с 10 мл гексана, промывали гексаном (3 × 5 мл) и перекристаллизовывали из смеси бензол–гептан (1 : 1). Полученый желтый порошок отделяли фильтрованием, промывали пентаном (2 × 5 мл) и высушивали в вакууме. Выход 107 мг (64%).
ИК-спектр (ν, cм–1): 2021 о.с, 1929 о.с, (CO) 1640 ср, 1610 ср (OCOаs) 1440 ср, 1430 ср (OCOs).
Синтез (tBu–N=CH–CH=N–tBu)Ni(κ2-O2CC5H4)- Mn(CO)3)2 (II). К раствору 200 мг (0.8 ммоль) Ni(O2CCH3)2 · 4H2O и 400 мг (0.8 ммоль) цимантренкарбоновой кислоты в 20 мл метанола кипятили в течение 2 ч. Растворитель удаляли в вакууме, к твердому остатку добавляли 190 мг L2 и экстрагировали 30 мл толуола. К полученному желто-зеленому раствору добавляли 5 мл гексана и выдерживали при –18°С в течение 4 сут. Выход зеленых кристаллов 215 мг (37%).
ИК-спектр (ν, cм–1): 2973 сл, 2936 сл, 2023 о.с, 1931 о.с, 1674 ср, 1626 сл, 1550 ср, 1478 сл, 1463 сл, 1369 ср, 1224 сл, 1038 сл, 977 сл, 927 сл, 879 ср, 621 ср, 530 сл.
РСА выполнен на дифрактометре Bruker APEX II CCD для комплекса I и Siemens P4 для комплекса II. Поглощение учтено методом множественного измерения эквивалентных отражений по программе SADABS [24] для комплекса I и ψ‑сканирования для II. Структуры I, II определены с помощью программы SHELXT [25] и уточнены методом наименьших квадратов относительно F 2 в анизотропном приближении для неводородных атомов с использованием пакетов программ SHELX-2014 [25] и OLEX2 [26]. Положения атомов Н рассчитаны геометрически. Кристаллографические данные и параметры уточнения структуры I, II приведены в табл. 1, основные длины связей и валентные углы – в подписях к рис. 1, 2. Структурный вклад разупорядоченых молекул сольватного растворителя в кристалле II был удален с помощью процедуры SQUEEZE, реализованной в программе PLATON [27].
Таблица 1.
Кристаллографические данные и параметры уточнения структуры комплексов I, II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C28H22O10Mn2Ru | C28H28O10N2Mn2Ni |
| Излучение (λ, Å) | MoKα (λ = 0.71073) | |
| Температура, K | 100(2) | 298 |
| Сингония | Моноклинная | Орторомбическая |
| Пр. гр. | P21/n | Pbcn |
| а, Å | 10.4399(5) | 15.9854(13) |
| b, Å | 11.6595(6) | 13.8462(14) |
| c, Å | 22.7288(11) | 29.599(2) |
| α, град | 90 | 90 |
| β, град | 96.601(2) | 90 |
| γ, град | 90 | 90 |
| V, Å3 | 2748.3(2) | 6551(1) |
| Z | 4 | 8 |
| ρ(выч.), г/cм–3 | 1.763 | 1.462 |
| μ, мм–1 | 1.505 | 1.382 |
| F(000) | 1456.0 | 2944.0 |
| Область θ, град сканирования, град | 4.13–61.092 | 3.892–65.142 |
| Тип сканирования | ω | |
| Общее число отражений | 88 065 | 6576 |
| Независимых отражений (N1) | 8381 (Rint = 0.0716) | 3264 (Rint = 0.0314) |
| Отражений с I > 2σ(I) (N2) | 6963 | 2577 |
| Число уточняемых параметров | 373 | 389 |
| GOОF (F 2) | 1.131 | 1.029 |
| R1 для N2 | 0.0467 | 0.0329 |
| wR2 для N1 | 0.0917 | 0.0819 |
| Δρmax/Δρmin, e Å–3 | 0.93/–0.96 | 0.24/–0.24 |
Рис. 1.
Молекулярная структура комплекса I. Атомы водорода опущены для ясности. Избранные длины связей и валентные углы (I): Ru(1)–O(1) 2.162(2), Ru(1)–O(2) 2.140(2), Ru(1)–O(6) 2.092(2), O(1)–C(1) 1.263(3), O(2)–C(1) 1.274(3), O(6)–C(10) 1.286(3), O(7)–C(10) 1.226(3) Å и O(1)C(1)O(2) 118.9(3)°, O(7)C(10)O(6) 126.6(3)°.
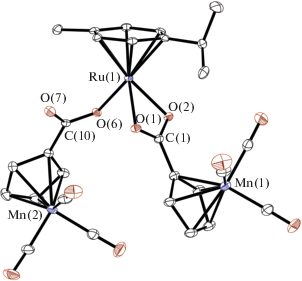
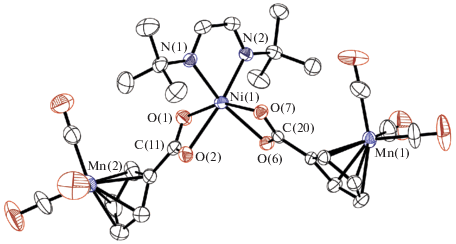
Рис. 2.
Молекулярная структура комплекса II. Атомы водорода опущены для ясности. Избранные длины связей: Ni(1)–N(1) 2.086(3), Ni(1)–N(2) 2.080(3), Ni(1)–O(1) 2.066(3), Ni(1)–O(2) 2.197(3), Ni(1)–O(6) 2.153(3), Ni(1)–O(7) 2.072(3), C(1)–C(2) 1.472(6), C(1)–N(1) 1.265(5), C(2)–N(2) 1.260(5), C(11)–O(1) 1.262(5), C(11)–O(2) 1.251(5), C(20)–O(6) 1.262(5), C(20)–O(7) 1.263(5) Å.
Координаты атомов и другие параметры структур депонированы в Кембриджском банке структурных данных (№ 2001354 (I), 2001355 (II); http://www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Комплекс I был получен замещением пивалатных лигандов в (MeC6H4iPr)Ru(OOCtBu)2 на цимантренкарбоксилатные при действии цимантренкарбоновой кислоты в кипящем бензоле.
По данным РСА, в структуре комплекса I атом рутения связан с монодентантным и бидентантным карбоксилатными лигандaми. Связь Ru–O короче в первом случае (2.092(2) Å), в то время как расстояния Ru–O для симметрично координированного бидентантного (κ2) лиганда составляют 2.162(2) и 2.140(2) Å. Связи C–O в κ2-карбоксилате также практически одинаковы (1.263(3) и 1.274(3) Å), тогда как для монодентантного лиганда расстояние C–O c некоординированным атомом кислорода (1.226(3) Å) заметно короче, чем с координированным (1.286(3) Å). Также заметно отличаются углы OCO 118.9(3)° и 126.6(3)° для κ2- и κ1-лиганда соответственно, что связано с напряжением в четырехчленном цикле RuOCO. Такие особенности строения двух карбоксилатных лигандов при атоме Ru наблюдались в ранее охарактеризованных ацетатном [28], пивалатном [9] и бензоатном комплексах [29].
Комплекс II был получен последовательным действием 2 экв. цимантренкарбоновой кислоты и 1,4-ди-трет-бутил-1,4-диазабутадиена (L2) на ацетат никеля. Полученные зеленые кристаллы плохо растворимы в бензоле, дихлорметане, метаноле и ацетоне.
По данным РСА, в структуре II связи Ni–N 2.086(3) и 2.080(3) Å близки к таковым в комплексе DipyNi(OOCCMe3)2 (2.033(3)–2.059(4) Å) [30]. Связи Ni–O, расположенные в транс-положении к атомам кислорода, на 0.1 короче соответствующих связей в транс-положении к диазабутадиеновому лиганду (2.066(3) и 2.072(3) Å для более коротких связей и 2.197(3) и 2.153(3) Å – для более длинных). Похожая, но менее выраженная разница в расстояниях Ni–O наблюдается в бензоатном комплексе DipyNi(OOCPh)2 (Ni–O 2.145, 2.155 Å в транc-положении к атомам азота, и 2.051, 2.075 Å в транс-положении к атомам кислорода) [31]. В комплексе с более донорными пивалатами DipyNi(OOCCMe3)2 различия в расстояниях Ni–O практически отсутствуют, и соответствующие связи составляют 2.104(4)–2.137(3) Å, в то время как монодентантный цимантренкарбоксилат в комплексе Ni[(OOCC5H4)Mn(CO)3]2[O(H)Me]4 образует связь Ni–O 2.0305(14) Å [21]. В некоординированном лиганде L2 в транс-конформации связь C=N составляет 1.269(2) Å, C–C – 1.477(2) Å [32]. При координации атома никеля лиганд L2 преобретает цис-конформацию, но это практически не сказывается на длинах связей в нем (C–C 1.472(6), C=N 1.265(5) и 1.260(5) Å).
Таким образом, в работе были синтезированы гетерометаллические комплексы никеля(II) и рутения(II) со стерически загруженными лигандами: 4-изопропил-1-метилбензолом (L1) и 1,4-ди-трет-бутил-1,4-диазабутадиеном-1,3 (L2), содержащие ИК-метки в виде цимантренильной групп-ы.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Drabina P., Funk P., Ruzicka A. et al. // Transition Met. Chem. 2010. V. 35. P. 363.
Mesbah A., Jacques S., Rocca E. et al. // Eur. J. Inorg. Chem. 2011. P. 1315.
Uddin N., Sirajuddin M., Uddin N. et al. // Spectrochim. Acta Mol. Biomol. Spectrosc. 2015. V. 140. P. 563.
Dobson A., Robinson S.D. // Inorg. Chem. 1977. V. 16. P. 137.
Lynam J.M., Welby C.E., Whitwood A.C. // Organometallics. 2009. V. 28. P. 1320.
Hiett N.P., Lynam J.M., Welby C.E. et al. // J. Organomet. Chem. 2011. V. 696. P. 378.
Gawin R., Makal A., Woźniak K. et al. // Angew. Chem. Int. Ed. 2007. V. 46. P. 7206.
Lipovska P., Rathouska L., Šimůnek O. et al. // J. Fluor. Chem. 2016. V. 191. P. 14.
Arockiam P.B., Fischmeister C., Bruneau C. et al. // Angew. Chem. Int. Ed. 2010. V. 49. P. 6629.
Liu J.Y., Cao G.E., Xu W. et al. // Appl. Organomet. Chem. 2010 V. 24. № 10 P. 685.
Gong M., Zhou W., Tsai M.-C. et al. // Nat. Commun. 2014. P. 4695.
Haider A. J., Al- Anbari R., Sami H. M. et al. // J. Mater. Res. Technol. 2019. V. 8. № 3. P. 2802.
Halawy S.A., Mohamed M.A., Abdelkader A. // Arab. J. Chem. 2018. V. 11. I. 6. P. 991.
Brammer L., Rivas J.C.M., Atencio R. et al. // Dalton Trans. 2000. 3855.
Murugesapandian B., Roesky P.W. // Dalton Trans. 2010. V. 39. P. 9598.
Orlova T.Yu., Setkina V.N., Kursanov D.N. // J. Organomet. Chem. 1984. V. 267. P. 309.
Wang Y.-P., Pang S.-R., Cheng H.-Y. et al. // J. Organomet. Chem. 2008. V. 693. P. 329.
van Staveren D.R., Weyhermuller T., Metzler-Nolte N. // Organometallics. 2000. V. 1. P. 3730.
Агешина А.А., Уварова М.А., Нефедов С.Е. // Журн. неорган. химии. 2015. Т. 60. С. 1192 (Ageshina A.A., Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2015. V. 60. P. 1085). https://doi.org/10.1134/s0036023615090028
Пасынский А.А., Шаповалов С.С., Гордиенко А.В. и др. // Коорд. химия. 2011. Т. 37. № 2. С. 129 (Pasynskii A.A., Shapovalov S.S., Gordienko A.V. et al. // Russ. J. Coord. Chem. 2011. V. 37. P. 127). https://doi.org/10.1134/s1070328411020072
Van Koten G., Vrieze K. // Adv. Inorg. Chem. 1982. V. 21. P. 151.
Шаповалов С.С., Пасынский А.А., Скабицкий И.В. и др. // Коорд. химия. 2014. Т. 40. № 2. С. 75 (Shapovalov S.S., Pasynskii A.A., Skabitskii I.V. et al. // Russ. J. Coord. Chem. 2014. V. 40. P. 77). https://doi.org/10.1134/s1070328414020092
Chang Y.-Ch., Lee Y.-Ch., Chang M.-F. // J. Organomet. Chem. 2016. V. 808. P. 23.
Sheldrick G.M. SADABS (2016/2). Göttingen (Germany): Univ. of Göttingen, 2016.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Cryst. 2009. V. 42. P. 339.
Spek A.L. // Acta Crystallogr. D. 2009. V. 65. P. 148.
Kossoy E., Diskin-Posner Y., Leitus G., Milstein D. // Adv. Synth. Catal. 2012. V. 354. P. 497.
Lo V.K.-Y., Guo Z., Choi M.K.-W. et al. // J. Am. Chem. Soc. 2012. V. 134. P. 7588.
Eremenko I.L., Nefedov S.E., Sidorov A.A. et al. // Inorg. Chem. 1999. V. 38. № 17. P. 3764.
Baruah A.M., Karmakar A., Baruah J.B. // Polyhedron. 2007. V. 26. P. 4479.
Haaf M., Schmiedl A., Schmedake T.A. et al. // J. Am. Chem. Soc. 1998. V. 120. P. 12714.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия