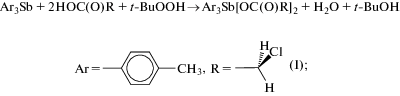Координационная химия, 2021, T. 47, № 5, стр. 293-299
Синтез и строение дикарбоксилатов трифенил- и трис(пара-толил)сурьмы
В. В. Шарутин 1, О. К. Шарутина 1, А. Н. Ефремов 1, *
1 Национальный исследовательский Южно-Уральский государственный университет
Челябинск, Россия
* E-mail: efremov_an94@mail.ru
Поступила в редакцию 18.07.2020
После доработки 31.07.2020
Принята к публикации 03.08.2020
Аннотация
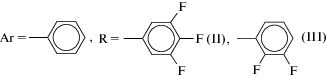
Взаимодействием трис(пара-толил)сурьмы (4-МеС6H4)3Sb с хлоруксусной и трифенилсурьмы Ph3Sb с 3,4,5-трифторбензойной, 2,3-дифторбензойной кислотами в присутствии трет-бутилгидропероксида получены дикарбоксилаты триарилсурьмы Ar3Sb[OC(O)R]2, Ar = p-Tol, R = CH2Cl (I), Ar = Ph, C6H2F3-3,4,5 (II), C6H3F2-2,3 (III). По данным рентгеноструктурного анализа (CIF files CCDC № 1883320 (I), 1979844 (II), 1980334 (III)) атомы Sb в I−III имеют координацию тригональной бипирамиды. Аксиальные углы OSbO составляют 174.47(6)° (I), 173.98(7)° (II) и 175.98(6)° (III). Длины связей Sb−O и Sb−С равны 2.145(2), 2.143(2) и 2.104(2)–2.109(2) Å в I; 2.121(2), 2.121(2) и 2.098(2)–2.112(3) Å в II; 2.1302(18), 2.1132(18) и 2.109(3)–2.117(3) Å в III. Внутримолекулярные расстояния Sb⋅⋅⋅O с карбонильным атомом кислорода (3.054(3), 3.080(3) Å (I); 3.033 Å (II); 2.959(3), 3.054(2) Å (III)) меньше суммы ван-дер-ваальсовых радиусов Sb и O. Структурная организация соединений обусловлена водородными связями типа О⋅⋅⋅H и F⋅⋅⋅H, СН⋅⋅⋅π-, F⋅⋅⋅π-взаимодействиями и стэкинг-эффектом.
Известно, что биологическая активность органических соединений сурьмы зависит от типа лигандов при атоме металла и природы заместителей в лигандах [1, 2]. Установлено, что большей активностью обладают дикарбоксилаты триарилсурьмы, содержащие атомы фтора в арильных лигандах [3, 4].
Можно предположить, что введение атомов фтора в карбоксилатные лиганды приведет к повышению их биологической активности, поэтому синтез подобных производных сурьмы весьма актуален.
К настоящему времени известен ряд дикарбоксилатов триарилсурьмы, полученных по реакции окислительного присоединения из три-арилсурьмы и карбоновых кислот НХ в присутствии пероксида [5–12], либо по реакции замещения [3, 4, 13, 14]. О синтезе и особенностях строения дикарбоксилатов трифенилсурьмы с высокой концентрацией атомов фтора в карбоксилатных лигандах сообщалось в [9, 15–18].
В продолжение исследования особенностей синтеза и строения соединений пятивалентной сурьмы мы получили дикарбоксилат трис(пара-толил)сурьмы p-Tol3Sb[OC(O)CH2Cl]2 (I) и дикарбоксилаты трифенилсурьмы Ph3Sb[OC(O)R]2 (R = C6H2F3-3,4,5 (II), C6H3F2-2,3 (III)) с атомами галогенов (хлор, фтор) в карбоксилатных лигандах и изучили их молекулярные и кристаллические структуры.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез бис(хлорацетата) трис(пара-толил)сурьмы (I). К раствору 0.100 г (0.25 ммоль) три(пара-толил)сурьмы и 0.047 г (0.50 ммоль) хлоруксусной кислоты в 20 мл диэтилового эфира прибавляли 0.032 г (0.25 ммоль) 70%-ного водного раствора трет-бутилгидропероксида. Выдерживали смесь 24 ч при 20°С, наблюдая образование бесцветных кристаллов. Выход I 179 мг (99%). Тразл = 148°С.
ИК-спектр (ν, см−1): 3035, 3018, 2954, 2920, 2866, 1683, 1654, 1591, 1492, 1444, 1398, 328, 1317, 1255, 1219, 1197, 1192, 1165, 1118, 1068, 1014, 933, 837, 798, 698, 677, 586, 514, 486, 443.
Соединения II и III синтезировали по аналогичной методике.
Бис(3,4,5-трифторбензоат) трифенилсурьмы (II): бесцветные кристаллы, выход 99%, Тпл = 236°С.
ИК-спектр (ν, см−1): 3145, 3080, 3066, 2991, 1971, 1886, 1822, 1778, 1662, 1622, 1595, 1577, 1552, 1525, 1481, 1436, 1369, 1355, 1336, 1286, 1267, 1232, 1195, 1188, 1161, 1097, 1082, 1070, 1047, 1022, 997, 960, 914, 889, 875, 844, 804, 777, 740, 709, 690, 669, 657, 644, 615, 561, 522, 474, 457, 449.
Бис(2,3-дифторбензоат) трифенилсурьмы (III): бесцветные кристаллы, выход 99%, Тпл = 194°С.
ИК-спектр (ν, см−1): 3093, 3072, 3045, 1967, 1894, 1828, 1778, 1728, 1645, 1589, 1573, 1481, 1436, 1408, 1348, 1328, 1273, 1224, 1199, 1184, 1151, 1099, 1064, 1020, 997, 954, 918, 854, 835, 785, 758, 738, 690, 634, 513, 493, 453.
ИК-спектры комплексов I−III регистрировали на ИК-спектрометре Shimadzu IR Affinity-1S в области 4000–400 см–1 (таблетки KBr).
РСА кристаллов I−III проведен на дифрактометре D8 Quest фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 293 К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [19]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [20] и OLEX2 [21]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положения атомов водорода определены геометрически по модели “наездника”. Кристаллографические данные и результаты уточнения структур приведены в табл. 1, основные длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I–III
| Параметр | I | II | III |
|---|---|---|---|
| М | 582.10 | 703.22 | 667.24 |
| Сингония | Триклинная | Моноклинная | Триклинная |
| Т, K | 293.15 | 293.15 | 293.15 |
| Пр. гр. | P1 | I2/a | P1 |
| a, Å | 10.273(6) | 11.525(7) | 9.113(5) |
| b, Å | 11.681(8) | 22.814(13) | 11.043(6) |
| c, Å | 12.876(6) | 11.965(8) | 14.770(12) |
| α, град | 106.891(19) | 90 | 69.74(3) |
| β, град | 104.18(2) | 114.48(5) | 86.98(3) |
| γ, град | 108.55(3) | 90 | 83.203(18) |
| V, Å3 | 1301.2(14) | 2863(3) | 1384.5(16) |
| Z | 2 | 4 | 2 |
| ρ(выч), г/см3 | 1.486 | 1.631 | 1.601 |
| μ, мм−1 | 1.293 | 1.039 | 1.060 |
| F(000) | 584.0 | 1392.0 | 664.0 |
| Размер кристалла, мм | 0.32 × 0.14 × 0.1 | 0.36 × 0.24 × 0.17 | 0.36 × 0.33 × 0.19 |
| 2θ, град | 5.866–56.998 | 6.534–56.988 | 5.666–57 |
| Интервалы индексов отражений | –13 ≤ h ≤ 13, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
–15 ≤ h ≤ 15, –30 ≤ k ≤ 30, –16 ≤ l ≤ 15 |
–12 ≤ h ≤ 12, –14 ≤ k ≤ 14, –19 ≤ l ≤ 19 |
| Всего отражений | 77 253 | 54 936 | 59 367 |
| Независимых отражений (Rint) | 6582 (0.0365) | 3636 (0.0313) | 7001 (0.0280) |
| Отражений с I > 2σ(I) | 5933 | 3352 | 6369 |
| Число уточняемых параметров | 293 | 197 | 377 |
| GOOF | 1.032 | 1.074 | 1.084 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0271 wR2 = 0.0695 |
R1 = 0.0228 wR2 = 0.0564 |
R1 = 0.0273 wR2 = 0.0647 |
| R-факторы по всем отражениям | R1 = 0.0323 wR2 = 0.0722 |
R1 = 0.0265 wR2 = 0.0583 |
R1 = 0.0328 wR2 = 0.0697 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.76/–1.06 | 0.39/–0.34 | 0.88/–0.41 |
Таблица 2.
Основные длины связей и валентные углы в структурах I−III*
| Связь | Длина, Å | Угол | ω, град |
|---|---|---|---|
| I | |||
| Sb(1)–O(1) | 2.145(2) | O(3)Sb(1)O(1) | 174.47(6) |
| Sb(1)–O(3) | 2.143(2) | C(1)Sb(1)O(1) | 90.52(9) |
| Sb(1)–C(1) | 2.109(2) | C(1)Sb(1)O(3) | 89.55(9) |
| Sb(1)–C(11) | 2.109(2) | C(11)Sb(1)O(1) | 86.99(8) |
| Sb(1)–C(21) | 2.104(2) | C(11)Sb(1)O(3) | 87.90(8) |
| O(1)–C(8) | 1.264(3) | C(11)Sb(1)C(1) | 113.26(9) |
| O(2)–C(8) | 1.220(3) | C(21)Sb(1)O(1) | 91.59(9) |
| O(3)–C(18) | 1.264(3) | C(21)Sb(1)O(3) | 92.22(9) |
| O(4)–C(18) | 1.215(3) | C(21)Sb(1)C(1) | 135.67(9) |
| Sb(1)⋅⋅⋅O(2) | 3.054(3) | C(21)Sb(1)C(11) | 111.07(9) |
| Sb(1)⋅⋅⋅O(4) | 3.080(3) | C(8)O(1)Sb(1) | 115.73(16) |
| II | |||
| Sb(1)–O(1) | 2.121(2) | O(1)Sb(1)O(1)1 | 173.98(7) |
| Sb(1)–O(1)1 | 2.121(2) | C(1)1Sb(1)O(1) | 91.73(8) |
| Sb(1)–C(1) | 2.098(2) | C(1)Sb(1)O(1)1 | 91.73(8) |
| Sb(1)–C(1)1 | 2.098(2) | C(1)1Sb(1)O(1)1 | 90.53(8) |
| Sb(1)–C(7) | 2.112(3) | C(1)Sb(1)O(1) | 90.53(8) |
| O(1)–C(17) | 1.305(2) | C(1)1Sb(1)C(1) | 135.90(12) |
| O(2)–C(17) | 1.213(3) | C(1)1Sb(1)C(7) | 112.05(6) |
| F(2)–C(14) | 1.336(3) | C(1)Sb(1)C(7) | 112.05(6) |
| F(1)–C(13) | 1.343(4) | C(7)Sb(1)O(1) | 86.99(3) |
| Sb(1)⋅⋅⋅O(2) | 3.033 | C(7)Sb(1)O(1)1 | 86.99(3) |
| III | |||
| Sb(1)–O(1) | 2.1302(18) | O(3)Sb(1)O(1) | 175.98(6) |
| Sb(1)–O(3) | 2.1132(18) | O(3)Sb(1)C(1) | 88.16(8) |
| Sb(1)–C(1) | 2.117(3) | C(1)Sb(1)O(1) | 88.24(8) |
| Sb(1)–C(11) | 2.111(3) | C(11)Sb(1)O(1) | 87.94(8) |
| Sb(1)–C(21) | 2.109(3) | C(11)Sb(1)O(3) | 91.73(8) |
| O(1)–C(37) | 1.300(3) | C(11)Sb(1)C(1) | 111.70(10) |
| O(2)–C(37) | 1.221(3) | C(21)Sb(1)O(1) | 91.26(8) |
| O(3)–C(47) | 1.301(3) | C(21)Sb(1)O(3) | 91.52(8) |
| O(4)–C(47) | 1.222(3) | C(21)Sb(1)C(1) | 107.40(10) |
| Sb(1)⋅⋅⋅O(2) | 2.959(3) | C(21)Sb(1)C(11) | 140.85(9) |
| Sb(1)⋅⋅⋅O(4) | 3.054(2) | C(37)O(1)Sb(1) | 113.19(13) |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1883320 (I), 1979844 (II), 1980334 (III); deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что окисление трифенилсурьмы трет-бутилгидропероксидом в присутствии карбоновых кислот приводит к синтезу дикарбоксилатов трифенилсурьмы общей формулы Ph3Sb[OC(O)R)]2 [4].
Мы установили, что реакции трис(пара-толил)сурьмы с хлоруксусной и трифенилсурьмы с 3,4,5-трифтор- и 2,3-дифторбензойными кислотами в присутствии трет-бутилгидропероксида (мольное соотношение 1 : 2 : 1) протекают в эфире с образованием дикарбоксилатов триарилсурьмы, выделяемых с выходом до 99%.
После испарения диэтилового эфира получали устойчивые на воздухе бесцветные кристаллы целевых соединений.
В ИК-спектрах соединений I–III наблюдается интенсивная полоса поглощения валентных колебаний фрагмента SbC3 при 486, 457 и 453 см–1 соответственно. Наличие карбонильной группы характеризуется присутствием полосы поглощения валентных колебаний связи С=О высокой интенсивности при 1683 (I), 1662 (II) и 1645 (III) см–1. Полосы поглощения при 1591, 1492, 1444 см–1 (I); 1595, 1481, 1436 см–1 (II); 1589, 1481, 1436 см–1 (III) характеризуют валентные колебания углеродного скелета бензольных колец. Валентным колебаниям связей CAr–H отвечает полоса поглощения средней интенсивности при 3035 (I), 3066 (II), 3072 (III) см–1, а внеплоскостным деформационным колебаниям этих же связей – высокоинтенсивные полосы при 798 и 698 (I), 740 и 690 (II), 738 и 690 (III) см–1. В ИК-спектре соединения I присутствуют полосы поглощения валентных колебаний метильных групп, асимметричные колебания которых находятся при 2920 см–1, симметричные колебания – 2866 см–1 [22, 23].
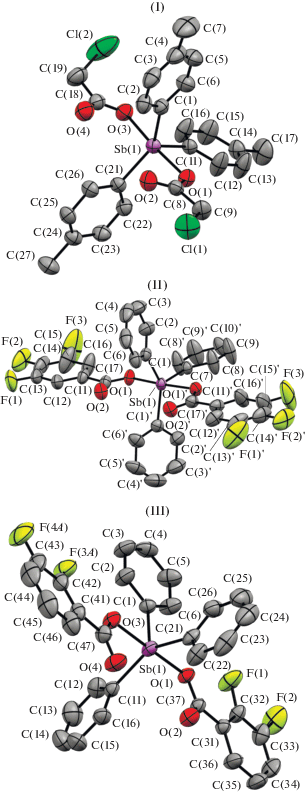
По данным РСА, в соединениях I−III атомы Sb находятся в экваториальной плоскости и имеют искаженную тригонально-бипирамидальную координацию с атомами кислорода карбоксилатных лигандов в аксиальных положениях (рис. 1). Молекулы соединения II симметричны и содержат ось симметрии второго порядка, лежащую вдоль связи Sb(1)–C(7). Атомы фтора одного карбоксилатного лиганда соединения III разупорядочены по двум положениям. Уточненное соотношение вкладов положений в разупорядоченный фрагмент составляет 0.91/0.09.
Суммы углов в экваториальной плоскости СS-bС в молекулах дикарбоксилатов триарилсурьмы составляют 360°. Атом сурьмы выходит из экваториальной плоскости [С3] только в структурах I и III на 0.002 и 0.028 Å соответственно, в структуре II – лежит в ней. Экваториальные лиганды в структурах I–III развернуты вокруг связей Sb−C таким образом, чтобы свести к минимуму внутри- и межмолекулярные контакты. Двугранные углы между плоскостями бензольных колец арильных лигандов и экваториальной плоскостью составляют 9.30° C(1)–C(6), 87.46° C(11)–C(16), 4.88° С(21)–С(26) (I); 19.98° C(1)–C(6), 19.98° C(1')–C(6'), 80.29° C(7)–C(8') (II); 87.14° C(1)–C(6), 15.87° C(11)–C(16), 12.90° С(21)–С(26) (III). Отметим, что во всех структурах одно из колец, расположенное напротив наибольшего экваториального угла, практически перпендикулярно экваториальной плоскости. Аксиальные углы OSbO в I–III составляют 174.47(6)°, 173.98(7)°, 175.98(6)° соответственно.
Интервалы изменения длин связей Sb–C составляют 2.104(2)–2.109(2) (средн. 2.107(2)) (I), 2.098(2)–2.112(3) (2.103(2)) (II), 2.109(3)–2.117(3) Å (2.112(3) Å) (III). Расстояния Sb–O составляют 2.145(2), 2.143(2) (I); 2.121(2), 2.121(2) (II); 2.1302(18), 2.1132(18) Å (III). Связи Sb–C короче расстояний Sb–O, что характерно для ранее структурно охарактеризованных дикарбоксилатов триарилсурьмы [19]. Как и в других дикарбоксилатах триарилсурьмы в I–III имеет место взаимодействие центрального атома с атомами кислорода карбонильных групп. Расстояния Sb⋅⋅⋅O(=С) составляют 3.054(3), 3.080(3) (I); 3.033 (II); 2.959(3), 3.054(2) Å (III). Следует отметить, что аналогичные расстояния в дикарбосилатах триарилсурьмы, содержащих атомы фтора в арильных группах, значительно короче [3, 4, 9–11], что обусловлено влиянием электронных эффектов заместителя в арильном лиганде. Расстояния Sb⋅⋅⋅O в молекулах I–III сопоставимы с аналогичными расстояниями в других структурно охарактеризованных дикарбоксилатах триарилсурьмы с кислотными остатками, содержащими электроотрицательные группы [15–18, 24–26]. Укорочение данных расстояний в ряду от I к III связано с усилением –I-эффекта заместителей в кислотных остатках.
Карбоксилатные лиганды в I–III проявляют анизобидентатные свойства, при этом степень асимметрии координации лигандов, которую можно выразить отношением расстояний Sb⋅⋅⋅O(=С) к длинам связей Sb–O, различна и составляет 1.424, 1.437 (I); 1.430 (II); 1.389, 1.445 (III).
Карбоксильные группы имеют цис-конформацию относительно экваториальной плоскости [С3] и лежат приблизительно в одной плоскости (двугранные углы между плоскостями карбоксильных групп равны 6.85°, 8.17°, 1.57° в соединениях I–III соответственно). Такое расположение карбоксильных групп приводит к увеличению одного экваториального угла СSbС со стороны контактов Sb⋅⋅⋅O(=С) (135.67(9)° (I), 135.90(12)° (II), 140.85(9)° (III)), при этом наблюдается уменьшение значений двух других экваториальных углов. Следует отметить, что коротким расстояниям Sb⋅⋅⋅O(=С) соответствует большее значение экваториального угла.
Формирование трехмерной сетки в кристаллах соединений I и II обусловлено наличием слабых водородных связей типа О⋅⋅⋅H с участием карбонильного атома кислорода (2.64, 2.58, 2.57 (I); 2.48 Å (II)) и СН⋅⋅⋅π-взаимодействий. В соединении II также наблюдается стэкинг-эффект между ароматическими кольцами карбоксилатных лигандов (расстояние между плоскостями бензольных колец составляет 3.44 Å). В кристалле соединения III наблюдаются СН⋅⋅⋅π- и F⋅⋅⋅π-взаимодействия, межмолекулярные контакты F⋅⋅⋅H (2.58, 2.52, 2.65 Å) и частичное взаимодействие π-систем ароматических колец карбоксилатных лигандов. Наименьшее расстояние между плоскостями данных π-систем составляет 3.387(4) Å (С(32)⋅⋅⋅С(42)).
Таким образом, взаимодействие трис(пара-толил)сурьмы с хлоруксусной кислотой и трифенилсурьмы с 3,4,5-трифтор- и 2,3-дифторбензойными кислотами в присутствии трет-бутилгидропероксида приводит к образованию соответствующих дикарбоксилатов триарилсурьмы. По данным РСА, координационный полиэдр атома сурьмы представляет собой тригональную бипирамиду с атомами кислорода карбоксилатных лигандов в аксиальных положениях. Наличие внутримолекулярных контактов атома сурьмы с карбонильным атомом кислорода приводит к увеличению одного из экваториальных углов. Структурная организация соединений обусловлена не только водородными связями типа О⋅⋅⋅H (в I и II) и F⋅⋅⋅H (в III), но и СН⋅⋅⋅π-, F⋅⋅⋅π-взаимодействиями (в III) и стэкинг-эффектом (в II).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Hadjikakou S.K., Ozturk I.I., Banti C.N. et al. // J. I-norg. Biochem. 2015. V. 153. P. 293. https://doi.org/10.1016/j.jinorgbio.2015.06.006
Ali M.I., Rauf M.K., Badshah A. et al. // Dalton Trans. 2013. V. 42. P. 16733. https://doi.org/10.1039/C3DT51382C
Yu L., Ma Y.-Q., Wang G.-C. et al. // Heteroatom Chem. 2004. V. 15. P. 32. https://doi.org/10.1002/hc.10208
Yu L., Ma Y.-Q., Liu R.-C. et al. // Polyhedron. 2004. V. 23. P. 823. https://doi.org/10.1016/j.poly.2003.12.002
Thepe T.C., Garascia R.J., Selvoski M.A. et al. // Ohio J. Sci. 1977. V. 77. № 3. P. 134.
Шарутин В.В., Сенчурин В.С. Именные реакции в химии элементоорганических соединений. Челябинск: Издательский центр ЮУрГУ, 2011. 427 с.
Шарутин В.В., Шарутина О.К., Котляров А.Р. // Журн. неорган. химии. 2015. Т. 60. № 4. С. 525 (Sharutin V.V., Sharutina O.K., Kotlyarov A.R. // Russ. J. Inorg. Chem. 2015. V. 60. № 4. P. 465). https://doi.org/10.1134/S0036023615040221
Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. неорган. химии. 2015. Т. 60. № 9. С. 1093 (Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Inorg. Chem. 2015. V. 60. № 9. P. 1093). https://doi.org/10.1134/S0036023615060145
Шарутин В.В., Шарутина О.К. // Изв. АН. Сер. хим. 2017. № 4. С. 707 (Sharutin V.V., Sharutina O.K. // Russ. Chem. Bull. 2017. V. 66. № 4. P. 707). https://doi.org/10.1007/s11172-017-1796-6
Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Журн. неорган. химии. 2016. Т. 61. № 1. С. 46 (Sharutin V.V., Sharutina O.K., Efremov A.N. // Russ. J. Inorg. Chem. 2016. V. 61. № 1. P. 43). https://doi.org/10.1134/S003602361601023X
Шарутин В.В., Шарутина О.К. // Журн. общ. химии. 2016. Т. 86. № 8. С. 1366 (Sharutin V.V., Sharutina O.K. // Russ. J. Gen. Chem. 2016. V. 86. № 8. P. 1902). https://doi.org/10.1134/S107036321608020X
Шарутин В.В., Шарутина О.К., Пакусина А.П. и др. // Журн. коорд. химии. 2003. Т. 29. № 10. С. 750 (Sharutin V.V., Sharutina O.K., Pakusina A.P. et al. // Russ. J. Coord. Chem. 2003. V. 29. № 10. P. 694). https://doi.org/10.1023/A:1026020032214
Ferguson G., Kaitner B., Glidewell C. et al. // J. Organomet. Chem. 1991. V. 419. № 3. P. 283. https://doi.org/10.1016/0022-328X(91)80241-B
Шарутин В.В., Шарутина О.К., Бондарь Е.А. и др. // Журн. коорд. химии. 2002. Т. 28. № 5. С. 356 (Sharutin V.V., Sharutina O.K., Bondar’ E.A. et al. // Russ. J. Coord. Chem. 2002. V. 28. № 5. P. 333). https://doi.org/10.1023/A:1015517216693
Wen L., Yin H., Quan L. et al. // Acta Crystallogr. E. 2008. V. 64. P. m1303. https://doi.org/10.1107/S1600536808029656
Yin H.-D., Wen L.-Y., Cui J.-C. et al. // Polyhedron. 2009. V. 28. № 14. P. 2919. https://doi.org/10.1016/j.poly.2009.06.065
Quan L., Yin H., Cui L. et al. // Acta Crystallogr. E. 2009. V. 65. P. m656. https://doi.org/10.1107/S1600536809017449
Zhang X.-Y., Cui L., Zhang X. et al. // J. Mol. Struct. 2017. V. 1134. P. 742. https://doi.org/10.1016/j.molstruc.2017.01.039
SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison (WI, USA): Bruker AXS Inc., 1998.
SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison (WI, USA): Bruker AXS Inc., 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Васильев А.В., Гриненко Е.В., Щукин А.О., Федулина Т.Г. Инфракрасная спектроскопия органических и природных соединений. СПб: СПбГЛТА, 2007. 54 с.
Тарасевич Б.Н. ИК спектры основных классов органических соединений. М.: МГУ, 2012. 55 с.
Cambridge Crystallographic Data Center, 2020 (deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
Шарутина О.К., Шарутин В.В. Молекулярные структуры органических соединений сурьмы (V). Челябинск: Издательский центр ЮУрГУ, 2012. 395 с.
Wen L., Yin H., Li W. et al. // Inorg. Chim. Acta. 2010. V. 363. № 4. P. 676. https://doi.org/10.1016/j.ica.2009.11.022
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия