Координационная химия, 2021, T. 47, № 5, стр. 283-287
Комплекс цинка(II) c 1,2-бис(2-пиридил-1,2,4-триазол-3-ил)этаном и дианионами 1-гидроксиэтан-1,1-дифосфоновой кислоты
В. Ф. Шульгин 1, *, М. А. Кискин 2, А. Н. Гусев 1, Ю. И. Балуда 1, И. О. Рюш 1
1 Крымский федеральный университет им. В.И. Вернадского
Симферополь, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: shulvic@gmail.com
Поступила в редакцию 17.11.2020
После доработки 07.12.2020
Принята к публикации 10.12.2020
Аннотация
Реакцией ZnSO4 ∙ 7Н2О с 1,2-бис(2-пиридил-1,2,4-триазол-3-ил)этаном (Н2L) и 1-гидроксиэтан-1,1-дифосфоновой кислотой (H4EDP) в водной среде получен комплекс {[Zn2(H2L)(H2EDP)2- (H2O)2] ∙ 2H2O}n, исследованный методами элементного анализа и ИК-спектроскопии. Структура комплекса установлена методом РСА (CIF file CCDC № 2043698). Комплекс имеет 1D-полимерное строение и представляет собой зигзагообразную цепь, в которой два катиона цинка(II) объединены двумя бифосфонатными анионами в центросимметричные биядерные фрагменты, связанные мостиковыми молекулами бис(триазолил)этана. Катион цинка(II) дополнительно координирует молекулу воды и находится в искаженно октаэдрическом координационном окружении. В спектре люминесценции комплекса наблюдается широкая полоса излучения с максимумом при 408 нм и квантовым выходом 4%.
2-Пиридилзамещенные азольные лиганды являются структурными аналогами хелатирующих 2,2'-дипиридила и 1,10-фенантролина и обладают высокой координирующей способностью. Поэтому лиганды данного типа вызывают повышенный интерес исследователей [1–3]. Связывание хелатирующих группировок углеводородным спейсером и использование дополнительных экстралигандов позволяет расширить их координирующие способности и синтезировать комплексы с оригинальной структурой и свойствами, которые в основном определяются длиной и природой спейсера [4–7]. Значительное влияние на строение синтезированных комплексов оказывают также условия синтеза и кристаллизации продуктов реакции.
В настоящей статье описан синтез и строение полимерного комплекса цинка(II), полученного на основе дианионов 1-гидроксиэтан-1,1-дифосфоновой кислоты (H4EDP) и 1,2-бис(2-пиридил-1,2,4-триазол-3-ил)этана (H2L) – представителя удобного типа пролигандов, пригодных для самосборки координационных соединений различной ядерности и топологии [1, 4]. Комплексы цинка(II) c азотсодержащими лигандами и анионами H4EDP описаны в [8–10].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали 1,2-бис(2-пиридил-1,2,4-триазол-3-ил)этан, полученный по методике, описанной в [4]. Для синтеза использовали ZnSO4 ⋅ 7H2O (“х. ч.”) и 1-гидроксиэтан-1,1-дифосфоновую кислоту (этидроновая кислота, моногидрат, препарат фирмы Aldrich).
Синтез комплекса {[Zn2(H2L)(H2EDP)2(H2O)2] · · 2H2O}n (I). К суспензии, содержащей 0.5 ммоль (0.160 г) Н2L в 10 мл воды, добавляли раствор 1 ммоль (0.225 г) H4EDP в 5 мл воды и перемешивали при температуре 70–80°С в течение 10 мин до полного растворения реагентов. К полученному раствору добавляли раствор 1 ммоль (0.287 г) ZnSO4 ⋅ 7Н2О в 5 мл воды и охлаждали до комнатной температуры при перемешивании, после чего медленно добавляли 2 ммоль триэтиламина до рН 6–7. Полученный раствор выдерживали 3 сут при комнатной температуре. Образовавшиеся кристаллы отделяли от маточного раствора фильтрованием, промывали водой и сушили на воздухе. Выход бесцветного мелкокристаллического вещества 0.140 г (15% в расчете на Н2L).
ИК-спектр (ν, см–1): 3218, 1620, 1610, 1569, 1481, 1455, 1402, 1349, 1288, 1238, 1127, 1031, 999, 906, 892, 754, 710, 645, 550, 449, 413.
Монокристаллы I, пригодные для РСА, выращивали перекристаллизацией мелкокристаллического продукта из воды в условиях гидротермального синтеза. Для этого 20 мг вещества помещали в герметичную тефлоновую пробирку, приливали 10 мл воды, добавляли 1–2 капли 60%-ного раствора этидроновой кислоты и нагревали до 80°С со скоростью 0.2°С/мин. Температуру выдерживали 2 ч и медленно с такой же скоростью охлаждали до комнатной температуры. Образовавшиеся кристаллы отделяли фильтрованием.
РСА монокристаллов I проведен при температуре 150 K на дифрактометре Bruker Smart APEXII, оборудованном CCD-детектором и источником монохроматического излучения (MoKα, λ = 0.71073 Å, графитовый монохроматор) с использованием стандартной процедуры [11]. Введена поправка на поглощение [12]. Структура расшифрована прямым методом и уточнена в полноматричном анизотропном приближении для всех неводородных атомов. Расчеты проведены с использованием программы SHELXL-2018/3 [13]. Атомы водорода генерированы геометрически и уточнены в модели “наездника”. Атомы H при атомах кислорода, O(3) и O(5) фосфорильных групп выявлены из разностного синтеза Фурье и зафиксированы при помощи функций AFIX с учетом разупорядочения по двум позициям с равнозначными заселенностями по 0.5.
Кристаллографические параметры и детали уточнения структур для I: C20H36N8O19P4Zn2, М = = 947.19, размер кристалла 0.1 × 0.1 × 0.08 мм, бесцветные кристаллы, T = 150(2) K, триклинная сингония, пр. гр. $P\bar {1},$ a = 8.9186(5), b = 10.2871(6), c = 10.4426(6) Å, α = 110.053(2)°, β = 107.600(2)°, γ = 93.077(2)°, V = 844.51(8) Å3, Z = 1, ρ = 1.862 г/см3, μ = 1.704 мм–1, θ = 2.14°–28.28°, –11 ≤ h ≤ 10, –13 ≤ ≤ k ≤ 13, –13 ≤ l ≤ 13; всего 8794 отражений, независимых отражений 4142, отражений с I ≥ 2σ(I) 3688, Rint = 0.0229, Tmin/Tmax = 0.6371/0.7461, S = = 0.820, R1 = 0.0382, wR2 = 0.0888 (для всех данных), R1 = 0.0333, wR2 = 0.0849 (для I ≥ 2σ(I)), Δρmin/Δρmax = –0.574/1.144 е Å–3.
Координаты атомов и другие параметры структуры I депонированы в Кембриджском банке структурных данных (CCDC № 2043698); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ data_request/cif).
Элементный анализ выполняли на автоматическом анализаторе EURO Vector 3000A. ИК-спектры записывали на ИК-спектрометре с Фурье-преобразованием Spectrum Two, снабженном приставкой однократно нарушенного полного внутреннего отражения (Perkin Elmer). Спектры возбуждения и люминесценции поликристаллических образцов изучали на приборе FluoroMax-4 (Horiba).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
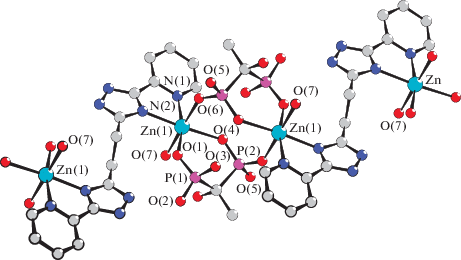
Установлено, что в ходе реакции 1,2-бис(2-пиридил-1,2,4-триазол-3-ил)этана (Н2L), 1-гидроксиэтан-1,1-дифосфоновой кислоты (H4EDP) и ZnSO4 ∙ 7Н2О (в соотношении 1 : 2 : 2) в воде при нейтрализацией триэтиламином происходит образование комплекса {[Zn2(H2L)(H2EDP)2(H2O)2] · · 2H2O}n (I). Структура I установлена методом РСА. Показано, что комплекс кристаллизуется в виде зигзагообразного 1D-полимера и содержит биядерные фрагменты, образованные катионами цинка и дифосфонатными дианионами (рис. 1), которые выполняют хелатно-мостиковую функцию, координируя катионы цинка(II) фосфорильными атомами кислорода. Расстояния между катионами цинка(II) в димере равно 5.262 Å. Димерные фрагменты связаны в полимерную цепь спейсерированными молекулами Н2L. Наиболее короткое расстояние между катионами цинка(II) в соседних димерах равно 8.045 Å. Избранные длины связей, образованные с участием атомов цинка и фосфора, приведены в табл. 1.
Таблица 1.
Наиболее важные длины связей с участием атомов цинка и фосфора в молекулярной структуре комплекса I
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Zn(1)–O(1) | 2.022(2) | P(1)–O(1) | 1.502(2) |
| Zn(1)–O(4) | 2.170(2) | P(1)–O(2) | 1.511(2) |
| Zn(1)–O(6) | 2.067(2) | P(1)–O(3) | 1.571(2) |
| Zn(1)–O(7) | 2.109(2) | P(2)–O(4) | 1.516(2) |
| Zn(1)–N(1) | 2.265(2) | P(2)–O(5) | 1.580(2) |
| Zn(1)–N(2) | 2.142(2) | P(2)–O(6) | 1.503(2) |
Каждый бифосфонатный анион H2EDP2– образует с катионом цинка(II) шестичленный хелатный цикл Zn(1)O(1)P(1)C(9)P(2)O(4) c геометрией, приближенной к конформации “ванна”. Связи катиона цинка(II) с депротонированными атомами кислорода бисфосфонат-аниона O(1) и O(4) неэквивалентны (2.022(2) и 2.170(2) Å) и сопоставимы с длиной связи катионов цинка(II) с атомом кислорода координированной молекулы воды – Zn–O(7) 2.109(2) Å. Связывание атома кислорода O(6) аниона кислоты с соседним катионом цинка(II) обеспечивает объединение мономерных фрагментов в димер, длина мостиковой связи Zn–O(6) составляет 2.067(2) Å. Образующийся восьмичленный цикл Zn(1)O(6)P(2)O(4)Zn(1)O(6)P(2)O(4) изогнут и имеет геометрию, близкую к конформации “ванна”.
Молекулы спейсерированного 2-пиридил-1,2,4-триазола связывают димерные фрагменты в полимерную цепь за счет координации атомов азота N(1) и N(2) пиридильного и триазольного фрагментов. Связи атомов Zn с атомами азота триазольного фрагмента – Zn(1)–N(2) равны 2.142(2) Å и короче по сравнению со связями с атомами азота пиридильного заместителя – Zn(1)–N(1) 2.265(2) Å. Длины связей и валентные углы в пределах органических лигандов имеют значения, близкие к обычным [14]. Связывание полимерных слоев экстралигандами наблюдалось ранее при изучении бифосфонатных комплексов цинка(II) с 4,4'-бипиридилами и их спейсерированными аналогами [8, 9].
Гидратные молекулы воды занимают полости кристаллической решетки и участвуют в образовании системы водородных связей с вовлечением гетероциклических атомов азота, а также атомов кислорода фосфорильных групп (табл. 2). Такое H-связывание цепочек координационного полимера в кристалле приводит к образованию трехмерной супрамолекулярной структуры.
Таблица 2.
Геометрические параметры водородных связей в кристаллической структуре I
| Контакт D–H⋅⋅⋅A | Расстояние, Å | Угол DHA, град | Симметрия атома А | ||
|---|---|---|---|---|---|
| D–H | H···A | D···A | |||
| N(4)–H(4B)∙∙∙O(2) | 0.88 | 1.82 | 2.683(3) | 168 | –x + 1, –y, –z |
| O(3)–H(3B)∙∙∙O(4) | 0.84 | 1.79 | 2.629(2) | 174 | –x + 1, –y + 1, –z + 1 |
| O(5)–H(5A)∙∙∙O(2w) | 0.84 | 1.95 | 2.774(3) | 168 | x, y, z |
| O(5)–H(5A)∙∙∙O(1wA) | 0.83 | 1.88 | 2.701(8) | 168 | x, y, z |
| O(7)–H(7A)∙∙∙O(8) | 0.89 | 1.87 | 2.711(3) | 155 | x, y, z |
| O(7)–H(7B)∙∙∙N(3) | 0.89 | 2.13 | 2.844(3) | 137 | –x, –y, –z |
| O(8)–H(8C)∙∙∙O(2) | 0.84 | 1.91 | 2.687(2) | 152 | –x + 1, –y + 1, –z |
| O(2w)-H(2wB)∙∙∙O(2) | 0.87 | 2.08 | 2.878(4) | 153 | –x + 1, –y, –z |
ИК-спектр поглощения комплекса I наряду с полосами спейсерированного 2-пиридил-1,2,4-триазола (1610–1288 см–1) содержит широкие интенсивные полосы с максимумами поглощения при 1237–550 cм–1, обусловленные валентными колебаниями связей фосфор–кислород и фосфор–углерод [15]. В области около 3220 см–1 проявляется широкая огибающая, включающая полосы валентных колебаний молекул воды, деформационные колебания которых наблюдаются в виде слабой полосы с максимумом около 1620 см–1.
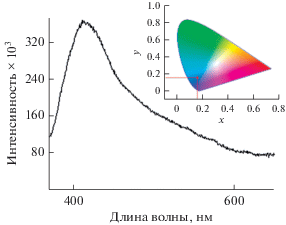
Ранее в литературе была описана люминесценция комплексов бифосфонатов цинка(II) с пиридилсодержащими лигандами, обусловленная π–π*-переходами внутри азотсодержащего гетероцикла (λэм = 420–450 нм, λвозб = 330–365 нм) [8, 9]. Спектр люминесценции комплекса I содержит аналогичную широкую полосу эмиссии с максимумом при 408 нм (λвозб = 350 нм) и квантовым выходом 4%. Координаты на диаграмме цветности x = 0.6, y = 0.16 (рис. 2). Полоса люминесценции свободных молекул H4EDP наблюдается в области около 360 нм (λвозб = 320 нм) [10], что позволяет исключить электронные переходы внутри дифосфонатного лиганда в качестве источника люминесценции комплекса I.
Таким образом, установлено, что использование дианиона 1-гидроксиэтан-1,1-дифосфоновой кислоты, способствующего формированию полиядерных структур, в присутствии дитопного 1,2-бис(2-пиридил-1,2,4-триазол-3-ил)этана в реакции с ионами цинка(II) приводит к образованию биядерных фрагментов, связанных между собой в полимерную цепь спейсерированным триазолом. Примечательно, что в рассматриваемом комплексе спейсерированный триазольный лиганд проявляет мостиковую функцию. В то время как в ранее описанных комплексах Н2L демонстрировал только терминальный способ координации [4]. Очевидно, что дополнительное комплексообразование с этидроновой кислотой расширяет координирующие возможности спейсерированных триазолов, что может оказаться перспективным для целенаправленного получения полиядерных кластеров.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Гусев А.Н., Шульгин В.Ф., Кискин М.А. // Журн. структур. химии. 2019. Т. 60. № 3. С. 353.
Chi Y., Tong B., Chou P.-T. // Coord. Chem. Rev. 2014. 281. P. 1.
Ward M.D. // Chem. Commun. 2009. P. 4487.
Gusev A.N., Shul’gin V.F., Ryush I.O. et al. // Eur. J. In-org. Chem. 2017. P. 704.
Gusev A.N., Shul’gin V.F., Riush I.O. et al. // Inorg. Chim. Acta. 2017. V. 456. P. 136.
Gusev A., Nemec I., Herchel R. et al. // Dalton Trans. 2019. V. 48. P. 3052.
Gusev A., Nemec I., Herchel R. et al. // Dalton Trans. 2019. V. 48. P. 10526.
Liu Hao-Hao, Ma Yu-Juan, Han Song-De et al. // Dalton Trans. 2019. V. 48. P. 3955.
Ma Yu-Juan, Han Song-De, Mu Ying et al. // Dalton Trans. 2018. V. 47. P. 1650.
Pan Jie, Ma Yu-Juan, Han Song-De // Cryst. Growth Des. 2019. V. 19. P. 2919.
SMART (control) and SAINT (integration) Sofware. Version 5.0. Madison (WI, USA), Bruker AXS Inc., 1997.
Krause L., Herbst-Irmer R., Sheldrick G.M., Stalke D. // J. Appl. Cryst. 2015. V. 48. P. 3.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Allen F.H., Kennard O., Watson D.G. et al. // Perkin Trans. 2. 1987. V. 12. P. 1.
Pan Ling-ling, Yuan Yi-Xuan, Xiao Y. et al. // J. Mol. Struct. 2008. V. 892. P. 272.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия