Координационная химия, 2021, T. 47, № 6, стр. 327-337
Новые низкоразмерные перовскиты на основе бромида свинца
К. Л. Исаковская 1, 2, И. А. Никовский 1, Ю. В. Нелюбина 1, 3, *
1 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
2 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
3 Московский государственный технический университет им. Н.Э. Баумана
Москва, Россия
* E-mail: unelya@ineos.ac.ru
Поступила в редакцию 01.12.2020
После доработки 19.01.2021
Принята к публикации 21.01.2021
Аннотация
При взаимодействии бромида свинца с 7,7,8,8-тетрацианохинодиметаном и антрацен-9-илметанамин гидробромидом в диметилформамиде (DMF) получен известный низкоразмерный перовскит {PbBr2(DMF)}n (I) с примесью нового гибридного 1D-перовскита {Ca(DMF)6[PbBr3]2}n (II), который выделен в индивидуальном виде и охарактеризован при помощи РСА. В кристалле II бромид свинца образует бесконечные цепочки из октаэдров PbBr5 с одной вакантной вершиной, между которыми располагаются координированные молекулами DMF катионы кальция, предположительно попавшие в реакционную смесь из воды, использовавшейся для промывания сосуда для кристаллизации после предыдущей попытки синтеза. Попытка целенаправленного получения данного гибридного 1D-перовскита из различных солей кальция в качестве источника ионов данного металла привела к еще одному новому низкоразмерному перовскиту {Ca(DMF)6[PbBr2.3Cl0.7]2}n (III), в котором галогенид-анионы (бромид- и хлорид-анионы из бромида свинца и хлорида кальция соответственно) достраивают координационную сферу иона свинца до октаэдрической, не вызывая заметных изменений в кристаллической упаковке по сравнению с II. CIF files CCDC № 2045586 (I), 2047219 (II), 2047220 (III).
Одно из наиболее впечатляющих достижений последних лет в области возобновляемых источников энергии связано с созданием гибридных перовскитных полупроводников [1, 2] с общей формулой AMX3, где M – ион металла (Pb2+ и Sn2+), X – галогенид-анион (I–, Br– или Cl–), A – органический катион (например, ${\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{NH}}_{3}^{ + }$ или ${\text{N}}{{{\text{H}}}_{{\text{2}}}}{\text{CHNH}}_{2}^{ + }$). По своим оптоэлектронным характеристикам данные материалы, в которых октаэдры MX6 образуют трехмерную кристаллическую структуру, сопоставимы с кристаллическим кремнием, активно применяемым в современных солнечных батареях. Основным их недостатком, препятствующим дальнейшему развитию использующей их технологии [3], является низкая стабильность гибридных перовскитов, которые легко разрушаются под действием кислорода и влаги воздуха, а также высокой температуры и даже при длительном облучении солнечным светом.
В качестве одного из вариантов решения данной проблемы в последнее время исследователи-химики и материаловеды по всему миру рассматривают переход к так называемым “низкоразмерным” гибридным перовскитам [3–8], в которых октаэдры MX6 (или пирамиды MX5 [9] и тетраэдры MX4 [10]) образуют кристаллическую структуру меньшей размерности, благодаря чему они обладают более высокой стабильностью [11, 12] по сравнению с описанными выше традиционными 3D-перовскитами. Кроме того, более широкие возможности выбора органического катиона [13], который уже не должен удовлетворять жестким требованиям к размеру [14, 15], позволяют целенаправленно получать 2D- [16–20], 1D- [21–23] или даже 0D-перовскиты [9, 23, 24] (или перовскитоподобные материалы) с различными оптоэлектронными свойствами, ограниченными на данный момент лишь использованием инертных органических катионов. Дальнейшее улучшение указанных свойств, которые у низкоразмерных гибридных перовскитов еще недостаточны для их практического применения в солнечных батареях [25], с сохранением необходимой стабильности материала возможно при замене инертных органических катионов на электроактивные сопряженные молекулы [26]. В качестве таких молекул недавно были предложены полиароматические соединения (например, пирен [27, 28]), способные образовывать комплексы с переносом заряда [27–30] с различными органическими акцепторами [31, 32]. Несомненным преимуществом подобных органо-неорганических материалов является возможность “тонкой настройки” их оптоэлектронных свойств при помощи различных комбинаций донора и акцептора [31, 32], что открывает широкие перспективы направленного дизайна новых перовскитных материалов для современных солнечных батарей.
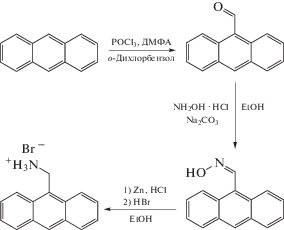
Для этого в настоящей работе мы синтезировали антрацен-9-илметанамин гидробромид, наличие в котором аммонийной группы должно обеспечить связывание с неорганической составляющей гибридного 1D- [28] или 2D-перовскита [27] на основе бромида свинца посредством прочных водородных связей N–H…Br, а антраценового фрагмента – образование комплекса с переносом заряда с подходящим органическим акцептором. Однако его последующее взаимодействие с бромидом свинца и 7,7,8,8-тетрацианохинодиметаном, являющимся одним из наиболее популярных акцепторов, в диметилформамиде неожиданно привело к получению хорошо известного соединения – {PbBr2(DMF)}n (I). Оно было выделено в индивидуальном виде и охарактеризовано при помощи элементного анализов и РСА. Структура второго (неожиданного) побочного продукта – нового низкоразмерного гибридного перовскита {Ca(DMF)6[PbBr3]2}n (II), образовавшегося в небольшом количестве (<1 мг) в виде бледно-желтых кристаллов иглообразной формы, также подтверждена данными РСА. Наши попытки его целенаправленного получения из различных солей кальция завершились обнаружением еще одного нового низкоразмерного гибридного перовскита {Ca(DMF)6[PbBr2.3Cl0.7]2}n (III).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции выполняли на воздухе с использованием коммерчески доступных органических растворителей, перегнанных в атмосфере аргона. Антрацен и бромид свинца(II) (Sigma-Aldrich) использовали без дополнительной очистки, 7,7,8,8-тетрацианохинодиметан предварительно перекристаллизовали из его раствора в этилацетате при 0°С. Синтез антрацен-9-илметанамина и его гидробромида осуществляли с помощью модифицированной методики (cхема 1) [33]. Анализ на содержание углерода, азота и водорода проводили на микроанализаторе Carlo Erba, модель 1106.
Схема 1 .
Синтез антрацен-9-карбальдегида. В круглодонную колбу с магнитной мешалкой и обратным холодильником помещали 120 мл DMF, 10.5 мл (0.23 моль) оксихлорида фосфора, 10 мл о-дихлорбензола и 11.25 г (0.065 моль) антрацена. Смесь нагревали до 90–95°С при перемешивании в течение 20 мин до полного растворения антрацена с образованием темно-красного раствора и выделением хлористого водорода. Затем нагревание продолжали еще 1 ч, после чего раствор нейтрализовали насыщенным водным раствором ацетата натрия. Полученную смесь оставляли при –5°С на 2 ч. Образовавшийся твердый остаток измельчали, отфильтровывали и промывали 300 мл дистиллированной воды. Неочищенное твердое вещество перекристаллизовывали в горячей ледяной уксусной кислоте. Выход 10.18 г (76%).
ЯМР 1H (400 МГц; CDCl3; δ, м.д.): 7.51 (т., J = = 10 Гц, 7-H и 2-Н, 2H), 7.64 (т., J = 7.5 Гц, 3-Н и 6-Н, 2H), 8.00 (д., J = 7.5 Гц, 4-H и 5-Н, 2H), 8.72 (s., 10-Н, 1H), 9.01 (д., J = 10 Гц, 8-H и 1-Н, 2H), 11.45 (c., CHO, 1H). ЯМР 13C (100 МГц; CDCl3; δ, м.д.): 123.46, 124.52, 125.63, 129,09, 125.25, 130.95, 132.04, 135.24, 192.98.
Синтез оксима антрацен-9-карбальдегида. В круглодонную колбу с магнитной мешалкой помещали 2 г (9.64 ммоль) антрацен-9-карбальдегида и 0.742 г (10.66 ммоль) гидрохлорид гидроксиламина. Затем добавляли 25 мл этанола и 2.055 г (19.39 ммоль) карбоната натрия. Полученную смесь перемешивали при комнатной температуре в течение 24 ч, после чего упаривали растворитель, остаток промывали дистиллированной водой для удаления неорганических веществ и очищали перекристаллизацией в этаноле. Выход 1.73 г (81%).
1H ЯМР (400 МГц; CDCl3; δ, м.д.): 7.51 (м., 2‑H, 3-Н, 6-Н, 7-Н, 4H), 8.00 (д., J = 8.0 Гц, 4-Н и 5-Н, 2H), 8.40 (д., J = 5 Гц, 1-H и 8-Н, 2H), 8.48 (s., 10-Н, 1H), 9.18 (c., CHO, 1H). 13C ЯМР (100 МГц; CDCl3; δ, м.д.): 124.91, 125.41, 126.45, 126.82, 128.87, 129.37, 130.17, 131.24, 148.80.
Синтез антрацен-9-илметанамин гидробромид. К раствору 2.16 г (9.8 ммоль) оксим антрацен-9-карбальдегида в 100 мл этанола добавляли последовательно соляную кислоту (12 М, 3.26 мл), цинковую пыль (1.6 г, 24.5 ммоль) и перемешивали при комнатной температуре в течение 15 мин, после чего добавляли растворы аммиака (30%-ный, 2.8 мл) и гидроксида натрия (6 М, 6 мл). Полученную смесь перемешивали еще 15 мин. Осадок отфильтровывали и отбрасывали, фильтрат экстрагировали хлористым метиленом и высушивали над безводным сульфатом натрия. Растворитель упаривали на роторном испарителе. Сухой остаток диспергировали в 10 мл бромоводородистой кислоты, отфильтровывали и промывали небольшим количеством этилацетата. Полученный осадок высушивали в глубоком вакууме. Выход 1.32 г (47%).
ЯМР 1H (400 МГц; ДМСО-d6; δ, м.д.): 5.06 (д., J = 5.9 Гц, СН2, 2Н), 7.58 (т., J = 8.0 Гц, 7-H и 2-Н, 2H), 7.67 (т., J = 8.0 Гц, 3-Н и 6-Н, 2H), 8.16 (д., J = = 8.6 Гц, 1-H и 8-Н, 2H), 8.32 (уш. с., NH3Br, 3H), 8.41 (д., J = 9.0 Гц, 4-H и 5-Н, 2H), 8.75 (c., 10-Н, 1H). ЯМР 13C (100 МГц; ДМСО-d6; δ, м.д.): 34.81, 124.55, 125.31, 125.96, 127.42, 129.56, 129.73, 130.62, 131.35.
Синтез {PbBr2(DMF)}n (I). В стеклянной виале для кристаллизации объемом 2 мл растворяли 7 мг антрацен-9-илметанамина гидробромида, 8.9 мг бромида свинца и 5 мг 7,7,8,8-тетрацианохинодиметана в DMF. Газовая диффузия диэтилового эфира в полученный раствор привела к образованию продукта в виде прозрачных кристаллов иглообразной формы. Выход 10 мг (64%).
Синтез {Ca(DMF)6[PbBr3]2}n (II). В стеклянной виале для кристаллизации объемом 2 мл растворяли 7 мг антрацен-9-илметанамина гидробромида, 8.9 мг бромида свинца и 5 мг 7,7,8,8-тетрацианохинодиметана в DMF. Газовая диффузия диэтилового эфира в полученный раствор привела к образованию бледно-желтых кристаллов иглообразной формы. Выход <1 мг.
Синтез {Ca(DMF)6[PbBr2.3Cl0.7]2}n (III). В стеклянной виале для кристаллизации объемом 2 мл растворяли 8.9 мг бромида свинца и 2.6 мг хлорида кальция в DMF (0.2 мл) с добавленными двумя каплями уксусной кислоты. Газовая диффузия диэтилового эфира в полученный раствор привела к образованию прозрачных кристаллов иглообразной формы. Выход 23 мг (73%).
| Найдено, %: | C 17.65; | H 3.71; | N 6.9. |
| Для C18H42N6O6Cl1.39Br4.61CaPb2 | |||
| вычислено, %: | C 16.50; | H 3.23; | N 6.41. |
РСА монокристаллов I–III проведен на дифрактометре Bruker APEX2 DUO CCD (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структуры расшифрованы с использованием программы ShelXT [34] и уточнены в полноматричном МНК с помощью программы Olex2 [35] в анизотропном приближении по $F_{{hkl}}^{2}.$ Положения атомов водорода рассчитаны геометрически, и они уточнены в изотропном приближении по модели наездника. Основные кристаллографические данные и параметры уточнения представлены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения структур I–III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| Брутто формула | C3H7NOBr2Pb | C18H42N6O6Br6CaPb2 | C18H42N6O6Cl1.39Br4.61CaPb2 |
| М | 440.11 | 1372.49 | 1310.69 |
| T, K | 120 | ||
| Сингония | Моноклинная | Триклинная | Триклинная |
| Пр. гр. | P21/n | P1 | P1 |
| Z | 4 | 1 | 1 |
| a, Å | 4.3214(10) | 8.656(2) | 7.6907(5) |
| b, Å | 17.386(4) | 9.915(2) | 10.4125(7) |
| c, Å | 11.431(3) | 12.002(3) | 12.4493(9) |
| α, град | 90.00 | 92.254(5) | 82.6500(10) |
| β, град | 93.272(5) | 107.019(5) | 83.3890(10) |
| γ, град | 90.00 | 97.759(5) | 76.0660(10) |
| V, Å3 | 857.5(3) | 972.5(4) | 955.96(11) |
| ρ(выч.), г см–3 | 3.409 | 2.344 | 2.277 |
| μ, см−1 | 289.18 | 149.76 | 139.79 |
| F(000) | 768 | 634 | 609 |
| 2θmax, град | 54 | 56 | 52 |
| Число измеренных отражений | 13318 | 18 085 | 13610 |
| Число независимых отражений | 1876 | 4687 | 3759 |
| Число отражений с I > 2σ(I) | 1445 | 3971 | 3228 |
| Количество уточняемых параметров | 75 | 184 | 227 |
| R1 | 0.0561 | 0.0294 | 0.0327 |
| wR2 | 0.1281 | 0.0722 | 0.0993 |
| GOОF | 1.073 | 1.042 | 1.055 |
| Остаточная электронная плотность (max/min), e Å–3 | 2.375/–2.309 | 1.697/–1.310 | 1.674/–2.462 |
Структурные данные для I–III депонированы в Кембриджском банке структурных данных (CCDC № 2045586, 2047219 и 2047220 соответственно; http://www.ccdc.cam.ac.uk/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В качестве органического донора для образования комплекса переноса заряда в составе целевого гибридного перовскита на основе бромида свинца мы выбрали антрацен-9-илметанамин, синтезированный по модифицированной методике (схема 1 ) [33] из антрацена при его формилировании по Вильсмееру – Хааку с образованием антрацен-9-карбальдегида и восстановлением соответствующего альдоксима цинком в соляной кислоте и промыванием полученного продукта бромоводородной кислотой. Хотя две последние реакции можно проводить в одну стадию, это сопряжено со снижением выхода с 47 до 19%.
В качестве органического акцептора выбран часто используемый для этих целей 7,7,8,8-тетрацианохинодиметан, который смешивали в эквимолярных количествах с полученным нами антрацен-9-илметанамин гидробромидом и бромидом свинца в подходящем растворителе. Например, наилучшая растворимость бромида свинца наблюдается в диметилформамиде, диметилсульфоксиде и глицерине. Однако попытки получения соответствующего перовскита методом жидкостной диффузии диэтилового эфира или хлористого метилена из растворов указанных реагентов в глицерине или диметилсульфоксиде заканчивались образованием маслообразных продуктов. Напротив, использование диметилформамида после длительного (около 24 сут) выдерживания реакционной смеси в стеклянной виале для кристаллизации приводило к появлению двух типов иглообразных кристаллов, отличающихся цветом. Согласно данным их РСА (табл. 1), основной кристаллический продукт прозрачного цвета представлял собой известное соединение {PbBr2(DMF)}n (I) [36], которое можно рассматривать как гибридный 1D-перовскит [22, 28] на основе бромида свинца, образующего в кристалле 1D-бесконечные сдвоенные цепочки с молекулами органического растворителя, достраивающими координационную сферу иона свинца до искаженного октаэдра (табл. 2, рис. 1).
Рис. 1.
Фрагмент кристаллической упаковки 1D-перовскита I, иллюстрирующий образование бесконечных цепей бромида свинца. Атомы водорода не показаны для ясности.
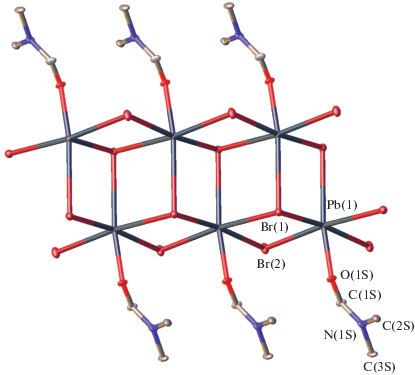
Однако минорный продукт бледно-желтого цвета, выделенный лишь в небольшом количестве (<1 мг), оказался новым низкоразмерным гибридным перовскитом {Ca(DMF)6[PbBr3]2}n (II), структура которого (рис. 2) аналогична синтезированному ранее {Mg(DMF)6[PbI3]2}n (IV) [37] при добавлении диэфирата иодистого магния к раствору иодида свинца в DMF. Как и в случае изоструктурного IV или уже описанных 1D-перовскитов [22, 28] (в том числе с комплексами с переносом заряда [28]), неорганическая часть комплекса II представляет собой 1D-бесконечные цепочки вдоль кристаллографической оси a (pис. 3), образованные катионами свинца(II) с тремя симметрически-неэквивалентными бромид-анионами (Pb–Br 2.7212(8)–3.1333(8) Å), два из которых выполняют роль мостиковых лигандов (табл. 3). В результате координационное окружение иона свинца можно охарактеризовать как квадратно-пирамидальное [9], предложенное для описания упомянутого выше IV, или же октаэдрическое с одной вакантной вершиной. Более надежно это можно определить с помощью так называемых “мер симметрии” [38], количественно характеризующих отклонение формы координационного полиэдра (КП) иона металла от идеальной квадратной пирамиды (SPY-5) или октаэдра с одной вакантной вершиной (vOC-5). Чем эти значения меньше, тем ближе форма КП к соответствующему многограннику. Для иона свинца в кристалле II величины “мер симметрии” S(SPY-5) и S(vOC-5), оцененные на основе низкотемпературных рентгенодифракционных данных с использованием программы Shape 2.1 [38], составляют 1.090 и 0.451 соответственно (табл. 3). Поэтому его координационное окружение правильнее всего рассматривать как октаэдр с одной вакантной вершиной (vOC-5). Для сравнения “мера симметрии”, отвечающая отклонению от еще одного идеального КП с пятью вершинами – тригональной бипирамиды (TBPY-5) – принимает заметно более высокое значение в 6.344.
Рис. 2.
Общий вид 1D-перовскита II в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Атомы водорода не показаны, а нумерация атомов приведена только для симметрически-независимой части элементарной ячейки.
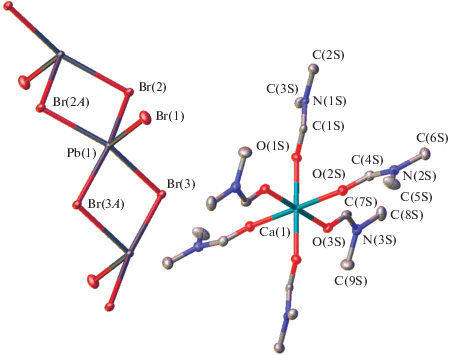
Таблица 3.
Основные геометрические параметры для II по данным РСА при 120 К*
| Параметр | II |
|---|---|
| Pb(1)–Br(1), Å | 2.7212(8) |
| Pb(1)–Br(2)/Pb(1)–Br(2A), Å | 3.0129(7)/3.1333(8) |
| Pb(1)–Br(3)/Pb(1)–Br(3A), Å | 2.9727(8)/3.0602(7) |
| Ca(1)–O(1S), Å | 2.286(4) |
| Ca(1)–O(2S), Å | 2.273(4) |
| Ca(1)–O(3S), Å | 2.277(4) |
| S(SPY-5) | 1.090 |
| S(vOC-5) | 0.451 |
| S(TBPY-5) | 6.344 |
| S(OC-6) | 0.125 |
* Атомы Br(2A) и Br(3A) являются симметрическими эквивалентами атомов Br(2) и Br(3), полученными при помощи симметрического преобразования –x, –y, –z. S(SPY-5), S(vOC-5) и S(TBPY-5) – отклонение формы КП PbBr5 от идеальной квадратной пирамиды (SPY-5), идеального октаэдра с одной вакантной вершиной (vOC-5) и идеальной тригональной бипирамиды S(TBPY-5) соответственно. S(OC-6) – отклонение формы КП CaO6 от идеального октаэдра (OC-6).
Между 1D-цепочками {PbBr3}n из соответствующих октаэдров PbBr5 с одной вакантной вершиной в кристалле II (pис. 3) располагаются катионы кальция, координированные шестью молекулами DMF (Ca–O 2.273(4)–2.286(4) Å) в вершинах практически идеального октаэдра (рис. 2), что подтверждает величина октаэдрической “меры симметрии” S(OC-6) в 0.125 (табл. 3). Указанные катионы ${\text{Ca}}({\text{DMF}})_{6}^{{2 + }}$ упаковываются в бесконечные слои, перпендикулярные кристаллографической оси с (рис. 4), с двумя координированными молекулами DMF, которые разделяют соседние цепочки {PbBr3}n, препятствуя таким образом образованию перовскитной структуры более высокой размерности (рис. 3).
Рис. 3.
Фрагмент кристаллической упаковки 1D-перовскита II, иллюстрирующий образование бесконечных цепей бромида свинца. Атомы водорода не показаны для ясности.
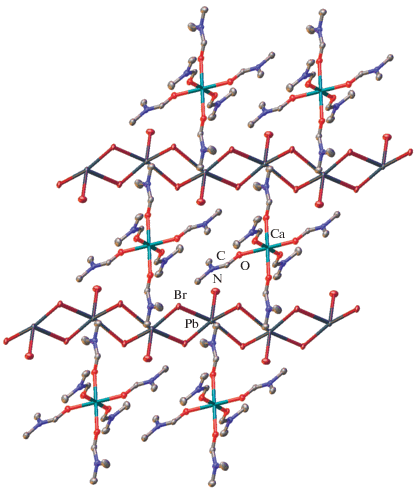
Рис. 4.
Фрагмент кристаллической упаковки 1D-перовскита II, иллюстрирующий образование катионами [Ca(DMF)6]2+ бесконечных слоев. Атомы водорода не показаны для ясности.
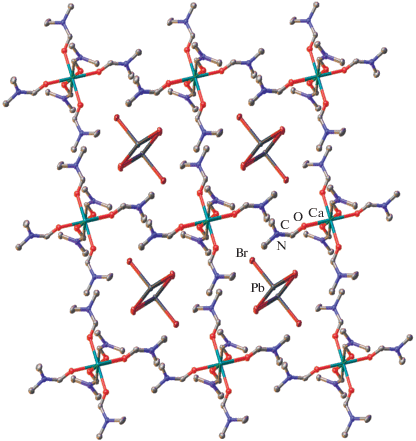
Двумя наиболее вероятными причинами появления ионов кальция, приведших к получению гибридного 1D-перовскита II, является материал стеклянного сосуда для кристаллизации (он мог содержать, например, карбонат кальция, который входит в состав известняка, применяемого на производстве стекла) или вода, использованная для промывания указанного сосуда после предыдущей попытки синтеза гибридного перовскита с 7,7,8,8-тетрацианохинодиметаном и антрацен-9-илметанамин гидробромидом. Для ответа на этот вопрос мы попробовали воспроизвести синтез полученных нами продуктов I и II в тех же условиях при выдерживании реакционной смеси в DMF в течение того же времени (24 сут) в другой стеклянной виале для кристаллизации, ранее не бывшей в употреблении. В результате образовался только один тип (прозрачных) кристаллов иглообразной формы, соответствующих известному [36] низкоразмерному перовскиту I согласно данным их элементного анализа и РСА. Бледно-желтых кристаллов гибридного 1D-перовскита II в продуктах реакции обнаружено не было.
Попытки целенаправленного получения II из различных солей кальция (нитрата, ацетата, сульфата и хлорида) в качестве источника ионов данного металла также не увенчались успехом. При смешивании эквимолярных количеств бромида свинца и ацетата или нитрата кальция, демонстрирующих удовлетворительную растворимость в DMF, наблюдалось образование только описанного выше низкоразмерного перовскита I, чего не удавалось добиться в случае сульфата кальция из-за его очень низкой растворимости в указанном растворителе. Добавление другого растворителя, такого как глицерин, для лучшей растворимости всех реагентов позволяло растворить исходный сульфат кальция, однако дальнейшие попытки кристаллизации в данном растворе давали маслообразные продукты. Использование для этих целей смеси растворителей DMF–уксусная кислота приводило к аналогичному результату.
Напротив, выбор хлорида кальция как источника ионов кальция позволил получить еще один новый гибридный перовскит – {Ca(DMF)6[PbBr2.3Cl0.7]2}n (III) (рис. 5), который был выделен в индивидуальном виде и охарактеризован при помощи элементного анализа и РСА. Согласно результатам последнего, он отличается от целевого продукта II наличием в составе неорганической части хлорид-аниона, находящегося в одной позиции с бромид-анионом Br(3) в соотношении 70 : 30. Это приводит к формированию вдоль кристаллографической оси a 1D-бесконечных цепочек {PbBr2.3Cl0.7}n (рис. 6), в которых указанный хлорид- или бромид-анион достраивает координационную сферу иона свинца, имеющую в II форму октаэдра с одной вакантной вершиной, до практически идеального октаэдра (Pb–Br 2.87(3)–3.0343(11), Pb–Cl 2.91(3)–2.97(3) Å), как следует из величин октаэдрической “меры симметрии” в диапазоне 0.827–0.944 (табл. 4). Для сравнения соответствующее значение в описанном выше низкоразмерном перовските I составляет 1.442 (табл. 2). Интересно, что подобное изменение в структуре неорганической части гибридного перовскита III по сравнению с таковой в II не приводит к заметному изменению кристаллической упаковки (pис. 4 и 6). Исключение составляет некоторое искажение координационного окружения иона кальция, образованного шестью молекулами DMF, четыре из которых разупорядочены по двум положениям, в результате чего октаэдрическая “мера симметрии” достигает 0.944.
Рис. 5.
Общий вид 1D-перовскита III в представлении атомов эллипсоидами тепловых колебаний (p = 50%). Атомы водорода и минорная компонента разупорядоченных молекул DMF не показаны, а нумерация атомов приведена только для симметрически-независимой части элементарной ячейки.
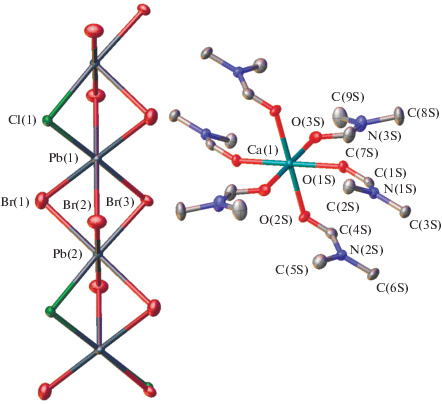
Рис. 6.
Фрагмент кристаллической упаковки 1D-перовскита III, иллюстрирующий образование катионами [Ca(DMF)6]2+ бесконечных слоев. Атомы водорода не показаны для ясности.
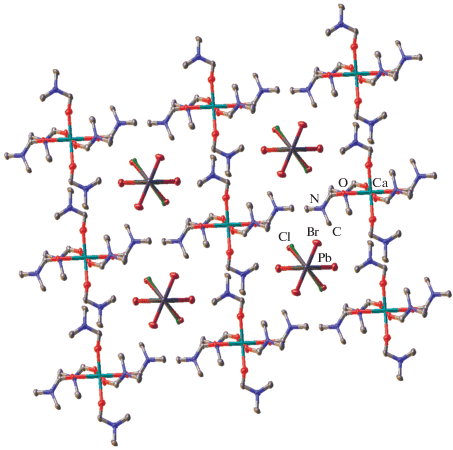
Таблица 4.
Основные геометрические параметры для III по данным РСА при 120 К*
| Параметр | III |
|---|---|
| Pb(1)–Br(1), Å | 3.0343(11) |
| Pb(1)–Br(2), Å | 3.0193(9) |
| Pb(1)–Br(3)/Pb(1)–Br(3A), Å | 2.87(3)/2.94(3) |
| Pb(1)–Cl(1)/Pb(1)–Cl(1A), Å | 2.97(3)/2.91(3) |
| Ca(1)–O(1S), Å | 2.288(5) |
| Ca(1)–O(2S)/Ca(1)–O(2S'), Å | 2.308(7)/2.35(2) |
| Ca(1)–O(3S)/Ca(1)–O(3S'), Å | 2.348(13)/2.33(3) |
| S(OC-6) | 0.240–0.944 |
* Атомы O(2S') и O(3S') принадлежат минорной компоненте разупорядоченных молекул DMF. Атомы Br(3A) и Cl(1A) являются симметрическими эквивалентами атомов Br(3) и Cl(1), полученными при помощи симметрического преобразования –x, –y, –z. S(OC-6) – отклонение формы КП PbX6 и CaO6 от идеального октаэдра (OC-6).
Таким образом, мы синтезировали и охарактеризовали новый гибридный низкоразмерный перовскит Ca(DMF)6[PbBr3]2 (II), полученный при выдерживании на воздухе раствора бромида свинца в DMF, 7,7,8,8-тетрацианохинодиметана и антрацен-9-илметанамин гидробромида в стеклянном сосуде для кристаллизации. В кристаллах указанного побочного продукта бромид свинца присутствует в виде 1D-бесконечных цепочек {PbBr3}n из октаэдров PbBr5 с одной вакантной вершиной, разделенных координированными с молекулами DMF катионами кальция, которые предположительно попали в реакционную смесь из воды, использовавшейся для промывания указанного сосуда после предыдущей попытки синтеза. Хотя более тщательная подготовка таких многоразовых сосудов позволяет в большинстве случаев решить данную проблему, полностью ее устранить оказывается возможно только при переходе к одноразовой лабораторной посуде, например, изготовленной по аддитивной технологии 3D-печати [39]. Попытка целенаправленного получения гибридного 1D-перовскита II из различных солей металлов в случае хлорида кальция ожидаемо привела к еще одному новому гибридному перовскиту – {Ca(DMF)6[PbBr2.3Cl0.7]2}n (III). Он отличается от II наличием хлорид-аниона в составе неорганической части, имеющей вид 1D-бесконечной цепочки {PbBr2.3Cl0.7}n, в которой координационная сфера иона свинца достраивается до октаэдрической без заметного изменения кристаллической упаковки.
К сожалению, получить в таких условиях целевой низкоразмерный перовскит на основе бромида свинца, содержащий комплекс с переносом заряда с антрацен-9-илметанамин гидробромидом и 7,7,8,8-тетрацианохинодиметаном в качестве органического донора и акцептора соответственно, нам не удалось. К наиболее вероятным причинам можно отнести стерический эффект объемного антраценильного фрагмента, удаленного лишь на одну метиленовую группу от аммонийной группы и поэтому способного препятствовать ее связыванию с неорганической частью, или стерический эффект алкиламмонийного заместителя, который затрудняет приближение 7,7,8,8-тетрацианохинодиметана к π-системе антраценильного фрагмента. Кроме того, это может быть еще и электронный эффект аммонийной группы, из-за которого антраценильный фрагмент может оказаться недостаточно хорошим акцептором для выбранного органического донора. На перечисленные причины, в частности, указывает продемонстрированная ранее возможность “самосборки” низкоразмерных 1D- и 2D-перовскитов [31, 32] в аналогичных условиях, но при использовании полиароматического амина с большей длиной алкильной цепи – 4-пиренбутанамина. Однако в нашем случае нельзя также исключить проблему низкой растворимости антрацен-9-илметанамин гидробромида в DMF, которую можно решить выбором альтернативного растворителя или сорастворителя (например, метанола) и/или введением донора и акцептора в реакцию с бромидом свинца в виде заранее подготовленного концентрированного раствора, в котором они уже образовали комплекс с переносом заряда (например, по данным оптической спектроскопии).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Kojima A., Teshima K., Shirai Y., Miyasaka T. // J. Am. Chem. Soc. 2009. V. 131. № 17. P. 6050.
Jena A.K., Kulkarni A., Miyasaka T. // Chem. Rev. 2019. V. 119. № 5. P. 3036.
Liu C., Hu M., Zhou X. et al. // NPG Asia Mater. 2018. V. 10. № 6. P. 552.
Hong K., Le Q.V., Kim S.Y., Jang H.W. // J. Mat. Chem. C. 2018. V. 6. № 9. P. 2189.
Niu T., Ren H., Wu B. et al. // J. Phys. Chem. Lett. 2019. V. 10. № 10. P. 2349.
Misra R.K., Cohen B.-E., Iagher L., Etgar L. // ChemSusChem. 2017. V. 10. № 19. P. 3712.
Zhang J., Yang X., Deng H. et al. // Nano-Micro Lett. 2017. V. 9. № 3. P. 36.
Zhou C., Lin H., He Q. et al. // Mater. Sci. Eng. Reports. 2019. V. 137. P. 38.
Zhou C., Worku M., Neu J. et al. // Chem. Mater. 2018. V. 30. № 7. P. 2374.
Xu L.-J., Sun C.-Z., Xiao H. et al. // Adv. Mater. 2017. V. 29. № 10. P. 1605739.
Huo C., Cai B., Yuan Z. et al. // Small Methods. 2017. V. 1. № 3. P. 1600018.
Smith I.C., Hoke E.T., Solis-Ibarra D. et al. // Angew. Chem. Int. Ed. 2014. V. 53. № 42. P. 11232.
Saparov B., Mitzi D.B. // Chem. Rev. 2016. V. 116. № 7. P. 4558.
Kieslich G., Sun S., Cheetham A.K. // Chem. Sci. 2015. V. 6. № 6. P. 3430.
Travis W., Glover E.N.K., Bronstein H. et al. // Chem. Sci. 2016. V. 7. № 7. P. 4548.
Grancini G., Nazeeruddin M.K. // Nature Rev. Mater. 2019. V. 4. № 1. P. 4.
He T., Li S., Jiang Y. et al. // Nat. Commun. 2020. V. 11. № 1. P. 1672.
Lan C., Zhou Z., Wei R., Ho J.C. // Materials Today Energy. 2019. V. 11. P. 61.
Zhang F., Lu H., Tong J. et al. // Energy Environ. Sci. 2020. V. 13. № 4. P. 1154.
Mao L., Stoumpos C.C., Kanatzidis M.G. // J. Am. Chem. Soc. 2019. V. 141. № 3. P. 1171.
Mousdis G.A., Gionis V., C. Papavassiliou G. et al. // J. Mat. Chem. 1998. V. 8. № 10. P. 2259.
Ma C., Shen D., Huang B. et al. // J. Mat. Chem. A. 2019. V. 7. № 15. P. 8811.
Zhou C., Tian Y., Wang M. et al. // Angew. Chem. Int. Ed. 2017. V. 56. № 31. P. 9018.
Yin J., Maity P., De Bastiani M. et al. // Sci. Adv. 2017. V. 3. № 12. P. e1701793.
Zhou C., Lin H., Lee S., Chaaban M., Ma B. // Mat. Res. Lett. 2018. V. 6. № 10. P. 552.
Passarelli J.V., Fairfield D.J., Sather N.A. et al. // J. Am. Chem. Soc. 2018. V. 140. № 23. P. 7313.
Van Gompel W.T.M., Herckens R., Van Hecke K. et al. // Chem. Commun. 2019. V. 55. № 17. P. 2481.
Marchal N., Van Gompel W., Gélvez-Rueda M.C. et al. // Chem. Mater. 2019. V. 31. № 17. P. 6880.
Evans H.A., Lehner A.J., Labram J.G. et al. // Chem. Mater. 2016. V. 28. № 11. P. 3607.
Maughan A.E., Kurzman J.A., Neilson J.R. // Inorg. Chem. 2015. V. 54. № 1. P. 370.
Goetz K.P., Vermeulen D., Payne M.E. et al. // J. Mater. Chem. C. 2014. V. 2. № 17. P. 3065.
Jiang H., Hu P., Ye J. et al. // J. Mat. Chem. C. 2018. V. 6. № 8. P. 1884.
Ayedi M.A., Le Bigot Y., Ammar H. et al. // Synth. Commun. 2013. V. 43. № 16. P. 2127.
Sheldrick G.M. // Acta Crystallogr. A. 2008. V. 64. P. 112.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Ap-pl. Cryst. 2009. V. 42. P. 339.
Liu M., Zhao J., Luo Z. et al. // Chem. Mater. 2018. V. 30. № 17. P. 5846.
Krautscheid H., Vielsack F. // Z. Anorg. Allg. Chem. 1999. V. 625. P. 562.
Alvarez S. // Chem. Rev. 2015. V. 115. P. 13447.
Zalesskiy S.S., Kitson P.J., Frei P. et al. // Nat. Commun. 2019. V. 10. P. 5496.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия