Координационная химия, 2021, T. 47, № 6, стр. 356-362
Синтез и строение ароксидов тетрафенилсурьмы Ph4SbOAr (Ar = C6H3F2-2,4, C6H3F2-2,5, C6H3Cl-2-F-4)
В. В. Шарутин 1, О. К. Шарутина 1, А. Н. Ефремов 1, *
1 Национальный исследовательский Южно-Уральский государственный университет
Челябинск, Россия
* E-mail: efremov_an94@mail.ru
Поступила в редакцию 25.08.2020
После доработки 10.11.2020
Принята к публикации 10.11.2020
Аннотация
Взаимодействием пентафенилсурьмы с 2,4-дифтор-, 2,5-дифтор- и 2-фтор-4-хлорфенолом в бензольно-октановой смеси растворителей получены ароксиды тетрафенилсурьмы Ph4SbOC6H3F2-2,4 (I), Ph4SbOC6H3F2-2,5 (II), Ph4SbOC6H3(Cl-2)(F-4) (III). По данным рентгеноструктурного анализа (CIF files № 1973286 (I), 1975709 (II), 1973305 (III)), атомы сурьмы в соединениях имеют координацию искаженной тригональной бипирамиды с ароксидным атомом кислорода в аксиальном положении. Аксиальные углы OSbС в соединениях I–III составляют 177.86(6)°, 177.29(7)°, 174.34(6)° соответственно. Геометрические параметры молекул I–III схожи длинами связей Sb−Cэкв и Sb−O (2.118(2)−2.127(2) и 2.1780(16) Å в I; 2.122(2)−2.130(2) и 2.179(2) Å в II; 2.116(2)−2.119(2) и 2.1803(16) Å в III). Структурная организация в кристаллах соединений обусловлена слабыми водородными связями с участием F и C–H∙∙∙π-взаимодействиями. Данные взаимодействия структурируют молекулы в кристалле соединения I в трехмерную сетку, в II – в парные цепочки, в III – в слои.
Сурьмаорганические производные общей формулы Ar4SbX, где X – лиганд, связанный с атомом сурьмы через гетероатом, достаточно хорошо изучены методом рентгеноструктурного анализа [1–15]. К таким соединениям относится широкий ряд структурно охарактеризованных ароксидов тетрафенилсурьмы [1, 16–21], большинство из которых содержат электроотрицательные группы в остатке фенола. Синтез таких производных осуществляют по реакциям замещения из Ph5Sb и HOAr [16–18] или перераспределения лигандов между Ph5Sb и производным симметричного строения Ph3SbX2 [19–21].
В продолжение исследования особенностей строения и синтеза ароксидов тетрафенилсурьмы с фторсодержащими ароксидными лигандами получены комплексы Ph4SbOC6H3F2-2,4 (I), Ph4SbOC6H3F2-2,5 (II), Ph4SbOC6H3Cl-2-F-4 (III) и изучены их молекулярные структуры.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходный реагент − пентафенилсурьму − получали по методике, описанной [22]. В работе также использовали 2,4-дифторфенол, 2,5-дифторфенол и 2-хлор-4-фторфенол (Alfa Aesar). Растворители бензол и октан квалификации “х. ч.” просушивали над хлоридом кальция перед проведением синтеза.
Синтез 2,4-дифторфеноксида тетрафенилсурьмы (I). Раствор 100 мг (0.197 ммоль) пентафенилсурьмы и 26 мг (0.197 ммоль) 2,4-дифторфенола в смеси растворителей бензол–октан (5 : 1 объемн.) выдерживали до полного удаления растворителей при 20°C. Получили бесцветные кристаллы I с Тпл = 154°С. Выход 98 мг (89%).
ИК-спектр (ν, см–1): 3053, 3014, 3001, 1598, 1577, 1492, 1479, 1435, 1332, 1305, 1247, 1201, 1184, 1159, 1126, 1089, 1064, 1020, 997, 954, 918, 848, 804, 732, 719, 702, 692, 651, 599, 588, 507, 468, 455, 447, 408.
Аналогично синтезировали соединения II и III.
Синтез 2,5-дифторфеноксида тетрафенилсурьмы (II). Выход 86%, Тпл = 146°С. ИК-спектр (ν, см–1): 3059, 3049, 1637, 1614, 1575, 1566, 1492, 1479, 1458, 1433, 1425, 1413, 1332, 1317, 1282, 1230, 1193, 1163, 1143, 1093, 1064, 1022, 997, 974, 900, 846, 837, 783, 771, 731, 692, 669, 651, 621, 605, 522, 470, 459, 453, 443.
Синтез 2-хлор-4-фторфеноксида тетрафенилсурьмы (III). Выход 72%, Тпл = 168°С. ИК-спектр (ν, см–1): 3105, 3064, 3049, 1591, 1577, 1564, 1473, 1433, 1427, 1396, 1334, 1292, 1242, 1182, 1161, 1116, 1062, 1039, 1020, 997, 900, 848, 808, 794, 732, 692, 650, 615, 569, 543, 487, 472, 460, 453, 441, 428.
ИК-спектры соединений I–III регистрировали на ИК-спектрометре Shimadzu IR Affinity-1S в области 4000–400 см–1 (таблетки KBr).
РСА кристаллов I–III проведен на дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [23]. Все расчеты по определению и уточнению структур выполнены с использованием программ SHELXL/PC [24], OLEX2 [25]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структур приведены в табл. 1.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I–III
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| М | 559.23 | 559.23 | 575.68 |
| Сингония | Триклинная | Триклинная | Моноклинная |
| Пр. гр. | P1 | P1 | P21/c |
| a, Å | 10.161(4) | 10.190(6) | 15.201(10) |
| b, Å | 10.472(4) | 10.509(5) | 10.343(8) |
| c, Å | 13.316(5) | 13.395(6) | 17.602(11) |
| α, град | 73.573(18) | 76.488(16) | 90 |
| β, град | 69.819(14) | 67.96(3) | 112.500(19) |
| γ, град | 89.92(2) | 89.10(2) | 90 |
| V, Å3 | 1268.4(8) | 1288.6(11) | 2557(3) |
| Z | 2 | 2 | 4 |
| ρ(выч.), г/см3 | 1.464 | 1.441 | 1.495 |
| μ, мм−1 | 1.122 | 1.104 | 1.211 |
| F(000) | 560.0 | 560.0 | 1152.0 |
| Размер кристалла, мм | 0.22 × 0.16 × 0.11 | 0.32 × 0.15 × 0.13 | 0.65 × 0.41 × 0.05 |
| 2θ, град | 6.232–57.506 | 5.84–57 | 5.802–56.998 |
| Интервалы индексов отражений | –13 ≤ h ≤ 13, –14 ≤ k ≤ 14, –17 ≤ l ≤ 17 | –13 ≤ h ≤ 13, –14 ≤ k ≤ 14, –17 ≤ l ≤ 17 | –20 ≤ h ≤ 20, –13 ≤ k ≤ 13, –23 ≤ l ≤ 23 |
| Всего отражений | 43 002 | 56 904 | 56 784 |
| Независимых отражений (Rint) | 6527 (0.0362) | 6518 (0.0733) | 6480 (0.0360) |
| Отражений с I > 2σ(I) | 5748 | 5908 | 5619 |
| Число уточняемых параметров | 307 | 307 | 307 |
| GOOF | 1.077 | 1.077 | 1.035 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0251, wR2 = 0.0585 | R1 = 0.0305, wR2 = 0.0769 | R1 = 0.0218, wR2 = 0.0520 |
| R-факторы по всем отражениям | R1 = 0.0321, wR2 = 0.0612 | R1= 0.0355, wR2 = 0.0800 | R1= 0.0281, wR2 = 0.0553 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.61/–0.55 | 0.41/–1.24 | 0.47/–0.46 |
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (ССDC № 1973286 (I), 1975709 (II), 1973305 (III); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/ structures).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Высокоэффективными методами синтеза соединений сурьмы общей формулы Ar4SbOAr' являются методы, основанные на реакциях пентаарилсурьмы с производными симметричного строения Ar3Sb(OAr')2 [19–21] или фенолами [16–18]. Данные методы имеют одну стадию синтеза, характеризуются высоким выходом и чистотой целевого соединения, мягкими условиями протекания реакций.
Синтез соединений I–III осуществляли взаимодействием Ph5Sb с галогенфенолами:
Соединения I−III представляют собой кристаллические, бесцветные вещества с четкой температурой плавления.
В ИК-спектрах соединений I–III присутствует интенсивная полоса поглощения, обусловленная колебаниями ν(Sb–C), при 455, 453, 453 см–1 соответственно. Полоса поглощения при 1247 (I), 1230 (II) и 1242 (III) см–1 характеризует колебания ν(С–О), полосы 1577, 1492, 1435 см–1 (I); 1575, 1492, 1433 см–1 (II); 1577, 1473, 1433 см–1 (III) − валентные колебания углеродного скелета арильных групп. Колебаниям ν(CAr–H) отвечает полоса поглощения средней интенсивности при 3053 (I), 3059 (II), 3064 (III) см–1, а колебаниям δ(CAr–H) – высокоинтенсивные полосы при 732 и 692 (I), 731 и 692 (II), 732 и 692 (III) см–1 [26, 27].
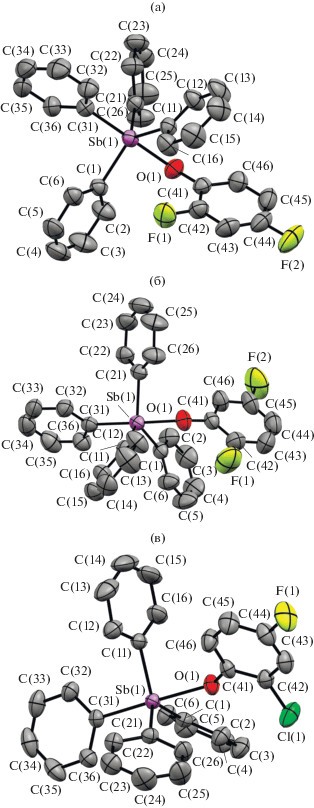
По данным РСА, атомы Sb в соединениях I–III имеют искаженную координацию тригональной бипирамиды с аксиально расположенным атомом кислорода ароксидного лиганда (рис. 1).
Аксиальные углы OSbС в I–III составляют 177.86(6)°, 177.29(7)°, 174.34(6)° соответственно, при этом последнее значение является наименьшим из величин аналогичных углов в галогенсодержащих ароксидах тетрафенилсурьмы [1]. Наибольший угол, близкий к идеальному в 180°, наблюдается в структуре 2,4,6-трибромфеноксида тетрафенилсурьмы [18]. Суммы углов СSbС в экваториальной плоскости равны 358.09(8)° (I), 357.51(9)° (II), 357.43(8)° (III). Значения углов ОаксSbCэкв меньше 90°, а СаксSbCэкв больше этого значения. Выходы атомов сурьмы из экваториальной плоскости [C3] в сторону Сакс составляют 0.170 Å (I), 0.195 Å (II), 0.198 Å (III). Приведенные геометрические характеристики сопоставимы с другими ранее структурно охарактеризованными соединениями общей формулы Ph4SbOAr [1, 16–21].
Экваториальные фенильные кольца в I–III повернуты вокруг связей Sb−Cэкв таким образом, чтобы минимизировать внутри- и межмолекулярные взаимодействия. Двугранные углы между плоскостями колец и экваториальной плоскостью С(1)С(11)С(21) составляют: 11.27° С(11)–С(16), 49.39° С(21)–С(26), 54.63° С(1)–С(6) (I); 14.77° С(1)–С(6), 54.97° С(21)–С(26), 55.50° С(11)–С(16) (II); 23.27° С(11)–С(16), 53.76° С(1)–С(6), 58.99° С(21)–С(26) (III). Интересно отметить, что в соединениях I и II наблюдается частичное взаимодействие π-систем фенильного лиганда (С(11)–С(16) в I и С(1)–С(6) в II), расположенного практически в экваториальной плоскости, и ароматического кольца ароксигруппы. Плоскости этих групп располагаются друг напротив друга, образуя межплоскостной угол в 48.17° (I) и 40.75° (II). Наименьшие расстояния между плоскостями данных π-систем составляют 3.144(3) Å (С(11)⋅⋅⋅С(41)) в I, 3.101(4) Å (C(1)⋅⋅⋅С(41)) и 3.322(5) Å (С(2)⋅⋅⋅С(46)) в II, что меньше суммы ван-дер-ваальсовых радиусов двух углеродов (3.5 Å). Подобные взаимодействия наблюдаются и в других ароксидах тетраарилсурьмы [1, 21, 28].
Геометрические параметры молекул I–III схожи длинами связей Sb−Cэкв и Sb−O (2.118(2)−2.127(2) и 2.1780(16) Å в I; 2.122(2)−2.130(2) и 2.179(2) Å в II; 2.116(2)−2.119(2) и 2.1803(16) Å в III). Расстояния Sb−Cакс в соединениях I и II превышает длину связи Sb−O (2.188(2) и 2.185(3) Å соответственно), что встречается редко и присуще также 4-иодфеноксиду тетрафенилсурьмы [1]. Обратное наблюдается в большинстве структур галогенароксидов тетрафенилсурьмы, включая соединение III (2.175(2) Å).
Интересно проследить за изменением длины связи Sb−O в ряду структурно охарактеризованных галогенароксидов тетрафенилсурьмы Ph4SbOAr (Ar = C6H4I-4, C6H3F2-2,4 (I), C6H3F2-2,5 (II), C6H3Cl-2-F-4 (III), C6H3Cl2-2,6, C6H2Cl3-2,4,6, C6H2Br3-2,4,6, C6F5). В приведенном ряду наблюдается увеличение расстояния Sb−O (от 2.162 до 2.285 Å), что указывает на уменьшение ее прочности. Основность лигандов напрямую зависит от силы электронных эффектов галогенов (–I и +М), их положения в бензольном кольце и количества. Данное расположение не совсем логично для бром- и хлорсодержащих феноксидных остатков, так как –I-эффекты галогенов изменяются в ряду I < Br < Cl < F и затухают в ряду пара- < мета- < < орто-. Положение в данном ряду 2,4,6-трибромфеноксида, возможно, связано с большим объемом атомов брома, а их суммарный индуктивный эффект в большей степени влияет на основность лиганда, чем более электротрицательные атомы фтора в меньшем количестве в I–III. В соединениях I–III связи Sb−O практически равны, следовательно, замена атома фтора на хлор в орто-положении соединения III и смена пара-положения атома F на мета- в II по сравнению с соединением I не влияет на длину данной связи.
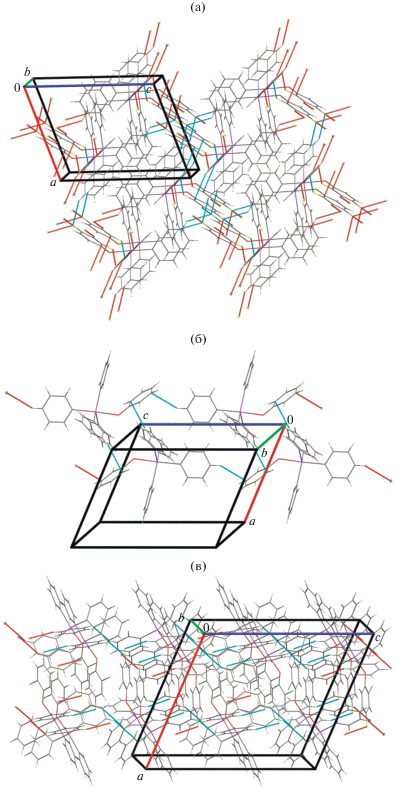
Организация структуры кристаллов соединений I и III обусловлена слабыми водородными связями с участием атомов F (2.59, 2.57, 2.63 Å в I и 2.52 Å в III) и C–H∙∙∙π-взаимодействиями. В кристалле соединения II – только C–H∙∙∙π-взаимодействиями. Данные взаимодействия структурируют молекулы в кристалле соединения I в трехмерную сетку (рис. 2а), в II – в парные цепочки, расположенные вдоль кристаллографической оси c (рис. 2б), в III – в слои, перпендикулярные оси a, толщиной в две молекулы (рис. 2в).
Таким образом, взаимодействие пентафенилсурьмы с галогенфенолами приводит к образованию ароксидов тетрафенилсурьмы, в молекулах которых атомы сурьмы имеют конфигурацию тригональной бипирамиды с атомом кислорода ароксидного лиганда в аксиальном положении. Расстояние Sb−Cакс в соединениях I и II превышает длину связи Sb−O, что не характерно для соединений подобного типа. В этих же структурах наблюдается частичное взаимодействие π-систем фенильного лиганда, расположенного в экваториальной плоскости, и ароматического кольца ароксигруппы. Молекулы в кристаллах соединений структурированы в трехмерную сетку (в I), парные цепочки (в II), в слои (в III) посредством водородных связей F∙∙∙H и C–H∙∙∙π-взаимодействий.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Cambridge Crystallographic Data Centre. 2020. http://www.ccdc.cam.ac.uk.
Егорова И.В., Жидков В.В., Гринишак И.П. и др. // Журн. общ. химии. 2014. Т. 71. № 6. С. 1176 (Egorova I.V., Zhidkov V.V., Grinishak I.P. et al. // Russ. J. Gen. Chem. 2014. V. 84. № 7. P. 1371). https://doi.org/10.1134/S1070363214070214
Robertson A.P.M., Chitnis S.S., Jenkins H.A. et al. // Chem.-Eur. J. 2015. V. 21. № 21. P. 7902. https://doi.org/10.1002/chem.201406469
Pan B., Gabbai F.P. // J. Am. Chem. Soc. 2014. V. 136. № 27. P. 9564. https://doi.org/10.1021/ja505214m
Dinsdale N., Jeffrey J.C., Kilby R.J. et al. // Inorg. Chim. Acta. 2007. V. 360. № 1. P. 418. https://doi.org/10.1016/j.ica.2006.07.091
Yang M., Pati N., Belanger-Chabot G. et al. // Dalton Trans. 2018. V. 47. P. 11843. https://doi.org/10.1039/C8DT00702K
Иванов А.В., Пакусина А.П., Иванов М.А. и др. // Д-окл. РАН. 2005. Т. 401. № 5. С. 643.
Yamamichi H., Matsukawa S., Kojima S. et al. // Heteroatom Chem. 2011. V. 22. № 3–4. P. 553. https://doi.org/10.1002/hc.20721
Wang G.-C., Lu Y.-N., Xiao J. et al. // J. Organomet. Chem. 2005. V. 690. № 1. P. 151. https://doi.org/10.1016/j.jorganchem.2004.09.002
Wang G.-C., Xiao J., Yu L. et al. // J. Organomet. Chem. 2004. V. 689. № 9. P. 1631. https://doi.org/10.1016/j.jorganchem.2004.02.015
Domasevitch K.V., Gerasimchuk N.N., Mokhir A. // Inorg. Chem. 2000. V. 39. № 6. P. 1227. https://doi.org/10.1021/ic9906048
Ma C., Zhang Q., Sun J. et al. // J. Organomet. Chem. 2006. V. 691. № 11. P. 2567. https://doi.org/10.1016/j.jorganchem.2006.01.049
Li J.-S., Liu R.-C., Chi X.-B.et al. // Inorg. Chim. Acta. 2004. V. 357. № 7. P. 2176. https://doi.org/10.1016/j.ica.2003.12.012
Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Журн. неорган. химии. 2020. Т. 65. № 4. С. 482. https://doi.org/10.31857/S0044457X20040170 (Sharutin V.V., Sharutina O.K., Efremov A.N. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 502.) https://doi.org/10.1134/S0036023620040178
Шарутин В.В., Шарутина О.К., Губанова Ю.О. // Журн. неорган. химии. 2019. Т. 64. № 9. С. 957. https://doi.org/10.1134/S0044457X19090198 (Sharutin V.V., Sharutina O.K., Gubanova, Y.O. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 9. P. 1138.)https://doi.org/10.1134/S0036023619090195
Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. неорган. химии. 2017. Т. 62. № 3. С. 290. https://doi.org/10.7868/S0044457X17030151 (Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Inorg. Chem. 2017. V. 62. № 3. P. 295.)https://doi.org/10.1134/S0036023617030147
Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Коорд. химия. 2016. Т. 42. № 1. С. 34. https://doi.org/10.7868/S0132344X15120075 (Sharutin V.V., Sharutina O.K., Senchurin V.S. // Russ. J. Coord. Chem. 2016. V. 42. № 1. P. 32.)https://doi.org/10.1134/S1070328415120076
Шарутин В.В., Пакусина А.П., Шарутина О.К. и др. // Химия и компьютерное моделирование. Бутлеровские сообщения. 2003. Т. 4. № 1. С. 22.
Шарутин В.В., Шарутина О.К., Осипов П.Е. и др. // Журн. общ. химии. 2001. Т. 71. № 6. С. 1045 (Sharutin V.V., Sharutina O.K., Osipov P.E. et al. // Russ. J. Gen. Chem. 2001. V. 71. № 6. P. 983). https://doi.org/10.1023/A:1012368510207
Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. общ. химии. 2016. Т. 86. № 1. С. 92 (Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Gen. Chem. 2016. V. 86. № 1. P. 85). https://doi.org/10.1134/S1070363216010151
Шарутин В.В., Шарутина О.К., Ефремов А.Н. и др. // Журн. неорган. химии. 2017. Т. 62. № 10. С. 1330. https://doi.org/10.7868/S0044457X17100075 (Sharutin V.V., Sharutina O.K., Efremov A.N. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 10. P. 1320.) https://doi.org/10.1134/S0036023617100163
Кочешков К.А., Сколдинов А.П., Землянский Н.Н. Методы элементоорганической химии. Сурьма. Висмут. М.: Наука, 1976. 485 с.
SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Madison (WI, USA): Bruker AXS Inc., 1998.
SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Madison (WI, USA): Bruker AXS Inc., 1998.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Васильев А.В., Гриненко Е.В., Щукин А.О., Федулина Т.Г. Инфракрасная спектроскопия органических и природных соединений. СПб: СПбГЛТА, 2007. 54 с.
Тарасевич Б.Н. ИК спектры основных классов органических соединений. М.: МГУ, 2012. 55 с.
Quan L., Yin H., Cui J. et al. // J. Organomet. Chem. 2009. V. 694. № 23. P. 3683. https://doi.org/10.1016/j.jorganchem.2009.07.041
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия