Координационная химия, 2021, T. 47, № 7, стр. 424-430
Гидротермальный синтез и исследование соединений на основе цианида меди(I) и октаэдрических кластерных цианогидроксокомплексов рения
А. В. Ермолаев 1, *, А. И. Смоленцев 1, Ю. В. Миронов 1
1 Институт неорганической химии им. А.В. Николаева СО РАН
Новосибирск, Россия
* E-mail: ermolaev@niic.nsc.ru
Поступила в редакцию 14.01.2021
После доработки 26.01.2021
Принята к публикации 28.01.2021
Аннотация
Два новых соединения состава Cs2[Cu2Re6S8(CN)6] ⋅ 3H2O (I) и (H3O)2[Cu{Cu2(µ-CN)}Re6Se8(CN)6] · · 6.5H2O (II) синтезированы в гидротермальных условиях из смеси CuCN и Cs2.67K1.33[Re6S8(CN)2-(OH)4] · 4H2O или Cs2.75K1.25[Re6Se8(CN)4(OH)2] · H2O соответственно. В результате реакции происходит замещение OH– на CN– и формирование взаимопроникающих анионных каркасов за счет мостиков –CN–Cu–CN–. В полостях находятся противоионы и молекулы воды. Полученные соединения охарактеризованы методами РСА (CIF files CSD № 2048821 (I), 2048822 (II)), ИК-спектроскопии и элементного анализа.
В химии кластерных соединений рения наиболее представительными являются кластерные комплексы, содержащие ядро {Re6Q8}2+ (Q = S, Se, Te) [1–4]. Недавно данный ряд соединений был дополнен смешанолигандными кластерными комплексами Cs2.67K1.33[Re6S8(CN)2(OH)4] · 4H2O и Cs2.75K1.25[Re6Se8(CN)4(OH)2] · H2O [5, 6]. Такие соединения интересны тем, что включают в состав как относительно лабильные лиганды OH–, которые можно заместить на органические или неорганические лиганды, так и амбидентатные лиганды CN–, способные формировать полимерные соединения различной размерности за счет мостиков –CN–M–CN–, подобно гексацианидным кластерным комплексам рения с переходными металлами [7–11]. К настоящему времени получены ионные [5, 6, 12, 13], молекулярные [6, 14] и полимерные соединения [15], включающие в состав смешанолигандные кластерные анионы и катонные комплексы Ni(II) или Cu(II) с аминами. Попытки синтеза соединений на основе октаэдрических кластерных цианогидроксокомплексов рения, CuCN и 2,2'-бипиридина (Bipy) по аналогии с гексацианидными [16], приводят к получению одной из модификаций циано-мостикового координационного комплекса меди(I) [CuCN(Bipy)]n [17]. Поэтому мы предприняли попытку синтеза новых соединений в тех же реакционных условиях, но без участия Bipy. В результате были получены два новых кординационных полимера состава Cs2[Cu2Re6S8(CN)6] ⋅ 3H2O (I) и (H3O)2[Cu{Cu2(µ-CN)}Re6Se8(CN)6] · 6.5H2O (II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные кластерные соли Cs2.67K1.33[Re6S8-(CN)2(OH)4] · 4H2O и Cs2.75K1.25[Re6Se8(CN)4(OH)2] · · H2O получали по ранее описанным методикам [5, 6]; остальные реагенты использовали коммерческие.
Синтез I. Запаянную стеклянную ампулу, заполненную смесью 100 мг Cs2.67K1.33[Re6S8(CN)2-(OH)4] · 4H2O (0.051 ммоль), 40 мг CuCN (0.446 ммоль) и 0.5 мл дистиллированной воды, нагревали до 150°С, выдерживали 48 ч, затем охлаждали в течение 24 ч. Состав конечного продукта представлял собой смесь пластинчатых оранжево-красных и игольчатых белых кристаллов. Белые кристаллы – непрореагировавший CuCN. Продукт реакции отмывали водой на бумажном фильтре и высушивали на воздухе. Выход основного продукта определить не удалось из-за примеси белых кристаллов. EDAX показал соотношение элементов в образце Cs : Cu : Re : S = 1.6 : 2 : 6 : 6.6.
ИК-спектр (ν, см–1): 409 ν(ReS), 1075 ν(OHaq), 1598 δ(H2O), 2114 и 2160 ν(CN), 3432 ν(OH–).
Синтез II выполняли по методике, аналогичной для I (количество реагентов: 100 мг Cs2.75K1.25[Re6Se8(CN)4(OH)2] · H2O (0.043 ммоль), 40 мг CuCN (0.446 ммоль) и 0.4 мл дистиллированной воды). Комплекс II представляет собой красные призматические кристаллы, выход которых определить не удалось, так как количество кристаллов было незначительным по отношению к общей массе продукта. Выделенный продукт представлял собой сростки красных и белых кристаллов. EDAX показал соотношение элементов в образце Cu : Re : S = 2.8 : 6 : 6.9.
ИК-спектр (ν, см–1): 1064 ν(OHaq), 1575 δ(H2O), 2152 ν(CN), 3416 ν(OH–).
Соотношение тяжелых элементов определяли методом энергодисперсионного рентгеновского анализа (EDAX) с помощью анализатора EX-23000BU на растровом электронном микроскопе JSM-6700F.
ИК-спектры в диапазоне 4000–400 см–1 снимали для образцов в виде таблеток с KBr на Фурье-спектрометре Scimitar FTS 2000. Для приготовления образцов использовали отобранные из реакционных смесей кристаллы соединений I и II.
РСА. Строение соединений I и II установлено по стандартной методике на автоматическом четырехкружном дифрактометре Bruker-Nonius X8 Apex, оснащенном двухкоординатным CCD детектором (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при температуре 293(2) К для соединения I и 173(2) К для соединения II. Поглощение учтено эмпирически (по интенсивностям эквивалентных отражений) при помощи программы SADABS [18]. Кристаллическая структура расшифрована прямым методом. Атомы водорода молекул воды не локализованы. Окончательное уточнение проведено полноматричным МНК в анизотропном приближении для всех неводородных атомов по независимым отражениям. Все расчеты выполнены по комплексу программ SHELXL-2018/3 [19]. Рисунки выполнены с использованием программы DIAMOND [20]. Кристаллографические характеристики и детали дифракционных экспериментов приведены в табл. 1.
Таблица 1.
Кристаллографические характеристики, детали дифракционных экспериментов и уточнения структуры I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| М | 1976.75 | 2267.78 |
| Сингония | Ромбическая | Моноклинная |
| Пр. гр. | Pnna | C2/m |
| a, Å | 15.9614(3) | 18.7168(5) |
| b, Å | 15.9522(3) | 23.9787(9) |
| c, Å | 10.9551(3) | 8.9836(3) |
| β, град | 97.836(2) | |
| V, Å3 | 2789.4(2) | 3994.2(2) |
| Z | 4 | 4 |
| ρ(выч.), г см–3 | 4.707 | 3.771 |
| µ(MoKα), мм–1 | 30.610 | 26.990 |
| Размер кристалла, мм | 0.12 × 0.10 × 0.06 | 0.18 × 0.12 × 0.12 |
| Область сбора данных θ, град | 3.41–27.46 | 2.78–30.57 |
| Диапазоны h, k, l | –15 ≤ h ≤ 20, –20 ≤ k ≤ 17, –14 ≤ l ≤ 14 |
–26 ≤ h ≤ 14, –34 ≤ k ≤ 33, –12 ≤ l ≤ 12 |
| Число измеренных отражений | 20 060 | 19 023 |
| Число независимых отражений (Rint) | 3214 (0.0350) | 6238 (0.0251) |
| Число наблюдаемых отражений (I > 2σ(I)) | 2661 | 5094 |
| Число уточняемых параметров | 155 | 219 |
| F(000) | 3416 | 3928 |
| R (F 2 > 2σ(F 2)) | R1 = 0.0250, wR2 = 0.0547 |
R1 = 0.0265, wR2 = 0.0776 |
| R (F 2 по всем отражениям) | R1 = 0.0348, wR2 = 0.0571 |
R1 = 0.0265, wR2 = 0.0894 |
| GOOF | 1.049 | 1.135 |
| Δρmax/Δρmin, e Å–3 | 3.265/–3.439 | 4.274/–2.812 |
Координаты атомов и величины тепловых параметров депонированы в Неорганическом банке структурных данных (CSD № 2048821 (I), 2048822 (II)) и могут быть получены по адресу https:// www.ccdc.cam.ac.uk/structures или у авторов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для получения соединений с цианидом меди(I) мы использовали отработанный ранее метод, а именно гидротермальный синтез. Типичная процедура этого метода состоит в следующем: стеклянную запаянную ампулу, заполненную реагентами, нагревают и выдерживают при заданной температуре. В ходе исследованных в настоящей работе реакций в обоих случаях произошло замещение лигандов OH– кластерного комплекса на лиганды CN– с формированием взаимопроникающих каркасов через мостики –CN–Cu–CN–.
В ИК-спектре соединения I имеются полосы валентных колебаний CN– кластерного аниона [Re6S8(CN)6]4– 2114 и 2160 см–1. Полосы 1075 и 3432 см–1 относятся к валентным колебаниям молекул H2O. Деформационным колебаниям H2O соответствует полоса при 1598 см–1. Полоса 409 см–1 относится к валентным колебаниям ReS [21].
В ИК-спектре соединения II имеются полосы валентных колебаний молекул H2O 1064, 3416 см–1. К деформационным колебаниям H2O относится полоса 1575 см–1. Полоса 2152 см–1 обусловлена валентными колебаниями CN– кластерного аниона [Re6Se8(CN)6]4– [21].
Соединение I кристаллизуется в пр. гр. Pnna (ромбическая сингония). В элементарной ячейке содержится центросимметричный кластерный анион [Re6S8(CN)6]4–, координированный к этому кластерному аниону катион Cu+, две молекулы H2O с заселенностью 1 и 0.5 и два катиона Cs+, компенсирующих отрицательный заряд каркасного полимера. Данное соединение представляет собой два взаимопроникающих каркаса, в полостях которых находятся катионы Cs+ и молекулы H2O (рис. 1). Координационное окружение Cs сложное и состоит из CN–, μ3-S и атомов кислорода H2O. Атомы Cs(1) находятся в одной плоскости с двумя соседними кластерными анионами. Молекулы H2O и Cs(1) лежат в перпендикулярной плоскости. Атомы Cs(2) находятся в окружении трех кластерных анионов и двух молекул H2O. В полимере все шесть лигандов CN– кластерных анионов [Re6S8(CN)6]4– вовлечены в координацию к атомам меди. Координационное число атомов меди равно 3. Координационное окружение меди образовано атомами N цианидных лигандов кластерных анионов (рис. 2). В свою очередь, каждый кластерный анион связан с десятью соседними кластерными анионами: по два в транс-положении и шесть в экваториальной плоскости (в транс-положении с одним кластерным анионом другой связывается двумя катионами меди и еще два аниона через один катион меди) (рис. 3). Основные расстояния в сравнении с некоторыми другими соединениями приведены в табл. 2.
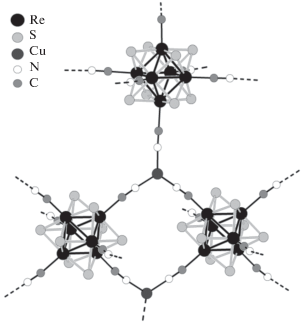
Рис. 1.
Общий вид структуры Cs2[Cu2Re6S8(CN)6] ⋅ · 3H2O вдоль оси a (а) и вдоль оси с (б), молекулы H2O и катионы Cs+ показаны для одной элементарной ячейки, белым цветом показан взаимопроникающий каркас, кластерные ядра {Re6S8}2+ изображены в виде октаэдров.
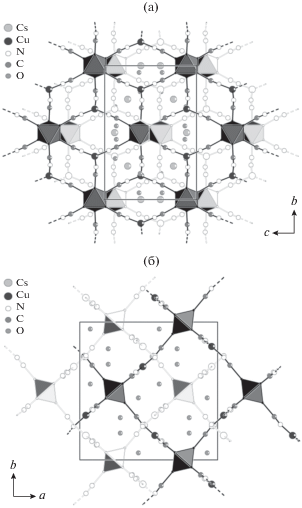
Рис. 3.
Схематичный фрагмент каркаса [Cu2Re6S8(CN)6]2–, кластерный комплекс [Re6S8(CN)6]4– изображен в виде октаэдров, в узлах – атомы меди.
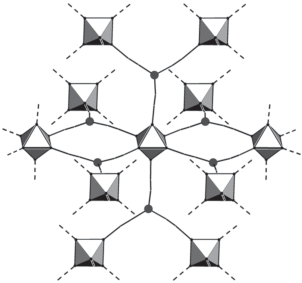
Таблица 2.
Основные геометрические характеристики в полученных и некоторых известных соединениях
| Соединение | d, Å | Литература | |||
|---|---|---|---|---|---|
| Re–Re | Re–(µ3-Q) | Re–C | Cu–N | ||
| I | 2.5861(6)–2.6056(4) | 2.390(2)–2.4154(2) | 2.098(8)–2.110(8) | 1.910(7)–1.933(7) | Настоящая работа |
| II | 2.6238(4)–2.6295(4) | 2.5152(7)–2.5265(8) | 2.080(8)–2.096(7) | 1.835(6)–1.944(8) | Настоящая работа |
| Cs2.67K1.33[Re6S8(CN)2(OH)4] · 4H2O | 2.5810(2)–2.5860(1) | 2.407(3)–2.406(4) | 2.07(3) | [5] | |
| Cs2.75K1.25[Re6Se8(CN)4(OH)2] · H2O | 2.6160(2)–2.6239(2) | 2.518(2)–2.532(2) | 2.01(2)–2.05(2) | [6] | |
| Cs3K[Re6S8(CN)6] | 2.601(1)–2.611(1) | 2.402(4)–2.593(3) | 2.725(2) | [22] | |
| K4[Re6Se8(CN)6] · 3.5H2O | 2.624(1)–2.642(1) | 2.516(1)–2.538(1) | 2.09(2)–2.12(2) | [23] | |
| [{Cu(Bipy)2(μ-CN)Cu(Bipy)}2Re6S8(CN)6] · Bipy · 2H2O | 2.6005(2)–2.6035(2) | 2.4004(8)–2.4146(8) | 2.109(3)–2.126(4) | 1.909(4)–2.100(3) | [16] |
| [{Cu(Bipy)}2(μ-CN)][{Cu(Bipy)}3Re6S8(CN)6] | 2.6016(2)–2.6101(2) | 2.4040(9)–2.4212(9) | 2.106(4)–2.119(4) | 1.848(4)–2.138(3) | [16] |
| [{Cu(Bipy)(μ-CN)Cu(Bipy)}2{Cu(Bipy)}2Re6Se8(CN)6] | 2.6306(2)–2.6420(2) | 2.5107(4)–2.5385(4) | 2.106(4)–2.110(4) | 1.844(4)–2.118(4) | [16] |
Соединение II кристаллизуется в пр. гр. C2/m (моноклинная сингония). В элементарной ячейке содержится половина центросимметричного кластерного аниона [Re6Se8(CN)6]4–, три координированных катиона Cu+, два из которых разупорядочены по двум близколежащим позициям. К разупорядоченным Cu+ координированы CN–, являющиеся мостиковыми. Кроме этого, в элементарной ячейке содержится восемь независимых позиций, занятых молекулами H2O и катионами H3O+. Атомы O в этих позициях обладают частичной заселенностью. Точное расположение катионов H3O+ среди этих позиций определить невозможно, а их число задано исходя из электронейтральности соединения. Координационное окружение разупорядоченных близколежащих Cu(1) и Cu(2) треугольное и состоит из двух лигандов CN– кластерных анионов, мостикового лиганда CN–, соединяющего соседние Cu(1) и Cu(2). Мостиковый лиганд CN–, соединяющий два ближайших Cu(2), разупорядочен по двум позициям. Координационное окружение Cu(3) линейное и состоит из двух лигандов CN– соседних кластерных анионов (рис. 4). Кластерные анионы и {Cu2(μ-CN)}+ образуют слой (рис. 5), который объединяется в каркас катионами Cu(3). В структуре существуют два таких каркаса, которые взаимопроникают (рис. 6). В полостях взаимопроникающих каркасов находятся молекулы H2O и катионы H3O+.
Рис. 5.
Схематичный фрагмент слоя, образованного {Cu2(μ-CN)}+ и кластерными анионами в II. Кластерные ядра {Re6Se8}2+ изображены в виде октаэдров.
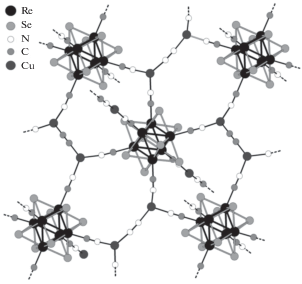
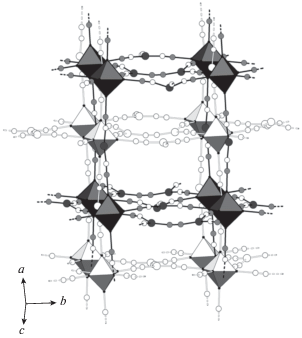
Рис. 6.
Общий вид структуры (H3O)2[Cu{Cu2(µ-CN)}Re6Se8(CN)6] · 6.5H2O, белым цветом показан взаимопроникающий каркас, кластерные ядра {Re6Se8}2+ изображены в виде октаэдров.
В настоящей работе были впервые изучены реакции октаэдрических халькогенидных кластерных цианогидроксокомплексов рения с CuCN. В результате гидротермального синтеза образуются взаимопроникающие каркасы, в полостях которых находятся катионы, компенсирующие отрицательный заряд, и молекулы H2O. Различие в строении каркасов может быть обусловлено небольшим различием линейных размеров кластерных комплексов из-за отличия атомов халькогена и соотношения CN : OH.
Список литературы
Fedorov V.E., Naumov N.G., Mironov Y.V. et al. // J. Struct. Chem. 2002. V. 43. № 4. P. 669.
Naumov N.G., Brylev K.A., Mironov Y.V. et al. // J. Struct. Chem. 2014. V. 55. № 8. P. 1371.
Cordier S., Molard Y., Brylev K.A. et al. // J. Cluster Sci. 2015. V. 26. P. 53.
Fedorov V.E., Naumov N.G. // Struct. Bond. 2019. V. 180. P. 31.
Mironov Y.V., Brylev K.A., Smolentsev A.I. et al. // RSC Advances. 2014. V. 4. № 105. P. 60808.
Mironov Y.V., Brylev K.A., Kim S.-J. et al. // Inorg. Chim. Acta. 2011. V. 370. № 1. P. 363.
Naumov N.G., Virovets A.V., Sokolov M.N. et al. // Angew. Chem. Int. Ed. 1998. V. 37. № 13–14. P. 1943.
Shores M.P., Beauvais L.G., Long J.R. // J. Am. Chem. Soc. 1999. V. 121. № 4. P. 775.
Beauvais L.G., Shores M.P., Long J.R. // J. Am. Chem. Soc. 2000. V. 122. № 12. P. 2763.
Bennett M.V., Beauvais L.G., Shores M.P. et al. // J. Am. Chem. Soc. 2001. V. 123. № 33. P. 8022.
Naumov N.G., Soldatov D.V., Ripmeester J.A. et al. // Chem. Commun. 2001. V. 6. P. 571.
Smolentsev A.I., Ermolaev A.V., Mironov Y.V. // J. Mol. Struct. 2012. V. 1014. P. 57.
Ермолаев А.В., Смоленцев А.И., Миронов Ю.В. // Коорд. химия. 2016. Т. 42. № 11. С. 700 (Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // Russ. J. Coord. Chem. 2016. 42. № 11. P. 730). https://doi.org/10.1134/S1070328416110026
Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // J. Struct. Chem. 2011. V. 52. № 6. P. 1124.
Ермолаев А.В., Смоленцев А.И., Миронов Ю.В. // Коорд. химия. 2014. Т. 40. № 8. С. 487 (Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // Russ. J. Coord. Chem. 2014. 40. № 8. P. 558). https://doi.org/10.1134/S1070328414080028
Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // Polyhedron 2015. V. 102. P. 417.
Ermolaev A.V., Smolentsev A.I., Mironov Y.V. // J. Struct. Chem. 2014. V. 55. № 4. P. 731.
APEX2 (version 1.08), SAINT (version 7.03), SADABS (version 2.11), Madison (WI, USA): Bruker Advanced X-ray Solutions, 2004.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
DIAMOND (version 3.2a). Bonn (Germany): Crystal Impact GbR. 2009.
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds, John Wiley & Sons, Inc., 2008.
Slougui A., Mironov Y.V., Perrin A. et al. // Croat. Chem. Acta. 1995. V. 68. № 4. P. 885.
Naumov N.G., Virovets A.V., Podberezskaya N.V. et al. // J. Struct. Chem. 1997. V. 38. № 5. P. 857.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия