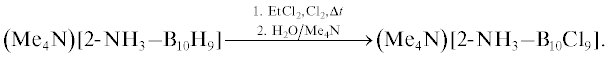Координационная химия, 2021, T. 47, № 8, стр. 457-483
Соли и комплексные соединения, содержащие декахлор-клозо-декаборатный анион
В. В. Авдеева 1, *, Е. А. Малинина 1, К. Ю. Жижин 1, Н. Т. Кузнецов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова
Москва, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 18.12.2020
После доработки 04.02.2021
Принята к публикации 08.02.2021
Аннотация
В обзоре представлены известные на настоящий момент соли и комплексные соединения металлов, содержащие декахлор-клозо-декаборатный анион [B10Cl10]2–. Обсуждено влияние природы катиона, растворителя, металла и/или органических лигандов на состав и строение продуктов реакций. Приведены также соли и комплексные соединения, содержащие катионы щелочных металлов, органические катионы и катионные комплексы металлов Ag(I), Cu(II), Fe(II), Co(II), Ni(II), Mn(II), Pb(II) с декахлор-клозо-декаборатным анионом в качестве противоиона. Описаны первые примеры комплексов серебра(I) с координированным анионом [B10Cl10]2–. Обсуждается способность перхлорированного клозо-декаборатного аниона участвовать в дополнительных невалентных взаимодействиях B–Cl…X (X = C, N, O) с катионами щелочных металлов, органическими катионами, органическими лигандами и молекулами растворителя, которые можно идентифицировать методом спектроскопии ЯКР 35Cl и РСА. Описан ряд новых соединений на основе перхлорированных кластеров бора, содержащих девять атомов галогена и функциональную группу [B10Hal9R]–.
К кластерным анионам бора относятся соединения общей формулы [BnHn]2– (n = 6−12) [1–3], которые представляют собой замкнутые объемные полиэдры, построенные из атомов бора. В свою очередь, каждый атом бора связан с экзо-полиэдрическим атомом водорода. Полиэдрические анионы бора [BnHn]2– (n = 6−12) обладают трехмерной ароматичностью и склонны участвовать в реакциях замещения терминальных атомов водорода с сохранением борного остова, образуя замещенные производные с числом заместителей от 1 до n. Интерес к этому классу анионов обусловлен широкими возможностями варьирования их электронного строения, геометрических и физических характеристик, что позволяет получать соединения с заданными свойствами. Особенности химического поведения кластерных анионов бора и их производных, термическая устойчивость и кинетическая стабильность соединений на их основе связаны в первую очередь с особенностями строения этих объектов [4–6].
Наиболее интересными областями практического применения соединений, содержащих кластерные анионы бора и их замещенные производные, традиционно считались области науки, связанные с высокой энергоемкостью соединений. Обнаруженная позднее способность атома бора поглощать тепловые нейтроны существенно расширило область применения борсодержащих соединений и послужило основой для использования последних в качестве прекурсоров для создания прочных термостойких полимерных нейтронозащитных покрытий с хорошей адгезией к различным материалам, нейтронозащитных тканей и материалов [7–9] и контрастных агентов для МРТ-диагностики [10]. Комплексные соединения металлов с анионами [BnHn]2– нашли широкое применение как экстрагенты тяжелых металлов, прекурсоры металлоборидных соединений сложного состава, координационные полимеры, соединения с высокой энергоемкостью и т.д. [11–14].
Некоторые проблемы химии кластерных анионов бора, их строение, способность к замещению экзо-полиэдрических атомов водорода на различные функциональные группы с сохранением борного остова описаны в обзорах [15–25]. В данных работах описаны синтез, строение и свойства солей и комплексов металлов, содержащих 10-, 11- и 12-вершинные кластеры бора [BnHn]2– в силу их большей синтетической доступности по сравнению с другими кластерами бора [BnHn]2–. До недавнего времени химическое поведение пергалогенированных кластерных анионов бора в реакциях комплексообразования практически не изучалось, а имеющиеся в литературе сведения носили разрозненный характер.
В настоящем обзоре обобщены сведения о солях и комплексных соединениях, содержащих декахлор-клозо-декаборатный анион [B10Cl10]2–, обсуждены окислительно-восстановительные процессы, протекающие в реакционных растворах, условия получения и особенности строения конечных соединений.
ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ СОЕДИНЕНИЙ С ДЕКАХЛОР-клозо-ДЕКАБОРАТНЫМ АНИОНОМ
Простые соли декахлор-клозо-декаборатного аниона получают хлорированием солей незамещенного аниона [B10H10]2– хлорирующими агентами, такими как газообразный хлор или SOCl2. При этом возможно образование целого ряда продуктов с различными степенями замещения [B10H10 – xClx]2– (x = 1–10), которые могут быть разделены хроматографически или с помощью электрофореза [26–28]. Обобщение строения соединений общей формулы [B10H10 –xClx]2– (x = 1–9) выходит за рамки данного обзора. Отметим лишь, что целый ряд соединений с частично хлорированным клозо-декаборатным анионом был исследован методом РСА, например [(C5H5N)2CH2][2-B10H9Cl] [29], (Me4N)[1,6,8-B10H7Cl3] [30], 3-CH3-2,8-[NMe2(CH2Cl)]2-7-Cl-B10H6 [31], (Ph3(NaphCH2)P)2B10H8Cl2 [32].
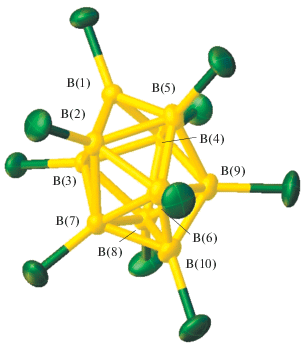
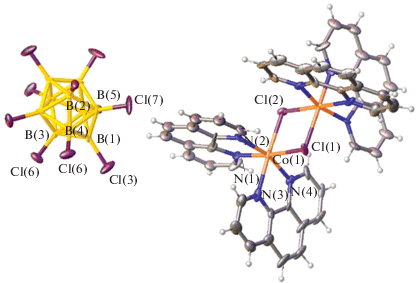
Соединения, содержащие анион [B10Cl10]2–, могут быть идентифицированы с помощью ИК-, ЯМР- и КР-спектроскопии [33–35]. Геометрически перхлорированный анион [B10Cl10]2– представляет собой квадратную Архимедову антипризму (рис. 1). В ИК-спектре соединений наблюдаются полосы валентных колебаний ν(B–Cl) в области 1150 и 1000 см–1, а также полосa около 850 см–1, соответствующая валентным колебаниям B–B борного остова. В КР-спектре отчетливо видна интенсивная полоса при 310 см–1, соответствующая валентным колебаниям B10–Cl. В спектре ЯМР 11В растворов солей перхлорированного аниона наблюдается два сигнала с соотношением интегральных интенсивностей 1 : 4, что соответствует присутствию двух типов атомов бора в полиэдре, апикальных и экваториальных. В отличие от спектров незамещенного аниона, в отсутствии широкополосного подавления спин-спинового взаимодействия B–H, сигналы не расщепляются в дублеты, оставаясь синглетными. Авторы [36] приводят данные фотоэлектронной спектроскопии и вольтамперометрии кластеров [BnCln]2– (n = 10, 11, 12) и делают вывод о стабильности кластеров В10 и В12 по сравнению с борным кластером В11.
Для идентификации соединений с декахлор-клозо-декаборатным анионом может быть использован метод ЯКР-спектроскопии. Этот метод зарекомендовал себя благодаря высокой чувствительности спектральных параметров ЯКР к особенностям электронного распределения, геометрическому строению и стереохимии соединений и применялся для других объектов как эффективный метод исследования кристаллохимии соединений [37]. Результаты исследований спектроскопии ЯКР 35Сl, проведенные для ряда соединений, содержащих анион [B10Cl10]2–, показали возможность этого метода из всей совокупности межатомных контактов, определенных методом РСА, выделить те, которые обусловлены вторичными взаимодействиями притяжения [38].
Дианион [B10Cl10]2– образует катионно-анионные соединения с различными катионами, включая катионы щелочных металлов, органические и комплексные катионы. На основании данных рентгеноструктурного анализа в этих соединениях, как правило, формируется разветвленная сеть вторичных взаимодействий с участием групп B–Cl борного кластера. Гипотетический спектр ЯКР 35Cl “свободного”, не участвующего в каких-либо взаимодействиях борного кластера, должен представлять собой два сигнала с соотношением интенсивностей 1 : 4, что соответствует присутствию двух типов атомов хлора, которые связаны с апикальными и экваториальными атомами бора полиэдра. Участие атомов хлора во вторичных взаимодействиях приводит к снятию эквивалентности, что приводит к расщеплению компонент дублета.
В работе приведены результаты РСА соединений, содержащих клозо-декаборатный анион [B10Cl10]2–, а для ряда соединений – данные спектроскопии ЯКР 35Сl, что позволяет обсуждать природу вторичных взаимодействий, в которых принимает участие борный кластер.
ХИМИЧЕСКОЕ ПОВЕДЕНИЕ ДЕКАХЛОР-клозо-ДЕКАБОРАТНОГО АНИОНА В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЯХ
Известно, что клозо-декаборатный анион [B10Cl10]2– подвергается обратимому электрохимическому окислению (E1/2 = 1.01 В) с образованием радикала гиперклозо-[B10Cl10]–, который придает реакционному раствору глубокий фиолетовый цвет [39, 40]. Анион-радикал [B10Cl10]– также может быть получен химическим окислением аниона [B10Cl10]2– такими окислителями, как церий(IV) [41] или таллий(III) [39]. Другой способ получения описан авторами [42]: указанный анион-радикал образуется при обработке солей аниона [B10Cl10]2– тионилхлоридом в дихлорэтане или контролируемым дегидрированием H2[B10Cl10] · 7.5H2O при 100–160°C.
Изучение химического поведения декахлор-клозо-декаборатного аниона в реакциях комплексообразования железа(III) и кобальта(III), сопровождающихся окислительно-восстановительными превращениями, показало, что анион [B10Cl10]2– не стабилизирует указанные степени окисления металлов. В результате взаимодействия (Et3NH)2-[B10Cl10] с сульфатом или хлоридом железа(III) наблюдается образование комплексов железа(II) состава [FeIIL3][В10Cl10], при этом выход комплексов не превышает 65% [43].
L = 2,2'-бипиридин (Bipy) или 1,10-фенантролин (Phen)
Аналогично кластерный анион ведет себя в реакциях комплексообразования в присутствии кобальта(III). Введение соли кластерного аниона [B10Cl10]2– в реакционный раствор, содержащий комплекс кобальта(III) in situ, привело к получению соответствующего комплекса кобальта(II) [Co(Рhen)3][В10Cl10] [44], строение которого будет описано ниже.
КАТИОННО-АНИОННЫЕ СОЕДИНЕНИЯ С ДЕКАХЛОР-клозо-ДЕКАБОРАТНЫМ АНИОНОМ
Соли с катионами щелочных металлов
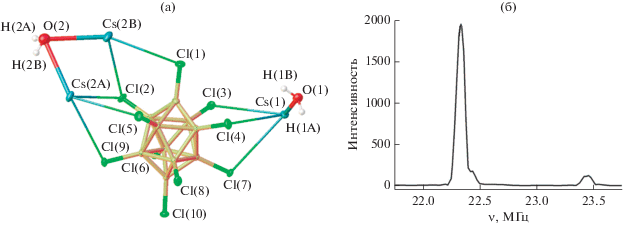
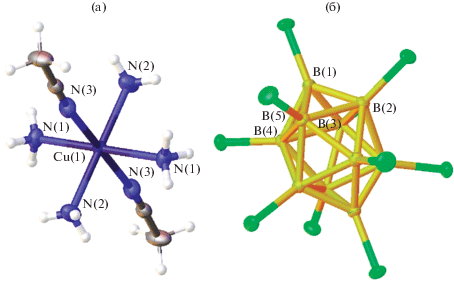
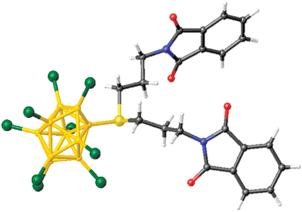
Сольваты K2[B10Cl10] ∙ 3H2O и K2[B10Cl10] ∙ DMF ∙ ∙ 2H2O, строение которых представлено на рис. 2, образуются при перекристаллизации K2[B10Cl10] из воды или диметилформамида. В ИК-спектрах солей перхлорированного аниона наблюдаются две интенсивные широкие полосы ν(BCl) с максимумами около 1150 и 1010 см–1, соответствующие валентным колебаниям апикальных и экваториальных групп B–Cl. Согласно данным РСА, в соединении K2[B10Cl10] ∙ 3H2O определяется большое число контактов атомов хлора с атомом калия и молекулами воды. Методом спектроскопии ЯКР 35Сl был изучен тригидрат K2[B10Cl10] ⋅ 3H2O. На основании полученных данных показано (рис. 2б), что атомы водорода и калия вносят вклад в градиент электрического поля на атомах хлора [45]. Таким образом, в соединении K2[B10Cl10] ⋅ 3H2O на основании совокупности данных РСА и спектроскопии ЯКР 35Сl можно предполагать наличие взаимодействий Cl…H и Cl…O (наименьшее расстояние 2.277 и 3.062 Å соответственно). Отметим, что в ИК-спектре соединений наличие вторичных взаимодействий не отражается какими-либо изменениями, в то время как для солей с незамещенными анионами [BnHn]2– изменения в ИК-спектрах отчетливо проявляются в области валентных колебаний ν(ВН).
Рис. 2.
Фрагмент структуры (а) и спектр ЯКР 35Cl (б) сольвата K2[B10Cl10] ∙ 3H2O и фрагмент структуры K2[B10Cl10] ∙ · DMF ∙ 2H2O (в).
При перекристаллизации соли Cs2[B10Cl10] из водного раствора получено два сольвата, отличающихся числом молекул воды: Cs2[B10Cl10] ⋅ 2H2O и Cs2[B10Cl10] ⋅ H2O [40]. Согласно данным РСА (рис. 3а), дигидрат Cs2[B10Cl10] ⋅ 2H2O содержит один кластерный анион в элементарной ячейке. Среди расстояний, определенных методом РСА, можно выделить три (О–Н…Cl), значения которых меньше ван-дер-ваальсовых (2.863, 2.536 и 2.570 Å). Вклад атомов цезия в градиент атома хлора незначителен ввиду очень высоких координационных чисел последнего (от 9 до 11). Авторы [46] отмечают, что элементарная ячейка дигидрата Cs2[B10Cl10] ⋅ 2H2O содержит атомы цезия, разупорядоченные по двум позициям примерно с равной заселенностью.
Спектр ЯКР 35Cl дигидрата Cs2[B10Cl10] ⋅ 2H2O приведен на рис. 3б. Из представленных данных следует, что по характеру спектр соединения наиболее приближен к теоретически возможному спектру свободного аниона [B10Cl10]2–, не связанного с другими компонентами структуры.
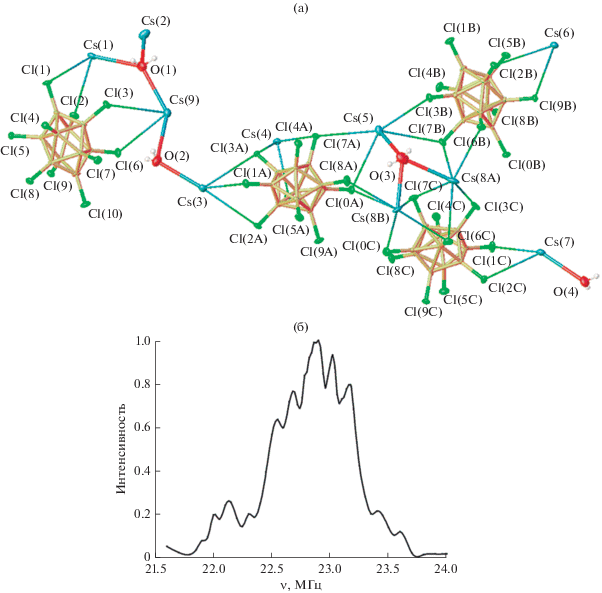
Строение моносольвата Cs2[B10Cl10] ⋅ H2O более сложное (рис. 4). В ячейке содержится четыре независимых декахлор-клозо-декаборатных аниона. В структуре наблюдается большое число специфических взаимодействий B–Cl…H с наименьшим расстоянием 2.518 Å. Основываясь на данных РСА, авторы высказывают предположение о наличии невалентных взаимодействий В–Cl…H с участием атомов хлора [46].
Соли с органическими катионами
Соли с органическими катионами получали при добавлении к солям с катионами щелочных металлов соответствующих хлоридов. Для ряда солей декахлор-клозо-декаборатного аниона с органическими катионами изучены спектры ЯКР 35Cl и проведен РСА. Установлено, что соединение (Ph4P)2[B10Cl10] кристаллизуется в виде ассоциата (Ph4P)2[B10Cl10] ⋅ CH3CN [47], структура которого представлена на рис. 5. Согласно данным РСА, в структуре (Ph4P)2[B10Cl10] ⋅ 3CH3CN помимо водородных связей, обнаруженных методом РСА, можно выделить большое число контактов Cl…C и Cl…N, в которых расстояние между атомами короче суммы ван-дер-вальсовых радиусов взаимодействующих атомов. Кроме того, в соединении существуют π–π-стэкинг-взаимодействия между ароматическими системами борного кластера аниона и фенильных колец катиона.
Рис. 5.
Строение соединения (Ph4P)2[B10Cl10] · 3CH3CN: фрагмент структуры (а), окружение борного кластера (б); спектр ЯКР 35Cl (в). Значок * показывает контакты, отражающиеся в спектре ЯКР 35Cl.
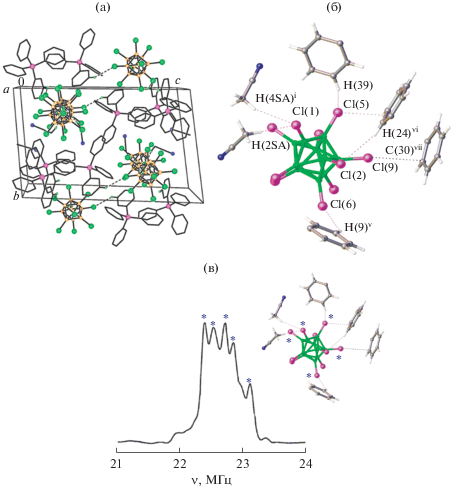
Судя по характеру спектра ЯКР 35Cl (рис. 5в), в соединении существуют, по крайней мере, четыре связи B–Cl...H и один укороченный контакт B–Cl...С, который следует отнести к структурному проявлению π–π-стэкинга-взаимодействия. Наименьшее расстояние Cl…C составляет 3.351 Å [47].
В [47] на основании данных спектроскопии ЯКР 35Cl и рентгенофазового анализа (РФА) проанализировано строение соли (Et3NH)2[B10Cl10]. Спектр ЯКР 35Cl соединения сильно расщеплен (рис. 6а), что можно объяснить наличием дальних контактов с СН- и NН-группами органического катиона. Мультиплетность спектра превышает 10, что указывает на существование в кристаллической решетке соединения нескольких кристаллографически неэквивалентных борных кластеров и не менее 12 атомов Сl, вовлеченных во вторичные взаимодействия. В спектре ЯКР 35Cl соли (Et3NH)2[B10Cl10], записанного при 77 K, отсутствует частотный сдвиг при нагревании образца от 19 до 77 К (рис. 6б) [47].
Рис. 6.
Спектр ЯКР 35Cl соли (Et3NH)2[B10Cl10] при 19 (а) и 77 K (б); рентгенограмма соли (Et3NH)2[B10Cl10] (в).
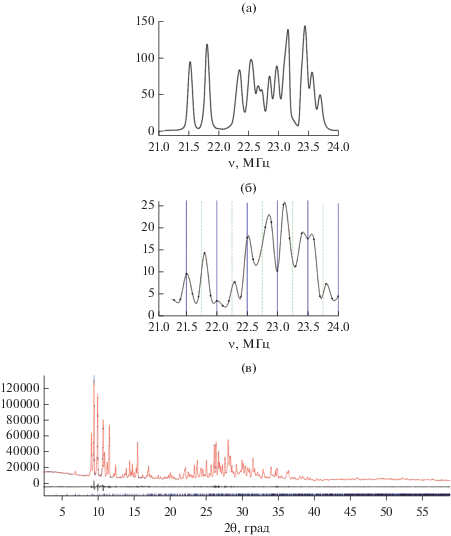
Методом РФА подтверждено присутствие неэквивалентных анионов [B10Cl10]2– в ячейке соли (Et3NH)2[B10Cl10] (рис. 6в). Согласно полученным данным, параметры ячейки соединения составляют: a = 26.3857, b = 10.3570, c = 30.3518 Å, β = = 123.43°, V = 6406.5 Å3, пространственная группа P21/c (RBragg = 0.068, Rwp = 2.50), что соответствует присутствию в ячейке четырех кристаллографически неэквивалентных катионов и двух кристаллографически независимых анионов. В данном соединении можно предполагать наличие не только взаимодействия C–H…Cl, но и контактов N–H…Cl, которые и обусловливают сильное расщепление спектра ЯКР 35Cl.
В [48] описан синтез и строение солей [CnMim]2- [B10Cl10] ([CnMim]+ = (1-алкил-3-метилимидазолий; n = 2, 4, 6, 8, 10, 12, 14, 16, 18), изучены их термические свойства и показано, что соли обладают низкими температурами плавления. Показана возможность получения ионных жидкостей на основе полученных соединений.
Катионно-анионные соединения с комплексными катионами
В качестве катионов в соединениях с перхлорированным борным кластером могут выступать катионные комплексы металлов с присутствующими в реакционном растворе органическими лигандами или молекулами растворителей. При этом кластерные анионы бора находятся во внешней сфере комплексов, участвуя в образовании невалентных взаимодействий.
Комплексы железа(II). В реакциях комплексообразования железа(II) с анионом [B10Cl10]2– в присутствии органических лигандов установлено, что независимо от используемого растворителя и соотношения реагентов (Fe : L = 1 : 1, 1 : 2, 1 : 3) образуются трис-хелатные комплексы [FeL3][B10Cl10] (L = Bipy, Phen) [43], образование последних объясняется высокой устойчивостью трис-хелатных катионных комплексов [FeL3]2+ в реакционном растворе.
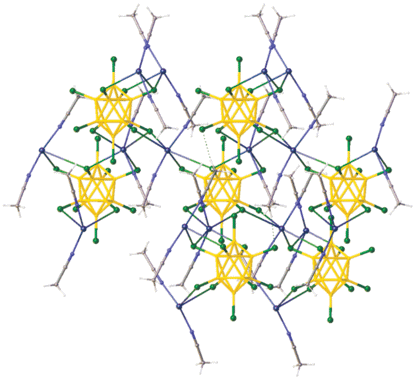
Из реакционных растворов трис-хелатные комплексы общей формулы [FeL3][B10Cl10] выделяются в виде сольватов с молекулами растворителей, содержащихся в реакционной смеси (H2O, CH3CN, DMF). Ряд сольватов охарактеризован методом РСА, их строение представлено на рис. 7. Согласно полученным данным, соединения построены из катионных комплексов [FeL3]2+, кластерных анионов бора и молекул растворителя. Комплекс [Fe(Bipy)3][B10Cl10] ∙ 2CH3CN ∙ H2O (рис. 7б) содержит три кристаллографически независимых катионных комплекса железа(II) и три кластерных аниона бора; в комплексе [Fe(Phen)3]- [B10Cl10] ∙ 0.88CH3CN ∙ 0.12H2O (рис. 7в) одна из трех координированных молекул Phen разупорядочена по трем позициям. Кластерные анионы бора во всех соединениях формируют внешнюю сферу комплексов. Увеличение избытка лиганда по отношению к металлу приводит к образованию клатрата [Fe(Bipy)3][B10Cl10] ⋅ 2Bipy ⋅ CH3CN (рис. 7г), в котором молекула Bipy внедряется в структуру кристалла.
Рис. 7.
Строение комплексов [Fe(Bipy)3][B10Cl10] ∙ CH3CN (а) (молекула CH3CN не показана), [Fe(Bipy)3][B10Cl10] ∙ · 2CH3CN ∙ H2O (б), [Fe(Phen)3][B10Cl10] ∙ 0.88 CH3CN ∙ 0.12 H2O (в), [Fe(Bipy)3][B10Cl10] ∙ 2 Bipy ∙ CH3CN (г).
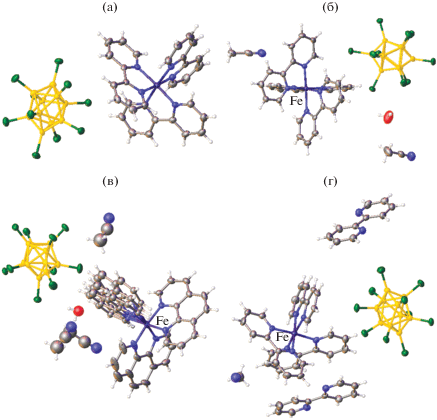
В [49] описан синтез и строение комплексов железа Cat[B10Cl10], где Cat – [Fe(HTrz)3]2+ (HTrz = = 1,2,4-триазол), [Fe(NH2Trz)3]2+ (NH2Trz = 4-амино-1,2,4-триазол) и [Fe(HC(Pz)3)2]2+ (HC(Pz)3 = = трис(пиразол-1-ил)метан), изучены их ИК-, EXAFS-спектры и ЭСП, а также статическая магнитная восприимчивость в области 78–500 К. Показано, что комплексы с [Cat] = [Fe(Htrz)3]2+ и [Fe(NH2Trz)3]2+ в рассматриваемом интервале температур остаются в высокоспиновом состоянии, тогда как в спектре низкоспинового комплекса [Fe(HC(Рz)3)2][B10Cl10] наблюдается неполный спиновый переход и соединение разлагается при нагревании выше 440 K.
Комплексы кобальта(II). При проведении реакций комплексообразования кобальта(II) в присутствии органических лигандов L, в отличие от комплексов железа(II), установлено влияние соотношения компонентов реакции (металл : лиганд) на состав и строение конечных продуктов реакций [44].
При взаимодействии хлорида кобальта с (Et3NH)2 [B10Cl10] и трехкратным избытком Phen или Bipy в CH3CN или DMF выделяется трис-хелатный комплекс [CoL3][B10Cl10] желтого цвета. Реакция протекает согласно схеме:
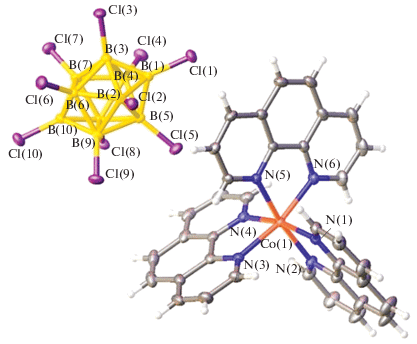
Строение комплекса [Co(Phen)3][B10H10] · CH3CN представлено на рис. 8. Комплекс состоит из комплексных катионов [Co(Phen)3]2+ и анионов [B10Cl10]2–. Кластерные анионы бора формируют внешнюю сферу соединения.
В тех же условиях двукратный избыток лиганда Phen по отношению к кобальту приводит к образованию биядерного комплекса кобальта(II) с атомами хлора в качестве мостиковых лигандов [Co2(Phen)4Cl2][B10Cl10] [44] (рис. 9). Комплекс выпадает из реакционного раствора в виде кристаллов розового цвета согласно схеме:
В биядерном комплексе [(Phen)2Co(Cl2)Co(Phen)2]- [B10Cl10] атомы кобальта находятся в октаэдрическом окружении, образованном двумя молекулами фенантролина и атомами хлора, которые соединяют атомы кобальта между собой. Кластерный анион бора находится во внешней сфере.
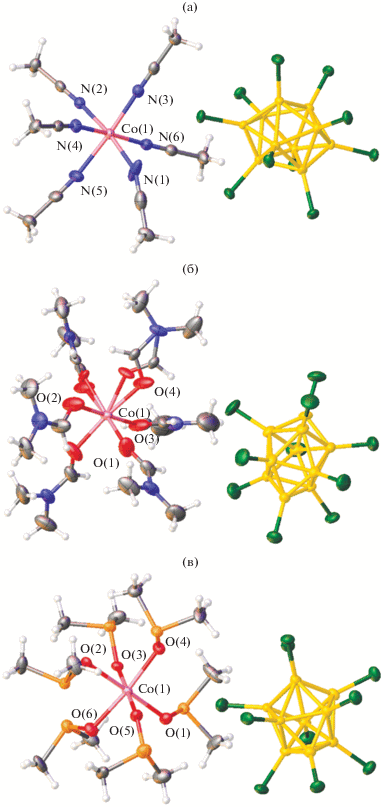
В качестве лигандов в образовании комплексных катионов могут принимать участие молекулы растворителей. Этот факт стоит принимать во внимание при проведении реакций комплексообразования в растворах: большее сродство металла-комплексообразователя к молекулам растворителя может приводить к тому, что присутствующий лиганд останется непрореагировавшим. Комплексы общей формулы [Co(solv)6][B10Cl10] (solv = CH3CN, DMF, DMSO) описаны в [50]. Они образуются в виде малорастворимых форм при взаимодействии (Et3NH)2[B10Cl10] с хлоридом кобальта CoCl2 или нитратом кобальта Co(NO3)2 в соответствующих растворителях:
Строение соединений [Co(solv)6][B10Cl10] установлено методом РСА (рис. 10) [50]. Кристаллы комплексов построены из катионов [Co(solv)6]2+ и анионов [B10Cl10]2–. Молекулы диметилформамида в катионном комплексе кобальта(II) разупорядочены, на рис. 10б представлено одно из их положений.
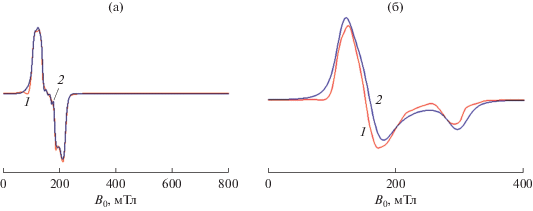
Комплексы кобальта изучены методом ЭПР-спектроскопии. Спектры высокоспиновых ионов кобальта в октаэдрическом окружении представляют собой нерасщепленную линию эффективного спина S = 1/2 с изотропным g-фактором 4.33. Однако в исследованных соединениях октаэдрическое окружение искажено, поэтому наблюдается ромбически расщепленная линия эффективного спина Sэфф = 1/2. Наиболее близкая к октаэдру структура наблюдается у соединения [Co(DMF)6]- [B10Cl10] [50] (рис. 11).
Рис. 11.
а – спектр ЭПР порошка [Co(DMF)6][B10Cl10] при Т = 4.5 K: эксперимент (1), симуляция с параметрами СГ (2) (gz = 4.108, gx = 4.052, gy = 4.201, A = 2.852 × 10–2 см–1, B = 2.055 × 10–2 см–1, C = 1.072 × 10–2 см–1); б – cпектр ЭПР порошка [Co(Phen)3][B10Cl10] при Т = 8 K: эксперимент (1), симуляция с параметрами СГ: gz = 5.61, gx = 4.20, gy = 2.26 (2).
В [51] описан синтез и строение псевдоклатрохелатного комплекса кобальта [Co-(PzOx)3- (BC6H5)DMF]2[B10Cl10]. Соединение получено при взаимодействии 2-ацетилпиразолоксима PzOxH и фенилборной кислоты с вышеописанным комплексом [Co(DMF)6][B10Cl10]. Согласно данным РСА, соединение содержит два независимых катиона кобальта(II) в высокоспиновом состоянии [Co-(PzOx)3(BC6H5)DMF]+ (Co–N 2.115(4)–2.198(3) Å), анион [B10Cl10]2–, сольватные молекулы бензола и дихлорметана и две молекулы DMF, которые связаны с моношапочными трис-пиразолоксиматными лигандами с помощью водородных связей N–H…O (рис. 12). Описаны данные магнитной восприимчивости соединения; обнаружено, что соединение демонстрирует высокую магнитную анизотропию. Результаты магнитометрических исследований в переменном магнитном поле позволяют предположить, что данный комплекс проявляет свойства молекулярного магнита с эффективным барьером перемагничивания ~130 см–1.
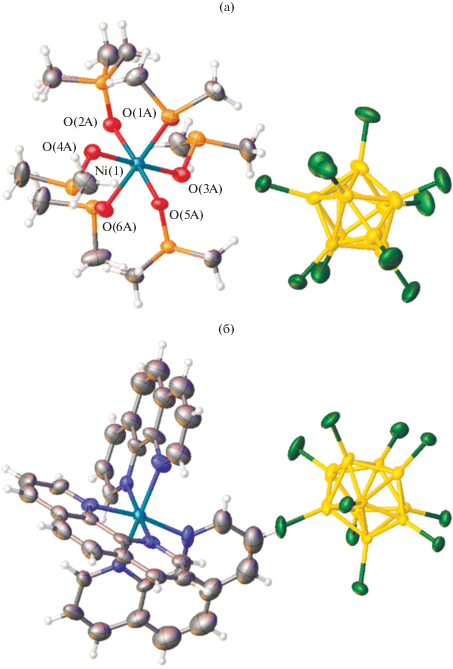
Комплексы никеля(II). Комплексы никеля(II) [Ni(DMF)6][B10Cl10] и [Ni(DMSO)6][B10Cl10] [50], аналогичные вышеописанным комплексам кобальта(II), образуются при взаимодействии солей (Et3NH)2[B10Cl10] и хлорида или нитрата никеля в DMF или DMSO соответственно.
В ИК-спектрах комплексов [Ni(DMF)6][B10Cl10] и [Ni(DMSO)6][B10Cl10] присутствуют полосы, отвечающие соответствующим валентным колебаниям координированных молекул растворителя (см–1): при ~1640 ν(СО) (DMF); ~1004 ν(SO) (DMSO). В спектре [Ni(DMF)6][B10Cl10] присутствуют две полосы, обусловленные валентными колебаниями ν(BCl) апикальных и экваториальных групп B–Cl с максимумами при 1015 и 1157 см–1 соответственно. Строение комплекса [Ni(DMF)6][B10Cl10] представлено на рис. 13а.
Рис. 13.
Строение комплексов никеля: [Ni(DMF)6][B10Cl10] (а), [Ni(Phen)3][B10Cl10] ∙ DMF (б). Молекулы растворителей не показаны.
Образование трис-хелатных комплексов никеля(II) с азагетероциклическими лигандами L и кластерными анионами бора [B10Cl10]2– общей формулы [NiL3][B10Cl10] (L = Bipy, Phen) описано в [50]. Соединения образуются при взаимодействии вышеописанных комплексов [Ni(solv)6]- [B10Cl10] с лигандами L в системе CH3CN–H2O или DMF–H2O согласно схеме:
Полученные соединения получены в виде сольватов из соответствующих реакционных растворов. Целевые соединения могут быть синтезированы в результате твердофазного синтеза в ходе механоактивации твердых компонентов реакции [50]. Методом РСА установлена структура кристаллов [Ni(Phen)3][B10Cl10] ∙ DMF. Соединение построено из комплексных катионов [Ni(Phen)3]2+ и анионов [B10Cl10]2–. В комплексных катионах три бидентатно координированных лиганда расположены в приблизительно взаимно перпендикулярных плоскостях, образуя искаженное октаэдрическое окружение атома Ni (рис. 13б).
Комплексы марганца(II). Однотипность поведения солей марганца(II) солям кобальта(II) в реакциях комплексообразования с азагетероциклическими лигандами и анионом [B10Cl10]2– была показана в [52]. Так, в случае трехкратного избытка лиганда Bipy по отношению к металлу выделяется комплекс [Mn(Bipy)3][B10Cl10] [52]. Ввиду хорошей растворимости исходных реагентов в органических растворителях реакцию проводили в DMF или CH3CN:
Методом РСА изучено строение [Mn(Bipy)3]- [B10Cl10]. Комплекс состоит из комплексных катионов [Mn(Bipy)3]2+ и перхлорированных анионов бора. Строение соединения представлено на рис. 14а.
Рис. 14.
Строение [Mn(Bipy)3][B10Cl10] (а) и [Mn2(Bipy)4Cl2][B10Cl10] ⋅ 2CH3CN (б) (молекулы ацетонитрила не показаны).
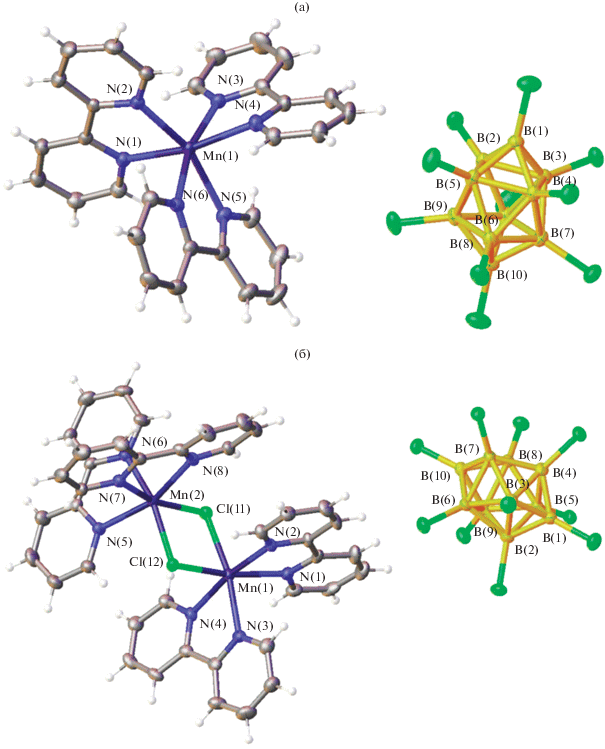
Снижение соотношения металл : лиганд до значений 1 : 2, как и в случае с кобальтом(II), приводит к выделению биядерного катионного комплекса марганца(II) с мостиковыми атомами хлора [52]:
Близость окраски моно- и биядерного комплексов марганца(II) (кристаллы [Mn(Bipy)3][B10Cl10] ярко-желтые, [Mn2(Bipy)4Cl2][B10Cl10] лимонно-желтые), а также однотипность их ИК-спектров (присутствие полосы валентных колебаний ν(B–Cl) при 1158 и 1004 см–1) не позволили авторам различить два комплекса марганца на первом этапе исследования. Различный состав комплексов был определен на основании данных элементного анализа и впоследствии подтвержден методом РСА. Строение комплекса [Mn2(Bipy)4Cl2][B10Cl10] представлено на рис. 14б.
Комплексы меди(II). В ходе реакций комплексообразования сульфата меди(II) в присутствии трехкратного избытка лиганда Bipy в ацетонитриле образуется трис-хелатный комплекс [Cu(Bipy)3] [B10Cl10] [53].
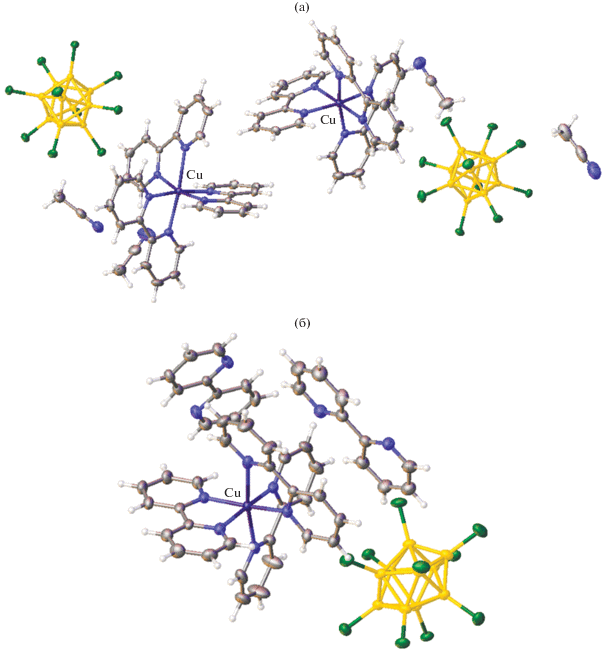
МетодомРСА установлено, что в соединении [Cu(Bipy)3][B10Cl10] ⋅ 2CH3CNприсутствуютпо два кристаллографически неэквивалентных комплексных катиона [Cu(Bipy)3]2+, аниона [B10Cl10]2– и четыре молекулы ацетонитрила (рис. 15а). Перхлорированный анион [B10Cl10]2– выполняет роль противоиона. Как и в других соединениях с анионом [B10Cl10]2–, ряд специфических взаимодействий Cl…H был установлен на основании полученных структурных данных.
Увеличение содержания в реакционном растворе органического лиганда приводит к формированию кокристалла [Cu(Bipy)3][B10Cl10] · 2Bipy [53]:
Строение соединения установлено методом РСА (рис. 15б). Соединение построено из катионов [Cu(Bipy)3]2+, анионов [B10Cl10]2– и двух молекул Bipy.
Как оказалось, природа лиганда и противоиона в солях меди(II) оказывают существенное влияние на ход реакции комплексообразования, а также состав и строение конечных продуктов. В [53] изучена реакция взаимодействия водных растворов ацетата меди(II) и аммиака с анионом [B10Cl10]2–. К реакционному раствору, содержащему ацетат меди(II) и NH3 ∙ H2O, добавляли раствор соли (Et3NH)2[B10Cl10] в ацетонитриле. В результате изотермического упаривания на воздухе из реакционного раствора были выделены кристаллы смешанолигандного комплекса [Cu(NH3)4- (CH3CN)2][B10Cl10].
В комплексе [Cu(NH3)4(CH3CN)2][B10Cl10], согласно данным РСА (рис. 16), атом меди находится в плоскоквадратном окружении, которое формируют атомы азота четырех молекул аммиака. Два атома азота молекул ацетонитрила достраивают координационную сферу меди(II) до искаженного октаэдра, вытянутого в аксиальном направлении. Декахлор-клозо-декаборатный анион находится во внешней сфере.
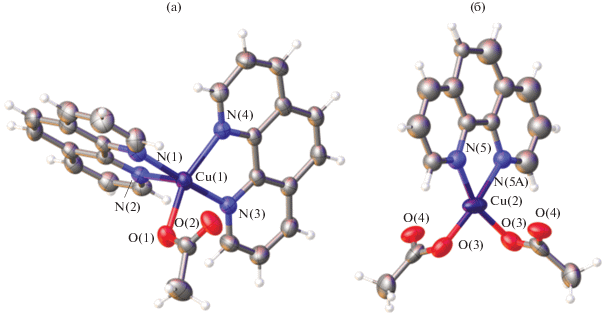
Взаимодействие ацетата меди(II) с 1,10-фенантролином в присутствии (Et3NH)2[B10Cl10] в DMSO носит принципиально иной характер. Первоначально происходит формирование кокристалла [CuPhen2-(CH3CO2)]2[B10Cl10] ∙ [CuPhen(CH3CO2)2] [54]:
По данным РСА, кокристалл [CuPhen2(CH3CO2)]2- [B10Cl10] ∙ [CuPhen(CH3CO2)2] состоит из катионных комплексов [CuPhen2(CH3CO2)]+, анионов [B10Cl10]2– и нейтральных комплексов [CuPhen(CH3CO2)2]. Строение комплексов меди, входящих в состав соединения, представлено на рис. 17. Оба комплекса меди(II), нейтральный и катионный, являются моноядерными.
Рис. 17.
Строение комплексов меди в составе соединения [CuPhen2(CH3CO2)]2[B10Cl10] ∙ [CuPhen(CH3CO2)2].
Длительное кипячение полученного соединения в DMSO приводит к выделению комплексного катиона с тремя мостиковыми группами – двумя ацетатными и гидроксо-группой [54]:
Согласно данным РСА (рис. 18а), атомы меди в биядерном катионном комплексе [Cu2Phen2(CH3CO2)2OH]+ связаны двумя атомами кислорода от двух ацетатных мостиков и атомом кислорода гидроксогрупы. Достаточно короткое расстояние Cu…Cu в димере составляет 3.234(2) Å, угол CuOCu равен 116.1(3)°.
Рис. 18.
Строение катионной части (а), спектр ЯКР 35Cl при 4.2 K (б) и экспериментальный (1) и теоретический (2) ЭПР-спектры поликристаллического образца при T = 293 K (gz = 2.239; gx = 2.037; gy = 2.093) (в) комплекса [Cu2Phen2(CH3CO2)2OH]2[B10Cl10] ∙ 3DMSO ∙ 0.5H2O.
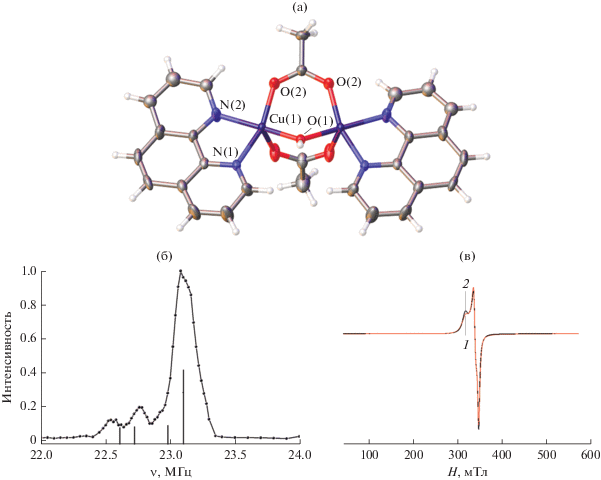
Соединение [Cu2Phen2(CH3CO2)2OH]2[B10Cl10] ∙ ∙ 3DMSO ∙ 0.5H2O было изучено методами спектроскопии ЯКР 35Cl- и ЭПР [54] (рис. 18б, 18в). Спектры ЭПР при Т = 293 К представляют собой плохо разрешенные спектры в параллельной и перпендикулярной ориентации g-тензора. Несмотря на содержание в комплексе двух атомов меди, связанных тремя цепочками, в спектрах отсутствуют признаки наличия обменных взаимодействий между атомами металла, а именно отсутствует “запрещенный” переход в половинном магнитном поле и уширение линий в центральной части спектра. Спектры ЭПР характерны для мономерных комплексов меди со спином S = 1/2.
Среди реакций комплексообразования металлов М(II), имеющих несколько устойчивых степеней окисления и представленных в данном обзоре, отметим, что взаимодействие с солями меди(I) сопровождается окислительно-восстановительными превращениями.
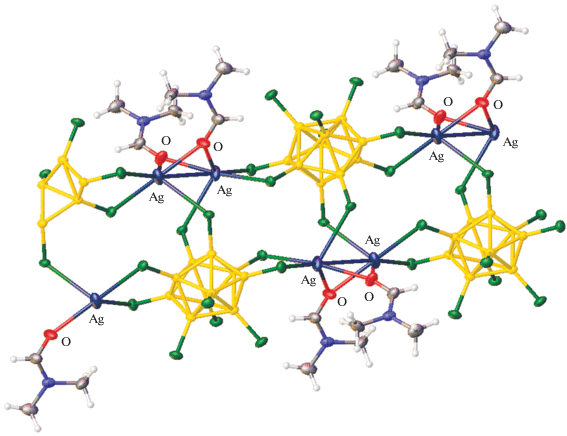
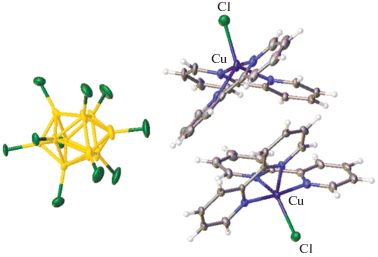
При использовании в качестве исходного реагента хлорида меди(I) установлено, что реакция комплексообразования в присутствии азагетероциклического лиганда Bipy сопровождается окислением меди(I) до меди(II) под действием кислорода воздуха и образованием в качестве конечного продукта комплекса меди(II) [54]. При добавлении раствора Bipy в DMF к реакционному раствору, содержащему CuCl и (Et3NH)2[B10Cl10] в том же растворителе, мгновенно выпадает осадок, представляющий собой моноядерный смешанолигандный комплекс меди(II) [Cu(Bipy)2Cl]2[B10Cl10] [54]:
Перекристаллизация осадка из DMF привела к получению монокристалловсоединения [Cu(Bipy)2Cl]2[B10Cl10] · 2DMF, строение которых представлено на рис. 19. Согласно РСА, соединение содержит комплексный катион [Cu(Bipy)2Cl]+, кластерный анион [B10Cl10]2– и две молекулы DMF.
Рис. 19.
Строение [Cu(Bipy)2Cl]2[транс-B20H18] (показан один из двух катионов) и [Cu(Bipy)2Cl]2[B10Cl10] · 2DMF (б) (молекулы DMF не показаны).
Изученыкристаллическиеструктуры аквакомплексов меди(II) [Cu(H2O)4][B10Cl10]⋅ 5H2O [55] и [Cu(H2O)6][B10Cl10] ⋅ 4H2O[56],образующиеся принейтрализацииосновного карбоната меди(II) кислотой[(H3O)2][B10Cl10]:
Комплекс [Cu(H2O)6][B10Cl10] · 4H2O построен из октаэдров [Cu(H2O)6]2+, которые связаны сольватными молекулами воды в бесконечные цепи, между которыми расположены кластерные анионы бора.
Комплексы свинца(II). В [57] описан синтез комплексов свинца(II) с 2,2'-бипиридилом и 2,2'-бипиридиламином [Pb(Bipy)3]B10Cl10] и [Pb(Py2NH)2]B10Cl10]. Соединения были синтезированы при взаимодействии соли клозо-декаборатного аниона, нитрата свинца и лиганда L (L = Bipy, BPA) согласно схеме:
Согласно данным ИК-спектроскопии, лиганды образуют внутреннюю координационную сферу атома свинца(II).
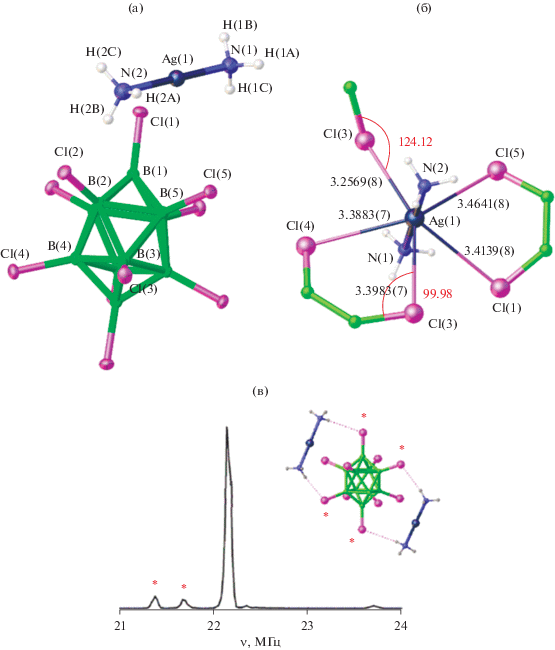
Комплексы серебра(I). В [47] изучены реакции комплексообразования серебра(I) в присутствии аммиака и получен комплекс серебра [Ag(NH3)2]2- [B10Cl10], в котором атом металла координирует две молекулы аммиака, а анион [В10Cl10]2– расположен во внешней сфере. Для получения соединения к водному раствору (Et3NH)2[B10Cl10] и AgNO3 добавляли водный раствор NH3 ∙ H2O:
Из реакционного раствора выпадали крупные игольчатые кристаллы соединения [Ag(NH3)2]2- [B10Cl10]. Согласно данным РСА (рис. 20а, 20б), катион [Ag(NH3)2]+ практически линейный, угол NAgN составляет 178.9°. Расстояния Ag–Cl в структуре находятся в интервале 3.257–3.464 Å. Изучение данных РСА показывает, что для каждого атома хлора можно предполагать наличие специфических взаимодействий N–H…Cl (<2.95 Å) и Ag…Cl (<3.5 Å). Между тем в спектре ЯКР 35Cl (рис. 20в) присутствуют всего три сигнала, что указывает на малое число специфических взаимодействий, вносящих вклад в градиент атома хлора.
Рис. 20.
Строение [Ag(NH3)2]2[B10Cl10]: независимая ячейка (а); окружение атома серебра(I) в структуре (б), спектр ЯКР 35Cl при 19 K (в). Значок * показывает контакты, которые отражаются в 35Cl ЯКР-спектре.
При проведении реакций комплексообразования серебра(I) в присутствии трифенилфосфина (Ph3P) установлено, что строение катионного комплекса серебра зависит от природы исходных реагентов и их соотношения Ag : Ph3P. Соединение [Ag2(Ph3P)3(H2O)][B10Cl10] · 2DMF образуется при взаимодействии K2[B10Cl10] и предварительно полученного комплекса серебра(I) [Ag(Ph3P)3NO3] в H2O–DMF. В этом соединении атом серебра координирует три молекулы трифенилфосфина и молекулу воды (рис. 21а) [58]:
Рис. 21.
Строение комплексов серебра(I): [Ag(PPh3)2(DMF)2]2[B10Cl10] · 2DMF (а); [Ag2(Ph3P)3(H2O)][B10Cl10] · · 2DMF (б).
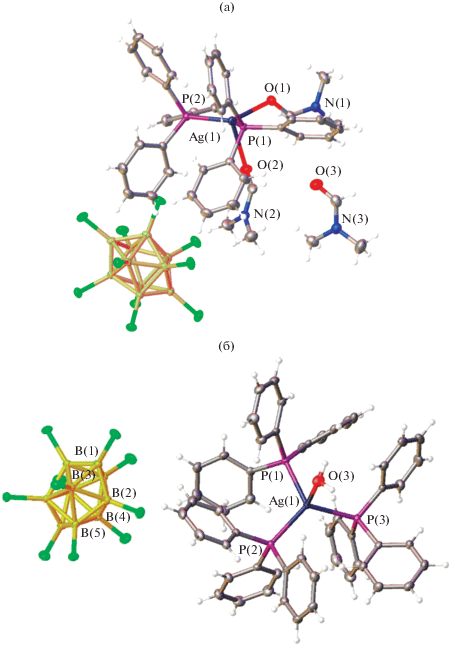
В случае использования в качестве исходных реагентов нитрата серебра(I) и свободного лиганда Ph3P и при соотношении реагентов Ag : Ph3P = = 1 : 2 из реакционного раствора был выделен комплекс [Ag(PPh3)2(DMF)2]2[B10Cl10] · 2DMF (рис. 21б) [58]:
Анализируя полученные результаты, авторы [58] полагают, что формирование конечного координационного полиэдра металла определяется координационным окружением металла в растворе с последующим взаимозамещением лигандов.
Комплексы урана(IV). В [59, 60] изучены аквакомплексы уранила [UO2(H2O)6][B10Cl10]. Установлено, что внутреннюю сферу уранила образуют молекулы воды, а борные кластеры [В10Cl10]2– находятся во внешней сфере и не взаимодействуют с уранильной группой. Авторами [61] описан синтез и строение аналогичного комплекса с диметилсульфоксидом состава [UO2(DMSO)6][B10Cl10].
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ С КООРДИНИРОВАННЫМ ДЕКАХЛОР-клозо-ДЕКАБОРАТНЫМ АНИОНОМ
Учитывая результаты, описанные выше, очевидно, что проведение реакций комплексообразования металлов с анионом [B10Cl10]2– в присутствии конкурентоспособных лигандов L приводит, как правило, к образованию соединений с комплексными катионами, в которых перхлорированным анионам отводится лишь роль противоиона. Между тем в литературе известны примеры комплексов серебра(I) с координированным перхлорированным клозо-додекаборатным анионом [B12Cl12]2– [62, 63] и галогенированными карборанами [64–69].
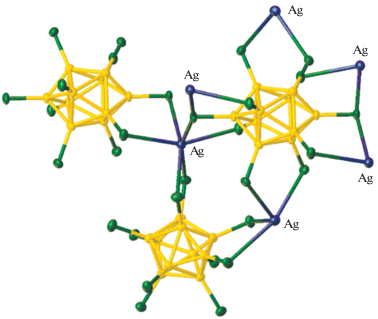
Проведение реакции комплексообразования в отсутствии конкурирующих лигандов показало возможность получения соединений с координированным анионом [B10Cl10]2–. В [58] описаны синтез и строение полимерного комплекса [Ag2[B10Cl10]]n. Соединение образуется в водном растворе согласно схеме при взаимодействии соответствующих солей:
Методом РСА определено его строение. В комплексе катион металла координирует три кластерных аниона с образованием пятичленных колец Cl–B–B–Cl–Ag; координационный полиэдр атома серебра(I) – октаэдр AgCl6, расстояния Ag–Cl составляют 2.706(1)–2.893(1) Å. В свою очередь, каждый кластерный анион окружен шестью монокатионами. Четыре из них координируют один апикальный и один экваториальный атомы хлора, а два атома серебра взаимодействуют с двумя экваториальными атомами хлора (рис. 22). В результате перечисленных выше взаимодействий формируется координационный полимер.
При проведении аналогичной реакции в ацетонитриле установлена возможность синтеза смешанолигандного комплекса полимерного строения, в котором атом серебра(I) координирует кластерные анионы бора и молекулы растворителя.
В данной реакции при сливании реагентов мгновенно образуется нитрат калия, который практически количественно выводится из реакционного раствора. Таким образом, в реакционном растворе остаются только катионы серебра, кластерные анионы бора и молекулы растворителя, а изотермическое упаривание раствора приводит к селективному выделению полимерного комплекса [Ag2(CH3CN)2[B10Cl10]]n [58]. Согласно данным РСА, атом серебра(I) координирует две молекулы растворителя и два аниона [B10Cl10]2– с образованием координационного полиэдра AgN2Cl4. Каждый анион [B10Cl10]2–координирован четырьмя атомами металла; в результате образуется трехмерная каркасная структура (рис. 23).
Проведение аналогичной реакции в диметилформамиде приводит к получению полимерного соединения [Ag2[B10Cl10](DMF)2]n (рис. 24) [58]:
Соединение [Ag2[B10Cl10](DMF)2]n представляет собой координационный полимер, построенный из анионов [B10Cl10]2−, атомов серебра(I)и координированных молекул DMF (рис. 24).Два атома серебра(I) стянуты молекулами DMF,расстояние Ag–Ag в кристалле составляет3.202Å, длины связей Ag−B находятся в пределах 2.636−2.828 Å. Соединение было изучено методом КР-спектроскопии. Согласно полученным данным, можно предположить о наличии в комплексе связи Ag–Ag [58].
СОЕДИНЕНИЯ С ПЕРХЛОРИРОВАННЫМ АНИОНОМ И ЗАМЕСТИТЕЛЯМИ [B10Hal9R]2–
В последнее время активно изучается метод синтеза нового класса соединений, содержащих перхлорированный клозо-декаборатный анион с введенным заместителем R. Для их получения замещенные производные декагидро-клозо-декаборатного аниона [B10H9R]–, содержащие экзополиэдрическую функциональную группу R, хлорируют, что приводит к замещению всех атомов водорода на атомы галогенов с образованием производных [B10Hal9R]–.
Так, при хлорировании аминозамещенного клозо-декаборатного аниона получен нонахлор-клозо-2-аминодекаборатный анион [70]:
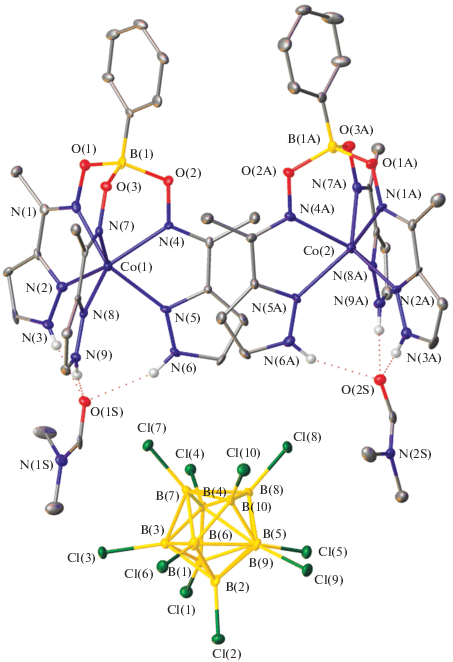
Отметим, что проведение данной реакции в воде приводит к протеканию ряда побочных процессов. При температуре выше 200°С происходит деградация борного кластера; хлорирование при комнатной температуре приводит к получению целого ряда продуктов с различной степенью замещения, содержащих до восьми атомов хлора; более того, обнаружены замещенные производные, содержащие атомы галогена и гидроксогруппы в качестве заместителей. Наилучший способ проведения данной реакции − медленное нагревание суспензии (Me4N)[2-NH3–B10H9] в дихлорэтане в избытке хлора при температуре от –78 до 80°С в течении недели. Строение конечного соединения представлено на рис. 25.
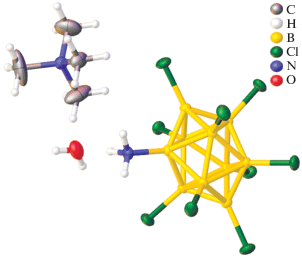
Хлорирование аниона [B10H9S((CH2)3N(CO)2C6H4)2]– с использованием SO2Cl2 привело к синтезу соединения (Bu4N)[B10Cl9S((CH2)3N(CO)2C6H4)2], строение которого представлено на рис. 26 [71]. В структуре соединения кластерные анионы обращены друг к другу экзополиэдрическими заместителями, а анионы [B10Cl9]– расположены между катионами Bu4N+. Расстояние B–S составляет 1.890(3) Å.
В заключении отметим, что замещенные производные кластерных анионов бора можно фактически рассматривать как кластер металла, который присоединяет к себе “лиганд” – молекулы заместителей. Такую точку зрения высказывал А.А. Пасынский, который много лет работал в ИНЭОС РАН и ИОНХ РАН и всегда проявлял интерес к работам, связанным с химией кластерных анионов бора, и призывал находить аналогии в химическом поведении соединений разных классов [72].
Анализируя литературные данные, описанные в настоящей работе, можно сделать следующие выводы.
1. Для большинства соединений, содержащих перхлорированный анион [B10Cl10]2–, можно ожидать наличие вторичных взаимодействий Cl…X (X = N, C, O) с молекулами растворителей, органическими лигандами и/или органическими катионами. Образование данного вида взаимодействий может быть идентифицировано совокупностью методов спектроскопии ЯКР 35Cl и рентгеноструктурного анализа.
2. В комплексных соединениях металлов М(II) (Fe(II), Co(II), Ni(II), Mn(II), Cu(II)) в присутствии органических и неорганических лигандов L перхлорированные кластерные анионы бора [B10Cl10]2– образуют внешнюю сферу и не участвуют в образовании координационных связей с металлом. В этих соединениях атомы металла координируют лиганды L или молекулы растворителя.
3. Состав и строение соединений с анионом [B10Cl10]2– зависит от стабильности катионных комплексов металлов в реакционном растворе. Для М(II) при трехкратном избытке лигандов L (Bipy, Phen) получены трис-хелатные комплексы [ML3][B10Cl10]. Для марганца(II) и кобальта(II) обнаружено, что снижение содержания лиганда L по отношению к металлу приводит к образованию биядерных комплексов [M2L4Cl2][B10Cl10].
4. В настоящее время известны первые примеры полимерных комплексов серебра с координированным анионом [B10Cl10]2–. Синтез подобных соединений может быть реализован при отсутствии конкурентоспособных объемных лигандов. Выделены и охарактеризованы комплексы [Ag2[B10Cl10]]n, [Ag2(CH3CN)2[B10Cl10]]n и [Ag2[B10Cl10](DMF)2]n, которые представляют собой координационные полимеры с трехмерной каркасной структурой.
5. Разработан метод синтеза нового класса соединений на основе пергалогенированного 10-вершинного кластера, которые содержат замещенный клозо-декаборатный анион с девятью атомами хлора и введенной функциональной группой [B10Cl9R]–. Полученные соединения предоставляют новые возможности для изучения химического поведения галогенированных анионов и особенностей строения полученных соединений (участие в невалентных взаимодействиях, координационную способность и т.д.).
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Muetterties E.L., Knoth W.H. Polyhedral Boranes. N.Y.: Dekker, 1968.
Greenwood N.N., Earnshaw A. Chemistry of the Elements, Butterworth-Heinemann, 1997.
Boron Science: New Technologies and Applications / Ed. Hosmane N.S. CRC Press, 2012.
Bruce King R. // Chem. Rev. 2001. V. 101. № 5. P. 1119. https://doi.org/10.1021/cr000442t
Chen Z., King R.B. // Chem. Rev. 2005. V. 105. P. 3613. https://doi.org/10.1021/cr0300892
Кузнецов Н.Т., Ионов С.П., Солнцев К.А. Развитие концепции ароматичности: полиэдрические структуры. М.: Наука, 2009. 488 с.
Sivaev I.B. // Chem. Heterocycl. Comp. 2017. V. 53. P. 638. https://doi.org/10.1007/s10593-017-2106-9
Knoth W.H. Polyamides and Polyesters of Polyhedral Boron Compounds. Pat. USA. № 3354121.
Скачкова В.К., Грачев А.В., Гоева Л.В. и др. Пат. RU 2550156 C1 (10.05.2015).
Goswami L.N., Ma L., Chakravarty Sh. et al. // Inorg. Chem. 2013. V. 52. P. 1694. https://doi.org/10.1021/ic3017613
Plesek J. // Chem. Rev. 1992. V. 92. P. 269. https://doi.org/10.1021/cr00010a005
Sivaev I.B., Bregadze V.I., Kuznetsov N.T. // Russ. Chem. Bull. 2002. V. 51. P. 1362. https://doi.org/10.1023/A:1020942418765
Sivaev I.B., Bregadze V.I. // Eur. J. Inorg. Chem. 2009. P. 1433. https://doi.org/10.1002/ejic.200900003
Teixidor F., Viñas C., Demonceau A., Núñez R. // Pure Appl. Chem. 2003. V. 75. P. 1305. https://doi.org/10.1351/pac200375091305
Kuznetsov N.T. // Russ. J. Inorg. Chem. 2002. V. 47. Suppl. 1. P. 68.
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Sivaev I.B., Prikaznov A.V., Naoufal D. // Coll. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czech. Chem. Commun. 2002. V. 67. P. 679. https://doi.org/10.1135/cccc20020679
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystals. 2016. P. 6. Article number 60. https://doi.org/10.3390/cryst6050060
Malinina E.A., Avdeeva V.V., Goeva LV. et al. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2148. https://doi.org/10.1134/S0036023610140032
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1673. https://doi.org/10.1134/S0036023617130022
Авдеева В.В., Малинина Е.А., Жижин К.Ю. и др. // Журн. неорган. химии. 2020. Т. 65. № 4. С. 495 (Avdeeva V.V., Malinina E.A., Zhizhin K.Yu. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 514). https://doi.org/10.1134/S0036023620040026
Авдеева В.В., Малинина Е.А., Жижин К.Ю. и др. // Журн. структ. химии. 2019. Т. 60. № 5. С. 726 (Avdeeva V.V., Malinina E.A., Zhizhin K.Yu. et al. // J. Struct. Chem. 2019. V. 60. P. 692). https://doi.org/10.1134/S0022476619050020
Авдеева В.В., Малинина Е.А., Кузнецов Н.Т. // Журн. неорган. химии. 2020. Т. 64. № 3. С. 334 (Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. P. 335). https://doi.org/10.1134/S003602362003002X
Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. P. 955. https://doi.org/10.1134/S003602361908014X
Knoth W.H., Miller H.C., Sauer J.C. et al. // Inorg. Chem. 1964. V. 3. P. 159.
Johnson J.W., Brody J.F. // J. Electrochem. Soc. 1982. V. 129. P. 2213.
Preetz W., Srebny H.-G., Marsmann H.C. // Z. Naturforsch. B. 1984. V. 39. P. 6.
Preetz W., Nachtigal C. // Z. Anorg. Allg. Chem. 1995. V. 621. P. 1632.
Scarbrough F.E., Lipscomb W.N. // Inorg. Chem. 1972. V. 11. P. 369.
Дроздова В.В., Лисовский М.В., Полякова И.Н. и др. // Журн. неорган. химии. 2006. Т. 51. № 10. С. 1651 (Drozdova V.V., Lisovskii M.V., Polyakova I.N. et al. // Russ. J. Inorg. Chem. 2006. V. 51. P. 1552). https://doi.org/10.1134/S003602360610007X
Дроздова В.В., Жижин К.Ю., Малинина Е.А. // Журн. неорган. химии. 2007. Т. 52. № 7. С. 1072 (Drozdova, V.V., Zhizhin, K.Yu., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2007. V. 52. P. 996). https://doi.org/10.1134/S0036023607070042
Muetterties E.L., Merrifield R.E., Miller H.C. et al. // J. Am. Chem. Soc. 1962. V. 84. P. 2506.
Leites L.A. // Chem. Rev. 1992. V. 92. P. 279.
Huang Y., Butler I.S. // Inorg. Chim. Acta. 1992. V. 192. P. 5.
Warneke J., Konieczka S.Z., Hou G.-L. et al. // Phys. Chem. Chem. Phys. 2019. V. 21. P. 5903.
Buslaev Yu.A., Kravchenko E.A., Kolditz L. // Coord. Chem. Rev. 1987. V. 82. P. 9.
Kravchenko E.A., Gippius A.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. P. 546. https://doi.org/10.1134/S0036023620040105
Einholz W., Vaas K., Wieloch C. et al. // Z. Anorg. Allg. Chem. 2002. V. 628. P. 258.
Bowden W. // J. Electrochem. Soc. 1982. V. 129. P. 1249.
Кузнецов Н.Т., Земскова Л.А. // Журн. неорган. химии. 1982. Т. 27. С. 1320.
Rupich M.W., Foos J.S., Brummer S.B. // J. Electrochem. Soc. 1985. V. 132. P. 119.
Kravchenko E.A., Gippius A.A., Polyakova I.N. et al. // Z. Anorg. Allg. Chem. 2017. V. 643. P. 1939. https://doi.org/10.1002/zaac.201700293
Avdeeva V.V., Polyakova I.N., Malinina E.A. et al. // Inorg. Chim. Acta. 2015. V. 428. P. 154. https://doi.org/10.1016/j.ica.2014.12.029
Kravchenko E.A., Gippius A.A., Vologzhanina A.V. et al. // Polyhedron. 2016. V. 117. P. 561. https://doi.org/10.1016/j.poly.2016.06.016
Kravchenko E.A., Gippius A.A., Vologzhanina A.V. et al. // Polyhedron. 2017. V. 138. P. 140. https://doi.org/10.1016/j.poly.2017.09.022
Kravchenko E.A., Gippius A.A., Korlyukov A.A. et al. // Inorg. Chim. Acta. 2016 V. 447. P. 22. https://doi.org/10.1016/j.ica.2016.03.025
Nieuwenhuyzen M., Seddon K.R., Teixidor F. et al. // Inorg. Chem. 2009. V. 48. P. 889.
Шакирова О.Г., Далецкий В.А, Лавренова Л.Г. и др. // Журн. неорган. химии. 2013. V. 58. P. 739.
Avdeeva V.V., Vologzhanina A.V., Ugolkova E.A. et al. // J. Solid State Chem. 2020. V. 296. P. 121989. https://doi.org/10.1016/j.jssc.2021.121989
Belov A.S., Voloshin Y.Z., Pavlov A.A. et al. // Inorg. Chem. 2020. V. 59. P. 5845. https://doi.org/10.1021/acs.inorgchem.9b03335
Авдеева В.В., Вологжанина А.В., Малинина Е.А. и др. // Коорд. химия. 2019. Т. 45. № 4. С. 242 (Avdeeva V.V., Vologzhanina A.V., Malinina E.A. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 4. P. 295). https://doi.org/10.1134/S1070328420050024
Kravchenko E.A., Gippius A.A., Vologzhanina A.V. et al. // Polyhedron. 2017. V. 127. P. 238. https://doi.org/10.1016/j.poly.2017.02.015
Avdeeva V.V., Kravchenko E.A., Gippius A.A. et al. // Inorg. Chim. Acta. 2019. V. 487. P. 208. https://doi.org/10.1016/j.ica.2018.12.008
Kleeberg F.M., Schleid T. // Z. Kristallogr. 2017. Suppl. 37. P. 107.
Bareiß K., Schleid T. // Z. Kristallogr. 2019. Suppl. 39. P. 87.
Орлова А.М., Гоева Л.В., Солнцев К.А., Кузнецов Н.Т. // Журн. неорган. химии. 1996. V. 41. P. 796 (Orlova A.M., Goeva L.V., Solntsev K.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 1996. V. 41. P. 769).
Avdeeva V.V., Buzanov G.A., Malinina E.A. et al. // Crystals. 2020. V. 10. P. 389. https://doi.org/10.3390/cryst10050389
Кузнецов Н.Т., Земскова Л.А., Гоева Л.В. // Коорд. химия. 1981. Т. 7. № 2. С. 232.
Кузнецов H.T., Земскова Л.A., Ипполитов E.Г. // Журн. неорган. химии. 1981. Т. 26. № 7. С. 1862.
Кузнецов Н.Т., Земскова Л.А. // Журн. неорган. химии. 1982. Т. 27. № 5. С. 1320.
Tiritiris I., Schleid T. // Z. Anorg. Allg. Chem. 2003. V. 629. P. 581. https://doi.org/10.1002/zaac.200390095
Sivaev I.B., Bregadze V.I. // Handbook of Boron Science with Applications in Organometallics, Catalysis, Materials and Medicine. V. 1 / Eds. Hosmane N.S., Eagling R. World Scientific, 2019. P. 147.
Saleh M., Powell D.R., Wehmschulte R.J. // Inorg. Chem. 2016. V. 55. P. 10617. https://doi.org/10.1021/acs.inorgchem.6b01867
Hague C., Patmore N.J., Frost C.G. et al. // Chem. Commun. 2001. V. 21. P. 2286. https://doi.org/10.1039/B106719B
Patmore N.J., Ingleson M.J., Mahon M.F. et al. // Dalton Trans. 2003. V. 14. P. 2894. https://doi.org/10.1039/B303537A
Cunha-Silva L., Carr M.J., Kennedy J.D., Hardie M.J. // Cryst. Growth Des. 2013. V. 13. P. 3162. https://doi.org/10.1021/cg4005328
Jenne C., Wegener B. // Z. Anorg. Allg. Chem. 2018. V. 644. P. 1123. https://doi.org/10.1002/zaac.201800358
Tsang C.-W., Yang Q., Sze E.T.-P. et al. // Inorg. Chem. 2000. V. 39. P. 5851. https://doi.org/10.1021/ic000354r
Anwar S.El, Holub J., Tok O. et al. // J. Organomet. Chem. 2018. 865. P. 89.
Kubasov A.S., Turishev E.S., Golubev A.V. et al. // Inorg. Chim. Acta. 2020. V. 507. P. 119589. https://doi.org/10.1016/j.ica.2020.119589
Сиваев И.Б. // Журн. неорган. химии. 2020. Т. 65. № 12. С. 1643 (Sivaev I.B. // Russ. J. Inorg. Chem. 2020. V. 65. № 12. P. 1854). https://doi.org/10.1134/S0036023620120165
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия