Координационная химия, 2021, T. 47, № 8, стр. 516-520
Особенности координации катионов [Ni(Еn)2]2+ к кластерному аниону [{Re4(µ3-CCN)4}(CN)12]8–
А. С. Пронин 1, А. И. Смоленцев 1, Ю. В. Миронов 1, *
1 Институт неорганической химии им. А.В. Николаева СО РАН
г. Новосибирск, Россия
* E-mail: yuri@niic.nsc.ru
Поступила в редакцию 25.01.2021
После доработки 15.02.2021
Принята к публикации 18.02.2021
Аннотация
Высокотемпературной реакцией ReI3 с KCN и последующей перекристаллизацией из водного раствора при добавлении Me4NI получен кластерный комплекс (Me4N)K7[{Re4(µ3-CCN)4}(CN)12] · 10H2O (I). Анион комплекса I содержит лиганды µ3-CCN3–, стабилизирующиеся за счет координации к треугольным граням тетраэдрического металлокластера {Re4}. На примере [Ni(Еn)2]2+ показано, что лиганды µ3-CCN3– амбидентатны и могут взаимодействовать с катионами переходных металлов аналогично концевым CN-группам, что приводит к образованию координационного полимера [Ni(En)2(NH3)2][{Ni(En)2}3{Re4(µ3-CCN)4}(CN)12] · 7.5H2O (II). Строение комплексов I и II установлено методом РСА (CIF files ССDС № 2057450 (I) и 2057451 (II)).
Кластерные соединения переходных металлов 5–7 групп, благодаря их структурному разнообразию и проявляемым физико-химическим свойствам, изучаются уже в течение нескольких десятилетий. Среди наиболее интересных свойств этих соединений можно выделить яркую люминесценцию в красной и ближней инфракрасной областях [1–3] и обратимые окислительно-восстановительные превращения [4, 5]. Интересной и менее изученной областью является использование кластерных комплексов молибдена, вольфрама и рения в качестве строительных блоков для синтеза функциональных координационных полимеров [6–8]. Высокая симметрия и большой объем кластерных комплексов делают их удобными для конструирования кристаллических координационных полимеров и металлоорганических каркасов, в то время как спектроскопические и окислительно-восстановительные характеристики кластеров могут использоваться для придания желаемых свойств получаемому продукту [5]. Свойства кластерных соединений определяются как составом, так и геометрией кластерного ядра, поэтому поиск методов синтеза новых кластерных комплексов остается актуальной задачей.
В течение последних нескольких лет мы изучали образование кластерных фаз при взаимодействии оксидов и иодидов молибдена, вольфрама и рения с неорганическими цианидами при температурах от 350 до 550°С [9–15]. Характерной особенностью этих реакций является их протекание при температурах ниже температур плавления соответствующих цианидов. Мы показали, что использование оксидов и иодидов в качестве исходных соединений при относительно невысоких температурах синтеза приводит к возможности получения соединений с новыми типами кластерных ядер и/или необычными внутренними лигандами. В качестве примеров можно привести битетраэдрические комплексы вольфрама с лигандами µ3-CCN3– [15] или тетраэдрические комплексы рения с лигандами µ3-PO3–, µ3-${\text{PO}}_{2}^{{3 - }},$ µ3-As3– и µ3-AsO3– [9, 16].
В настоящей работе в продолжение наших исследований по получению кластерных комплексов рения исходя из ReI3 мы сообщаем о синтезе и строении нового тетраэдрического кластера (Me4N)K7[{Re4(µ3-CCN)4}(CN)12] · 10H2O (I). Данный комплекс был получен реакцией между ReI3 с избытком KCN при температуре 480°С и последующей перекристаллизацией из воды при добавлении Me4NI. Дальнейшее взаимодействие соединения I с [Ni(En)2]Cl2 (En = этилендиамин) в концентрированном аммиаке привела к образованию координационного полимера составa [Ni(En)2- (NH3)2][{Ni(Еn)2}3{Re4(µ3-CCN)4}(CN)12] · 7.5H2O (II). В данном соединении лиганды CCN3– проявляют амбидентатный характер и участвуют в образовании каркаса полимера.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ReI3 получали по известной методике [17]. Другие реагенты и растворители использовали в виде коммерчески доступных реактивов без дополнительной очистки. Соотношение тяжелых элементов определяли методом энергодисперсионного элементного анализа (EDS) с помощью настольного сканирующего микроскопа Hitachi TM3000 TableTop SEM на оборудовании Bruker QUANTAX 70 EDS. Элементный анализ выполняли на приборе Euro-Vector EA3000 Elemental Analyzer. ИК-спектры в диапазоне 4000–400 см–1 записывали для образцов, приготовленных в виде таблеток с бромидом калия, на спектрометре Bruker Vertex 80.
Синтез (Me4N)K7[{Re4(µ3-CCN)4}(CN)12] · 10H2O (I). Смесь ReI3 (0.300 г, 0.53 ммоль) и цианида калия (0.345 г, 5.30 ммоль) тщательно перетирали в ступке, помещали в кварцевую ампулу, которую вакуумировали и запаивали. Ампулу нагревали до 480°С за 4 ч, выдерживали при этой температуре в течение 72 ч, затем охлаждали со скоростью 50°С/ч. Осторожно! При открытии ампулы возможно выделение высокотоксичного дициана. Продукты реакции растворяли в воде, кипятили и отфильтровывали. К раствору добавляли 0.200 г Me4NI, упаривали до объема 3 мл и охлаждали до комнатной температуры. Целевой продукт в виде красных кристаллов, пригодных для РСА, выделяли путем диффузии паров MeOH в полученный водный раствор. Выход I 0.078 г (34%).
EDS: K : Re = 6.8 : 4.0. ИК-спектр (ν, см–1): 1616 δ(OH), 2130, 2086, 2065 ν(CN), 3432 ν(OH).
Синтез [Ni(En)2(NH3)2][{Ni(En)2}3{Re4(µ3-CCN)4}- (CN)12] · 7.5H2O (II). Раствор [Ni(En)2]Cl2 (0.015 г, 0.06 ммоль) в 30%-ном водном растворе аммиака (5 мл) осторожно наслаивали в стеклянной пробирке на раствор (Me4N)K7[{Re4(µ3-CCN)4}- (CN)12] · 10H2O (0.020 г, 0.012 ммоль) в 5 мл H2O. Через неделю образовавшиеся темно-красные кристаллы отфильтровывали и высушивали на бумажном фильтре. Выход II 0.022 г (87%).
EDS: Ni : Re = 4.1 : 4.0. ИК-спектр (ν, см–1): 1618 δ(OH), 2132, 2098, 2074 ν(CN), 2800–3000 ν(CH), 3312, 3261 ν(NH), 3454 ν(OH).
РСА I и II проведен на автодифрактометре Bruker-Nonius X8 Apex с использованием излучения MoKα (λ = 0.71073 Å) с графитовым монохроматором. Поглощение учтено полуэмпирически по интенсивностям эквивалентных рефлексов (SADABS) [18]. Структура расшифрована прямым методом и уточнена полноматричным МНК по F 2 в анизотропном приближении для неводородных атомов (SHELXL) [19]. Атомы водорода лигандов NH3 и Еn в II локализованы геометрически. Атомы водорода сольватных молекул воды не локализованы. Рисунки выполнены в программе DIAMOND [20]. Основные кристаллографические данные и параметры уточнения структур I и II представлены в табл. 1.
Таблица 1.
Кристаллографические данные и параметры уточнения структур I и II
| Параметр | Значение | |
|---|---|---|
| I | II | |
| Брутто-формула | C24H32N17O10K7Re4 | C36H86N34O7.5Ni4Re4 |
| М | 1737.16 | 2103.02 |
| Сингония | Кубическая | Моноклинная |
| Пр. гр. | F-43m | P21/c |
| a, Å | 16.9835(9) | 14.7439(3) |
| b, Å | 16.9835(9) | 20.5652(4) |
| c, Å | 16.9835(9) | 22.7708(5) |
| α , град | 90 | 90 |
| β, град | 90 | 90.3290(10) |
| γ, град | 90 | 90 |
| V, Å3 | 4898.7(8) | 6904.2(2) |
| Z | 4 | 4 |
| ρ(выч.), г/см3 | 2.355 | 2.023 |
| μ, мм–1 | 10.509 | 8.112 |
| F(000) | 3232 | 3720 |
| Размеры кристалла, мм | 0.08 × 0.08 × 0.08 | 0.28 × 0.26× 0.10 |
| Интервалы индексов h, k, l | –19 ≤ h ≤ 19, –22 ≤ k ≤ 22, –22 ≤ l ≤ 22 |
–15 ≤ h ≤ 19, –26 ≤ k ≤ 18, –29 ≤ l ≤ 29 |
| Измерено отражений | 6080 | 44 052 |
| Независимых отражений | 615 | 15 796 |
| Rint | 0.0521 | 0.0262 |
| Отражений с I > 2σ(I) | 586 | 14 224 |
| R1, wR2 (I >2σ(I)) | 0.0316, 0.0816 | 0.0329, 0.0795 |
| R1, wR2 (все отражения) | 0.0337, 0.0827 | 0.0390, 0.0815 |
| Δρmin/Δρmax, e Å–3 | –0.743/1.019 | –1.264/2.815 |
Координаты атомов и другие параметры структур депонированы в Кембриджском банке структурных данных (CCDC № 2057450 (I) и 2057451 (II); deposit@ccdc.cam.ac.uk или http:// www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Недавно было показано, что ReI3 является перспективным прекурсором для синтеза новых кластеров рения при температурах, при которых другие исходные соединения остаются инертными. Так, реакция ReI3 с KCN при 480°C приводит к образованию комплекса K8[{Re4(µ3-CCN)4}- (CN)12] · 5H2O · KCN [9]. Соединение стабильно на воздухе и демонстрирует отличную растворимость в H2O, однако попытки растворить полученный комплекс в других доступных растворителях оказались безуспешными.
Надеясь перейти от водных растворов к органическим, в данной работе мы попытались получить соль с органическим катионом, добавив в систему Me4NI. Получив монокристаллы и определив кристаллическую структуру методом РСА, было установлено, что в случае использования Me4NI продуктом является комплекс (Me4N)K7[{Re4(µ3-CCN)4}(CN)12] · 10H2O (I) (это подтверждается данными элементного анализа). Как и калиевая соль, соединение I оказалось растворимо только в воде.
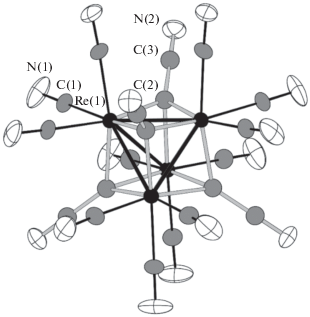
Согласно структурным данным, соединение I кристаллизуется в кубической сингонии, пр. гр. F-43m, Z = 4. Кристаллическая структура I включает в себя кластерный анион [{Re4(µ3-CCN)4}- (CN)12]8– (рис. 1), семь катионов K+, один катион Me4N+ и деcять молекул некоординированной воды. Строение аниона в I наиболее близко напоминает строение тетраэдрических халькоцианидных комплексов [{Re4Q4}(CN)12]n– (Q = S2–, Se2–, Te2–) [21–23] и недавно полученных пниктоген-содержащих представителей цианокластерных комплексов типа [{Re4X4}(CN)12]n– (X = PO3–, ${\text{PO}}_{2}^{{3 - }},$ As3–, AsO3–) [9, 10, 16]. Это типичный 12-электронный кластерный комплекс, имеющий шесть двухэлектронных связей метал–метал, однако длина связи Re–Re (2.6837(14) Å) заметно сокращена (~0.05–0.20 Å) по сравнению со значениями, наблюдаемыми в вышеупомянутых соединениях. К каждой грани тетраэдра Re4 координирован тригонально-пирамидальным образом μ3-мостиковый лиганд CCN3– с расстоянием Re–CCCN 2.07(2) Å. Геометрические параметры лигандов µ3-CCN3– хорошо соответствуют тем, о которых сообщалось ранее [13, 15, 24, 25]: длины связей C–C и C–N составляют 1.47(5) и 1.13(4) Å соответственно.
Рис. 1.
Строение кластерного аниона [Re4(CCN)4-(CN)12]8–. Приведены тепловые эллипсоиды 30%-ной вероятности.
Одним из интересных свойств аниона [{Re4(µ3-CCN)4}(CN)12]8– является амбидентатный характер лигандов CCN3– и их участие в образовании каркаса координационного полимера [Cu(En)2]- [Cu(En)(NH3)2]3[{Re4(µ3-CCN)4}(CN)12] · 5H2O [13]. В данной работе мы продолжили изучение возможности использования аниона [{Re4(µ3-CCN)4}(CN)12]8– в качестве строительного блока. Так, взаимодействие соединения I с [Ni(En)2]Cl2 в концентрированном аммиаке привела к образованию полимера составa [Ni(En)2(NH3)2][{Ni(En)2}3-{Re4(µ3-CCN)4}(CN)12] · 7.5H2O (II).
Соединение II кристаллизуется в моноклинной сингонии, пр. гр. P21/c, Z = 4. Геометрические параметры кластерного аниона аналогичны таковым в соединении I. В частности, длины связей Re–Re и Re–CCCN меняются в интервалах 2.6713(3)–2.6961(3) и 2.071(5)–2.104(5) Å, а C–C и C–N в лигандах CCN3– составляют 1.402(8)–1.417(8) и 1.162(9)–1.174(9) Å соответственно.
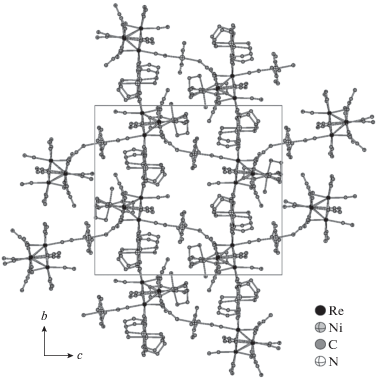
Катионная часть II включает четыре симметрически независимых иона никеля(II), один из которых имеет искаженное октаэдрическое строение и координирует по два линанда NH3 и En. Три других иона никеля(II) координируют только два лиганда En, что приводит к образованию плоско-квадратных комплексов [Ni(En)2]2+. Эти частицы участвуют в мостиковых взаимодействиях с пятью цианидными лигандами каждого аниона [Re4(CCN)4(CN)12]8– (pис. 2). При этом три из пяти мостиковых лигандов CN– принадлежат одному атому рения, а два – другому, в то время как лиганды CN– двух оставшихся атомов рения не участвуют в координации c катионом [Ni(Еn)2]2+. Длины мостиковых связей Ni–NCN (2.068(5)–2.098(5) Å) сопоставимы с длинами связей Ni–NNH3/Еn (2.075(7)–2.112(6) Å). Кроме того, один из лигандов CCN3– каждого аниона [Re4(CCN)4- (CN)12]8– образует контакт Re–CCN–Ni (Ni–NCCN 2.170(6) Å), что делает все центры Ni(II) шестикоординированными. Многочисленные мостиковые цианидные взаимодействия в II, а также водородные связи с участием лигандов NH3, En, CCN3–, CN– и сольватных молекул H2O приводят к образованию трехмерного каркаса, как показано на рис. 3.
Рис. 2.
Мостиковые взаимодействия катионов [Ni(En)2]2+ с лигандами CN– и CCN3– аниона [Re4(CCN)4(CN)12]8– в структуре II.
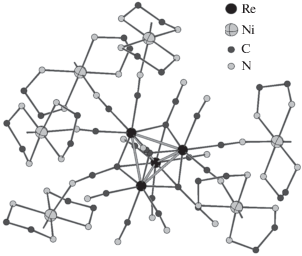
Рис. 3.
Упаковка катионов [Ni(Еn)2]2+ и анионов [Re4(CCN)4(CN)12]8– в структуре II вдоль кристаллографической оси а.
Таким образом, путем реакции между ReI3 с избытком KCN при температуре 480°С и последующей перекристаллизацией из воды при добавлении Me4NI был получен тетраэдрический кластерный комплекс рения (Me4N)K7[{Re4(µ3-CCN)4}(CN)12] · · 10H2O. Дальнейшая реакция полученного соединения с [Ni(En)2]Cl2 в концентрированном аммиаке привела к образованию координационного полимера составa [Ni(En)2(NH3)2][{Ni(En)2}3- {Re4(µ3-CCN)4}(CN)12] · 7.5H2O, в котором лиганды CCN3– проявляют амбидентатный характер и участвуют в образовании каркаса полимера. Кристаллические структуры полученных соединений были определены методом рентгеноструктурного анализа.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Sokolov M.N., Brylev K.A., Abramov P.A. et al. // Eur. J. Inorg. Chem. 2017. № 35. P. 4131.
Kirakci K., Fejfarova K., Kucerakova M. et al. // Chem. Rev. 2014. V. 2014. № 14. P. 2331.
Efremova O.A., Brylev K.A., Kozlova O. et al. // J. Mater. Chem. C. 2014. V. 2. № 40. P. 8630.
Fujii S., Horiguchi T., Akagi S. et al. // Inorg. Chem. 2016. V. 55. № 20. P. 10259.
Litvinova Y.M., Gayfulin Y.M., Kovalenko K.A. et al. // Inorg. Chem. 2018. V. 57. № 4. P. 2072.
Litvinova Y.M., Gayfulin Y.M., van Leusen J. et al. // Inorg. Chem. Front. 2019. V. 6. № 6. P. 1518.
Alexandrov E.V., Virovets A.V., Blatov V.A. et al. // Chem. Rev. 2015. V. 115. № 22. P. 12286.
Efremova O.A., Mironov Y.V., Fedorov V.E. // Eur. J. Inorg. Chem. 2006. № 13. P. 2533.
Pronin A.S., Smolentsev A.I., Kozlova S.G. et al. // Inorg. Chem. 2019. V. 58. № 11. P. 7368.
Pronin A.S., Gayfulin Y.M., Smolentsev A.I. et al. // J. Clust. Sci. 2019. V. 30. № 5. P. 1253.
Pronin A.S., Smolentsev A.I., Mironov Y.V. // Russ. Chem. Bull. 2019. V. 68. № 4. P. 777.
Пронин А.С., Яровой С.С., Смоленцев А.И., Миронов Ю.В. // Коорд. химия. 2019. Т. 45. № 2. С. 106 (Pronin A.S., Yarovoy S.S., Smolentsev A.I., Mironov Yu. V. // Russ. J. Coord. Chem. 2019. V. 45. № 2. P. 119). https://doi.org/10.1134/S1070328419020052
Pronin A.S., Gayfulin Y.M., Smolentsev A.I. et al. // Inorg. Chem. 2020. V. 59. № 14. P. 9710.
Pronin A.S., Smolentsev A.I., Mironov Y.V. // J. Struct. Chem. 2020. V. 61. № 1. P. 95.
Yarovoy S.S., Smolentsev A.I., Kozlova S.G. et al. // Chem. Commun. 2018. V. 54. № 98. P. 13837.
Pronin A.S., Smolentsev A.I., Mironov Y.V. // Russ. Chem. Bull. 2020. V. 69. № 11. P. 2129.
Malatesta L. // Inorg. Synth. 1963. V. 7. № 7. P. 185.
APEX2 (version 1.08), SADABS (version 2.11), SHELXTL (version 6.12). Madison (WI, USA): Bruker Advanced X-ray Solutions, 2004.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
DIAMOND (version 3.2a). Bonn (Germany): Crystal Impact GbR, 2010.
Mironov Y.V., Fedorov V.E. // Russ. Chem. Bull. 2002. V. 51. № 4. P. 569.
Mironov Y.V., Virovets A.V., Artemkina S.B. et al. // J. Struct. Chem. 1999. V. 40. № 2. P. 313.
Laing M., Kiernan P.M., Griffith W.P. // Chem. Commun. 1977. № 7. P. 221.
Jach F., Bruckner S.I., Ovchinnikov A. et al. // Angew. Chem. Int. Ed. 2017. V. 56. № 11. P. 2919.
Pei X.L., Yang Y., Lei Z. et al. // J. Am. Chem. Soc. 2013. V. 135. № 17. P. 6435.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


