Координационная химия, 2021, T. 47, № 8, стр. 484-488
Синтез, строение и термораспад гетерометаллических комплексов никеля с n-гетероциклическим карбеном
С. С. Шаповалов 1, *, О. Г. Тихонова 1, И. В. Скабицкий 1, С. Г. Сахаров 1, Н. П. Симоненко 1
1 Институт общей и неорганический химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: schss@yandex.ru
Поступила в редакцию 19.03.2021
После доработки 24.03.2021
Принята к публикации 25.03.2021
Аннотация
Полученный в реакции (η5-C5H5)Ni(SIMes)Cl c н-пропилмеркаптаном и NEt3 в CH2Cl2 тиолатный карбеновый комплекс никеля (η5-C5H5)Ni(SIMes)SnPr (I) (SIMes = 1,3-димезитилимидазол-2-илиден) образует при взаимодействии c W(CO)5(THF) гетерометаллический комплекс (η5-C5H5)Ni(SIMes)- (μ2-SnPr)W(CO)5 (II). Реакция I с (η5-С5H5)Mn(CO)2(THF) приводит к образованию соединения (η5-C5H5)Ni(SIMes)(μ2-SnPr)(η5-С5H5)Mn(CO)2 (III). Структуры I, II и III определены методом РСА (CIF files CCDC № 2024873–2024875 для комплексов I, III и II соответственно). По данным ТГА–ДСК, термораспад комплексов II и III происходит ступенчато в интервалах 101–500°С и 119–550°С, полного отщепления лигандов не наблюдается.
N-гетероциклические карбены (NHCs) на основе имидазол-2-илидена являются лигандами, обладающими одновременно сильными σ-донорными и слабыми π-акцепторными свойствами, что позволяет использовать их в качестве стабилизирующих лигандов в химии элементорганических соединений [1, 2]. Эти лиганды, с одной стороны, способны стабилизировать комплексы никеля в различных степенях окисления [3, 4], а с другой – за счет варьирования заместителей при атомах азота создавать достаточное экранирование металлоцентра, тем самым обеспечивая высокую каталитическую активность данного типа соединений. Ранее [5, 6] мы показали возможность получения гетерометаллических комплексов никеля с 1,3-диметилимидазол-2-илиденом (MeIm). В настоящей работе в качестве металлолигандов мы использовали тиолатный комплекс циклопентадиенилникеля c 1,3-димезитилимидазол-2-илиденом (SIMes) – (η5-C5H5)Ni(SIMes)SnPr (I) – для синтеза его гетерометаллических производных.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции, связанные с синтезом и выделением соединений, проводили в атмосфере аргона и в абсолютированных растворителях. Соединение (η5-C5H5)Ni(SIMes)Cl получали по методике [7]. Коммерческие никелоцен (99%, ООО Далхим), хлорид 1,3-бис(2,4,6-триметилфенил)имидазолия (95+%, ООО Далхим), W(CO)6 (97%, Sigma-Aldrich) использовали без дополнительной очистки. Триэтиламин (≥99.5%, Sigma-Aldrich) осушали над молекулярными ситами 3Е Sigma-Aldrich. УФ-облучение проводили с помощью лампы ДРЛ 250В без стеклянной колбы, покрытой люминофором. Химический анализ выполняли на ЕА3000 CHNS-анализаторе (Euro Vector). Для ИК-спектроскопии использовали ИК-Фурье-спектрометр Bruker Alpha с приставкой НПВО Platinum ATR. ЯМР спектры 1H (300.13 MГц) и 13C (75.4 MГц) NMR записывали на спектрометре Bruker AV 300, химические сдвиги приведены относительно тетраметилсилана. Синхронный (ТГ–ДСК) термический анализ (ТГ–ДСК = термогравиметрия–дифференциальная сканирующая калориметрия) полученных комплексов выполняли с использованием термоанализатора SDT Q-600; контролируемый нагрев производили в Al2O3-тиглях в интервале 20–600°С со скоростью 10°/мин в токе аргона (скорость потока 250 мл/мин); массу исходной навески варьировали в диапазоне 3.5–10.5 мг.
Синтез (η5-C5H5)Ni(SIMes)(SnPr) (I). К розовому раствору 0.301 г (0.649 ммоль) (η5-C5H5)Ni(SIMes)Cl в 15 мл толуола добавляли 0.1 мл (1.105 ммоль) н‑пропилмеркаптана и 0.12 мл (0.865 ммоль) триэтиламина. Реакционную смесь перемешивали в течение 48 ч. Полученный коричневый раствор отфильтровывали, растворители удаляли при пониженном давлении. Полученный коричневый масляный остаток кристаллизовали из гексана при температуре –24°С. Выход зелено-коричневых кристаллов 0.282 г (87%).
| Найдено, %: | C 69.32; | H 7.32; | N 5.47. |
| Для C29H36N2SNi (M = 503) | |||
| вычислено, %: | C 69.20; | H 7.21; | N 5.56. |
ИК (ν, см–1): 3170 сл, 3135 сл, 3102 сл, 3018 сл, 2951 ср.ш, 2913 ср.ш, 2862 сл, 2194 сл, 1718 сл.ш, 1651 сл, 1607 сл, 1548 сл, 1520 сл, 1483 ср.ш, 1459 ср.ш, 1396 с, 1372 ср, 1350 ср, 1322 с, 1281 сл, 1264 с, 1246 ср, 1218 ср, 1161 сл, 1113 сл, 1082 ср, 1054 ср, 1031 ср, 1015 с, 985 ср, 960 ср, 923 с, 890 ср, 848 с, 834 ср, 824 ср, 775 о.с, 741 ср, 725 о.с, 692 о.с, 645 ср, 593 ср, 575 ср, 501 сл, 452 сл, 430 ср. ЯМР 1H (C6D6; δ, м.д.): 1.01 (т., 3J = 7.11 Гц, 3H, Me, Pr), 1.53–1.77 (м., 4H, 2CH2, Pr), 2.15 (с., 6H, 2Me, Mes), 2.22 (с., 4Me, Mes), 4.92 (с., 5H, Cp), 6.17 (с., 2H, 2CH, Im), 6.85 (с., 4H, 2CH, Mes). ЯМР 13C{H} (C6D6; δ, м.д.): 15.0 (Me, Pr), 19.3 Me, Mes), 21.4 (Me, Mes), 28.8 (CH2, Pr), 34.9, (CH2, Pr), 91.7 (Ср), 123.8 (CH, Im), 129.6 (Mes), 136.6 (Mes), 138.0 (Mes), 139.0 (Mes), 174.8 (C, Im).
Синтез (η5-C5H5)Ni(SIMes)(μ2-SnPr)W(CO)5 (II). К розовому раствору 0.201 г (0.433 ммоль) (η5-C5H5)Ni(SIMes)Cl в 10 мл толуола добавляли 0.08 мл н-пропилмеркаптана и 0.09 мл триэтиламина. Реакционную смесь перемешивали в течение 48 ч. Полученный коричневый раствор отфильтровывали, растворители удаляли при пониженном давлении. К коричневому масляному остатку добавляли желтый раствор, полученный облучением ультрафиолетовой лампой 0.152 г W(CO)6 в 20 мл THF в течение 30 мин при водяном охлаждении. Растворитель удаляли при пониженном давлении, остаток экстрагировали кипящим гексаном. При выдерживании при –24°С в течение 18 ч образовались коричневые кристаллы, которые перекристаллизовывали из смеси толуол–гексан (1 : 1). Выход 0.179 г (49%).
ИК (ν, см–1): 2925 о.сл, 2057 о.сл, 1962 о.сл, 1904 о.с, 1874 ср, 1486 о.сл.ш, 1400 о.сл, 1377 о.сл, 1319 о.сл, 1266 о.сл.ш, 1034 о.сл.ш, 925 оч., 853 о.сл, 785 о.сл, 734 о.сл, 698 о.сл, 678 о.сл, 599 о.сл, 584 о.сл.ш. ЯМР 1H (C6D6; δ, м.д.): 0.70 (т., 3J = = 7.07 Гц, 3H, Me, Pr), 1.17–1.37 (м., 2H, CH2, Pr), 1.58–1.74 (м., 2H, CH2, Pr), 2.03 (с., 12H, 4Me, Mes), 2.13 (с., 6H, 2Me, Mes), 4.89 (с., 5H, Cp), 5.99 (с., 2H, 2CH, Im), 6.78 (с., 4H, CH, Mes). ЯМР 13C{H} (C6D6; δ, м.д.): 14.3 (Me, Pr), 19.1 Me, Mes), 21.4 (Me, Mes), 26.9 (CH2, Pr), 44.4 (CH2, Pr), 93.4 (Ср), 125.0 (CH, Im), 130.0 (Mes), 135.9 (Mes), 137.3 (Mes), 139.4 (Mes), 168.1 (C, Im), 201.1 (CO), 201.5 (CO).
| Найдено, %: | C 49.78; | H 5.43; | N 3.38. |
| Для C34H36N2O5SNiW (M = 827) | |||
| вычислено, %: | C 49.36; | H 4.39; | N 3.38. |
Синтез (η5-C5H5)Ni(SIMes)(μ2-SnPr)(η5-С5H5)Mn(CO)2 (III). К 0.12 г (0.24 ммоль) Cp (Mes2Im)SNiPr добавляли красный раствор, полученный облучением ультрафиолетовой лампой 0.06 г (0.24 ммоль) C5H5Mn(CO)3 в 15 мл THF в течение 50 мин при –40°С. Растворитель удаляли при пониженном давлении. Полученный темно-зеленый масляный остаток растирали с гексаном (30 мл), высушивали в вакууме и кристаллизовали из смеси толуол–гексан (1 : 1) при температуре ‒24°С в течение 18 ч. Выход темно-зеленых кристаллов 0.085 г (52%).
ИК (ν, см–1): 3129 о.сл.ш, 2958 сл.ш, 2919 о.сл.ш, 2866 о.сл, 1896 о.с, 1827 о.с.ш, 1608 о.сл, 1567 о.сл, 1485 сл.ш, 1461 сл.ш, 1422 сл, 1397 сл, 1375 сл, 1355 сл, 1318 ср, 1264 ср, 1224 сл, 1163 о.сл, 1112 о.сл, 1081 сл, 1013 сл.ш, 974 о.сл, 960 о.сл, 924 сл, 894 о.сл, 852 сл, 836 сл, 785 ср, 735 ср, 697 ср, 660 сл, 611 ср, 586 ср, 525 сл, 477 сл, 432 о.сл. ЯМР 1H (C6D6; δ, м.д.): 0.80 (т., 3J = 7.06 Гц, 3H, Me, Pr), 1.25 (м., 2H, CH2, Pr), 1.56 (м., 2H, CH2, Pr), 2.09 (с., 12H, Me, Mes), 2.17 (с., 6H, Me, Mes), 4.36 (с., 5H, Cp), 5.05 (с., 5H, Cp), 6.09 (с., 2H, 2CH, Mes2Im), 6.85 (с., 4H, CH, Mes). ЯМР 13C{H} (C6D6; δ, м.д.): 14.8 (Me, Pr), 19.3 Me, Mes), 21.5 (Me, Mes), 26.3 (CH2, Pr), 45.4 (CH2, Pr), 83.2 (Cp), 93.2 (Ср), 124.3 (CH, Im), 130.0 (Mes), 136.0 (Mes), 137.5 (Mes), 139.3 (Mes), 172.8 (C, Im), 238.1 (CO).
| Найдено, %: | C 63.58; | H 6.21; | N 3.98. |
| Для C36H41MnN2NiO2S (M = 679) | |||
| вычислено, %: | C 63.64; | H 6.08; | N 4.12. |
РСА. Дифракционные данные для I и II получены при 100 K, для III при 240 K на дифрактометре Bruker SMART APEX II, оснащенном двухкоординатным детектором Photon (графитовый монохроматор, λ(MoKα) = 0.71073 Å, ω-сканирование). Поглощение учтено методом множественного измерения эквивалентных отражений по программе SADABS [8]. Кристаллические структуры расшифрованы с использованием программы SHELXT и уточнены полноматричным МНК в анизотропном (за исключением атомов водорода) приближении с использованием программы SHELXL [9] и OLEX2 [10]. Позиции атомов водорода органических лигандов рассчитаны геометрически и уточнены по модели “наездника”. Кристаллографические данные и детали дифракционных экспериментов приведены в табл. 1.
Таблица 1.
Кристаллографические данные и детали уточнения для структуры I
| Параметр | Значение | ||
|---|---|---|---|
| I | II | III | |
| Брутто-формула | C29H36N2NiS | C34H36N2NiO5SW | C36H41MnN2NiO2S |
| M | 503.37 | 827.27 | 679.42 |
| Сингония | Моноклинная | Триклинная | Триклинная |
| Пр. гр. | P21/n | P1 | P1 |
| a, Å | 8.6491(2) | 11.0741(5) | 10.8085(4) |
| b, Å | 19.1568(4) | 16.0171(8) | 11.4279(4) |
| c, Å | 16.0388(4) | 19.7876(9) | 15.6174(6) |
| α, град | 90 | 93.160(2) | 75.4760(1) |
| β, град | 101.282(1) | 93.460(2) | 76.4640(1) |
| γ, град | 90 | 104.531(2) | 66.5140(1) |
| V, Å3 | 2606.10(10) | 3382.4(3) | 1693.04(11) |
| Z | 4 | 4 | 2 |
| ρ(выч.), г/см3 | 1.283 | 1.624 | 1.333 |
| μ, мм−1 | 0.844 | 4.058 | 1.024 |
| F(000) | 1072.0 | 1648.0 | 712.0 |
| Размер кристалла, мм | 0.21 × 0.17 × 0.15 | 0.13 × 0.13 × 0.1 | 0.23 × 0.17 × 0.12 |
| Область сканирования по θ, град | 4.98–63.754 | 4.47–61.008 | 4.156–58.288 |
| Диапазон индексов hkl | –12 ≤ h ≤ 12 –27 ≤ k ≤ 25 –23 ≤ l ≤ 22 |
–15 ≤ h ≤ 13 –22 ≤ k ≤ 20 –28 ≤ l ≤ 27 |
–13 ≤ h ≤ 14 –15 ≤ k ≤ 15 –19 ≤ l ≤ 21 |
| Измерено отражений | 51 327 | 40 541 | 18 470 |
| Независимых отражений (Rint) | 8205 (0.0352) | 18 132 (0.0287) | 8474 (0.0248) |
| Отражений с I > 2σ(I) | 7080 | 15 289 | 11 223 |
| GOOF по F 2 | 1.060 | 1.021 | 1.058 |
| R-факторы по I ≥ 2σ(I) | R1 = 0.0433, wR2 = 0.0900 |
R1 = 0.0321, wR2 = 0.0585 |
R1 = 0.0512, wR2 = 0.1160 |
| R-факторы по всем отражениям | R1 = 0.0547, wR2 = 0.0943 |
R1 = 0.0425, wR2 = 0.0618 |
R1 = 0.0731, wR2 = 0.1272 |
| Остаточная электронная плотность (max/min), e/Å3 | 0.64/–0.45 | 1.19/–0.96 | 0.71/–0.47 |
Полные таблицы межатомных расстояний и валентных углов, координаты атомов и параметры атомных смещений депонированы в Кембриджском банке структурных данных (КСБД) (№ 2024873–2024875 для комплексов I, III и II соответственно; https://www.ccdc.cam.ac.uk/structures/).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Тиолатные комплексы на основе циклопентадиенилникеля, содержащие стерически нагруженные N-гетероциклические карбеновые лиганды, можно получать либо действием диарилдисульфида на 17-электронный комплекс (η5-C5H5)Ni(NHC) [11], либо синтетически более простым замещением галогена на SR в (η5-C5H5)Ni(NHC)Cl [12].
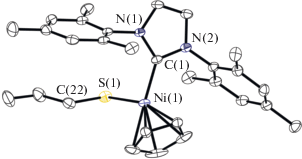
Использование второго подхода позволило получить комплекс (η5-C5H5)Ni(SIMes)SnPr (I) в реакции (η5-C5H5)Ni(SIMes)Cl с н-пропилмеркаптаном и триэтиламином. Монокристаллы I были получены паровой диффузией. По данным РСА (рис. 1), длины связи Ni–S и Ni–C в I составляют 2.1873(5) и 1.874(2) Å, что меньше суммы ковалентных радиусов (СКР): rNi + rS = 2.29, rNi + rC = = 1.97 Å [13].
Рис. 1.
Молекулярная структура комплекса I (тепловые эллипсоиды атомов на уровне 50%-ной вероятности). Атомы водорода опущены для ясности. Некоторые длины связей и валентные углы: Ni(1)–S(1) 2.1873(5), Ni(1)–C(1) 1.874(2), N(2)–C(1) 1.368(2), N(1)–C(1) 1.367(2) Å и C(22)S(1)Ni(1) 102.98(6)°.
Взаимодействие комплекса I с аддуктом W(CO)5- (THF), полученным при облучении раствора W(CO)6 в THF УФ-светом, приводит к образованию комплекса (η5-C5H5)Ni(SIMes)(μ2-SnPr)W(CO)5 (II), содержащего мостиковый тиолатный лиганд.
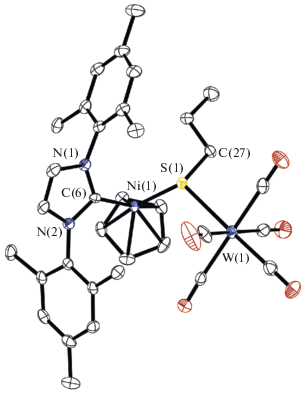
В ИК-спектре комплекса II наблюдаются полосы при 2057, 1962, 1904 и 1874 cм–1, соответствующие валентным колебаниям карбонильных групп фрагмента W(CO)5. По данным РСА (рис. 2), длины связи Ni–S в II (2.2139(8) и 2.2066(8) Å) меньше СКР (rNi + rS = 2.29 Å [13]), но больше аналогичной длины связи в I и в близком по стро-ению комплексе (η5-C5H5)Ni(MeIm)(μ2-SnPr)W(CO)5 (IIа) (2.1933(7) Å) [5]. Длины связей Ni–С c карбеновым лигандом составляют 1.903(3) и 1.900(3), что меньше соответствующей СКР (rNi + + rC = 1.97Å), но больше таковых в комплексе IIa (1.882(3) и 1.879(3) Å). Это свидетельствует о большей донорной способности фрагмента MeIm по сравнению с SIMes. Длины связей W–S (2.5800(7) и 2.5931(7) Å) меньше соответствующей СКР (RNi + RC = 1.97 Å, RW + RS = = 2.67 Å [13]) и сопоставимы с таковыми для комплекса IIа. В комплексе II углы NiSW составляют 116.46(3) и 117.30(3); увеличение этих значений по сравнению с IIа (109.66(3)° и 112.69(3)°) можно объяснить большим стерическим отталкиванием N-гетероциклического карбена и карбонильных групп фрагмента W(CO)5 по сравнению c Iа.
Рис. 2.
Молекулярная структура комплекса II (тепловые эллипсоиды атомов на уровне 50%-ной вероятности). Атомы водорода опущены для ясности. Показана одна из двух независимых молекул. Некоторые длины связей и валентные углы: W(1)–S(1) 2.5931(7), W(1)–C(2) 2.045(3), W(1)–C(4) 2.036(3), W(1)–C(3) 2.048(4), W(1)–C(1) 1.975(3), W(1)–C(5) 2.035(4), Ni(1)–S(1) 2.2139(8), Ni(1)–C(6) 1.903(3) Å и Ni(1)S(1)W(1) 116.46(3)°.
Взаимодействие комплекса I с аддуктом (η5-С5H5)Mn(CO)2(THF), полученным при облучении раствора (η5-С5H5)Mn(CO)3 в THF УФ-светом, приводит к образованию гетерометаллического комплекса (η5-C5H5)Ni(SIMes)(μ2-SnPr)(η5-С5H5)Mn(CO)2 (III).
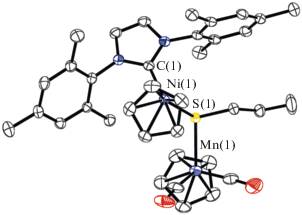
В ИК-спектре комплекса III наблюдаются полосы при 1896 и 1827 cм–1, соответствующие валентным колебаниям карбонильных групп фрагмента (η5-С5H5)Mn(CO)2. Для близкого по строению комплекса (η5-C5H5)Ni(MeIm)(μ2-SnPr)Mn(CO)2(η5-C5H5) (IIIa) соответствующие частоты составляют 1891, 1803 cм–1 [6]. По данным РСА (рис. 3), длины связей Ni–S, Ni–C и Mn–S (2.2153(7), 1.898(3) и 2.3538(8) Å) больше соответствующих значений в IIa (2.2087, 1.884 и 2.3308 Å), но меньше СКР (RNi + RS = 2.29 Å, RNi + RC = 1.97 Å, RMn + RS = = 2.44 Å).
Рис. 3.
Молекулярная структура комплекса III (тепловые эллипсоиды атомов на уровне 30%-ной вероятности). Атомы водорода опущены для ясности. Показана одна из двух независимых молекул. Некоторые длины связей и валентные углы: Ni(1)–S(1) 2.2153(7), Ni(1)–C(1) 1.898(3), Mn(1)–S(1) 2.3538(8), S(1)–C(27) 1.828(3) Å и Ni(1)S(1)Mn(1) 122.11(3)°.
По данным ТГА–ДСК, термораспад комплек-са II происходит ступенчато: при 101–137°С теряется одна молекула СО, затем в интервале 137–156°С происходит потеря еще двух молекул СО и в интервале 156–190°С отщепляются оставшиеся две молекулы СО, остальные органические лиганды отщепляются частично без выраженных границ до 500°С. Дальнейший нагрев до 550°С не приводит к дополнительной потере массы. Остаток (47.21%) может состоять из сульфидов никеля и вольфрама (NiWS, 33.19%), загрязненных продуктами пиролиза лигандов (14.02%).
Термораспад комплекса III происходит ступенчато, но без четких границ: при температуре 119–550°С происходит частичное отщепление органических лигандов. Остаток (47.21%) может состоять из сульфидов никеля и марганца (NiMnS, 21.44%), загрязненных продуктами пиролиза лигандов (13.48%).
Для комплекса IIа наблюдается полное ступенчатое отщепление лигандов (92–182°С – пять СO и C3H7, 183–550°С – C5H5 и Me2Im) c образованием остатка NiWS (эксп. 45.95%, теор. 44.35%).
Таким образом 1,3-диметилимидазол-2-илиден является более удобным лигандом для синтеза прекурсоров неорганических материалов, чем 1,3-димезитилимидазол-2-илиден. Данное исследование, с одной стороны, описывает первые примеры термораспада халькогенидных гетерометаллических комплексов с 1,3-димезитилимидазол-2-илиденом, а с другой – является продолжением серии работ по изолобальной аналогии, оригинальным примером которой может быть публикация И.Б. Сиваева в память об А.А. Пасынском [14].
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Lin J.C.Y., Huang R.T.W., Lee C.S. et al. // Chem. Rev. 2009. V. 109. P. 3561.
Johnson C., Albrecht M. // Coord. Chem. Rev. 2017. V. 352. P. 1.
Danopoulos A.A., Simler T., Braunstein P. // Chem. Rev. 2019. V. 119. P. 3730.
Lin C.-Y., Power P.P. // Chem. Soc. Rev. 2017. V. 46. P. 5347.
Shapovalov S.S., Pasynskii A.A., Skabitskii I.V. et al. // Russ. J. Coord. Chem. 2018. V. 44. P. 647. https://doi.org/10.1134/s1070328418110076
Шаповалов С.С., Тихонова О.Г., Григорьева М.О. и др. // Коорд. химия. 2019. Т. 45. № 10. С. 611 (Shapovalov S.S., Tikhonova O.G., Grigor’eva M.O. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 706). https://doi.org/10.1134/s1070328419100063
Kelly R.A., Scott N.M., Diez-Gonzalez S. et al. // Organometallics. 2005. V. 24. № 14.
Sheldrick G.M. SADABS (2016/2). Göttingen (Germany): Univ. of Göttingen, 2016.
Sheldrick G.M. // Acta Crystallogr. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. A-ppl. Cryst. 2009. V. 42. P. 339.
Pelties S., Herrmann D., de Bruin B. et al. // Chem. Commun. 2014. V. 50. P. 7014.
Malyshev D.A., Scott N.M., Marion N. et al. // Organometallics. 2006. V. 25. P. 4462.
Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. P. 2832.
Сиваев И.Б. // Журн. неорган. химии. 2020. Т. 65. № 12. С. 1643 (Sivaev I.B. // Russ. J. Inorg. Chem. 2020. V. 65. № 12. P. 1854). https://doi.org/10.1134/S0036023620120165
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия


