Координационная химия, 2022, T. 48, № 6, стр. 378-384
Tрис-2-(хинолил-8-иминометил)феноляты лантанидов: синтез и строение
К. И. Антипова 1, Л. Н. Пунтус 2, 3, К. А. Лысенко 4, Д. М. Ройтерштейн 2, 5, 6, *
1 Московский городской педагогический университет
Москва, Россия
2 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
3 Институт радиотехники и электроники им. В.А. Котельникова РАН,
Фрязинский филиал
Московская область, Фрязино, Россия
4 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
5 Институт органической химии им. Н.Д. Зелинского РАН
Москва, Россия
6 Национальный исследовательский университет “Высшая школа экономики”
Москва, Россия
* E-mail: roiter@yandex.ru
Поступила в редакцию 30.11.2021
После доработки 04.12.2021
Принята к публикации 09.12.2021
- EDN: HIRQST
- DOI: 10.31857/S0132344X22060019
Аннотация
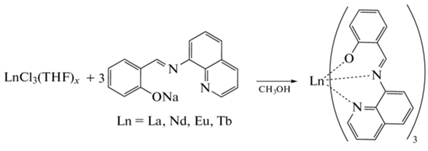
Взаимодействие 2-(хинолил-8-иминометил)фенолята натрия с хлоридами РЗЭ приводит к образованию гомолигандных моноядерных комплексов [Ln{2-(8-quinolyl)N=CH–C6H4O}3], Ln = La (I), Nd (II), Eu (III), Tb (IV) с 9-координированным ионом РЗЭ. Все полученные комплексы имеют сходное строение, при этом II, III и IV изоструктурны (CIF files CCDC № 2124365 (I), 2124364 (II), 2124366 (III), 2124367 (IV)). Соединения III и IV не обладают люминесценцией, для комплекса II зарегистрирована характеристическая люминесценция в ближнем ИК-диапазоне.
Большинство ионов РЗЭ Ln3+ с не полностью заполненной 4f-электронной оболочкой способны к люминесценции и демонстрируют характеристичные узкие линии в спектрах люминесценции [1–3].
Для люминесценции ионов РЗЭ характерны невысокие квантовые выходы, так как она обусловлена запрещенными 4f–4f-переходами. Для повышения квантового выхода люминесценции используют непрямое возбуждение иона РЗЭ через полосы поглощения координированного органического лиганда, способного эффективно поглощать электромагнитное излучение, с последующей передачей возбуждения на ион РЗЭ. Такое использование органического лиганда называют эффектом “антенны” [1, 4]. Часто, в качестве таких лигандов используют гетероциклические органические соединения, координированные с катионом лантанида гетероатомом [5–7]. Органические лиганды в координационной сфере иона РЗЭ также препятствуют контактам с молекулами растворителя, предотвращая тушение люминесценции за счет безызлучательной релаксации из-за колебаний групп O–H, N–H и C–H. Наиболее эффективно в этом отношении использование полидентатных органических лигандов, содержащих несколько донорных атомов (N, O), способных к координации с катионом РЗЭ, в особенности конденсированных ароматических соединений, способных выступать в роли лиганда-антенны [1, 3, 4]. Особый интерес, при этом вызывают возможные межлигандные взаимодействия, возникающие между объемными лигандами в координационной сфере комплекса РЗЭ и их влияние на фотофизические свойства. Эти взаимодействия могут приводить к возникновению “индуцированных” состояний переноса заряда (ПЗ) [8], вовлеченных в процессы сенсибилизации люминесценции, и управление ими может быть рассмотрено как новый метод дизайна люминесцентных материалов с заданными свойствами.
Цель настоящей работы – выяснение координационных возможностей тридентатного ONN-донорного 2-(хинолил-8-иминометил)фенолятного лиганда в комплексах РЗЭ и изучение фотофизических свойств таких соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все синтетические манипуляции проводили в атмосфере предварительно очищенного аргона в среде безводных растворителей с использованием аргон-вакуумной линии и сосудов Шленка. Тетрагидрофуран предварительно высушивали над NaOH и перегоняли над калий-бензофеноном. Гексан перегоняли над калий-натриевой эвтектикой и бензофеноном. Толуол перегоняли над натрий-бензофеноном. LnCl3(THF)x получали в соответствии с известной методикой [9]. Спектры ЯМР регистрировали на приборе Bruker AM-300. Для определения содержания лантанида в образце использовали прямое комплексонометрическое титрование раствором трилона Б с индикатором ксиленоловым оранжевым. Элементный анализ выполняли на автоматическом CHN-микроанализаторе Perkin-Elmer.
Синтез [La(C9H6N–N=CH–C6H4–O)3](THF) (I). К раствору безводного хлорида лантана 0.270 г (1.1 ммоль) в 25 мл сухого метанола, добавляли раствор 2-(хинолил-8-иминометил)фенолята натрия, полученного взаимодействием 0.818 г (3.3 ммоль) 2‑(хинолил-8-иминометил)фенола и 3.88 мл 0.85 М раствора метилата натрия (3.3 ммоль) в метаноле. Полученную смесь перемешивали 10 ч. Смесь упарили досуха, к остатку добавляли 20 мл TГФ и 5 мл CH3OH. Раствор отделили от осадка, осадок экстрагировали тетрагидрофураном. Объединенный экстракт упаривали втрое, выпавшие при стоянии в течение недели кристаллы растворяли в 15 мл TГФ и 5 мл метанола при нагревании (Т = = 60°C). К смеси осторожно добавляли гексан, смесь оставляли на 2 нед. Образовавшиеся кристаллы отделяли от маточного раствора и высушили в вакууме. Выход I 0.48 г (46%).
| Найдено, %: | La 14.72; | С 65.16; | H 3.81; | N 9.27. |
| Для C52H41N6O4La | ||||
| вычислено, %: | La 14.60; | С 65.56; | H 4.31; | N 8.82. |
Пригодные для РСА кристаллы получали в результате медленной диффузии гексана в раствор I в тетрагидрофуране.
ЯМР 1H (CDCl3; δ, м.д.): 1.80 м. (8Н), 3.75 м. (8Н), 6.00 д. (3Н), 6.2 т. (3Н), 6.7 м. (6Н), 6.90 м. (3Н), 7.15 м. (6Н), 7.25 м. (3Н), 7.87 м. (3Н), 8.02 м. (3Н), 9.01 д. (3Н). ЯМР 13С (CDCl3; δ, м.д.): 112.3, 117.4, 121.3, 123.0, 123.0, 124.1, 127.0, 128.4, 134.0, 135.3, 136.7, 143.4, 149.0, 152.5, 164.8, 169.6.
Синтез [Nd(C9H6N–N=CH–C6H4–O)3](CHCl3) (II) выполняли методом, аналогичным для комплекса I исходя из 1.40 г (3.69 ммоль) NdCl3 ∙ 1.8THF, 2.75 г (11.07 ммоль) 2-(хинолил-8-иминометил)фенола и 13.02 мл (0.85 М, 10.47 ммоль) раствора метилата натрия. Кристаллический II получали перекристаллизацией из хлороформа при медленном добавлении гексана. Выход II 2.63 г (80%). Найдено, %: Nd 14.12; Для C49H34N6O3Cl3Nd вычислено, %: Nd 14.33.
Синтез [Eu(C9H6N–N=CH–C6H4–O)3](CHCl3)2 (III) выполняли методом, аналогичным для комплекса I исходя из 0.39 г (0.96 ммоль) EuCl3 ∙ 2THF, 0.71 г (2.88 ммоль) 2-(хинолил-8-иминометил)фенола и 2.32 мл (1.24 М; 2.88 ммоль) раствора метилата натрия. Кристаллический III получали перекристаллизацией из хлороформа при медленном добавлении гексана. Выход III 0.24 г (78%).
Синтез [Tb(C9H6N–N=CH–C6H4–O)3](CHCl3) (IV) выполняли методом, аналогичным для комплекса I исходя из 0.61 г (1.26 ммоль) ТbCl3 ∙ 3THF, 0.94 г (3.78 ммоль) 2-(хинолил-8-иминометил)фенола и 2.58 мл раствора CH3ONa (1.464 М; 3.78 ммоль) раствора метилата натрия. Кристаллический IV получали перекристаллизацией из хлороформа при медленном добавлении гексана. Выход IV 0.75 г (58%).
| Найдено, %: | Tb 16.77; | С 58.12; | Н 3.40; | N 7.79. |
| Для C49H34N6O3Cl3Tb | ||||
| вычислено, %: | Tb 15.60; | С 57.70; | Н 3.33; | N 8.23. |
По данным РСА, монокристаллы всех исследованных соединений содержат в элементарных ячейках кристаллической решетки сольватные молекулы растворителя (четыре молекулы CHCl3 на одну формульную единицу (II–IV) и три молекулы ТГФ (I)). При высушивании в вакууме до постоянной массы часть сольватных молекул теряется.
РСА комплексов I–IV проведен на дифрактометре Bruker Quest D8 (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структуры расшифрованы прямым методом и уточнены МНК в анизотропном полноматричном приближении по $F_{{hkl}}^{2}.$ Учет поглощения проведен полуэмпирически по эквивалентным отражениям. При уточнении разупорядоченных сольватных молекул использованы ограничения для параметров атомных смещений и позиционных параметров (DFIX и EADP). Атомы водорода во всех структурах рассчитаны и уточнены по модели наездника. Все расчеты проведены по комплексу программ SHELXL-2014/2017. Основные кристаллографические данные и параметры уточнения для соединений I–IV приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные и параметры уточнения для соединений I–IV
| Параметр | Значение | |||
|---|---|---|---|---|
| La (I) | Nd (II) | Eu (III) | Tb (IV) | |
| Брутто-формула | C60H56N6O6La | C52H37N6O3Cl12Nd | C52H37N6O3Cl12Eu | C52H37N6O3Cl12Tb |
| М | 1096.01 | 1363.51 | 1371.23 | 1378.19 |
| T, K | 120 | 120 | 120 | 120 |
| Cингония | Ромбическая | Моноклинная | Моноклинная | Моноклинная |
| Пр. группа | Pbca | P21/c | P21/c | P21/c |
| Z | 8 | 4 | 4 | 4 |
| a, Å | 18.421(2) | 12.6867(11) | 12.6119(5) | 12.6223(5) |
| b, Å | 20.032(2) | 19.3960(16) | 19.4608(7) | 19.4964(8) |
| c, Å | 27.301(3) | 22.6510(19) | 22.6466(8) | 22.6394(9) |
| α, град | 90 | 90 | 90 | 90 |
| β, град | 90 | 96.933(2) | 97.0460(10) | 97.0108(9) |
| γ, град | 90 | 90 | 90 | 90 |
| V, Å3 | 10074(2) | 5533.0(8) | 5516.4(4) | 5529.7(4) |
| ρ(выч.), г см–3 | 1.445 | 1.637 | 1.651 | 1.655 |
| μ, см–1 | 9.08 | 15.67 | 17.67 | 19.08 |
| F(000) | 4504 | 2716 | 2728 | 2736 |
| 2θmax, град | 56 | 64 | 61 | 63 |
| Число измеренных отражений | 111 184 | 80 320 | 74 312 | 80 683 |
| Число независимых отражений | 12 164 | 9451 | 16 843 | 25 466 |
| Число отражений с I > 2σ(I) | 6624 | 16 160 | 12 630 | 18 671 |
| Количество уточняемых параметров | 654 | 742 | 742 | 742 |
| R1 | 0.0493 | 0.0401 | 0.0438 | 0.0464 |
| wR2 | 0.1312 | 0.1073 | 0.1114 | 0.1152 |
| GOОF | 0.956 | 1.033 | 1.018 | 0.930 |
| Остаточная электронная плотность (max/min), e Å–3 | 0.966/–1.064 | 1.940/–2.059 | 2.071/–1.821 | 2.094/–1.910 |
Координаты атомов и другие параметры структур I–IV депонированы в Кембриджском банке структурных данных (№ 2124364–2124367) соответственно, deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Комплексы лантана, неодима, европия и тербия с 2-(хинолил-8-иминометил)фенолят-анионом вида LnL3, где Ln = La (I), Nd (II), Eu (III), Tb (IV); L = {2-(8-quinolyl)N=CH–C6H4O}, получены при взаимодействии растворов LnCl3(THF)x в абсолютном метаноле c натриевой солью лиганда, синтезированнаядействием раствора метилата натрия в метанолена 2-(хинолил-8-иминометил)фенол (схе-ма 1 ).Монокристаллическиеобразцы комплексов получены перекристаллизациейизхлороформа (II–IV) или медленнымдобавлениемпетролейного эфира к раствору комплекса в ТГФ (I).
Схема 1 .
Строение соединений I–IV установлено методом рентгеноструктурного анализа (рис. 1, табл. 2).
Рис. 1.
Общий вид комплексов I–IV на примере комплекса Nd(III) в представлении атомов тепловыми эллипсоидами (p = 50%).
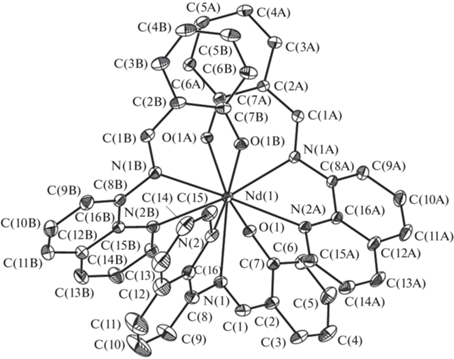
Таблица 2.
Основные структурные параметры комплексов I–IV
| Параметр | La (I) | Nd (II) | Eu (III) | Tb (IV) |
|---|---|---|---|---|
| Ln–O (Å) | 2.389(3)– 2.400(3) | 2.342(2)–2.355(2) | 2.309(2)–2.324(2) | 2.285(2)–2.302(2) |
| Ln–Nimino | 2.683(4)–2.791(4) | 2.616(2)–2.675(2) | 2.581(3)–2.641(3) | 2.564(2)–2.617(2) |
| Ln–Nqyinoline | 2.716(3)–2.822(4) | 2.687(2)–2.751(2) | 2.649(3)–2.726(3) | 2.628(2)–2.719(2) |
| С(7)…С(8a) | 3.338(4) | 3.390(4) | 3.343(4) | 3.323(3) |
| C(7)…С(16a) | 3.306(4) | 3.193(4) | 3.164(4) | 3.155(3) |
| C(1)…C(15a) | 3.365(4) | 3.254(4) | 3.229(4) | 3.218(3) |
| С(7a)…C(7b) | 3.357(4) | 3.234(4) | 3.226(4) | 3.198(3) |
| С(8b)…С(16) | 3.499(4) | 3.418(4) | 3.369(4) | 3.363(3) |
| С(16b)…С(8) | 3.447(4) | 3.418(4) | 3.408(4) | 3.390(3) |
| N(2b)…N(1) | 2.956(40 | 2.932(4) | 2.911(4) | 2.881(3) |
Комплексы неодима, европия и тербия (II–IV) изоструктурны (пространственная группа P21/с), кристаллизуются в виде сольвата с четырьмя молекулами CHCl3, тогда как комплекс лантана (I) получен в виде сольвата с тремя молекулами ТГФ, который принадлежит к пространственной группе Pbca. Несмотря на различия в числе и типе сольватных молекул строение комплексов фактически не отличается.
В комплексах I–IV катионы РЗЭ координированы двумя атомами азота и одним атомом кислорода каждого из трех лигандов. Координационное окружение катиона лантанида представляет собой “одношапочную” тетрагональную антипризму. Таким образом, координационное число атома металла равно 9. Тип координации лигандов и геометрия координационного полиэдра приводит к существенному нарушению планарности лигандов – угол между иминохинолиновым и гидроксифенильными фрагментами изменяется в узком интервале 34°–40°. Интересной особенностью данного комплекса является взаимное расположение π-систем соседних лигандов. Во всех комплексах реализуются три различных типа димеров, в которых можно предположить наличие стекинг-взаимодействий, а именно гидроксифенил…гидроксифенил, гидроксифенил…иминохинолин и иминохинолин…иминохинолин. В указанных димерах π-системы не параллельны и наклонены в сторону металла, однако во всех случаях реализуются весьма короткие контакты (см. рис. 2, табл. 2), которые могут рассматриваться как возможный “канал” передачи заряда. Действительно в данной системе межатомные расстояния сопоставимы с аналогичными контактами в [2.2]-парациклофане [10, 11]. Однако, в отличие от последнего, контакты в изучаемых комплексах реализуются, в том числе между различными по размерности и электронным характеристикам циклами. Важно, что данные внутримолекулярные контакты мало зависят как от природы металла, так и от сольватных молекул (влияния кристаллической упаковки).
Рис. 2.
Фрагменты кристаллической структуры II–III, иллюстрирующие расположение π-систем в возможных стекинг-димерах (схема наложения фрагментов фенокси…фенокси (а), фенокси…иминохинолин (б) и иминохинолин…иминохинолин (в)).
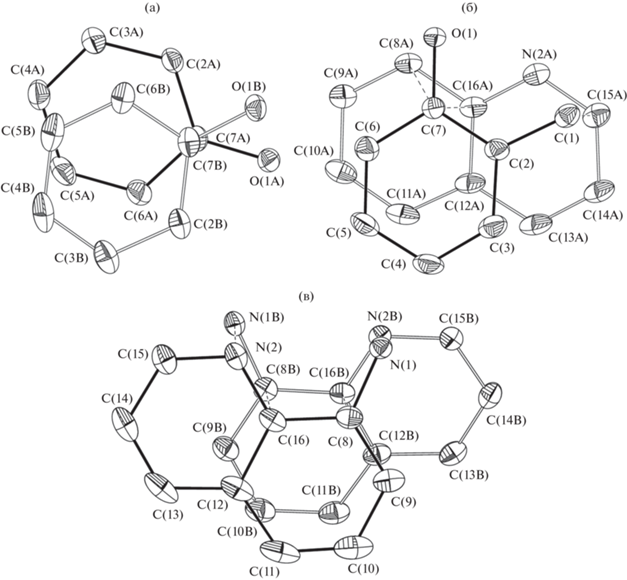
Исходя из этого, можно было ожидать, что данные контакты могут приводить к реализации ПЗ-состояний, существенно влияющих на процессы сенсибилизации люминесценции РЗЭ [12, 13]. Проведенные TD-DFT расчеты (PBe1PBE, 6-311G* для С,Н,О,N и f-in-core псевдопотенциал для атома европия) подтвердили наше предположение о наличии низколежащего ПЗ-состояния, отвечающего взаимодействию лигандов в координационной сфере РЗЭ. Согласно расчету, энергия нижайшего триплета составляет 632 нм. При этом, как показал анализ молекулярных орбиталей, данное состояние, как и ряд близких по энергии переходов, отвечает переносу с одного из лигандов на другой в пределах, описанных выше димеров.
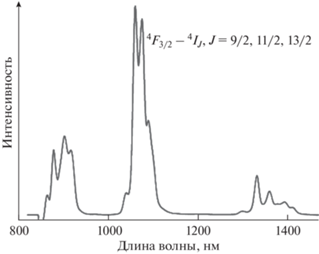
Если энергия возбужденных состояний действительно настолько низкая, то логично было предположить, что из рассмотренных комплексов только в случае комплексов неодима можно будет наблюдать люминесценцию. Действительно, резонансный уровень иона Nd3+ существенно ниже (870 нм (11 500 см–1)), чем иона Tb3+ (490 нм (20 410 см–1)). Проведенные нами предварительные исследования четко показали, что для европия и тербия люминесценция не детектируется, тогда как для неодима была зарегистрирована характеристическая люминесценция в области ближнего ИК-диапазона (рис. 3).
Принимая во внимание, что наблюдаемая геометрия комплексов мало зависит от природы металла можно предположить, что данная лигандная система, обладающая низколежащими состояниями внутримолекулярного переноса заряда, будет являться потенциально интересной и для других РЗЭ, демонстрирующих люминесценцию в ИК-диапазоне, что будет изучено нами в последующих исследованиях.
Авторы сообщают, что у них нет конфликта интересов.
Список литературы
Bünzli J.-C.G., Eliseeva S.V. // Chem. Sci. 2013. V. 4. P. 1939.
Zucchi G., Scopelliti R., Pittet P. et al. // Dalton Trans. 1999. V. 3. P. 931.
Bünzl, J.-C.G. // Acc. Chem. Res. 2006. V. 39. P. 53.
Weissman, S.I. // J. Chem. Phys. 1942. V. 10. P. 214.
Eliseeva S.V., Bünzli J.-C.G. // New J. Chem. 2011. V. 35. P. 1165.
Curnock E., Levason, W., Light M.E. // Dalton Trans. 2018. V. 47. P. 6059.
Bünzli J.C.G. // Handb. Phys. Chem. Rare Earths. 2016. V. 50. P. 141.
Bardonov D.A., Puntus L.N., Taidakov I.V. et al. // Mendeleev Commun. 2022. https://doi.org/10.1016/j.mencom.2022.03.015
Edelmann F.T., Poremba P. // Synthetic Methods of Organometallic and Inorganic Chemistry (Herrman/Brauer) / Eds. Edelmann F.T., Herrmann W.A. Stuttgart (Germany): Verlag, 1997. P. 34.
Lyssenko K.A., Korlyukov A.A., Antipin M.Y. // Mendeleev Commun. 2005. V. 15. P. 90.
Puntus L.N., Sergeeva E.V., Antonov D.Y. et al. // Mol. Cryst. Liq. Cryst. 2017. V. 655. P. 16.
Puntus L.N. // Helv. Chim. Acta. 2009. V. 92. P. 2552.
Puntus L.N., Lyssenko K.A., Pekareva I.S., Bünzli J.-C.G. // J. Phys. Chem. B. 2009. V. 113 P. 9265.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия