Координационная химия, 2022, T. 48, № 6, стр. 360-369
Несимметричное строение комплекса Co(III) С бис-гетарилгидразоном в гидразоновой и хинолоновой формах, стабилизированных водородной связью
Ю. П. Туполова 1, *, Д. В. Корчагин 2, **, В. Е. Лебедев 1, Л. Д. Попов 1, Г. В. Шилов 2, И. Н. Щербаков 1, В. А. Четверикова 1, С. М. Алдошин 2
1 Южный федеральный университет
Ростов-на-Дону, Россия
2 Институт проблем химической физики РАН
Черноголовка, Россия
* E-mail: yptupolova@sfedu.ru
** E-mail: korden@icp.ac.ru
Поступила в редакцию 11.09.2021
После доработки 06.12.2021
Принята к публикации 23.12.2021
- EDN: QWIXTM
- DOI: 10.31857/S0132344X22060068
Аннотация
Синтезирован бис-гетарилгидразон (H2L), продукт конденсации 2-гидразинохинолина с диацетилом, и моноядерный комплекс Co(III) [Co(HL)2]Br · 2ДМСО (I). Структура металлохелата установлена методом РСА (CIF file CCDC № 2099899). Ион Cо(III) в I находится в низкоспиновом состоянии и имеет слегка искаженное октаэдрическое строение координационного узла. Два монодепротонированных бис-хинолилгидразона в металлохелате выступают как тридентатные лиганды в различных таутомерных формах, стабилизированных межлигандной внутримолекулярной водородной связью.
Гидразоны, содержащие гетероциклические фрагменты, и комплексные соединения на их основе являются перспективными объектами синтеза и исследования для современной химии. Это связано прежде всего с возможным практическим применением данных соединений. На основе ге-тарилгидразонов получают препараты биохимического и фармакологического действия, так как они проявляют широкий спектр физиологически активных свойств: обладают гипотензивной, противотуберкулезной, противоопухолевой, антивирусной, антигипертонической и другими видами активности [1–5]. Также гетарилгидразоны применяются как аналитические реагенты на ионы переходных металлов, красители и катализаторы некоторых технологических процессов [1, 6, 7].
Гетарилгидразоны – перспективные лигандные системы, которые используются для синтеза комплексных соединений с различными структурными особенностями и свойствами, имеющими важное значение при создании магнитоактивных, оптических, каталитических материалов и лекарственных препаратов [8–19]. Известно, что содержание гетероциклического фрагмента сильно влияет на комплексообразующую способность лигандной системы. Широкий набор донорных атомов и способность менять дентатность в зависимости от условий проведения реакции обуслoвливает возможность существования гетарилгидразонов в различных таутомерных формах, что отражается на строении и, следовательно, свойствах образующихся комплексов [20–22]. Поэтому представляется важным установление факторов, влияющих на реализацию определенных таутомерных форм лиганда в комплексных соединениях.
Настоящая работа посвящена синтезу и исследованию новой полидентантной лигандной системы – продукта конденсации 2-гидразинохинолина с диацетилом (H2L) – и гетеролептического комплекса [Co(HL)2]Br · 2ДМСО (I) на его основе, в котором два монодепротонированных лиганда HL находятся в разных таутомерных формах благодаря стабилизирующей межлигандной внутримолекулярной водородной связи.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных соединений использовали коммерчески доступные реагенты. Очистку и сушку растворителей производили по стандартным методикам. 2-Гидразинохинолин синтезировали в соответствии с методикой [23].
Синтез H2L. К горячему раствору 0.64 г (4 ммоль) 2-гидразинхинолина в 8 мл изопропанола приливали раствор 0.17 г (2 ммоль) диацетила в изопропаноле. Реакционную смесь нагревали в течение 4.5 ч с обратным холодильником. Выпавший кристаллический желтый осадок отфильтровывали и промывали изопропанолом. Полученный бис-хинолилгидразон перекристаллизовывали из бутанола. Выход H2L 53%. Тпл = 280°С.
ИК-спектр (ν, см–1): 3337 сл ν(NH,); 1616 с, 1606 с ν(С=N), 1572 сл, 1463 сл, 1429 ср, 1377 сл, 1287 сл, 1244 сл, 1154 с, 1135 сл, 1120 сл, 1017 сл, 985 сл, 944 сл, 903 сл, 828 ср, 783 сл, 760 сл.
Спектр ЯМР 1Н (ДМСО-d6; δ, м.д. (J, Гц)): 2.32 (с., 6H, СН3), 7.29 (т., 2H, ${\text{Н}}_{{{\text{аром}}}}^{{\text{7}}}{\text{,}}$ 3JНН 6.0), 7.59 (т., 2H, ${\text{Н}}_{{{\text{аром}}}}^{{\text{8}}}{\text{,}}$ 3JНН 6.0), 7.63 (м. 4H, ${\text{Н}}_{{{\text{аром}}}}^{{{\text{4,6}}}}$), 7.78 (д., 2H, ${\text{Н}}_{{{\text{аром}}}}^{{\text{9}}}{\text{,}}$ 2JНН 6.0), 8.18 (д., 2H, ${\text{Н}}_{{{\text{аром}}}}^{{\text{3}}}{\text{,}}$ 2JНН 6.0), 10.21 (с., 2H, NH).
Синтез [Co(HL)2]Br · 2ДМСО (I). К горячей суспензии 0.15 г (4 ммоль) бис-хинолилгидразона (H2L) в 8 мл метанола приливали раствор 0.13 г (4.1 ммоль) соли CoBr2 · 6H2O в 2 мл метанола. Раствор окрашивался в темно-коричневый цвет, через полчаса выпадал осадок. Реакционную смесь нагревали в течение 4 ч с обратным холодильником. Светло-коричневый аморфный осадок отфильтровывали, промывали метанолом. Кристаллы выращивали из ДМСО. Выход 51%, Тпл > 280°С.
| Найдено, %: | C 66.45; | H 5.89; | Co 6.74; | N 9.76. |
| Для С48Н40N6O2S2Co | ||||
| вычислено, %: | C 66.57; | H 5.82; | Co 6.81; | N 9.70. |
ИК-спектр (ν, см–1): 3197 сл, 3052 сл ν(NH), 1638 ср, 1620, 1606 ср ν(С=N), 1577 сл, 1518 ср, 1482 сл, 1423 сл, 1388 сл, 1325 сл, 1306 сл, 1248 сл, 1229 ср, 1176 сл, 1141 сл, 1116 ср, 1135 сл, 1012 сл, 969 сл, 943 сл, 856 сл, 819 ср, 771 ср, 747 ср, 636 сл. Спектр ЯМР 1Н (ДМСО-d6; δ, м.д. (J, Гц)): 2.0 (с., 6H, СН3), 3.11 (с., 6H, СН3), 7.0–8.5 (м., 24H, Наром), 10.71 (с., 1H, NH), 12.41 (с., 1H, NH).
Элементный анализ выполняли на приборе Perkin-Elmer 240C в лаборатории микроанализа Южного федерального университета. Спектры ЯМР 1Н снимали на спектрометре Bruker, 300 МГц при 20°С. ИК-спектры регистрировали на приборе Varian Scimitar 1000 FT-IR в вазелиновом масле в области 400–4000 см–1.
Магнитную восприимчивость комплекса I определяли относительным методом Фарадея при температуре 300 К при напряженности магнитного поля 9000 Э. Калибровку установки проводили по комплексу Hg[Co(CNS)4].
Квантово-химический расчет проводили в рамках теории функционала плотности (DFT) с использованием гибридного обменно-корреляционного функционала B3LYP [24] в валентно-расщепленном базисе гауссовых функций, расширенного поляризационными и диффузными функциями на всех атомах 6-311++G**. Использовали программу Gaussian’09 [25]. Оптимизацию геометрии проводили без ограничения по симметрии, для всех структур нормальные колебания с мнимой частотой отсутствовали. Для подготовки данных, презентационной графики, визуализации результатов расчетов использовали программу Chemcraft [26].
РСА проведен на дифрактометре XCalibur с координатным детектором EOS (Agilent Technologies UK Ltd., Yarnton, Oxfordshire, England). Сбор рефлексов, определение и уточнение параметров элементарной ячейки проведены при температуре 100(1) K с использованием монохроматизированного MoKα-излучения с λ = 0.71073 Å по программе CrysAlis PRO [27]. Структура решена прямыми методами. Позиции и тепловые параметры неводородных атомов уточнены изотропно, а затем анизотропно по методу МНК. Позиции атомов водорода получены из разностных Фурье- синтезов и уточнены в “модели наездника”. Одна из сольватных молекул ДМСО разупорядочена по двум позициям с заселенностью 50%. Все расчеты выполнены в программном комплексе SHELXTL [28].
Кристаллографические параметры, детали уточнения структуры соединения I приведены в табл. 1, избранные межатомные расстояния и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структуры I
| Параметры | Значения |
|---|---|
| Брутто-формула | C48H50N12O2S2BrCo |
| M | 1029.96 |
| Сингония | Триклинная |
| Пр. группа | $P\bar {1}$ |
| Температура, K | 100.0(1) |
| a, Å | 11.4216(4) |
| b, Å | 11.9154(5) |
| c, Å | 18.6368(8) |
| α, град | 103.947(4) |
| β, град | 99.148(4) |
| γ, град | 98.326(3) |
| V, Å3 | 2385.5(2) |
| Z | 2 |
| ρ(выч.), г/см3 | 1.434 |
| μ, мм–1 | 1.338 |
| F(000) | 1064 |
| Размер монокристалла, мм | 0.4 × 0.2 × 0.15 |
| Интервал по θ, град | 2.81–29.07 |
| Отражения собранные/ | 21 725 |
| независимые (Rint) | 12 752 (0.0438) |
| Отражения с I > 2σ(I) | 2199 |
| GOOF | 1.013 |
| Число уточняемых параметров | 620 |
| R1/wR2 (I > 2σ(I)) | 0.0495/0.0975 |
| R1/wR2 (по всем отражениям) | 0.0893/0.1120 |
| Δρmax/Δρmin, e Å–3 | 0.711/–0.591 |
Таблица 2.
Длины связей (Å) и валентные углы (град) комплекса I
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| Co(1)–N(2) | 1.869(2) | Co(1)–N(5) | 1.870(2) |
| Co(1)–N(4) | 1.937(2) | Co(1)–N(1) | 1.953(2) |
| Co(1)–N(6) | 1.982(2) | Co(1)–N(3) | 1.985(2) |
| N(11)–C(36) | 1.359(4) | N(6)–C(27) | 1.354(3) |
| N(11)–N(4) | 1.392(3) | N(1)–N(8) | 1.391(3) |
| N(12)–N(5) | 1.336(3) | N(9)–N(2) | 1.348(3) |
| N(9)–C(9) | 1.358(4) | N(7)–C(18) | 1.361(4) |
| N(7)–C(26) | 1.393(3) | N(6)–C(35) | 1.388(3) |
| N(12)–C(27) | 1.365(4) | N(10)–C(36) | 1.321(3) |
| N(10)–C(44) | 1.382(4) | N(3)–C(9) | 1.354(3) |
| N(5)–C(4) | 1.326(3) | N(3)–C(17) | 1.383(3) |
| N(1)–C(1) | 1.301(3) | N(4)–C(3) | 1.309(3) |
| N(2)–C(2) | 1.307(4) | N(8)–C(18) | 1.317(3) |
| C(25)–C(24) | 1.381(4) | C(4)–C(3) | 1.438(4) |
| C(25)–C(26) | 1.402(4) | C(4)–C(8) | 1.494(4) |
| C(19)–C(20) | 1.344(4) | C(16)–C(15) | 1.371(4) |
| C(19)–C(18) | 1.454(3) | C(16)–C(17) | 1.405(4) |
| C(13)–C(14) | 1.369(4) | C(14)–C(15) | 1.406(4) |
| C(13)–C(12) | 1.403(4) | C(30)–C(31) | 1.417(4) |
| C(29)–C(28) | 1.349(4) | C(30)–C(35) | 1.423(4) |
| C(29)–C(30) | 1.427(4) | C(1)–C(2) | 1.448(3) |
| C(1)–C(5) | 1.487(4) | C(24)–C(23) | 1.402(4) |
| C(3)–C(7) | 1.487(4) | C(37)–C(36) | 1.438(4) |
| C(26)–C(21) | 1.411(4) | C(20)–C(21) | 1.438(4) |
| C(11)–C(10) | 1.349(4) | C(35)–C(34) | 1.411(4) |
| C(11)–C(12) | 1.421(4) | C(39)–C(40) | 1.409(4) |
| C(31)–C(32) | 1.365(4) | C(39)–C(44) | 1.415(4) |
| C(38)–C(37) | 1.349(4) | C(34)–C(33) | 1.380(4) |
| C(38)–C(39) | 1.421(4) | C(21)–C(22) | 1.404(4) |
| C(2)–C(6) | 1.495(4) | C(23)–C(22) | 1.373(4) |
| C(9)–C(10) | 1.430(4) | C(17)–C(12) | 1.431(4) |
| C(27)–C(28) | 1.423(4) | ||
| Угол | ω, град | Угол | ω, град |
| N(2)Co(1)N(3) | 80.4(1) | N(5)Co(1)N(6) | 80.3(1) |
| N(2)Co(1)N(4) | 96.1(1) | N(4)Co(1)N(1) | 98.64(9) |
| N(5)Co(1)N(4) | 80.8(1) | N(2)Co(1)N(1) | 81.06(9) |
| N(5)Co(1)N(1) | 94.1(1) | N(6)Co(1)N(3) | 95.10(9) |
| N(1)Co(1)N(6) | 85.50(9) | N(4)Co(1)N(3) | 87.00(9) |
| N(4)Co(1)N(6) | 160.9(1) | N(1)Co(1)N(3) | 161.0(1) |
| N(5)Co(1)N(3) | 104.7(1) | N(2)Co(1)N(6) | 103.0(1) |
| N(2)Co(1)N(5) | 173.75(9) |
Дополнительные структурные данные для I депонированы в Кембриджском банке структурных данных (CCDC № 2099899; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
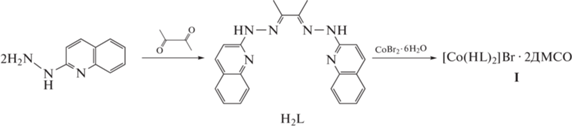
Бис-гетарилгидразон H2L и комплекс Co(III) на его основе I были синтезированы в соответствии со схемой 1 .
Схема 1 .
Состав и строение H2L были установлены с помощью методов элементного анализа, спектроскопии ЯМР 1Н и ИК.
В ИК-спектре H2L зарегистрирована полоса поглощения в области 3337 см–1, отвечающая валентным колебаниям NH-групп. В области 1616 и 1602 см–1 наблюдаются полосы поглощения валентных колебаний ν(C=N), соответствующие азометиновым группам и хинолиновым фрагментам соответственно.
В ЯМР 1Н спектре H2L зарегистрированы следующие сигналы: синглет в области 2.3 м.д. интенсивностью 6Н от протонов метильных групп диацетильного фрагмента; набор сигналов в области 7.3–8.2 м.д. интенсивностью 12Н от ароматических протонов хинолиновых фрагментов; синглет интенсивностью 2H в области 10.21 м.д. от NH-групп, который исчезает при добавлении D2O, что указывает на подвижный характер этих протонов. Такое положение сигналов подвижных NгидрH-протонов позволяет предположить реализацию в растворе единственного симметричного бис-гидразонового таутомера (a) (см. рис. 1). Бис-хинолоновый таутомер (в) в растворе ДМСО не присутствует, так как в этом случае сигнал NхинH должен быть сдвинут в слабое поле благодаря дезэкранирующему эффекту гетероароматического фрагмента (например, в спектре ЯМР 1H 2-хинолона в ДМСО-d6 этот сигнал наблюдается при 12.6 м.д.).
Рис. 1.
Пространственное изображение и значения относительных энергий ∆Е в ккал/моль таутомерных форм (а)–(в) лиганда H2L.
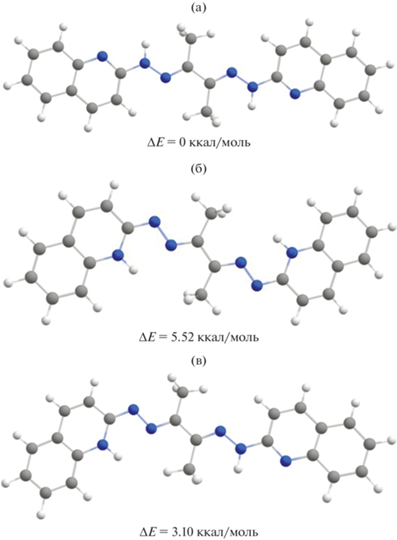
Для определения наиболее устойчивого таутомера лиганда H2L было проведено квантово-химическое моделирование строения таутомеров (а)–(в) в рамках теории функционала плотности (уровень теории B3LYP6-311++G**). Оценочными параметрами устойчивости являлись полная и относительная энергии таутомеров в газовой среде. В качестве сравнительной выступила форма с наименьшей полной энергией. Графическое изображение и значение относительных энергий, оптимизированных таутомерных форм представлены на рис. 1.
Результаты квантово-химического моделирования показали, что наиболее устойчивой является симметричная бис-гидразоновая форма (а), в которой атомы водорода локализированы на атомах азота гидразоновых фрагментов, что совпадает с экспериментальными результатами спектроскопии ЯМР. Бис-хинолоновая форма (б) является наименее устойчивой и дестабилизирована относительно формы (а) на 5.52 ккал/моль. Несимметричная форма (в) с локализацией протона на атомах азота гидразонового и хинолинового фрагментов дестабилизирована на 3.10 ккал/моль. Достаточно большая разница в энергиях между таутомерными формами (a)–(в) определяет присутствие в растворе единственного изомера (a).
При взаимодействии H2L с бромидом кобальта(II) было получено соединение [Co(HL)2]Br · · ДМСО (I), где HL – монодепротонированная форма лиганда (схема 1 ). На такой состав и строение соединения указывают данные элементного анализа, спектроскопии ИК, ЯМР 1Н, магнетохимии и РСА.
В ИК-спектре комплекса I в области 3197 и 3052 см–1 наблюдаются две полосы поглощения, соответствующие валентным колебаниям NH-групп. Полосы поглощения валентных колебаний групп C=N претерпевают высокочастотное смещение на 10–20 см–1, что указывает на координацию атомов азота азометиновых и хинолиновых фрагментов к иону металла.
Исследование магнитной восприимчивости комплекса I при комнатной температуре показало, что он проявляет диамагнитные свойства, характерные для низкоспиновых соединений Сo(III). Это обстоятельство свидетельствует о том, что в процессе комплексообразования происходит окисление иона Co2+ в Со3+. Такое явление достаточно часто наблюдается при получении октаэдричеcких комплексов Co(II) с лигандами, создающими сильное кристаллическое поле [22]. Его можно объяснить тем, что в низкоспиновом состоянии ион Co2+ имеет один неспаренный электрон на высоколежащих орбиталях ${{d}_{{{{x}^{2}} - {{y}^{2}}}}}$ или ${{d}_{{{{z}^{2}}}}}$ (состояние: (t2g)6(eg)1), поэтому для достижения более устойчивого состояния (t2g)6 ион Co2+ легко отдает электрон окислителю, переходя в Со3+.
В спектре ЯМР 1Н комплекса I зарегистрированы следующие сигналы: два синглета в области 2.0 и 3.11 м.д. интенсивностью 6Н каждый от протонов метильных групп двух диацетильных фрагментов; набор мультиплетов в области 7.0–8.5 м.д. интенсивностью 24Н от ароматических протонов хинолиновых фрагментов; два синглета (1Н) в области 10.71 и 12.41 м.д. от протонов NH-групп. Неэквивалентность протонов метильных и NH-групп, а также форма сигналов ароматических протонов указывает на то, что лиганды в комплексе находятся в различных таутомерных формах. Небольшой сдвиг одного из NH сигналов в комплексе (10.71 м.д.) по отношению к соединению H2L (10.21 м.д.) можно отнести за счет координации одного из лигандов с сохранением гидразоновой таутомерной формы, а значительный сдвиг второго сигналов в слабое поле (12.41 м.д.) может быть объяснено только реализацией хинолонового таутомера для второго лиганда.
Это предположение подтверждается результатами РСА комплекса I. На рис. 2 показана молекулярная структура соединения, которая представлена гексакоординированным катионным комплексом кобальта(III) с внешнесферным бромид анионом, а также двумя сольватными молекулами ДМСО.
Рис. 2.
Молекулярная структура соединения I. Штриховыми линиями показаны внутри- и межмолекулярные водородные связи. Сольватные молекулы ДМСО и атомы водородов, не участвующие в образовании H-связей, не показаны для ясности.
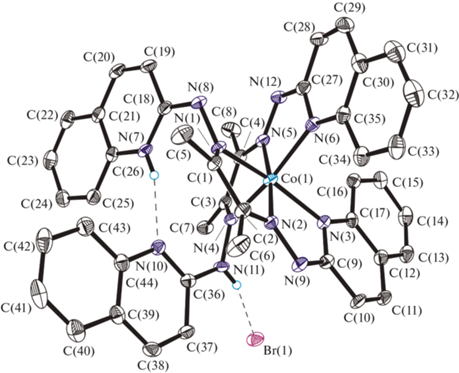
Катионный комплекс Co(III) образован двумя неэквивалентными монодепротонированными бис-хинолилгидразонами (HL), которые, как и в растворе ДМСО (что было независимо установлено методом спектроскопии ЯМР 1Н), так и в кристаллическом виде находятся в различных та-утомерных формах. Каждый из лигандов, несмотря на наличие большего количества координационных возможностей, выступает как тридентатный, а атомы азота одного из хинолиновых фрагментов каждого лиганда не участвуют в координации иона Co(III), при этом один из них (N(7)) протонирован и участвует в образовании внутримолекулярной межлигандной водородной связи N(7)–H…N(10) с другим атомом азота в хинолиновом фрагменте второго лиганда, как показано на рис. 2. Второй лиганд находится в гидразоновой форме, атом водорода, соответственно, локализован у атома азота N(11); в этом случае образуется межмолекулярная водородная связь с бромид анионом. Геометрические характеристики водородных связей представлены в табл. 3.
Таблица 3.
Геометрические характеристики внутри- и межмолекулярных водородных связей в кристаллической структуре соединения I
| Контакт D–H⋅⋅⋅A | Расстояние, Å | Угол DHA, град | ||
|---|---|---|---|---|
| D–H | H···A | D···A | ||
| N(7)–H···N(10) | 0.81 | 2.15 | 2.938(2) | 164.5 |
| N(7)–H···N(4) | 0.81 | 2.63 | 3.165(3) | 125.3 |
| N(11)–H···Br(1) | 0.83 | 2.43 | 3.220(3) | 161.5 |
Из данных табл. 3 видно, что несмотря на близкие значения расстояния донор–акцептор атома азота N(7) с атомом N(4) гидразонного фрагмента второго лиганда, водородная связь, образованная фрагментом N(7)H, ориентирована на гетероциклический атом азота N(10), о чем свидетельствует близкий к оптимальному угол DHA и расстояние H…N(10) 2.152 Å (что на 0.59 Å меньше суммы ван-дер-ваальсовых радиусов атомов водорода и азота). О прочности межлигандной связи N(7)–H…N(10) можно судить, сравнивая ее геометрические характеристики с другими охарактеризованными структурно соединениями. По данным Кембриджской базы структурных данных (КБСД, версия CSD 5.42 c дополнениями от февраля и мая 2021 года), для 132 производных хинолона, образующих межмолекулярную водородную связь NH с гетероароматическим атомом азота, среднее значение расстояний D…A и H…A равны 3.165 ± 0.205 и 2.357 ± 0.248 Å соответственно. Для соединения I данные расстояния значительно меньше средних значений.
Структурные характеристики водородной связи N(7)–H…Br(1) также свидетельствуют об ее прочности, угол DHA близок к 180°, расстояние H…Br(1) 2.427 Å (что на 0.62 Å меньше суммы ван-дер-ваальсовых радиусов атомов водорода и брома). Для 20 структур ациклических гидразонов с межмолекулярной водородной связью NH с бромид-анионом, обнаруженных в КБСД, среднее значение расстояний N…Br и NH…Br равны 3.412 ± 0.112 и 2.671 ± 0.164 Å соответственно, существенно превышая аналогичные расстояния в соединении I.
Следует отметить, что локализация атомов водорода при атомах азота в лигандах коррелирует с распределением в них длин связей. Действительно, геометрическое строение лигандов, координирующихся к иону кобальта(III) в разных таутомерных формах различно; на рис. 3 представлено сравнение длин связей в них. В каждом из рассматриваемых лигандов имеются различные связи N–N, одна из которых одинарная N(1)–N(8) или N(4)–N(11) (1.392(3) Å), а другая имеет более выраженный двойной характер N(2)–N(9) и N(5)–N(12) (1.347(3) и 1.336(3) Å соответственно). Следует отметить, что связь C(4)–N(5) 1.324(3) Å превосходит по длине аналогичные, лежащие в интервале 1.301(3)–1.309(3) Å. Связь C(18)–N(8) 1.317(3) Å в хинолоновом лиганде существенно короче аналогичных одинарных связей C–N (1.359(3)–1.365(3) Å). Обращает на себя внимание, удлинение связей C–N вблизи протонированного атома азота N(7) (1.361(3) и 1.393(3) Å) по сравнению с аналогичными в непротонированном некоординированном хинолиновом фрагменте, они ожидаемо сравнимы с таковыми в координированных к иону металла хинолиновых фрагментах. Координация лиганда в разных таутомерных формах дополнительно подтверждаются различием в величинах валентных углов при гетероатоме в протонированном и непротонированном хинолиновых фрагментах СN(7)С 123.8(2)° и СN(10)С 117.4(2)°.
Рис. 3.
Координация лигандов в хинолоновой (а) и гидразоновой (б) формах в составе катионного комплекса в соединении I.
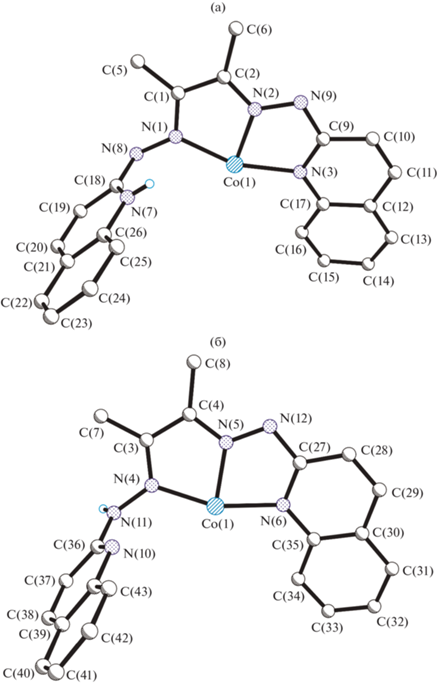
В отличие от свободных молекул, лиганды имеют неплоское строение, хинолиновые фрагменты в них находятся под углами 89.2° и 78.3° для лигандов в хинолоновой и гидразоновой формах соответственно. Хинолиновые фрагменты разных лигандов, которые координируются и не координируются к иону кобальта, также находятся примерно перпендикулярно друг к другу, 75.2° и 84.9° соответственно.
Ион Co(III) имеет искаженное октаэдрическое полностью азотное координационное окружение. Октаэдр CoN6 слегка сжат вдоль направления N(2)–Co(1)–N(5), среднее значение апикальных длин связей Co–N (1.870(2) Å). В экваториальной плоскости длины связей Co–N незначительно отличаются между собой и лежат в интервале 1.937(2)–1.985(2) Å. Для оценки искажений от идеальной октаэдрической геометрии были использованы параметры октаэдрического искажения (Σ, Θ и ζ). Параметры искажения ∑, Θ и ζ для катионного комплекса в соединении I составили 96.73°, 305.36° и 0.253 Å соответственно; что указывает на существенные искажения в валентных (см. табл. 2) и диэдральных углах при не столь сильных отличиях в длинах связей Co–N (идеальный октаэдрический комплекс соответствует Σ = = Θ = 0). Структурные искажения координационной среды иона кобальта(III) также были определены по программе SHAPE (2.216 для октаэдра и 9.981 для тригонально-призматического окружения, где нулевое значение показателя означает идеальную октаэдрическую геометрию). Проведенный анализ указывает на однозначное отличие от тригонально-призматического окружения, в пользу искаженного октаэдрического.
На основании баланса зарядов и длин связей Co–N (табл. 2) ион кобальта в рассматриваемом комплексе находится в низкоспиновом трехвалентном состоянии, что согласуется с диамагнитными свойствами данного комплекса.
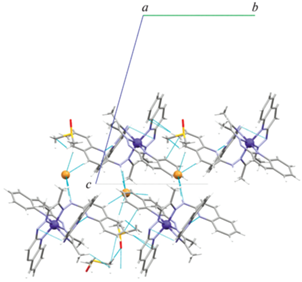
На рис. 4 показана кристаллическая упаковка I. Соединение I кристаллизуется в триклинной сингонии, пространственная группа $P\bar {1}$. Помимо электростатических сил, кристаллическая структура I стабилизирована водородными связями между бромид-анионами и молекулами катионного комплекса, а также сольватными молекулами ДМСО, атомы кислорода молекул ДМСО также участвуют в межмолекулярных Н-связях (рис. 4).
Рис. 4.
Кристаллическая упаковка I: проекция на кристаллографическую плоскость bc (штриховыми линиями показаны межмолекулярные контакты).
Таким образом, в настоящей работе был проведен синтез и исследование новой полидентантной лигандной системы – продукта конденсации 2-гидразинохинолина с диацетилом. По данным спектроскопии ЯМР и квантово-химического моделирования показано, что полученное соединение существует в единственной бис-гидразонной таутомерной форме. Методом рентгеноструктурного анализа показано, что при взаимодействии с бромидом кобальта(II) образуется низкоспиновый комплекс Co(III) несимметричного строения, в котором две монодепротонированные молекулы лиганда находятся в разных таутомерных формах – гидразоновой и хинолоновой. Одновременная реализация различных форм лиганда в металлохелате определяется прочными водородными связями между лигандами и одного из лигандов с внешнесферным бромид-анионом, которые стабилизируют соответствующие таутомерные формы.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Suvarapu L.N., Seo Y.K., Baek S.O., Ammireddy V.R. // J. Chem. 2012. V. 9. P. 1288.
Rollas S., Küçükgüzel Ş.G. // Molecules. 2007. V. 12. P. 1910.
Popp F.D. // Eur. J. Med. Chem. 1989. V. 24. № 3. P. 313.
Reece P.A. // Med. Res. Rev. 1981. V. 1. № 1. P. 73.
Bakale R.P., Ganesh N.N., Mangannavar C.V. et al. // Eur. J. Med. Chem. 2014. V. 73. P. 38.
Usegi K., Sik L.J., Nishioka H. et al. // Microchem. J. 1994. V. 50. № 1. P. 88.
Singh R.B., Jain P., Singh R.P. // Talanta. 1982. V. 29. № 2. P. 77.
Lukov V.V., Tsaturyan A.A., Tupolova Yu.P. et al. // J. Mol. Struct. 2020. V. 1199. Art. № 126952.
Tupolova Yu.P., Shcherbakov I.N., Popov L.D. et al. // Dalton Trans. 2019. V. 48. № 20. P. 6960.
Lukov V.V., Tsaturyan A.A., Tupolova Yu.P. et al. // Mendeleev Commun. 2019. V. 29. № 1. P. 43.
Tupolova Yu.P., Shcherbakov I.N., Korchagin D.V. et al. // J. Phys. Chem. C. 2020. V. 124. № 47. P. 25957.
Попов Л.Д., Распопова Е.А., Бородкин С.А. и др. // Журн. общ. химии. 2020. Т. 90. № 3. С. 432 (Popov L.D., Raspopova E.A., Borodkin S.A. et al. // Russ. J. Gen. Chem. 2020. V. 90. № 3. P. 410). https://doi.org/10.1134/S1070363220030135
Levchenkov S.I., Shcherbakov I.N., Popov L.D. et al. // Inorg. Chim. Acta. 2013. V. 405. P. 169.
Tupolova Y.P., Levchenkov S.I., Popov L.D. et al. // NJC. 2021. V. 45. № 27. P. 12236.
Зеленин К.Н., Хорсеева Л.А., Алексеев В.В. // Хим.-фарм. журн. 1992. Т. 26. № 5. С. 30.
Al-Sha’alan N.H. // Molecules. 2007. V. 12. P. 1080.
Marzano C., Pellei M., Tisato F., Santini C. // Anti-Cancer Agents Med. Chem. 2009. V. 9 P. 185.
Santini C., Maura Pellei M., Gandin V. et al. // Chem. Rev. 2014. V. 114. P. 815.
Луков В.В., Щербаков И.Н., Левченков С.И. и др. // Коорд. химия. 2019. Т. 45. № 3. С. 131 (Lukov V.V., Shcherbakov I.N., Levchenkov S.I. et al. // Russ. J. Coord. Chem. 2019. V. 45. P. 163). https://doi.org/10.1134/S1070328419030060
Туполова Ю.П., Щербаков И.Н., Ткачев В.В. и др. // Коорд. химия. 2018. Т. 44. № 1. С. 43 (Tupolova Y.P., Shcherbakov I.N., Popov L.D. et al. // Russ. J. Coord. Chem. 2018. V. 44. Р. 132). https://doi.org/10.1134/S1070328418020112
Lyubchenko S.N., Shcherbakov I.N., Tupolova Y.P. et al. // Inorg. Chim. Acta. 2020. V. 502. Art. № 119284.
Lukov V.V., Tsaturyan A.A., Tupolova Y.P. et al. // NJC. 2020. V. 44. № 5. P. 2146.
Дзиомко В.М., Красавин И.А., Мирошкина Н.И. // Методы получения химических реактивов и препаратов. 1965. № 12. С. 50.
Becke A.D. // J. Chem. Phys. 1993. V. 98. № 7. P. 5648. https://doi.org/10.1063/1.464913
Frisch M.J. Gaussian 09, Revision A.02. 2009.
Zhurko G.A., Zhurko D.A. Chemcraft. Version 1.6 (build 338). http://www.chemcraftprog.com.
CrysAlisPro. Version 171.36.20. Yarnton Oxfordshire (England): Agilent Technologies UK Ltd., 2011.
SHELXTL. Version 6.14. Madison (WI, USA): Bruker AXS, 2000.
Дополнительные материалы отсутствуют.
Инструменты
Координационная химия