Кристаллография, 2019, T. 64, № 1, стр. 144-151
Нуклеация и рост кристаллитов из модельного раствора жидкости полости рта в присутствии аминокислот
Е. С. Чиканова 1, *, О. А. Голованова 1
1 Омский государственный университет
Омск, Россия
* E-mail: chikanova_es@mail.ru
Поступила в редакцию 27.03.2017
После доработки 25.09.2017
Принята к публикации 29.09.2017
Аннотация
Изучены процессы зародышеобразования и роста кристаллитов из модельного раствора жидкости полости рта в присутствии аминокислот физиологической концентрации и в 5 раз больше нормы. Установлено, что добавки могут уменьшать или увеличивать скорость кристаллизации в зависимости от природы аминокислоты, ее концентрации и исходного пересыщения в растворе.
ВВЕДЕНИЕ
Отличительной чертой мира минералов и биологического мира является их дискретный характер и то, что они являются автономными системами, морфология и функционирование которых определяются в большей степени внутренними факторами, чем внешними [1, 2]. Естественные реакции живого организма на взаимодействующие с ним минеральные индивиды и агрегаты — разрушение или отторжение.
Характерным новообразованием, возникающим на зубах 75–80% людей, являются зубные камни – дентолиты [3–9]. К настоящему времени имеются данные по комплексному исследованию состава (минерального, элементного, органической неминеральной составляющей) зубных камней [3, 5–10]. Не выясненными остаются вопросы механизма образования дентолитов и факторов, способствующих данному процессу. Интерес к данной проблеме возрастает из-за ухудшения экологической обстановки в мире, что является одним из важнейших факторов роста заболеваний, приводящих к возникновению патогенных биоминеральных образований в организме человека [10–14].
Особенности кристаллизации камней в организме человека долгое время оставались исключительно в сфере интересов медицины с привычными для нее методами исследования. В настоящее время эти образования являются объектами активно развивающейся науки “Биоминералогии”, по данным которой взаимодействие органической и минеральной составляющих органоминеральных агрегатов (ОМА) имеет важное значение при биогенной и патогенной кристаллизации. С данными процессами связано формирование костного и зубного матрикса млекопитающих, а также зарождение и рост патогенных минералов [15–21].
Многие исследователи отмечают, что именно специфичность органической компоненты в значительной степени контролирует процесс фазообразования в организме человека [5, 15, 16, 18]. Например, в [22, 23] показано, что взаимодействие белков с фосфатами кальция (основные минералы зубных камней) в основном зависит от электростатических сил, а иногда и от водородной связи, что подтверждается результатами экспериментального и компьютерного моделирования результатов. Разные белки имеют различные механизмы взаимодействия заряженных групп, которые приводят к различному поведению фосфатов кальция при процессах кристаллизации.
На данный момент накоплены сведения о влиянии состава биологического раствора на фазовый состав осадков и кинетику кристаллизации фосфатов кальция [5, 16, 17, 19–21]. Однако недостаточно информации о характере их кристаллизации в сложных по составу физиологических растворах. Новые данные по изучению кристаллизации фосфатов кальция из растворов в присутствии аминокислот (АК) необходимы как с точки зрения фундаментальной перспективы понимания процессов биоминерализации, так и с медицинской точки зрения для предупреждения образования патогенных ОМА в организме человека.
Цель работы – изучение кинетических закономерностей кристаллизации (нуклеации и кинетики роста) из модельных растворов жидкости полости рта и установление роли АК биосред на параметры кристаллизации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление растворов. Для изучения были приготовлены модельные растворы по ионно-электролитному составу, рН, ионной силе, близкие к реальной системе (рН = 7.0, ионная сила 0.040 моль/л), методика их приготовления представлена в [20]. В качестве добавок выбраны АК различных групп, их концентрации представлены в табл. 1 [27]. Исходные α-АК были в виде порошков D-, L-изомеров, степень чистоты – ч.д.а. Изучение кинетики кристаллизации проводили при пересыщениях S = 25, 30, 35.
Таблица 1.
Вид и концентрация аминокислот
| Аминокислота | Изоэлектриче-ская точка pI | Сфиз, ммоль/л | Сфиз·5, ммоль/л |
|---|---|---|---|
| Глицин Gly | 5.97 | 1.93 | 9.65 |
| L-серин Ser | 2.98 | 1.67 | 8.35 |
| L-аланин Ala | 6.11 | 1.54 | 7.70 |
| D-, L-аспарагиновая кислота Asp | 5.68 | 1.28 | 6.40 |
| L-глутаминовая кислота Glu | 3.22 | 1.88 | 9.40 |
Скорость зародышеобразования. Для изучения стадии нуклеации использовался визуальный метод, основанный на фиксировании времени периода индукции (помутнение раствора) секундомером. Метод является достаточно точным (погрешность 5%) при установлении качественных зависимостей процесса кристаллизации. Процесс зародышеобразования регулировался путем соблюдения постоянства условий смешивания, термостатирования 25°С, отсутствия перемешивания. Расчет удельной поверхностной энергии σ описан в [20].
Скорость роста. Кинетические характеристики кристаллизации определяли турбидиметрическим методом – методом анализа мутных сред, основанным на измерении интенсивности поглощенного ими света. Измерения проводили на приборе КФК-2, в качестве холостого раствора использовалась дистиллированная вода. Измерения оптической плотности растворов проводили при длине волны λ = 670 нм в стеклянных кюветах с толщиной светопоглощающего слоя l = = 2.007 см. Показания колориметра отмечали по секундомеру через определенные промежутки времени, подобранные эмпирическим путем. Показания прибора снимали до тех пор, пока значение оптической плотности во времени не переставало изменяться. Для каждого опыта проводили по три параллельных измерения. Погрешность не превышала 5%.
Метод лазерной дифракции. Размер частиц определяли на лазерном дифракционном анализаторе Shimadzu SALD-2101. При проведении анализа модельный раствор помещали в кварцевую кювету анализатора, общий объем которой составлял 18 мл, после чего кювету с пробой помещали в анализатор и проводили снятие показаний прибора через определенные промежутки времени. По результатам анализа, используя специальное программное обеспечение (WING-2, WING-3), получили кривую распределения частиц по размеру, а также средний размер частиц в микрометрах. Для получения более достоверных результатов анализ образцов проводили с 4–5-кратной повторяемостью, при этом относительное стандартное отклонение для данных измерений составило Sr = 0.02–0.04.
Методика изучения адсорбции АК на минеральных фазах. Для проведения эксперимента навеску твердой фазы (m = 0.5 г) помещали в колбу и заливали раствором АК (V = 25 мл): концентрация 2, 4, 6, 8, 10, 15, 20, 25, 30 ммоль/л (диапазон концентрации, характерный для жидкости полости рта [27]). Проводили 30-минутное встряхивание, после чего оставляли на 48 ч. По истечении заданного времени содержимое отфильтровывали и определяли остаточное содержание АК в фильтрате (спектрофотометрия, КФК-2), рН раствора после сорбции, определяли массу осадков. Для описания изотерм адсорбции провели обработку экспериментальных данных с позиции теории Ленгмюра (1) и Фрейндлиха (2) [28]:
где Г∞ – величина предельной адсорбции, моль/кг, K – константа адсорбционного равновесия, С – равновесная концентрация адсорбата, моль/л; где а – коэффициент пропорциональности, n – показатель степени, n < 1.Расчет изменения энергии Гиббса адсорбции вели по формуле
где R – универсальная газовая постоянная, R = = 8.314 кДж/(моль·K), Т – температура, К, K – константа адсорбционного равновесия.Твердую фазу исследовали физическими методами (ИК-фурье-спектроскопия, рентгенофазовый анализ (РФА), оптическая микроскопия), удельную площадь поверхности по методу Брунауэра–Эммета–Теллера (БЭТ).
Рентгенофазовый анализ был проведен на порошковом рентгеновском дифрактометре D8 Advance (Bruker) в CuKα-излучении (λ = 0.15406 нм) с использованием позиционно-чувствительного линейного детектора Lynxeye. Использованы следующие режимы измерения: для фазового анализа шаг сканирования – 0.1°, время накопления сигнала – 2 с/точка, напряжение и ток накала 40 кВ и 40 мА соответственно. Область сканирования 2θ 4°–90°. Расшифровка полученных дифрактограмм проведена с использованием базы данных по порошковой дифракции ICDD PDF-2 2006 г.
ИК-фурье-спектроскопия. Изучение образцов методом ИК-фурье-спектроскопии проведено на приборе ФСМ-2202. Диапазон сканирования 400–5000 см–1, разрешение 8 см–1. Для этого были изготовлены таблетки исследуемого материала с KBr (ос. ч.).
Удельная площадь поверхности образцов определена классическим адсорбционным методом. Удельная поверхность образцов измерена по методике одноточечной адсорбции азота при 77.4 К на адсорбционном приборе “Сорбтометр” производства ООО Катакон, Россия. Расчет полученных величин SБЭТ (м2/г) выполнен по методу БЭТ.
Оптическая микроскопия. Образцы твердой фазы анализировали на оптическом бинокулярном микроскопе XSP-104, увеличение 100. Фотографии сделаны с помощью видеоокуляра ToupCam UCMOS03100KPA с разрешением 2048*1536 пикселей.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
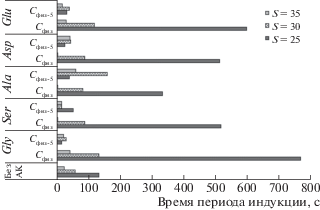
Исследование стадии зародышеобразования. В ходе работы установлено, что добавки АК значительно влияют на процессы кристаллизации нерастворимых фаз фосфатов кальция in vitro из раствора жидкости полости рта. Выявлено, что при физиологической концентрации и пересыщении S = 25, 30 АК уменьшают скорость зародышеобразования в 2.5–5.8 раз по сравнению с аналогичным раствором без АК (рис. 1). Предложен ряд по влиянию АК на процессы нуклеации – глицин (5.8 раз) > глутаминовая кислота (4.5 раз) > серин ≈ аспарагиновая кислота (3.9 раз) > аланин (2.5 раз). При S = 35 действие АК противоположно, так как они могут выступать центрами кристаллизации, за исключением глицина (уменьшает скорость нуклеации в 1.7 раз) и глутаминовой кислоты (в 1.2 раза). С ростом содержания добавки в модельном растворе (Сфиз·5) время периода индукции в большинстве случаев сокращается. Но отлично от других АК ведут себя аланин (при S = 30 – 2.7 раза, S = 35 – 2.4 раза) и аспарагиновая кислота (S = 35 – 1.7 раз). Таким образом, общий ингибирующий эффект наблюдается при физиологической концентрации и относительно невысоком пересыщении системы, что наиболее соответствует реальным процессам [29, 30].
Рис. 1.
Время периода индукции при варьировании концентрации аминокислот в модельном растворе жидкости полости рта.
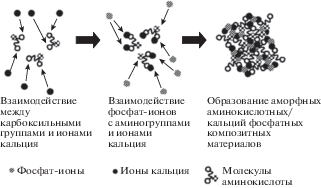
Анализ значений, представленных в табл. 2, показал, что АК, адсорбируясь на активных центрах зародыша и образуя комплексы с ионами кальция, уменьшают скорость нуклеации при физиологической концентрации и следовательно повышают удельную поверхностную энергию. Но при увеличении содержания АК выступают в роли затравок при нуклеации и σ в этом случае снижается. Значения σ указывают на гетерогенный механизм зарождения. При этом меньшее значение поверхностной энергии является “эффективным”, отражающим адгезию зародыша на активном центре. Поскольку при выбранном значении рН АК находятся в растворе в виде цвиттер-ионов [31], взаимодействие с фосфатами кальция может протекать по двум направлениям. Зарождение новой фазы инициируется активными центрами, входящими в состав органических молекул (карбоксильные и аминогруппы). Так, в [32] описано действие аспарагиновой и глутаминовой кислот на образование композиционных материалов АК/СаР, которое схематически представлено на рис. 2, что находится в соответствии с полученными результатами.
Таблица 2.
Удельная поверхностная энергия σ, рассчитанная по теории Гиббса–Фольмера, (мДж/м2)
| Аминокислота | Сфиз | Сфиз·5 |
|---|---|---|
| Без аминокислоты | 46 | |
| Глицин | 56.9 | 34.9 |
| Серин | 65.9 | 42.7 |
| Аланин | 63.6 | 31.9 |
| Аспарагиновая кислота | 65.9 | 32.2 |
| Глутаминовая кислота | 57.3 | 32.6 |
Рис. 2.
Схематическое взаимодействие аминокислот с ионами кальция и фосфатами с образованием композитов [11].
Исследование стадии роста. При сравнении действия АК на скорость роста при разных пересыщениях и разных концентрациях АК отмечено, что оно также неодинаково. При пересыщении S = 25 на кинетической кривой D = f(t) наблюдается один участок, с увеличением пересыщения участков становится два (рис. 3). При этом первый участок соответствует росту, а второй агрегации частиц [21].
Рис. 3.
Кинетические кривые кристаллизации из модельного раствора слюны в присутствии глицина (Сфиз): S = 25 (а), S = 35 (б).
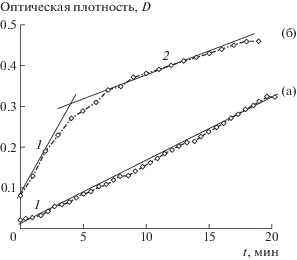
Рассчитанные графическим методом кинетические параметры представлены в табл. 3. Кажущийся порядок кристаллизации равен нулю. Значения констант скорости реакции, полученные при исходном пересыщении S = 25, меньше, чем в [21], что говорит об ингибирующем действии АК на стадии роста (в скобках указано относительное изменение скорости): глицин (2 раза) > > аспарагиновая кислота (1.9 раз) > глутаминовая кислота (1.2 раз) > серин (1.5 раза) > аланин (скорость роста практически не изменяет). Одновременное присутствие в кристаллизационной среде большого количества активных центров, а также диффузионные затруднения массопереноса (из-за меньшего исходного пересыщения) обусловливают протекание стадии зарождения преимущественно без последующего активного роста образовавшихся частиц [33], такие условия влияют на образование агрегатов меньшего размера. Так же, как и на стадии зародышеобразования, при S = 35 и Сфиз влияние на скорость роста противоположно. Увеличение скорости агрегации частиц с увеличением пересыщения и концентрации добавки связано с тем, что образующиеся агломераты становятся заряженными, поэтому сильнее притягиваются друг к другу, также увеличиваются константы скорости. Аналогичные закономерности описаны в работе по изучению кристаллизации оксалата кальция [34].
Таблица 3.
Кинетические параметры кристаллизации в присутствии аминокислот, Сфиз
| Аминокислота | Пересыщение S | ||||
|---|---|---|---|---|---|
| 25 | 30 | 35 | |||
| k × 103, с–1 | k × 103, с–1 | k × 103, с–1 | k × 103, с–1 | k × 103, с–1 | |
| Без аминокислоты | 13.0 ± 4.2 | 18.0 ± 4.0 | 5.5 ± 0.5 | 18.5 ± 2.9 | 5.1 ± 0.8 |
| Глицин | 8.4 ± 0.7 | 25.5 ± 3.8 | 8.9 ± 0.2 | 43.1 ± 2.5 | 11.0 ± 1.9 |
| Серин | 11.3 ± 0.9 | 28.9 ± 2.4 | 7.4 ± 0.6 | 47.3 ± 2.6 | 7.7 ± 0.7 |
| Аланин | 16.3 ± 1.1 | 28.3 ± 3.2 | 13.9 ± 0.8 | 61.0 ± 3.1 | 11.3 ± 1.8 |
| Аспарагиновая | 8.9 ± 0.7 | 18.5 ± 1.6 | 6.2 ± 0.4 | 55.0 ± 2.7 | 12.0 ± 1.5 |
| Глутаминовая | 8.6 ± 0.8 | 27.6 ± 3.5 | 8.7 ± 0.9 | 45.0 ± 3.8 | 9.0 ± 0.8 |
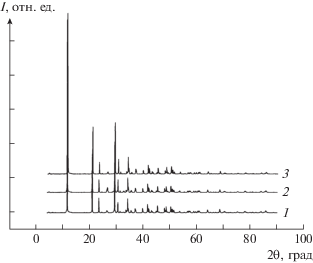
Методом лазерной дифракции по кривым распределения (рис. 4) определен размер образующихся твердых частиц (табл. 4). Как видно из таблицы, в целом добавки АК уменьшают размеры и скорость роста. Наименьшие агрегаты образуются из модельного раствора слюны в присутствии аланина физиологической концентрации, а наибольшие в присутствии глутаминовой кислоты. Преобладающим механизмом роста при низком пересыщении и концентрации добавки является оставльдовское созревание (изотермическая перегонка), с увеличением концентрации осадкообразующих ионов и АК – агрегация.
Рис. 4.
Дифференциальные кривые распределения размера частиц в процессе кристаллизации в разные
промежутки времени из модельного раствора жидкости полости рта S = 25 с добавкой глицина: 1 ( ), 5 (
), 5 ( ), 10 (
), 10 ( ), 15 (
), 15 (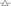 ), 20 мин (
), 20 мин ( ).
).
Таблица 4.
Средний размер (d) и средняя скорость роста (v) частиц в присутствии аминокислот
| Аминокислота | S = 25 | S = 30 | ||||||
|---|---|---|---|---|---|---|---|---|
| d, мкм | $\text{v}$, мкм/мин | d, мкм | $\text{v}$, мкм/мин | |||||
| Сфиз | Сфиз·5 | Сфиз | Сфиз·5 | Сфиз | Сфиз·5 | |||
| Без аминокислоты | 198.4 | 4.4 | 94.8 | 1.9 | ||||
| Глицин | 23.2 | 23.4 | 1.2 | 0.8 | 21.7 | 23.6 | 1.1 | 0.9 |
| Серин | 31.9 | 81.2 | 0.9 | 3.2 | 28.9 | 32.5 | 1.4 | 1.3 |
| Аланин | 12.0 | 32.8 | 0.7 | 1.1 | 39.8 | 28.7 | 2.2 | 1.3 |
| Аспарагиновая | 53.8 | 31.3 | 1.5 | 0.9 | 31.3 | 28.2 | 1.6 | 0.8 |
| Глутаминовая | 60.6 | 83.4 | 3.0 | 4.2 | 80.6 | 90.7 | 6.2 | 4.3 |
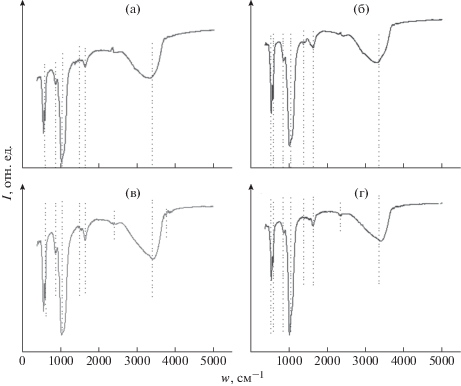
При анализе твердых образцов методом ИК-фурье-спектроскопии установлено, что АК входят в состав осадка. На ИК-спектрах (рис. 5) присутствуют колебания –NH2 1640–1630, 1530–485 см–1, колебания –СООН 1335–1330, 2120–2080 см–1. Кроме того, содержатся полосы, характерные для фосфатов кальция: 563, 602 см–1 соответствуют деформационным колебаниям ${\text{PO}}_{{\text{4}}}^{{3 - }}$, а полоса 1033.9 см–1 – валентным колебаниям этой группы, 3410.5 см–1 относится к колебаниям воды, малоинтенсивная полоса 868 см–1 соответствует деформационным колебаниям ${\text{CO}}_{3}^{{2 - }}$.
Рис. 5.
ИК-спектры образцов, полученных из модельного раствора жидкости ротовой полости, S = 25, рН = 7.0, 24 ч кристаллизации в присутствии: аланина (а), аспарагиновой кислоты (б), серина (в), глицина (г), концентрация АК физиологическая.
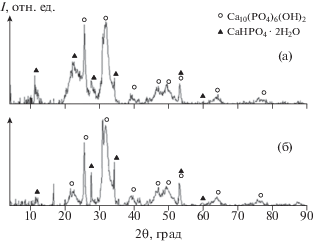
Данные РФА осадков, полученных в присутствии АК, показывают, что образуется смесь фосфатов кальция: Ca10(PO4)6((CO3)0,5(OH)) (ICDD 01-072-7532) и CaHPO4 · 2H2O (ICDD 01-072-0713), а также аморфный фосфат кальция (рис. 6). Отмечено, что содержание глицина в исходной среде увеличивает долю CaHPO4 · 2H2O в составе осадка. С другими АК состав примерно одинаков, с меньшим содержанием CaHPO4 · 2H2O. Изменение концентрации АК и исходного пересыщения не приводит к изменению фазового состава образцов.
Изучение адсорбции аминокислот на CaHPO4 · 2H2O и Ca10(PO4)6(OH)2. Согласно [6, 20] в пересыщенной модельной системе образуются две основные минеральные фазы – CaHPO4 · 2H2O и Ca10(PO4)6(OH)2, поэтому было изучено адсорбционное взаимодействие АК с этими фазами (табл. 5). Данные табл. 5 показывают, что выбранные фосфаты кальция отличаются дисперсностью, удельной поверхностью и зарядом частиц в водном растворе.
Таблица 5.
Характеристика минеральных фаз
| Показатель | CaHPO4 · 2H2O | Ca10(PO4)6(OH)2 |
|---|---|---|
| Значение удельной площади поверхности, м2/г | 12 | 93 |
| Размер кристаллитов, мкм | ~50 | ~13 |
| Заряд частиц в водном растворе | + | +/– |
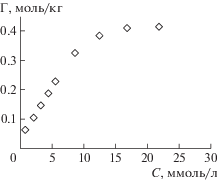
В работе установлено, что с достаточной степенью достоверности (0.95) изотермы адсорбции АК (рис. 7) для исследуемых фосфатов кальция описываются моделью Ленгмюра. Рассчитанные уравнения приведены в табл. 6. По величине предельной адсорбции АК можно расположить в ряд: для CaHPO4 · 2H2O – глицин > глутаминовая кислота > аспарагиновая кислота > аланин > серин; для Ca10(PO4)6(OH)2 – глицин > серин > глутаминовая кислота > аланин > аспарагиновая кислота. Выявлено, что глицин и серин лучше адсорбируются на поверхности Ca10(PO4)6(OH)2, в то время как глутаминовая и аспарагиновая кислоты на CaHPO4 · 2H2O, для аланина величина предельной адсорбции не зависит от типа сорбента.
Таблица 6.
Параметры адсорбции аминокислот на фосфатах кальция
| Аминокислота | CaHPO4 · 2H2O | Ca10(PO4)6(OH)2 | ||
|---|---|---|---|---|
| Уравнение Ленгмюра | ΔG, Дж/моль | Уравнение Ленгмюра | ΔG, Дж/моль | |
| Глицин | $\Gamma = {\text{0}}{\text{.597}}\frac{{{\text{49}}{\text{.95}}C}}{{{\text{1}} + {\text{49}}{\text{.95}}C}}$ | 689.8 | $\Gamma = {\text{0}}{\text{.668}}\frac{{{\text{41}}{\text{.23}}C}}{{{\text{1}} + {\text{41}}{\text{.23}}C}}$ | 214.5 |
| Глутаминовая | $\Gamma = {\text{0}}{\text{.371}}\frac{{{\text{18}}{\text{.01}}C}}{{{\text{1}} + {\text{18}}{\text{.01}}C}}$ | 162.5 | $\Gamma = {\text{0}}{\text{.357}}\frac{{{\text{37}}{\text{.98}}C}}{{{\text{1}} + {\text{37}}{\text{.98}}C}}$ | 011.1 |
| Аспарагиновая | ${Г = \;0}{\text{.291}}\frac{{{\text{8}}{\text{.06}}C}}{{{\text{1}} + {\text{8}}{\text{.06}}C}}$ | 170.8 | $\Gamma = {\text{0}}{\text{.188}}\frac{{{\text{8}}{\text{.79}}C}}{{{\text{1}} + {\text{8}}{\text{.79}}C}}$ | 383.9 |
| Серин | $\Gamma = {\text{0}}{\text{.197}}\frac{{{\text{6}}{\text{.55}}C}}{{{\text{1}} + {\text{6}}{\text{.55}}C}}$ | 654.6 | $\Gamma = {\text{0}}{\text{.378}}\frac{{{\text{11}}{\text{.59}}C}}{{{\text{1}} + {\text{11}}{\text{.59}}C}}$ | 071.5 |
| Аланин | $\Gamma = {\text{0}}{\text{.226}}\frac{{{\text{17}}{\text{.25}}C}}{{{\text{1}} + {\text{17}}{\text{.25}}C}}$ | 055.7 | $\Gamma = {\text{0}}{\text{.221}}\frac{{{\text{21}}{\text{.05}}C}}{{{\text{1}} + {\text{21}}{\text{.05}}C}}$ | 544.2 |
Как видно из табл. 6, рассчитанные величины энергии Гиббса указывают на механизм физической адсорбции, так как поверхность брушита и гидроксиапатита в водном растворе при выбранном значении рН заряжена (табл. 5).
Роль активных центров в процессе адсорбции на поверхности CaHPO4 · 2H2O выполняют СаОН+ и ${\text{С а }}{{{\text{Н }}}_{{\text{2}}}}{\text{Р О }}_{4}^{ + }$. Сближение с ними терминальных незаряженных карбоксильных группировок АК вызывает сильную поляризацию связи О–Н в составе –СООН и перераспределение электронной плотности между Са и О с образованием, например, в случае глутаминовой кислоты $[{\text{С а HPO}}_{4}^{ + }][{\text{О О С }}{{({\text{C}}{{{\text{H}}}_{{\text{2}}}})}_{{\text{2}}}}{\text{CH}}({\text{NH}}_{3}^{ + }){\text{CO}}{{{\text{O}}}^{ - }}]$ и/или $[{\text{С а O}}{{{\text{H}}}^{ + }}][{\text{О О С }}{{({\text{C}}{{{\text{H}}}_{{\text{2}}}})}_{{\text{2}}}}{\text{CH}}({\text{NH}}_{3}^{ + }){\text{CO}}{{{\text{O}}}^{ - }}]$. Вероятно, в дальнейшем за счет вращения углеводородный радикал адсорбата может принимать конфигурацию, при которой осуществляется дополнительное координирование α-СОО– и $ - {\text{NH}}_{3}^{ + }$ (фактически –NH2 в результате потери протона при сближении) с соседними группами СаОН+ и/или ${\text{С а Н Р О }}_{4}^{ + }$ и формируются хелатные комплексы на поверхности брушита [27]. Таким образом, по-видимому, происходит закрепление цвиттер-ионов АК на поверхности брушита.
В случае Ca10(PO4)6(OH)2 растворенные молекулы АК могут взаимодействовать с поверхностью зерен кристаллов за счет сил электростатического взаимодействия положительно и отрицательно заряженных центров, а также за счет образования водородных связей. Дополнительная стабилизация образующихся поверхностных соединений может быть обусловлена способностью АК образовывать полидентатные хелатные комплексы с ионами кальция [35].
Факт адсорбции подтверждается данными ИК-фурье-спектроскопии и анализа удельной площади поверхности (БЭТ): для CaHPO4 · 2H2O значение Sуд упало на 75% и составило 3 м2/г (не зависимо от природы АК), для Ca10(PO4)6(OH)2 – глицин 52 м2/г (↓44%), серин и глутаминовая кислота 60 м2/г (↓35%), аланин и аспарагиновая кислота 72 м2/г (↓22%). РФА показывает, что образования новых фаз в данных условиях не происходит (рис. 8).
ЗАКЛЮЧЕНИЕ
Изучена скорость зарождения и роста частиц из пересыщенных модельных растворов жидкости полости рта в присутствии аминокислот различной природы (нейтральные, основные, кислотные). Показано, что при физиологической концентрации и относительно не высоком пересыщении системы аминокислоты ингибируют стадии процесса кристаллизации, наиболее сильно эффект заметен на стадии нуклеации: глицин > глутаминовая кислота > серин ≈ аспарагиновая кислота > аланин. Отмечено уменьшение размеров образующихся частиц, при этом АК адсорбируются на поверхности осадков, не изменяя их фазовый состав. Изучен процесс адсорбции аминокислот на CaHPO4 · 2H2O и Ca10(PO4)6(OH)2, изотермы описываются моделью Ленгмюра.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (проект № 16-33-00684 Мол_а).
Список литературы
Юшкин Н.П. Биоминеральные взаимодействия. M.: Наука, 2002. 60 с.
Юшкин Н.П., Котова О.Б. Институт геологии: итоги и публикации 2001 г. Сыктывкар: Геопринт, 2002. 100 с.
Юшкин Н.П. // Зап. Всерос. минерал. о-ва. 2004. Ч. 133. № 4. С. 92.
Пальчик Н.А., Мороз Т.Н., Леонова И.В. и др. // Журн. неорган. химии. 2004. № 8. С. 1353.
Ткаленко А.Ф. Автореф. дис. “Влияние физико-химических характеристик слюны, слюнных и зубных отложений на исход лечения больных слюннокаменной болезнью” … канд. мед. наук. М., 2004.
Голованова О.А. Патогенные минералы в организме человека. Омск: изд-во ОмГУ, 2006. 400 с.
Цимбалистов А.В., Пихур О.Л., Голованова О.А., Бельская Л.В. // Маэстро стоматологии. 2009. № 4. С. 56.
Пихур О.Л. // Бюллетень Северного государственного медицинского университета. 2007. № 2. С. 53.
Пихур О.Л., Голованова О.А., Бельская Л.В., Лемешева С.А. // Российский семейный врач. 2007. Т. 11. № 1. С. 34.
Frank-Kamenetskaya O.V. // Minerals as Advanced Materials I. Berlin; Heidelberg: Springer Verlag, 2008. P. 241.
Кудряшов В.И., Серебряков А.С. // Экологическая химия. 2003. № 12. С. 179.
Щербо А.П., Цимбалистов А.В., Пихур О.Л., Трифонов Б.В. // Вестн. Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. 2007. № 1 (2). С. 124.
Пихур О.Л., Сериков А.А., Янковский В.В. и др. // Экология и развитие общества. 2014. № 1–2 (10). С. 93.
Цимбалистов А.В., Пихур О.Л., Михайлова Е.С. // Стоматолог. 2012. № 1. С. 50.
Skinner H.C.W. // Notes in Mineralogy. 2000. V. 2. P. 383.
Голованова О.А., Ачкасова Е.Ю., Пунин Ю.О., Желяев Е.В. // Кристаллография. 2006. Т. 51. № 2. С. 376.
Golovanova O.A., Gerk S.A., Mylnikova T.S. // Biogenic-Abiogenic Interactions in Natural and Anthropogenic Systems Lecture Notes in Earth System Sciences. Switzerland, Springer, 2016. P. 443.
Chikanova E.S., Golovanova O.A., Kuimova M.V. // Biogenic-Abiogenic Interactions in Natural and Anthropogenic Systems Lecture Notes in Earth System Sciences. Switzerland, Springer, 2016. P. 501.
Golovanova O.A., Punin Yu.O., Izatulina A.R., Korol’kov V.V. // J. Struct. Chem. 2014. V. 55. P. 178.
Golovanova O.A., Chikanova E.S., Punin Y.O. // Crystallography Reports. 2015. V. 60. № 3. P. 438.
Golovanova O.A., Chikanova E.S. // Crystallography Reports. 2015. V. 60. № 6. P. 960.
Izmailov R.R., Golovanova O.A. // Crystallography Reports. 2015. V. 60. № 3. P. 979.
Roach P., Eglin D., Rohde K., Perry C.C. // J. Mater. Sci. Mater. Med. 2007. V. 18. P. 1263.
Feng B., Chen J., Zhang X. // Biomaterials. 2002. V. 23. P. 2499.
Bhowmik R., Katti K.S., Katti D. // Polymer. 2007. V. 48. P. 664.
Bhowmik R., Katti K.S., Verma D., Katti D.R. // Mater. Sci. Eng. 2007. C. 27. P. 352.
Солоненко А.П., Бельская Л.В., Голованова О.А. // Химия в интересах устойчивого развития. 2010. Т. 18. № 1. С. 71.
Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. М.: Химия, 1988. 464 с.
Azoury R., Garti N., Sarig S. // Urol. Res. 1986. V. 14. P. 295.
Kohri K., Umekawa T., Kodama M. et al. // Eur. Urol. 1990. V. 17. P. 173.
Якубке Х.-Д., Ешкайт Х. Аминокислоты, пептиды, белки: Пер. с нем. М.: Мир, 1985. 456 с.
Ikawa N., Kimura T., Oumi Y., Sano T. // J. Mater. Chem. 2009. V. 19. P. 4906.
Солоненко А.П. Дис. “Исследование влияния условий кристаллизации на физико-химические свойства химически модифицированных фосфатов кальция” … канд. хим. наук. Омск: ОмГУ, 2014.
Izatulina A.R., Punin Y.O., Golovanova O.A. // J. Struct. Chem. 2014. V. 55. № 7. P. 1225.
Курочкин В.Ю. Дис. “Термодинамика процессов комплексообразования ионов кальция с аминокислотами в водном растворе” канд. хим. наук. Иваново, Ивановский государственный химико-технологический университет, 2011.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография