Кристаллография, 2019, T. 64, № 1, стр. 72-76
Кристаллическая упаковка 4,4'-диалкилзамещенных салицилиденанилинов, предшествующая мезофазе; структура C10H21O–C6H3(OH)–CH=N–C6H4–С7Н13)
Л. Г. Кузьмина 1, *, М. А. Навасардян 1, С. И. Беззубов 1
1 Институт общей и неорганической химии РАН
Москва, Россия
* E-mail: kuzmina@igic.ras.ru
Поступила в редакцию 06.03.2018
После доработки 26.03.2018
Принята к публикации 16.04.2018
Аннотация
По данным рентгеноструктурного анализа исследована кристаллическая структура 4,4'-замещенного салицилиденанилина C10H21O–C6H3(OH)–CH=N–C6H4–C7H13. В кристалле обнаружена высокая степень неупорядоченности обеих алкильных цепей. Кристаллическая упаковка разделяется на чередующиеся рыхлые алифатические и плотные ароматические области. В ароматических областях обнаружены слабые направленные взаимодействия типа С–Н···π. На основании полученных данных и результатов дифференциальной сканирующей калориметрии обсуждаются особенности кристаллической упаковки мезогенных соединений, предшествующей мезофазе, и их плавление, а также образование мезофазы при охлаждении изотропного расплава.
ВВЕДЕНИЕ
Хотя жидкие кристаллы открыты более ста лет назад, существующие теории мезофазы [1–8] не дают правильного предсказания многих физических характеристик, например теплоты образования, числа фазовых переходов с участием мезофазы и других [6]. Очевидно, что эти теории опираются на модельные представления, не учитывающие каких-либо ключевых особенностей мезофазы, потому нуждаются в уточнении.
Начаты исследования кристаллической упаковки мезоморфных соединений, поскольку она является предшественником мезофазы, а потому может дать новые сведения о возможной структуре мезофазы. Ранее были изучены кристаллические упаковки мезоморфных алкил- и алкилоксибензойных кислот [9–11], алкил- и алкилоксицианобифенилов [12, 13], н-(алкилоксибензилиден)- [14], алкил- и алкилоксифенилбензоатов [15–18]. Эти исследования позволили обнаружить ряд характерных особенностей структур мезоморфных кристаллов. Их кристаллические упаковки разделены на чередующиеся области – рыхлые алифатические и плотные ароматические области, состоящие из центральных сопряженных фрагментов молекул. В рыхлых областях имеется малое количество межмолекулярных ван-дер-ваальсовых контактов между атомами алифатических групп или такие контакты вообще отсутствуют. В плотных областях помимо большого количества ван-дер-ваальсовых контактов существуют слабые направленные взаимодействия с участием функциональных групп центрального фрагмента. Чаще всего такими взаимодействиями являются обычные водородные и слабые водородные связи (ВС) С–Н···O/N [19], взаимодействия С–Н···π, а также π···π-стэкинг-взаимодействия [19–23]. Обнаруженные особенности кристаллических упаковок дают основание предполагать, что при нагревании мезогенных кристаллов их плавление начинается по алифатическим областям, тогда как центральные сопряженные области в некотором температурном интервале сохраняют структурированность. Такой структурированный расплав представляет собой мезофазу.
Настоящая работа является продолжением исследования кристаллической и молекулярной структуры 4,4´-дизамещенных салицилиденанилинов по данным рентгеноструктурного анализа (РСА) с целью установления возможности образования мезофазы в производных с длинными алкильными цепями:
Ранее была изучена структура начальных членов этого гомологического ряда с малыми размерами алифатических заместителей [24], позволившая установить конформационную нежесткость молекул в отношении взаимного разворота фенильных колец. Эта геометрическая особенность, а также вовлеченность активного водорода во внутримолекулярную ВС должны понижать способность соединения к формированию мезофазы при его плавлении. Однако возможность возникновения в кристалле слабых направленных взаимодействий не может быть полностью исключена, например, за счет взаимодействий С–Н···π или слабых ВС С–Н···О. Последние взаимодействия часто наблюдаются в кристаллах фенилбензоатов [15–18].
В настоящей работе исследована кристаллическая структура салицилиденанилина C10H21O–C6H3(OH)–CH=N–C6H4–C7H13, содержащего длинные алкильные цепи, и проведено его исследование методом дифференциальной сканирующей калориметрии (ДСК).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Рентгеноструктурное исследование. Кристаллографические характеристики и параметры расшифровки и уточнения структуры приведены в таблице.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и уточнения структуры C30H45NO2
| Сингония, пр. гр., Z | Моноклинная , P21/c, 4 |
| a, b, c, Å | 21.3894(17), 9.6064(8), 13.3837(11) |
| β, град | 90.0250(13) |
| V, Å3 | 2750.0(4) |
| Dx, г/см3 | 1.091 |
| Излучение; λ, Å | MoKα; 0.71073 |
| μ, см–1 | 0.067 |
| Т, К | 150 |
| Размер образца | 0.34 × 0.24 × 0.01 |
| Дифрактометр | Bruker SMART Apex-II |
| Тип сканирования | ω |
| Учет поглощения; Тmin, Tmax | SADABS; 0.65, 0.75 |
| θmax, град | 28 |
| Пределы h, k, l | –28 ≤ h ≤ 28, –12 ≤ k ≤ 12, ‒17 ≤ l ≤ 17 |
| Число отражений: измеренных/независимых (N1), Rint/c I>2σ(I) (N2) | 18182/5001, 0.0598/2915 |
| Метод уточнения | Полноматричный МНК по F2 |
| Число параметров | 329 |
| Учет экстинкции | Не учитывалась |
| R1/wR2 по N1 | 0.1142/0.1893 |
| R1/wR2 по N2 | 0.0714/0.1746 |
| S | 0.896 |
| Δρmin/Δρmax | –0.35/0.28 |
| Программы | SAINT [25], SADABS [25], Olex-2 [26] |
Кристалл проявлял слабую отражательную способность, что априори указывало на высокую степень неупорядоченности в его структуре. Кристаллическая ячейка является псевдоромбической, поскольку угол моноклинности β близок к 90°. При обработке экспериментальных данных полученные значения Rint (0.0598 для моноклинной ячейки и 0.0623 для ромбической) больше соответствовали моноклинной кристаллической модификации, хотя различия в значениях невелики. Расшифровать структуру удалось только в моноклинной пр. гр. P21/c с одной кристаллографически независимой молекулой, что подтверждает истинность выбора пространственной группы.
Структура расшифрована прямым методом. Алкильная и алкилокси-цепи обнаруживают неупорядоченность по двум положениям. Соотношение заселенностей положений для алкилокси-цепи составляет 0.51 : 0.49, а для алкильной цепи – 0.62 : 0.38.
Уточнение структуры проведено в анизотропном приближении для неводородных атомов, исключая концевой атом углерода алкилокси-группы и всех атомов углерода алкильной цепи. Положения атомов водорода рассчитаны геометрически, и они включены в окончательные этапы уточнения по модели наездника. Все расчеты проведены по программам Olex-2 [26].
Координаты атомов и другие экспериментальные данные депонированы в Кембриджском банке структурных данных (КБСД) (CCDC № 1824840).
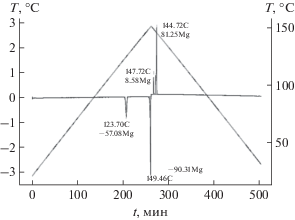
Калориметрические исследования. Параметры фазовых переходов измеряли методом калориметрии на приборе Shimadzu DSC-60 Plus при скорости нагрева/охлаждения 0.5 град /мин, снимали в токе аргона 50 мл/мин. На рис. 1 представлена термограмма, полученная в режиме нагревания поликристаллического образца и последующего охлаждения для регистрации монотропной фазы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
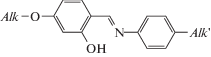
Молекулярная структура. Строение молекулы показано на рис. 2. В молекуле активный атом водорода ОН-группы вовлечен во внутримолекулярную ВС О–Н···N, замыкающую шестичленный цикл.
Рис. 2.
Строение молекулы; для атомов, уточненных в анизотропном приближении, эллипсоиды среднеквадратичных смещений атомов приведены на уровне вероятности 50%.
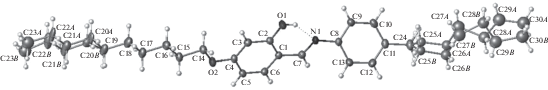
Центральный ненасыщенный фрагмент молекулы существенно неплоский. Двугранный угол между плоскостями бензольных колец составляет 42.2°, а двугранный угол между плоскостями бензольного кольца и фрагмента С1–С7–N1–С8 равен 1.4°. Это означает, что амидная группа находится в сопряжении с бензольным кольцом С1–С6. К плоскости второго бензольного кольца С8–С13 эта группа повернута на 35.1°.
Проведенный анализ данных КБСД ([27 ] , версия 5.38) свидетельствует, что в структурах 156 молекул, имеющих аналогичный центральный каркас, величина угла между бензольными кольцами имеет широкое распределение в области от 0° до 56°. Это означает, что такие молекулы проявляют структурную нежесткость; в них осуществляется разный взаимный разворот бензольных колец. Конкретное значение двугранного угла в значительной степени определяется условиями формирования кристаллической упаковки. Эта геометрическая особенность подавляет склонность сопряженных систем таких молекул к формированию π-стэкинговых элементов (димеров или стопок) упаковки. Действительно, кристаллическая упаковка ни в одной из упомянутых 156 молекул не содержит таких элементов, хотя обычно сопряженные и ароматические молекулы, особенно те, которые включают в себя гетероатомы или функциональные группы, весьма склонны к образованию кристаллических упаковок с такими элементами.
Кристаллическая упаковка. Ранее было упомянуто, что РСА может быть весьма эффективным методом, дающим представление о структуре мезофазы на основе анализа кристаллической упаковки жидкокристаллических соединений, в том случае, если кристалл является предшественником мезофазы. Однако ДСК-исследование показало, что при температуре 123.7°С наблюдается фазовый переход (ФП) Cr1–Cr2 (энтальпия перехода 25.8 Кдж/моль). Наблюдение за кристаллом на дифрактометре и под микроскопом при его нагревании до температуры, несколько превышающей температуру ФП, свидетельствует, что ФП Cr1–Cr2 сопровождается разрушением монокристалла с образованием поликристаллической фазы.
При температуре 149.5°С соединение плавится без образования мезофазы. Образование мезофазы происходит только из переохлажденного расплава при температуре 147.7°С, а при 144.7°С наблюдается ФП нематик–кристалл. Таким образом, исследованная кристаллическая структура не является предшественницей мезофазы. Однако ее изучение может дать представление о том, какие слабые направленные взаимодействия в соединении с данной геометрией молекул могут обусловливать структурированность расплава при его охлаждении, т.е. формирование мезофазы и, при дальнейшем охлаждении, новой кристаллической формы.
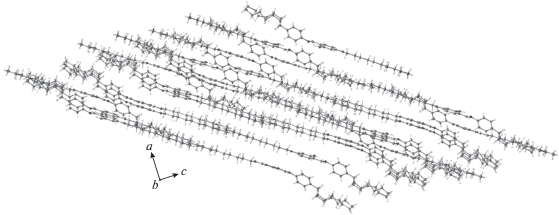
На рис. 3 показана кристаллическая упаковка соединения. Она имеет вид, типичный для упаковок жидкокристаллических соединений. В ней отчетливо выделяются чередующиеся алифатические области и области, образованные сопряженными фрагментами молекул.
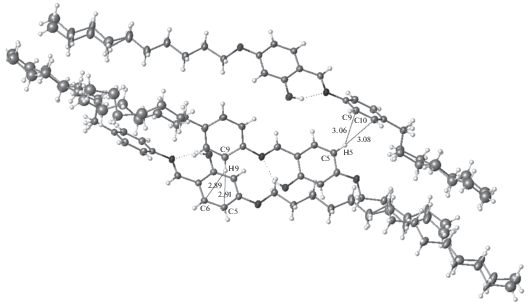
В областях сопряженных фрагментов существуют слабые направленные взаимодействия С–Н···π, объединяющие молекулы в цепочки (рис. 4). Найденная геометрия этих взаимодействий обычна [19–23]. Расстояния С···Н близки к характерным значениям 2.9–3.1 Å. В подавляющем большинстве случаев атом водорода проектируется не на центр бензольного кольца, а сдвинут к одной из его связей.
Других слабых направленных взаимодействий в этой системе не возникает из-за дефицита функциональных групп в молекуле. “Активный” атом водорода группы ОН задействован во внутримолекулярной ВС, а общая непланарность ненасыщенного центрального фрагмента понижает способность молекул к формированию межмолекулярных π···π-стэкинг-взаимодействий. Здесь также не возникает типичных для фенилбензоатов слабых ВС С–Н···О.
Алифатические области имеют очень рыхлое строение. Об этом свидетельствует высокая степень неупорядоченности насыщенных цепей, атомы которых испытывают значительное тепловое движение. В этой области также не обнаружено ван-дер-ваальсовых контактов между соседними атомами терминальных фрагментов алифатических цепочек, состоящих по крайней мере из шести атомов углерода. Все межмолекулярные контакты осуществляются только между ненасыщенными фрагментами молекул. По-видимому, это приводит к неустойчивости данной кристаллической формы и возникновению ФП кристалл–кристалл при нагревании. Однако если принять во внимание, что усиление тепловых колебаний алифатических цепей при повышении температуры означает также увеличение эффективных размеров их атомов, то в упаковке образовавшегося кристалла второй фазы, о которой ничего неизвестно, разбиение на ароматические и алифатические области, типичное для мезогенных упаковок, должно сохраниться. Поэтому отсутствие формирования мезофазы при плавлении кристаллов этой фазы, скорее всего, может быть обусловлено либо отсутствием в кристаллах слабых направленных взаимодействий, либо их разрушением при температурах плавления.
Отметим, что при охлаждении изотропного расплава из него начинает формироваться нематическая фаза при температуре только на два градуса ниже точки плавления, т.е. из переохлажденного расплава. В том случае, если истинной является вторая причина, понижение температуры плавления у кристаллов иных гомологов данного ряда соединений на немногим более двух градусов может привести к появлению энантиотропного мезоморфизма в них.
Таким образом, формирование соединением мезофазы при плавлении кристалла определяется не только спецификой кристаллической упаковки, обусловленной чередованием рыхлых алифатических и плотных ароматических областей, но и сохранением в последних элементов структурированности (слабых направленных взаимодействий) при температуре плавления соединения.
Работа выполнена при финансовой поддержке Российского научного фонда (грант № 16-13-10273).
Список литературы
Maier W., Saupe A. // Z. Naturforsch. 1960. B. 15a. S. 287.
Singh S. // Phys. Rep. 2000. V. 324. № 2–4. P. 107.
Humphries R.L., James P.G., Luckhurst G.R. // J. Chem. Soc. Faraday Trans. II. 1972. V. 68. P. 1031.
Madhusudana N.V., Savithramma K.L., Chandrasekhar S. // Pramana. 1977. V. 8. № 1. P. 22.
McGrother S.C., Sear R.P., Jacson G.J. // Chem. Phys. 1997. V. 106. № 17. P. 7315.
Vertogen G., Jeu W.H. Thermotropic liquid crystals, fundamentals. Berlin: Springer-Verlag, 1988. 324 p.
Ландау Л.Д., Лифшиц Е.М. Статистическая физика. М.: Наука, 1964. 565 с.
Gennes P.G., de Prost J. The physics of liquid crystals. New York: Oxford University Press, 1995. 616 p.
Кочетов А.Н., Кузьмина Л.Г., Чураков А.В. и др. // Кристаллография. 2006. Т. 51. № 1. С. 59.
Кузьмина Л.Г., Кучерепа Н.С., Пестов С.М. и др. // Кристаллография. 2009. Т. 54. № 5. С. 908.
Кузьмина Л.Г., Пестов С.М., Кочетов А.Н. и др. // Кристаллография. 2010. Т. 55. № 5. С. 835.
Кузьмина Л.Г., Кучерепа Н.С. // Кристаллография. 2011. Т. 56. № 2. С. 267.
Кузьмина Л.Г., Кучерепа Н.С., Чураков А.В. // Кристаллография. 2012. Т. 56. № 2. С. 212.
Kuz’mina L.G., Navasardyan M.A., Churakov A.V., Howard J.A.K. // Mol. Cryst. Liq. Cryst. 2016. V. 638. P. 60.
Константинов И.И., Чураков А.В., Кузьмина Л.Г. // Кристаллография. 2013. Т. 58. № 1. С. 89.
Kuz’mina L.G., Konstantinov I.I., Lermontova E.Kh. // Mol. Cryst. Liq. Cryst. 2014. V. 588. P. 1.
Kuz’mina L.G., Konstantinov I.I., Churakov A.V., Navasardyan M.A. // Acta Cryst. E. 2017. V. 73. P. 1052.
Кузьмина Л.Г., Константинов И.И., Беззубов С.И. // Химия высоких энергий. 2016. Т. 50. № 6. С. 478.
Nangia A. // Cryst. Eng. Comun. 2002. V. 4. № 17. P. 93.
Muller-Dethlefs K., Hobza P. // Chem. Rev. 2000. V. 100. P. 143.
Janiak Ch. // J. Chem. Soc. Dalton Trans. 2000. P. 3885.
Chen Z., Lohr A., Saha-Moller Cr., Wurthner F. // Chem. Soc. Rev. 2009. V. 38. P. 564.
Oxtoby N.S., Blake A.J., Champness N.R., Wilson C. // Cryst. Eng. Comm. 2003. V. 5. № 17. P. 82.
Кузьмина Л.Г., Навасардян М.А., Михайлов А.А. // Кристаллография. 2017. Т. 62. № 6. С. 889.
Bruker (2008). APEX2, SADABS and SAINT. Bruker AXS Inc. Madison, Wiskonsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R. J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография