Кристаллография, 2019, T. 64, № 1, стр. 68-71
Cинтез и кристаллическая структура 3-метокси-5-бромсалицилиден-2-фурфурилимина (HL5) и 3-нитросалицилиден-2-фурфурилимина (HL6)
В. С. Сергиенко 1, 2, *, В. Л. Абраменко 3, Ю. Е. Горбунова 1
1 Институт общей и неорганической химии РАН
Москва, Россия
2 Всероссийский институт научной и технической информации РАН
Москва, Россия
3 Луганский национальный университет
Луганск, Украина
* E-mail: sergienko@igic.ras.ru
Поступила в редакцию 20.02.2017
После доработки 08.05.2018
Принята к публикации 08.05.2018
Аннотация
Проведен синтез и рентгеноструктурный анализ 3-метокси-5-бромсалицилиден-2-фурфуриламина (HL5) и 3-нитросалицилиден-2-фурфуриламина (HL6). Обе структуры стабилизированы прочными внутримолекулярными водородными связями N1–H1···O2. Обе молекулы реализуются в цвиттер-ионной форме. В молекуле HL6 имеет место вклад таутомерной хиноидной формы.
ВВЕДЕНИЕ
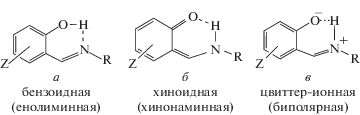
Рентгеноструктурный анализ (РСА) строения салицилидениминов (о-оксиазометинов) (НLn) показал, что при кристаллизации их из растворов возможна фиксация определенных таутомерных форм – бензоидной (а), хиноидной (б) или цвиттер-ионной (в) [1]:
В ряде работ установлено, что в кристаллическом состоянии о-оксиазометины могут сосуществовать как в хиноидной, так и енольной форме, т.е. кристаллы представляют собой суперпозицию двух таутомерных форм. Так, по данным РСА в кристалле N-(2-гидрокси-5-хлорфенил)салицилиденимина хинонаминная форма б составляет 68%, а енолиминная а – 32% [2]. Авторы [3], исследуя термохромизм 5-хлорсалицилиден-(4-гидроксифенил)имина при температурах от 375 до 90 K, пришли к выводу, что азометин кристаллизуется в виде находящихся в равновесии неразрешенных ОН- и цвиттер-ионной NH-форм, причем содержание последней увеличивается при снижении температуры. Недавно была получена серия о-оксиазометинов, производных замещенных салициловых альдегидов и 2-фурфуриламина HLn (R = –CH2–C4H4O; Z = H (n = 1), 3-OMe (n = 2) [4], 5-Br (n = 3), 4-ОН (n = 4) [5], строение которых установлено методами ИК-спектроскопии. Кристаллическая структура НLn (n = 2 и 4) определена методом РСА [4, 5]. Молекула НL2 по данным РСА кристаллизуется в бензоидной форме а, НL4 – в цвиттер-ионной в.
В продолжение исследований строения о-оксиазометинов и комплексов на их основе синтезированы малоизученные Z-салицилиден-2-фурфурилимины: Z = 3-ОМе, 5-Br (HL5) и Z = 3-NO2 (HL6), кристаллическая структура которых определена методом РСА.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез HL5. К раствору 2.31 г (0.01 моль) 3-метокси-5-бромсалицилового альдегида в 50 мл этанола добавляли 0.97 г (0.01 моль) 2-фурфуриламина. Смесь кипятили в течение 10 мин, после чего оставляли для кристаллизации в холодильнике на сутки. Выпавшие лимонные кристаллы фильтровали на фильтре Шотта, промывали холодным этанолом и сушили в токе сухого аргона. Тпл = 84–85°C. Аналогично получили HL6 в виде коричневых кристаллов, Тпл = 144–145°C.
ИК-спектр HL5, см–1: 1632, 1575, 1340, 1330, 1275, 1255, 1147, 1095, 1077, 1030, 1007, 992, 980, 950, 915, 886, 865, 848, 817, 742, 730, 696, 600, 578, 465.
ИК-спектр HL6, см–1: 1635, 1615, 1530, 1510, 1500, 1370, 1350, 1305, 1230, 1150, 1140, 1100, 1070, 1030, 1015, 990, 960, 928, 890, 868, 830, 803, 792, 755, 725, 645, 635, 600, 542, 480, 450.
ИК-спектры регистрировали на спектрометре ИКС-29 в суспензии в вазелиновом масле.
Рентгеноструктурный анализ. Кристаллографические данные и характеристики эксперимента для кристаллов HL5, HL6 приведены в табл. 1. Структуры расшифрованы прямым методом и уточнены методом наименьших квадратов в полноматричном анизотропном приближении для всех неводородных атомов. Позиции атомов водорода рассчитаны геометричеcки и включены в уточнение по модели “наездника”. Aтом H1 в структуре HL6 найден из разностного синтеза Фурье и уточнен в изотропном приближении. Атом Н1 в структуре HL5 задан в рассчитанной позиции при атоме N1 (а не при О2 или О3) исходя из величины R-фактора: 0.0530 (0.0537 или 0.0538 для вариантов с атомом Н1 соответственно при О2 или О3). Высокое значение R-фактора структуры HL6 определяется плохим качеством кристалла. Кристалл HL5 – рацемический двойник, структура уточнена по программе “Twin”; соотношение двух компонент двойника – 0.56:0.44. Основные длины связей и валентные углы в структуре HL5, HL6 приведены в табл. 2. Полные кристаллографические данные для HL5, HL6 депонированы в Кембриджском банке структурных данных (СCDC № 1529807, 1529947, http://www.ccdc.cam.ac.uk/deposit/).
Таблица 1.
Кристаллографические характеристики, данные эксперимента и уточнения структур HL5, С13H12BrNO3 и HL6, C12H10N2O4
| Структура | HL5 | HL6 |
|---|---|---|
| M | 310.15 | 246.22 |
| Сингония, пр. гр., Z | Моноклинная, P21, 2 | Ромбическая, Pbcn, 8 |
| a, b, c, Å | 4.8841(10), 12.1156(10), 10.9194(10) | 16562(3), 7.391(2), 18.177(4) |
| β, град | 96.214(10) | 90 |
| V, Å3 | 642.35(15) | 2225.0(8) |
| Dx, г/см3 | 1.604 | 1.470 |
| Излучение; λ, Å | СuKα; 1.54178 | |
| µ, мм–1 | 4.378 | 0.952 |
| T, K | 293(2) | |
| Размер образца, мм | 0.30 × 0.15 × 0.05 | 0.23 × 0.18 × 0.13 |
| Дифрактометр | Enraf-Nonius CAD-4 | |
| Тип сканирования | ω | |
| Учет поглощения; Tmin, Tmax | Полуэмпирический; 0.3534, 0.8108 | Полуэмпирический; 0.8110, 0.8862 |
| θmax, град | 49.98 | 49.99 |
| Пределы h, k, l | –3 ≤ h ≤ 4, –12≤ k ≤ 12, –10 ≤ l ≤ 10 | –16 ≤ h ≤ 16, –7≤ k ≤ 1, –1≤ l ≤ 18 |
| Число отражений: измеренных/независимых (N1), Rint/c I > 2σ(I) (N2) | 2396/1300, 0.0325/1126 | 2842/1147, 0.0174/1002 |
| Метод уточнения | Полноматричный МНК по F 2 | |
| Число параметров | 159 | 168 |
| R1, wR2 по N1 | 0.0651, 0.1460 | 0.0852, 0.2407 |
| R1, wR2 по N2 | 0.0530, 0.1388 | 0.0778, 0.2306 |
| S | 1.064 | 1.070 |
| Δρmin /Δρmax, э/Å3 | –0.392/0.575 | –0.527/0.707 |
| Программы | APEX2, SAINT и SADABS [6], SIR-92 [7], SHELXL-2014 [8] | |
Таблица 2.
Основные длины связей d (Å) и валентные углы ω (град) в структурах HL5 и HL6
| Связь | HL5 | HL6 | Угол | HL5 | HL6 |
|---|---|---|---|---|---|
| D | ω | ||||
| N1–C7 | 1.262(13) | 1.291(7) | C7–N1–C8 | 121.8(10) | 123.5(4) |
| N1–C8 | 1.476(13) | 1.485(7) | O1–C9–C10 | 104.9(10) | 109.5(5) |
| O1–C9 | 1.353(19) | 1.340(8) | O1–C9–C8 | 131.9(12) | 133.2(6) |
| O1–C12 | 1.374(19) | 1.427(8) | O1–C12–C11 | 104.7(16) | 107.1(6) |
| O2–C2 | 1.328(12) | 1.264(6) | C9–C10–C11 | 112.5(16) | 107.3(5) |
| C1–C2 | 1.407(14) | 1.443(7) | C10–C11–C12 | 107(2) | 110.3(6) |
| C1–C6 | 1.434(14) | 1.395(7) | O2–C2–C1 | 123.1(9) | 121.2(4) |
| C1–C7 | 1.416(15) | 1.406(7) | O2–C2–C3 | 118.1(9) | 125.0(5) |
| C2–C3 | 1.429(15) | 1.440(7) | Br1–C5–C4 | 117.5(8) | |
| C3–C4 | 1.371(14) | 1.388(7) | Br1–C5–C6 | 117.1(7) | |
| C4–C5 | 1.363(14) | 1.364(8) | C3–O3–C13 | 116.7(8) | |
| C5–C6 | 1.343(13) | 1.375(8) | O3–C3–C2 | 113.5(9) | |
| C8–C9 | 1.454(16) | 1.472(8) | O3–C3–C4 | 126.3(9) | |
| C9–C10 | 1.218(16) | 1.361(7) | O3–N2–O4 | 121.6(5) | |
| C10–C11 | 1.37(3) | 1.345(9) | O3–N2–C3 | 119.2(5) | |
| C11–C12 | 1.27(3) | 1.318(9) | O4–N2–C3 | 119.2(5) | |
| Br1–C5 | 1.928(10) | N2–C3–C4 | 116.3(5) | ||
| O3–C3 | 1.362(12) | N2–C3–C2 | 121.1(5) | ||
| O3–C13 | 1.413(10) | ||||
| N2–O3 | 1.203(6) | ||||
| N2–O4 | 1.224(6) | ||||
| N2–C3 | 1.439(7) | ||||
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
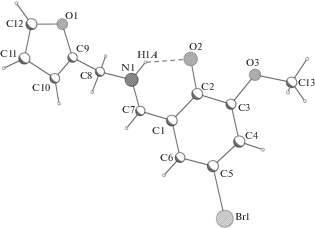
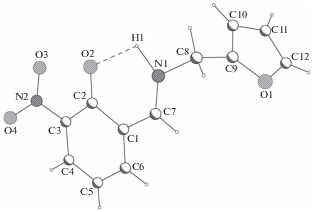
Строение молекул HLn показано на рис. 1 (n = 5) и 2 (n = 6). В обеих молекулах достаточно прочные внутримолекулярные водородные связи N1–H1···O2 (N–H 0.86 и 1.07(9) Å, H···O 1.91 и 1.87(9) Å, N···O 2.595(11) и 2.624(6) Å, N–H···O 135° и 124(6)° для HL5 и HL6 соответственно) замыкают шестичленные Н-циклы NHOC3, такие же, как в ранее исследованных молекулах HL2 [4] и HL4 [5]. Учитывая наличие достаточно длинной связи N1–H1 1.07(9) Å, можно полагать, что молекула HL6 (так же, как и HL4) реализуется в цвиттер-ионной биполярной форме в с положительным зарядом, локализованным на атоме азота, и отрицательным – на атоме кислорода. С другой стороны, в этой молекуле обе связи N1–C7 1.291(7) и О2–С2 1.264(6) Å имеют повышенную кратность (последняя связь существенно короче, чем аналогичная связь в структурах с n = 4 и 5: 1.304(6), 1.328(12) Å соответственно), что может свидетельствовать о вкладе таутомерной хиноидной формы б. Также сложно однозначно судить о таутомерной форме молекулы кристалла-двойника HL5, так как атом Н1, геометрически заданный при атоме N1 на расстоянии N1–H1 0.86 Å, не поддается уточнению. В этой структуре связь N1–C7 1.262(13) Å – самая короткая из аналогичных связей в трех структурно исследованных молекулах HLn (1.275(2), 1.303(7), 1.286(6) Å соответственно для n = 2, 4, 6). Наиболее приемлемый вариант таутомерной формы для HL5 – цвиттер-ионная.
Отметим, что замена заместителей в монозамещенных R-салицилиден-2-фурфуриламинах HLn (R = –CH2C4H4O; Z = 3-OMe (n = 2); 4-OH (n = 4); 3-OMe, 5-Br (n =5); 3-NO2 (n = 6)) влияет на реализацию одной из трех таутомерных форм: бензоидной, а (HL2), хиноидной, б; цвиттер-ионной, в (HL4), либо смеси двух из трех форм а, б, в.
В структурах HLn (n = 5, 6) между молекулами существуют только ван-дер-ваальсовы взаимодействия.
Авторы выражают благодарность А.В. Чуракову за помощь в проведении эксперимента РСА.
Список литературы
Гарновский А.Д., Васильченко И.С., Гарновский Д.А. Современные аспекты синтеза металлокомплексов. Основные лиганды и методы. Ростов н/Д: ЛаПО, 2000. 355 с.
Elerman Y., Kabak M., Kavlakoglu E. et al. // J. Mol. Struct. 1999. V. 510. № 1–3. P. 207.
Ogawa K., Fujiwara T., Harada J. // Mol. Cryst. Liq. Cryst. Sci. Technol. A. 1999. V. 344. № 1. P. 169.
Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е., Чураков А.В. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 180.
Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е. // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1043.
APEX2, SAINT, SADABS. Bruker AXS Inc., Madison, Wisconsin, USA. 2008–2009.
Altomare A., Gascsrano G., Giacovazzo C., Guagliard A. // J. Appl. Cryst. A. 1993. V. 26. P. 343.
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. P. 112.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография