Кристаллография, 2019, T. 64, № 2, стр. 259-264
Разработка микрофлюидного чипа для кристаллизации белка методом микробатч
А. М. Попов 1, *, П. В. Дороватовский 1, Д. А. Мамичев 1, М. А. Марченкова 1, 2, А. Ю. Николаева 1
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: antmp.86@yandex.ru
Поступила в редакцию 25.06.2018
После доработки 12.07.2018
Принята к публикации 27.07.2018
Аннотация
Разработан разборный микрофлюидный чип (МФЧ), представляющий собой технологическую систему для роста кристаллов белков с последующим проведением рентгеноструктурного анализа (РСА). Тестовые испытания по кристаллизации проводились на лизоциме из куриного яйца, аминотрансферазе из Methanococcus vannielii и эстеразе PMGL2 из метагеномной библиотеки вечной мерзлоты. Проведено сравнение материалов (боросиликатного стекла и полиметилметакрилата) для изготовления МФЧ. Показано, что при использовании полиметилметакрилата можно проводить in situ сравнительный РСА кристалла белка непосредственно в чипе. Исследования и эксперименты выполнены на станции “БЕЛОК” Курчатовского источника синхротронного излучения (НИЦ “Курчатовский институт”).
ВВЕДЕНИЕ
Изучение пространственных структур биологических макромолекул имеет чрезвычайно важное значение для понимания молекулярных механизмов работы клетки и ее отдельных компонентов, для создания лекарственных препаратов. Более 80% структур, депонированных в базу данных белков (Protein data bank), расшифрованы с помощью рентгеноструктурного анализа (РСА), позволяющего определять структуру макромолекулы с максимальным по сравнению с другими методами разрешением. Основным ограничением данного метода является необходимость получения кристалла исследуемого образца высокого качества.
К настоящему моменту нет достаточно проработанной теории кристаллизации биологических макромолекул, которая позволила бы заранее определить диапазон физико-химических параметров, необходимый для роста кристалла. В связи с этим подбор условий кристаллизации для нового объекта, называющийся кристаллизационным скринингом, носит эмпирический характер и сводится к перебору большого количества кристаллизационных “коктейлей” методом проб и ошибок.
Процедура выращивания белковых кристаллов осуществляется за счет медленного осаждения белка из слабо пересыщенных растворов [1]. Варьируя физические (температура, давление) и химические (pH, осадитель и его концентрация, ионная сила, концентрация белка) параметры, можно уменьшать растворимость белка вплоть до насыщения или пересыщения раствора [2]. Комбинации этих параметров приводят к созданию сотен различных условий. Поэтому растет интерес к разработке миниатюрных устройств, позволяющих снизить расход образца за счет постановки кристаллизационного эксперимента в нанолитровом объеме.
В связи с этим все более широкое применение получают микрофлюидика и микрофлюидные системы, имеющие преимущество не только в использовании малого объема вещества, но и в легком изготовлении, осуществлении прецизионного контроля потока жидкостей, точного управления параметрами процесса кристаллизации и других опций [3].
В основе микрофлюидного кристаллизатора лежит идея создания в протяженном микроканале большого количества капель-микрореакторов, в которых реализуются условия для кристаллизации белковых молекул, разделенных между собой жидкостью-носителем, несмешиваемой с содержимым микрореакторов [4]. При этом различное соотношение буферного раствора, белка и осадителя в каплях-микрореакторах осуществляется за счет точного управления потоками жидкости, поступающими в микроканалы из шприцевых насосов.
Отметим, что многие ведущие компании (Hitachi, Agilent Technologies, Dolomite и др.) финансируют исследования по развитию микрофлюидики, так как новые технологии и успехи в данной области позволяют достичь принципиально новых результатов [5–8]. Увеличивается как коммерческая привлекательность микрофлюидных систем, так и количество научных изданий, публикующих статьи по этой теме (Science, Nature, Chemical Society Reviews, Biosensors & Bioelectronics), в том числе специализированных (Lab on a Chip, Microfluidics and Nanofluidics, Biomicrofluidics).
Несмотря на активно развивающиеся технологии создания микрофлюидных систем, последние используются в основном для проведения кристаллизационного скрининга [9, 10].
В настоящей работе описаны разработка, изготовление и испытание разборного микрофлюидного чипа (МФЧ) для получения белковых кристаллов и исследования их структуры in situ методом РСА непосредственно в МФЧ без дополнительных операций по извлечению кристаллов и использования криопротекторов, которые могут влиять на качество дифракционных картин.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы и подготовка образцов. Возможность применения разработанного микрофлюидного устройства для кристаллизации белков тестировалась на трех объектах:
– лизоциме из куриного яйца (62971 Sigma-Aldrich), 10 мг/мл в буфере 50 мМ ацетата натрия, pH 4.6;
– аминотрансферазе из Methanococcus vannielii (АТ MV), 14 мг/мл в буфере 50 мМ Трис, 100 мМ хлорида натрия, 10 мкМ пиридоксальфосфата, pH 8.0;
– эстеразе PMGL2 из метагеномной библиотеки вечной мерзлоты, 10 мг/мл в буфере 20 мМ Трис, pH 8.0.
Белки кристаллизовали методом микробатч [11], основанном на смешивании раствора белка с осадителем с последующим помещением реакционной смеси в масло, предотвращающее испарение воды из смеси. Если при смешивании достигается состояние пересыщения, становится возможным образование кристаллических зародышей, к которым впоследствии присоединяются молекулы белка из раствора, приводя к росту кристалла. Основными достоинствами метода микробатч являются сравнительная простота, малый расход образца и осадителя, возможность проведения эксперимента при различных температурах, а также увеличение количества монокристаллов за счет отсутствия прямого контакта кристаллизационной смеси со стенками носителя, которые могут выступать в качестве кристаллизационных затравок.
Для постановки кристаллизационного эксперимента растворы белков в соответствующем буфере смешивали в пропорции 1 : 1 с растворами осадителей и подавались в МФЧ параллельно с жидкостью-носителем (силиконовым маслом), в результате чего формировались кристаллизационные капли-микрореакторы. В качестве осадителей использовали:
– для лизоцима – 1.4 М хлорид натрия в буфере 50 мМ ацетат натрия, pH 4.3;
– для АТ MV – 200 мМ ацетат калия, 3350 полиэтиленгликоль 19%;
– для PMGL2 – 100 мМ HEPES, pH 7.5, 200 мМ хлорид магния, 3350 полиэтиленгликоль 26%.
Чипы с кристаллизационными микрореакторами инкубировались в течение двух недель–одного месяца при температуре +15°С, затем был проведен анализ полученных кристаллов.
Микрофлюидный чип. В качестве материала для изготовления МФЧ использован полиметилметакрилат (ПММА), полученный литьевым способом, который по сравнению с ПММА, изготавливаемым экструзионным способом, обладает высокой механической прочностью, имеет лучшие характеристики плотности, химической стойкости и диапазона рабочих температур. К основным преимуществам используемого в работе ПММА можно отнести коммерческую доступность, простоту в обработке, биосовместимость, достаточную прочность, устойчивость к большому количеству кислот/оснований и растворителей, низкий уровень поглощения воды и отсутствие требования дорогостоящего технологического оборудования (например, литографического и плазмохимического) для создания на его основе микрофлюидных устройств или применения дорогостоящих химических реагентов для последующих процессов формирования микрофлюидных каналов [12]. Прозрачность ПММА в видимом диапазоне спектра позволяет in situ наблюдать за процессами, происходящими в микрофлюидном устройстве, как при подаче анализируемого вещества, так и при его последующем анализе [13]. На станции структурного материаловедения “СТМ” Курчатовского источника синхротронного излучения (НИЦ “Курчатовский институт”, Москва) проводилось тестирование материалов для изготовления МФЧ, рассматривались предметное стекло (боросиликатное) и ПММА, оба образца были толщиной 1 мм. Коэффициенты ослабления, т.е. отношение интенсивностей прошедшего и падающего пучков в интервале энергий 8–16 кэВ, показали, что поглощение рентгеновского излучения у ПММА не многим выше, чем у боросиликатного стекла. При этом простота обработки и дешевизна выгодно отличают ПММА от стекла.
Наиболее доступным методом для формирования микроканалов в ПММА является использование лазерного излучения, позволяющего достаточно быстро на одной установке получить микрофлюидные каналы в широком диапазоне размеров с различной топологией. В связи с этим для изготовления МФЧ использовали метод лазерной абляции [3, 12].
Для предварительной очистки поверхности пластины из ПММА протирали изопропиловым спиртом, а затем подвергали ультразвуковой обработке в деионизированной воде. После этого заготовки высушивали в потоке сухого азота. Далее в пластине из ПММА с помощью импульсного ИК-лазера (λ = 10.4 мкм) с номинальной мощностью 50 Вт были сформированы отверстия ввода/вывода и микроканалы. Посредством выбора параметров лазера регулировались глубина и ширина получаемого в ПММА реза (канала) (рис. 1). После формирования в пластине ПММА всех элементов МФЧ осуществлялась полировка полученной заготовки на шлифовально-полировальной машине с помощью мелкодисперсного абразива. Далее заготовку подвергали ультразвуковой обработке в деионизированной воде для очистки поверхности после полировки. На завершающем этапе формирования МФЧ были проведены совмещение вводных/выводных отверстий и каналов на двух частях МФЧ и их последующая термическая спайка при температуре 115–121°С под давлением 1500 мбар в течение 10–20 мин.
Получившийся МФЧ для анализа кристаллов белков в коллимированном пучке рентгеновского излучения представлен на рис. 2. Корпусом МФЧ служат две заготовки из ПММА размером 15 × 45 мм и толщиной 1 мм, в одной из которых сформирована система микроканалов, а в другой – отверстия для ввода/вывода растворов в/из МФЧ. В качестве топологии/дизайна канала выбрана змеевидная конструкция для лучшего смешивания растворов, обеспечения наиболее стабильного потока капель и увеличения общей протяженности рабочей части канала, заполняемого каплями-микрореакторами. Также ключевым элементом МФЧ является возможность проведения экспериментов РСА непосредственно в чипе. Главные требования к микроканалам – относительно низкая шероховатость (десятки нанометров) и размеры канала, позволяющие сформировать в нем объем жидкости, в котором может вырасти кристалл белка размером порядка 50–100 мкм (рис. 3).
Рис. 3.
Кристаллы аминотрансферазы из Methanococcus vannielii (а), лизоцима (б) и эстеразы PMGL2 (в).

Белковые растворы и жидкость-носитель (силиконовое масло) подавались в МФЧ параллельно посредством шприцевых насосов (LEGATO 100 и 210) по фторопластовым трубочкам с внутренним диаметром в 125 мкм, которые подводились к вводным отверстиям МФЧ.
Методика проведения РСА. Тестирование кристаллов, выращенных в микрофлюидной ячейке, для оценки возможности получения наборов дифракционных данных с целью решения структуры исследуемого белка проводилось на синхротронной станции “РСА” Курчатовского источника синхротронного излучения. Использовалось монохроматическое излучение с длиной волны 0.8024 Å. Образец был установлен на гониометр Marresearch dtb. Дифракционная картина регистрировалась двумерным детектором Rayonix SX165 (диаметр 165 мм, разрешение 2048 × 2048 пикселей) [14]. Расстояние образец–детектор составляло 80 мм. Для первичной обработки использовалась программа Automar (MarXperts) [15].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В каналах сконструированного МФЧ получены капли-микрореакторы размером 1500 × 200 мкм (средним объемом 20 нл), содержащие смесь белкового раствора с раствором осадителя. Между собой капли разделялись силиконовым маслом (ПМС-5), при этом плотность микрореакторов в чипе составляла 10 капель на 1 см длины канала. Используемый объем исходного раствора составил 1.5–2.5 мкл на один МФЧ. В течение семи дней при температуре +15°С в каплях-микрореакторах (для всех белковых растворов) были получены кристаллы с размером граней прядка 70–150 мкм (рис. 3). Прокрашивание кристаллов метиленовым синим подтвердило белковую, а не солевую природу кристаллов. Кристаллы были получены в одной трети сформированных капель, как правило, в одной капле находился один кристалл, реже два. Если кристаллов было больше, чем два, они уже не подходили для проведения РСА.
Возможность проведения рентгеностуктурного эксперимента in situ с использованием МФЧ оценивалась на полученных кристаллах лизоцима, АТ MV и PGML2 (рис. 3). В качестве параметров для оценки качества выращенных кристаллов по детектируемым дифракционным картинам использовались максимальный угол раствора дифракционного конуса и точность получаемых по дифракционным данным параметров элементарной ячейки. Максимальное полученное разрешение для анализируемых кристаллов составляло 2.74 Å для лизоцима, 2.95 Å для АТ MV и 2.89 Å для PMGL2, соотношение сигнал/шум во всех случаях составляло I/σ = 3. Выращенные кристаллы относятся к пр. гр. P4 c параметрами элементарной ячейки:
– для лизоцима – a = b = 77.276, c = 37.077 Å, α = β = γ = 90° (рис. 4);
Рис. 4.
Дифракционная картина, полученная от кристалла лизоцима в МФЧ, с разрешением 2.74 Å и первичная обработка данных с помощью программы Automar (MarXperts).
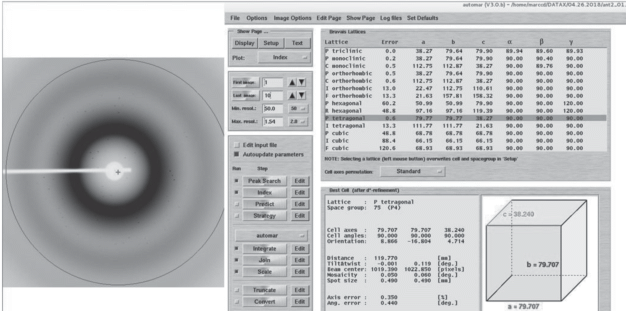
– для AT MV – a = 68.78, b = 97.1, c = 112.75 Å;
– для PMGL2 – a = 57.26, b = 84.8, c = 113.46 Å.
Полученные данные показывают возможность тестирования качества выращенных кристаллов непосредственно в МФЧ, а также сбора полного дифракционного набора с нескольких кристаллов, полученных на протяжении микроканалов МФЧ в каплях-микрореакторах, с последующим решением пространственной структуры исследуемого образца. Отметим, что сборная конструкция МФЧ позволяет извлекать выращенные кристаллы как продавливанием масла (жидкость-носитель) через микроканал, так и разборкой чипа с последующим извлечением кристалла кристаллографической петлей. Данная особенность позволяет использовать полученные кристаллы в экспериментах по настаиванию с лигандами либо подбору условий криопротекции.
ЗАКЛЮЧЕНИЕ
Продемонстрирована возможность конструирования МФЧ из ПММА для кристаллизации, тестирования дифракционного качества полученных кристаллов и изучения пространственной структуры биологических макромолекул. Низкая стоимость материала и простота технологии изготовления МФЧ из ПММА делают их привлекательными на рынке микрофлюидных устройств по сравнению с аналогичными МФЧ из боросиликатного стекла. Разработанный МФЧ может быть использован как в экспериментах по кристаллизации любых водорастворимых макромолекул и проведения РСА эксперимента in situ, так и для выращивания кристаллов в условиях микрогравитации в космосе в виду своей механической прочности и неприхотливости в обращении.
Авторы выражают благодарность М.Л. Занавескину за предоставление доступа к оборудованию и поддержку во время проведения эксперимента (отдел прикладных наноэлектронных структур Курчатовского НБИКС-центра) и В.О. Попову за предоставление белковых растворов и плодотворное обсуждение экспериментов (Институт биохимии им. А.Н. Баха).
Работа выполнена при частичной финансовой поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН и Российского фонда фундаментальных исследований (грант № 18-32-00059 мол_а).
Список литературы
Смирнова Е.А., Кислицын Ю.А., Сосфенов Н.И. и др. // Кристаллография. 2009. Т. 54. № 5. С. 948.
Leunissen M. An essay on several aspects of protein crystallization research. University of Cambridge. Department of solid state chemistry, 2001. 36 p.
Whitesides G.M. // Nature. 2006. V. 442. P. 368.
Pham N., Radajewski D., Round A. et al. // Anal. Chem. 2017. V. 89. № 4. P. 2282.
McPherson A. Preparation and analysis of protein crystals. Malabar; Fla.: R.E. Krieger Pub. Co., 1989. 371 p.
Rhodes G. Crystallography made crystal clear: a guide for users of macromolecular models. Edn. 3. Burlington; MA/San Diego; CA/London: Academic Press, 2006. 333 p.
DeLucas L., Bray T., Nagy L. et al. // J. Struct. Biol. 2003. V. 142. P. 188.
Villasenor A., Sha M., Thana P., Browner M. // BioTechniques. 2002. V. 32. P. 184.
Schieferstein J.M., Pawate A.S., Sun C. et al. // Biomicrofluidics. 2017. V. 11. № 2. P. 1.
Zheng B., Roach L.S., Ismagilov R.F. // J. Am. Chem. Soc. 2003. V. 125. № 37. P. 11170.
Chayen N.E., Shaw Stewart P.D., Blow D.M. // J. Cryst. Growth. 1992. V. 122. № 1–4. P. 176.
Chen Y., Zhang L., Chen G. // Electrophoresis. 2008. V. 29. P. 1801.
Gina S., Daniel T. // BioTechniques. 2005. V. 38. № 3. P. 429.
Doyle R. // Marccd software manual. Evanston; IL: Rayonix L.L.C., 2010. P. 185.
Bartels K. A very basic introductory tutorial. Automar. Norderstedt: Marresearch, 2008. 25 p.
Glatter O., Kratky O. Small Angle X-ray Scattering. London: Academic Press, 1982. 515 p.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография




