Кристаллография, 2019, T. 64, № 2, стр. 252-258
Метакрилатоуранилаты стронция и бария – синтез и структура
Л. Б. Сережкина 1, *, М. С. Григорьев 2, В. В. Клепов 1, Н. А. Шимин 1, В. Н. Сережкин 1
1 Самарский национальный исследовательский университет
Самара, Россия
2 Институт физической химии и электрохимии РАН
Москва, Россия
* E-mail: Lserezh@samsu.ru
Поступила в редакцию 10.11.2017
После доработки 09.01.2018
Принята к публикации 12.01.2018
Аннотация
Осуществлен синтез, проведено рентгеноструктурное и ИК-спектроскопическое исследование кристаллов Sr2[UO2(CH2C(CH3)COO)3]4 · 26H2O (I) и Ba2[UO2(CH2C(CH3)COO)3]4 · 26H2O (II), где CH2C(CH3)COO– – метакрилат-ион. Урансодержащими структурными единицами I и II являются одноядерные комплексы [UO2(CH2C(CH3)COO)3]–, относящиеся к кристаллохимической группе $AB_{3}^{{0{\text{1}}}}$ (А = ${\text{UO}}_{2}^{{2 + }}$, B01 = CH2C(CH3)COO–) комплексов уранила. Установлено, что важную структурообразующую роль в кристаллах I и II играет параллельная ориентация метакрилат-анионов соседних урансодержащих комплексов. Образованные за счет взаимодействий метакрилат-анионов объемные слои содержат пустоты, занятые катионами Sr или Ba. Связывание структурных фрагментов в каркас происходит за счет образования системы водородных связей, электростатических и ван-дер-ваальсовых взаимодействий.
ВВЕДЕНИЕ
Координационные полимеры переходных металлов, в которых роль линкеров играют непредельные карбоксилаты, привлекают особый интерес своими необычными физическими и физико-химическими свойствами: способность к ионному обмену [1], протонная проводимость [2], фотокаталитическая активность [3] и некоторые другие. Однако направленный синтез указанных координационных полимеров затруднен из-за ограниченного числа полученных и изученных соединений. Первые сведения, в частности, о метакрилатах уранила появились совсем недавно – в 2015 г. [4] – и касались синтеза и кристаллоструктурных данных соединений состава UO2(C3H5СОО)2 · nL, в которых роль электронейтральных лигандов L играют молекулы воды (n = 2), N,N-диметилкарбамида (n = 1.5) или тетраметилкарбамида (n = 1). Список изученных метакрилатов уранила пополнился данными о координационных полимерах состава [R(H2O)6][UO2(CH2C(CH3)COO)3]2 · 8H2O (R = = Mg или Zn) [5]. Развитие работ в этом направлении в экспериментальном плане затруднено: при солнечном освещении в присутствии ионов уранила происходит фотохимическая реакция быстрой и необратимой полимеризации метакриловой кислоты, которая проявляется в помутнении водного раствора и последующем образовании гелеобразного продукта [6]. Поэтому исследования метакрилатов уранила остаются пока немногочисленными.
В настоящей работе приводятся сведения о синтезе и кристаллической структуре двух новых комплексов уранила с метакрилат-анионами – R2[UO2(C3H5СОО)3]4 · 26H2O, где R = Sr (I) или Ba (II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. В качестве исходных веществ использовали оксид урана(VI), метакриловую кислоту и оксиды стронция или бария. Оксид стронция (0.073 г, 0.70 ммоль) растворяли в 10 мл водного раствора метакриловой кислоты (0.48 г, 5.6 ммоль). В раствор добавляли оксид урана(VI) (0.100 г, 0.35 ммоль) и нагревали на водяной бане до полного растворения. Мольное соотношение реагентов составило 2 : 16 : 1. Для предотвращения процесса полимеризации все синтезы проводили в сосудах, окрашенных в черный цвет. Полученный желтый раствор оставляли в темном месте для медленной кристаллизации на воздухе при комнатной температуре. Через 6–7 дней образовывались желтые призматические кристаллы, которые по данным химического анализа имели состав Sr2[UO2(CH2C(CH3)COO)3]4 · 26H2O (I) (найдено, %: U – 34.4; вычислено – 34.69).
При замене оксида стронция на оксид бария (0.107 г, 0.7 ммоль) был получен Ba2[UO2(CH2C(CH3)COO)3]4 · 26H2O (II) (найдено, %: U – 33.2; вычислено – 33.50).
Рентгеноструктурное исследование. Параметры рентгенодифракционного эксперимента и окончательные значения факторов недостоверности приведены в табл. 1. Структуры расшифрованы прямым методом и уточнены в анизотропном приближении для всех неводородных атомов. Атомы H групп CH2 и CH3 размещены в геометрически вычисленных позициях с изотропными температурными параметрами. Поскольку группы CH2 и CH3 в метакрилат-ионах имеют близкие размеры, в обеих структурах наблюдается их частичное разупорядочение (для двух и одного из 12 кристаллографически разных анионов соответственно в I и II), при котором одна и та же позиция может быть занята как метильной группой CH3, так и метиленовой CH2. При уточнении этим группам была приписана заселенность 0.5, при этом метакрилат-анион становится квазисимметричным относительно зеркальной плоскости, проходящей перпендикулярно плоскости молекулы вдоль линии связи >C–C<. Атомы H молекул воды в обеих структурах не были локализованы.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и уточнения структур Sr2[UO2(C3H5СОО)3]4 · 26H2O (I) и Ba2[UO2(C3H5СОО)3]4 · 26H2O (II)
| Соединение | I | II |
|---|---|---|
| Сингония, пр. гр., Z | Моноклинная, P21/c, 4 | Триклинная, P$\bar {1}$, 2 |
| a, b, c, Å | 24.2909(8), 13.7497(4), 26.7629(8) | 13.8887(7), 14.1874(7), 24.4512(11) |
| α, β, γ, град | 90, 100.680(1), 90 | 100.326(1), 91.511(1), 109.307(1) |
| V, Å3 | 8783.8(5) | 4454.3(4) |
| Dx, г/см3 | 2.076 | 2.140 |
| μ, мм–1 | 8.657 | 8.218 |
| Т, K | 100(2) | |
| Излучение; λ, Å | МоKα, 0.71073 | |
| Размер образца, мм | 0.32 × 0.20 × 0.18 | 0.18 × 0.08 × 0.06 |
| Дифрактометр | Bruker KAPPA APEX II | |
| Тип сканирования | φ и ω | |
| Тmin, Tmax | 0.168, 0.305 | 0.319, 0.638 |
| θmax, град | 30.00 | 24.41 |
| Пределы h, k, l | –33 ≤ h ≤ 34, –19 ≤ k ≤ 19, –37 ≤ l ≤ 37 |
–16 ≤ h ≤ 16, –16 ≤ k ≤ 13, –28 ≤ l ≤ 28 |
| Число отражений: измеренных/независимых (N1), Rint /c I > 1.96 σ(I) (N2) | 89 034/25 523, 0.0696/16 079 |
29 731/14 080, 0.0413/9984 |
| Метод уточнения | Полноматричный МНК по F 2 | |
| Число уточняемых параметров | 1000 | 996 |
| wR2 по N1 | 0.0901 | 0.0972 |
| R1 по N2 | 0.0421 | 0.0401 |
| S | 1.002 | 1.049 |
| Δρmin/Δρmax, э/Å3 | –2.749/3.295 | –1.123/3.749 |
| Программы | SAINT-Plus [7], SADABS [8], SHELXS97 [9], SHELXL-2014 [10] | |
Характеристики основных связей и валентных углов приведены в табл. 2. Определение координационных чисел (КЧ) всех атомов в изученных кристаллах проводили с помощью метода пересекающихся сфер [11].
Таблица 2.
Длины связей d (Å) и валентные углы ω (град) в структурах I и II
| Связь | d | Угол | ω | Связь | d | Угол | ω |
|---|---|---|---|---|---|---|---|
| I | II | ||||||
| Гексагональная бипирамида UO8 | |||||||
| U1–O1 | 1.788(4) | O1–U1–O2 | 179.63(19) | U1–O1 | 1.777(6) | O1–U1–O2 | 179.4(3) |
| U1–O2 | 1.764(4) | O3–U1–O4 | 52.16(14) | U1–O2 | 1.763(6) | O3–U1–O4 | 52.1(2) |
| U1–O3 | 2.478(4) | O4–U1–O5 | 67.67(14) | U1–O3 | 2.463(6) | O4–U1–O5 | 68.5(2) |
| U1–O4 | 2.470(4) | O5–U1–O6 | 52.90(14) | U1–O4 | 2.488(6) | O5–U1–O6 | 52.7(2) |
| U1–O5 | 2.447(4) | O6–U1–O7 | 66.60(14) | U1–O5 | 2.463(6) | O6–U1–O7 | 67.3(2) |
| U1–O6 | 2.457(4) | O7–U1–O8 | 52.90(14) | U1–O6 | 2.468(6) | O7–U1–O8 | 52.5(2) |
| U1–O7 | 2.456(4) | O3–U1–O8 | 67.76(14) | U1–O7 | 2.478(6) | O3–U1–O8 | 67.0(2) |
| U1–O8 | 2.442(4) | U1–O8 | 2.460(6) | ||||
| U2–O9 | 1.775(4) | O9–U2–O10 | 179.8(2) | U2–O9 | 1.780(6) | O9–U2–O10 | 179.3(3) |
| U2–O10 | 1.765(4) | O11–U2–O12 | 52.57(14) | U2–O10 | 1.757(6) | O11–U2–O12 | 53.1(2) |
| U2–O11 | 2.453(4) | O12–U2–-O13 | 66.37(14) | U2–O11 | 2.461(6) | O12–U2–O13 | 67.1(2) |
| U2–O12 | 2.479(4) | O13–U2–O14 | 52.47(13) | U2–O12 | 2.454(6) | O13–U2–O14 | 52.5(2) |
| U2–O13 | 2.464(4) | O14–U2–O15 | 68.98(13) | U2–O13 | 2.471(6) | O14–U2–O15 | 68.1(2) |
| U2–O14 | 2.464(4) | O15–U2–O16 | 52.25(13) | U2–O14 | 2.457(6) | O15–U2–O16 | 52.1(2) |
| U2–O15 | 2.487(4) | O11–U2–O16 | 67.41(14) | U2–O15 | 2.455(6) | O11–U2–O16 | 67.1(2) |
| U2–O16 | 2.471(4) | U2–O16 | 2.473(7) | ||||
| U3–O17 | 1.771(4) | O17–U3–O18 | 179.60(18) | U3–O17 | 1.770(6) | O17–U3–O18 | 179.5(3) |
| U3–O18 | 1.776(4) | O19–U3–O20 | 52.53(13) | U3–O18 | 1.772(6) | O19–U3–O20 | 52.2(2) |
| U3–O19 | 2.460(4) | O20–U3–O21 | 67.75(13) | U3–O19 | 2.470(6) | O20–U3–O21 | 67.0(2) |
| U3–O20 | 2.467(4) | O21–U3–O22 | 51.96(13) | U3–O20 | 2.471(6) | O21–U3–O22 | 52.2(2) |
| U3–O21 | 2.485(4) | O22–U3–O23 | 67.97(13) | U3–O21 | 2.470(6) | O22–U3–O23 | 68.0(2) |
| U3–O22 | 2.461(4) | O23–U3–O24 | 52.33(13) | U3–O22 | 2.477(6) | O23–U3–O24 | 52.1(2) |
| U3–O23 | 2.481(4) | O19–U3–O24 | 67.48(13) | U3–O23 | 2.469(6) | O19–U3–O24 | 68.6(2) |
| U3–O24 | 2.459(4) | U3–O24 | 2.473(6) | ||||
| U4–O25 | 1.766(4) | O25–U4–O26 | 179.35(19) | U4–O25 | 1.764(6) | O25–U4–O26 | 178.3(3) |
| U4–O26 | 1.766(4) | O27–U4–O28 | 53.16(13) | U4–O26 | 1.764(6) | O27–U4–O28 | 52.7(2) |
| U4–O27 | 2.423(4) | O28–U4–O29 | 65.90(13) | U4–O27 | 2.489(6) | O28–U4–O29 | 66.9(2) |
| U4–O28 | 2.481(4) | O29–U4–O30 | 52.36(14) | U4–O28 | 2.441(6) | O29–U4–O30 | 52.7(2) |
| U4–O29 | 2.498(4) | O30–U4–O31 | 68.92(14) | U4–O29 | 2.471(6) | O30–U4–O31 | 68.5(2) |
| U4–O30 | 2.456(4) | O31–U4–O32 | 52.53(14) | U4–O30 | 2.456(7) | O31–U4–O32 | 52.2(2) |
| U4–O31 | 2.450(4) | O32–U4–O27 | 67.16(14) | U4–O31 | 2.472(6) | O32–U4–O27 | 67.0(2) |
| U4–O32 | 2.470(4) | U4–O32 | 2.507(6) | ||||
| Средние характеристики 12 метакрилат-ионов | Средние характеристики 12 метакрилат-ионов | ||||||
| С=СH2 | 1.36(2) | С=С–СН3 | 124.0(8) | С=СH2 | 1.36(2) | С=С–СН3 | 124(1) |
| С–СH3 | 1.44(2) | O2C–C–CH3 | 118.7(7) | С–СH3 | 1.45(3) | O2C–C–CH3 | 119(1) |
| С–СO2 | 1.490(9) | O2C–C=CH2 | 117.3(7) | С–СO2 | 1.49(1) | O2C–C=CH2 | 117.5(8) |
| С–O | 1.270(9) | С–С–О | 121(1) | С–O | 1.268(9) | С–С–О | 121(1) |
| О–С–О | 118.3(6) | О–С–О | 118.6(7) | ||||
Координаты атомов и величины тепловых параметров депонированы в Кембриджском банке структурных данных (CCDC № 1577352 и 1577353 для I и II соответственно).
ИК-спектры записаны при комнатной температуре в диапазоне 400–4000 см–1 на ИК-фурье-спектрометре Spectrum 100. Образцы готовили прессованием таблеток с KBr.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
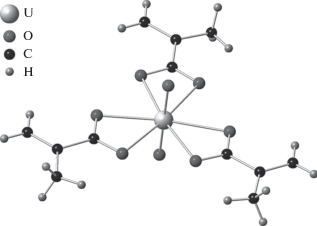
В структурах I и II содержится по четыре кристаллографически неэквивалентных атома U(VI). Координационными полиэдрами (KП) всех атомов урана являются гексагональные бипирамиды UO8, аксиальные позиции которых занимают атомы кислорода уранильной группы. В обеих структурах ионы уранила имеют практически линейное (угол O=U=O 178.4°–179.8° (I) и 178.3°–179.5° (II)) и симметричное строение (расстояния U=O 1.764–1.788 (I) и 1.757–1.780 Å (II)). В экваториальной плоскости гексагональных бипирамид UO8 шесть атомов кислорода принадлежат трем бидентатно-циклическим метакрилат-ионам (тип координации B01, рис. 1). Типы координации лигандов и кристаллохимические формулы записаны по методике [12, 13]. В I и II содержится по 12 кристаллографически разных метакрилат-ионов. Двугранные углы между экваториальной плоскостью ионов уранила и плоскостями, проходящими через атомы углерода практически плоских (без учета атомов Н) метакрилат-ионов, не превышают 10° и в среднем равны 4(3)° и 5(2)° для I и II соответственно. Отметим, что в экваториальной плоскости бипирамид UO8 внутрихелатные углы O–U–O в I и II равны соответственно 52.5(3)° и 52.4(3)°, тогда как межхелатные углы O–U–O увеличены до 67.5(9)° и 67.6(7)°.
Основной структурной единицей кристаллов I и II являются одноядерные комплексы [UO2(CH2C(CH3)COO)3]–, которые относятся к кристаллохимической группе $AB_{3}^{{01}}$ (A = ${\text{UO}}_{2}^{{2 + }}$, B01 = CH2C(CH3)COO–) комплексов уранила. Заметим, что с позиции правила 18 электронов [13–15] именно [UO2(CH2C(CH3)COO)3]– является одним из 14 наиболее стабильных типов метакрилатсодержащих комплексов уранила, которые теоретически могут существовать в водном растворе.
В изученных структурах объем полиэдров Вороного–Дирихле (ПВД) атомов урана (9.33–9.42 Å3 (I) и 9.33–9.43 Å3 (II)) в пределах погрешности совпадает со средним значением 9.3(2) Å3, установленным для ПВД атомов U(VI) с КЧ от 5 до 9 [16].
В обеих структурах содержится по два кристаллографически неэквивалентных атома R (R = Sr или Ba). Атомы R1 и Ba2 имеют КЧ 8 и образуют КП в виде тригональных додекаэдров, а Sr2 реализует КЧ 7 и КП в виде искаженной пентагональной бипирамиды. В координационную сферу атомов R1 входят два атома кислорода метакрилат-ионов триметакрилатоуранилатных комплексов, содержащих атомы U4, и атомы кислорода шести молекул воды. В КП Sr1О8 и Ba1О8 имеются соответственно две и три молекулы воды, разупорядоченные по двум позициям. В КП атомов R2 – Sr(H2O)7 и Ba(H2O)8 – по двум позициям разупорядочены соответственно шесть из семи и все восемь молекул воды. Расстояния Sr–O и Ba–O находятся в интервалах 2.49–2.73 и 2.63–2.88 Å соответственно. Отметим, что аквакомплексы в виде тригональных додекаэдров [R(H2O)8]2+ (R = Sr или Ва) встречаются в структурах гидроксидов [R(H2O)8]2+(OH)2 и пероксидов [R(H2O)8]2+O2 и недавно были зафиксированы в комплексе уранила [Ba(H2O)8]2[(UO2)8Ba2(C10H14O4)12(H2O)4] · 8H2O, где ${{{\text{C}}}_{{{\text{1}}0}}}{{{\text{H}}}_{{{\text{14}}}}}{\text{O}}_{4}^{{2 - }}$ – (1R,3S)-(+)-камфорат-ион [17]. В то же время I является первым соединением, содержащим в структуре аквакомплексы [Sr(H2O)7]2+.
Только один из четырех кристаллографических сортов комплексов [UO2(CH2C(CH3)COO)3]– связан с атомами R1 через атомы кислорода метакрилат-анионов. Образующиеся группировки {[R(H2O)6][UO2(CH2C(CH3)COO)3]}+, триметакрилатоуранилатные комплексы [UO2(CH2C(CH3)COO)3]– и гидратированные внешнесферные катионы R связаны в каркас посредством электростатических взаимодействий и водородных связей, в том числе с участием внешнесферных молекул воды. Высокая степень гидратации соединений в сочетании с сильным разупорядочением молекул воды не позволяет однозначно и кратко охарактеризовать систему возникающих водородных связей.
Сравнение I и II с изученными ранее метакрилатсодержащими комплексами уранила позволяет выделить общую структурообразующую особенность для соединений данного класса. Как и в комплексах [R(H2O)6][UO2(CH2C(CH3)COO)3]2 · · 8H2O (R = Mg (III) или Zn (IV)) [5], в I и II наблюдается практически параллельная упаковка комплексов [UO2(CH2C(CH3)COO)3]– (угол между экваториальными плоскостями соседних комплексов не превышает 4° в I и II), связанная, по-видимому, с межмолекулярным взаимодействием между сопряженными π-системами метакрилат-анионов [5]. При этом метакрилат-анионы соседних комплексов расположены друг над другом на расстоянии порядка 3.40–3.45 Å (рис. 2), а среднее значение угла между плоскостями, рассчитанными по четырем атомам углерода ближайших метакрилат-анионов, равно 4.3° и 3.4° для I и II соответственно. В структурах III и IV такая упаковка комплексов приводит к образованию бесконечных каналов, в которых находятся гидратированные комплексы [R(H2O)6]2+ и молекулы воды (рис. 3). Диаметр каналов составляет порядка 9 Å, а их внутренние стенки состоят как из гидрофильных (атомы кислорода метакрилат-анионов), так и из гидрофобных (винильные и метильные фрагменты метакрилат-анионов) группировок. В отличие от III и IV с бесконечными каналами в структурах I и II метакрилатоуранилатные комплексы объединяются в четырехслойные “пакеты” (рис. 3) высотой порядка 13 Å. Каждый пакет имеет пустоты, схожие по форме с гексагональными каналами в III и IV. Вследствие смещения пакетов друг относительно друга данные пустоты не накладываются друг на друга, как это происходит в III и IV (рис. 3). Внутри каждой пустоты располагаются по одному аквакомплексу [R(H2O)n]2+ (n = 7 или 8 для I и II соответственно) и внешнесферные молекулы воды. Также на границе каждого пакета находятся гидратированные атомы R1, выступающие за его пределы. При этом пакеты расположены друг относительно друга таким образом, что выступающие атомы R1 попадают в пустоты смежных слоев, обеспечивая их связывание друг с другом (рис. 4). Отметим, что, несмотря на разную симметрию соединений I и II (пр. гр. P21/c и P соответственно), в целом в их структурах реализуются одинаковые мотивы упаковки структурных фрагментов.
Рис. 2.
Взаимная ориентация комплексов [UO2(CH2C(CH3)COO)3]– в структуре I: а – проекция на плоскость (101), б – проекция на плоскость (001). Пунктирные линии связывают атомы углерода, расстояние между которыми не превышает 3.6 Å.
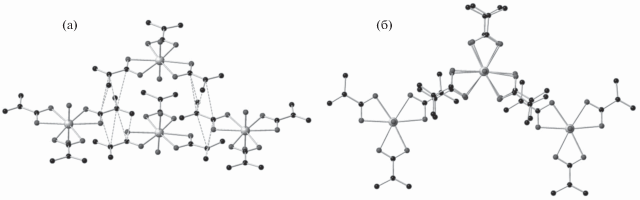
Рис. 3.
Взаимное расположение урансодержащих комплексов в структурах [Mg(H2O)6][UO2(CH2C(CH3)COO)3]2 · 8H2O (III, слева) и Ba2[UO2(CH2C(CH3)COO)3]4 · 26H2O (II, справа). В правой нижней части рисунка показано смещение двух четырехслойных пакетов друг относительно друга. Пунктиром показаны короткие (до 3.6 Å) расстояния между атомами углерода метакрилат-анионов соседних комплексов.
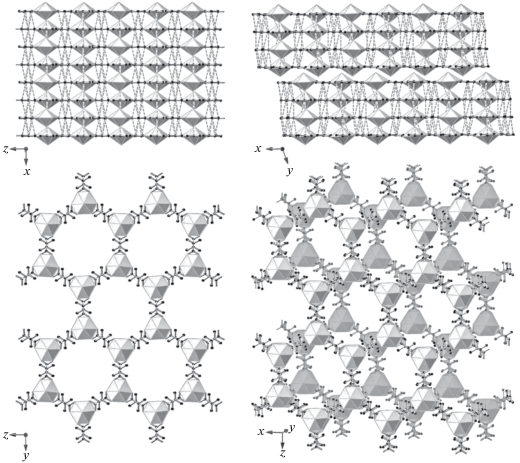
Рис. 4.
Объединение четырехслойных пакетов друг с другом за счет выступающих за границы пакетов акватированных катионов Ba в структуре Ba2[UO2(CH2C(CH3)COO)3]4 · 26H2O (II). Координационные полиэдры катионов бария показаны темным цветом.

Поскольку соединения I–IV были синтезированы при схожих условиях, различия в их структуре, очевидно, вызваны различной природой атомов R. Исходя из формулы соединений III и IV [R(H2O)6][UO2(CH2C(CH3)COO)3]2 · 8H2O, на каждые два уранильных комплекса приходятся один катион R2+ и 14 молекул воды, находящихся в гексагональных пустотах. В то же время в I и II с общей формулой R2[UO2(CH2C(CH3)COO)3]4 · · 26H2O на каждые два уранильных комплекса приходятся один катион R2+ и 13 молекул воды. С учетом того, что размеры катионов Sr2+ и Ba2+ больше, чем Mg2+ и Zn2+, “лишняя” молекула воды в III и IV, по-видимому, компенсирует разницу объемов катионов. При этом увеличение радиусов катионов Sr и Ba по сравнению с катионами Mg и Zn также вызывает увеличение их КЧ и, как следствие, размеров аквакомплексов в целом. Несмотря на это, кратчайшие расстояния между атомами R в структурах I и II меньше (6.24 и 6.43 Å), чем в III и IV (6.84 и 6.83 Å). Вызвано это тем, что в структурах III и IV между аквакомплексами находятся внешнесферные молекулы воды, в то время как координированные атомами R молекулы воды в структурах I и II взаимодействуют напрямую. Следовательно, основным фактором, вызывающим смещение пакетов друг относительно друга в структурах I и II, является склонность катионов Sr и Ba (по сравнению с катионами Mg и Zn) образовывать связи с атомами кислорода трикарбоксилатоуранилатных комплексов [18], а не возможные стерические затруднения в размещении аквакомплексов внутри каналов.
ИК-спектры полученных соединений согласуются с результатами рентгеноструктурного анализа. В спектрах присутствуют полосы поглощения, отвечающие характеристическим колебаниям ионов уранила, C3H5СОО– и молекул воды (табл. 3). Валентное антисимметричное колебание группы ${\text{UO}}_{2}^{{2 + }}$ наблюдается при 931 см–1 в спектрах I и II. Валентные колебания (антисимметричное и симметричное) групп COO– в спектрах I и II проявляются в области, отвечающей характеристическим колебаниям метакрилат-ионов: νas(COO) при 1506 (I) и 1505 (II) см–1, νs(COO) при 1462, 1439 (I) и 1461, 1440 (II) см–1.
Таблица 3.
Волновые числа и отнесение полос поглощения в ИК-спектрах I и II
| Волновые числа, см–1* | Отнесение | |
|---|---|---|
| I | II | |
| 3452 о.с. | 3452 о.с. | ν(H2O) |
| 2926 ср. 2852 ср. |
2925 ср. 2854 ср. |
ν(CH2), ν(CH3) |
| 1646 ср. | 1643 ср. | δ(H2О), ν(C=C) |
| 1506 с. | 1505 с. | νas(COO) |
| 1462 с. 1439 с. |
1461 с. 1440 с. |
νs(COO) |
| 1376 ср. 1238 ср. |
1375 ср. 1238 ср. |
δ(CH2) |
| 931 с. | 931 с. | νas(UO2) |
| 867 ср. 832 сл. |
867 ср. 832 сл. |
ν(С–C) |
| 620 ср. | 621 ср. | ρ(COO) |
Рентгенодифракционные эксперименты проведены в Центре коллективного пользования физическими методами исследования Института физической химии и электрохимии РАН, работа выполнена при частичном финансировании Министерства науки и высшего образования РФ (тема № АААА-А18-118040590105-4). Работа выполнена в рамках государственного задания Минобрнауки России по проекту 4.5037.2017/8.9.
Список литературы
Adelani P.O., Albrecht-Schmitt T.E. // Inorg. Chem. 2011. V. 50. № 23. P. 12184.
Grohol D., Subramanian M.A., Poojary D.M., Clearfield A. // Inorg. Chem. 1996. V. 35. № 18. P. 5264.
Chen W., Yuan H.-M., Wang J.-Y. et al. // J. Am. Chem. Soc. 2003. V. 125. № 31. P. 9266.
Сережкина Л.Б., Григорьев М.С., Шимин Н.А. и др. // Журн. неорган. химии. 2015. Т. 60. № 6. С. 746.
Klepov V.V., Serezhkina L.B., Pushkin D.V. et al. // Eur. J. Inorg. Chem. 2016. P. 118.
Whyte R.B., Melvill H.W. // J. Soc. Dyers Colourists.1949. V. 65. № 12. P. 703.
SAINT-Plus (Version 7.68) // Bruker AXS Inc., Madison, Wisconsin, USA. (2007).
SADABS. Bruker AXS Inc., Madison, Wisconsin, USA (2008).
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. № 1. P. 112.
Sheldrick G.M. // Acta Cryst. C. 2015. V. 71. № 1. P. 3.
Cережкин В.Н., Михайлов Ю.Н., Буслаев Ю.А. // Журн. неорган. химии. 1997. Т. 42. № 12. С. 2036.
Serezhkin V.N., Vologzhanina A.V., Serezhkina L.B. et al. // Acta Cryst. B. 2009. V. 65. № 1. P. 45.
Serezhkin V.N. Structural Chemistry of Inorganic Actinide Compounds / Eds. Krivovichev S.V. et al. Amsterdam: Elsevier, 2007. 31 p.
Сережкина Л.Б., Сережкин В.Н. // Журн. неорган. химии. 1996. Т. 41. № 3. С. 427.
Сережкина Л.Б., Сережкин В.Н. // Журн. неорган. химии. 1996. Т. 41. № 3. С. 438.
Сережкин В.Н., Карасев М.О., Сережкина Л.Б. // Радиохимия. 2013. Т. 55. № 2. С. 97.
Thuéry P. // Cryst. Growth Des. 2009. V. 9. № 11. P. 4592.
Savchenkov A.V., Klepov V.V., Vologzhanina A.V. et al. // Cryst. Eng. Commun. 2015. V. 17. P. 740.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография