Кристаллография, 2019, T. 64, № 4, стр. 535-538
К кристаллографии политипов SrAl12O19 (BaFe12O19)–BaFe18O27
С. В. Борисов 1, *, С. А. Магарилл 1, Н. В. Первухина 1, 2
1 Институт неорганической химии СО РАН
Новосибирск, Россия
2 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
* E-mail: borisov@niic.nsc.ru
Поступила в редакцию 16.03.2018
После доработки 16.03.2018
Принята к публикации 11.06.2018
Аннотация
Кристаллографический анализ SrAl12O19 (изоструктурного BaFe12O19) и BaFe18O27 показал, что в структурах обоих политипов имеются практически идентичные катионные и анионные (с участием крупного катиона) подрешетки, геометрия которых согласована с высокой симметрией P63/mmc этих соединений. Предполагается, что наличие единых “скелетных” подрешеток – главное условие образования политипных структур.
ВВЕДЕНИЕ
Экспоненциальный рост информации, добываемой научным сообществом в разных областях деятельности, делает все более трудным создание объективного общего представления об организации и функционировании материи. Только уникальные умы способны сейчас охватить и систематизировать знания на достигнутом уровне. Таким в области кристаллографии и кристаллохимии неорганических соединений был профессор Александр Франк Уэллс (2.09.1912–28.11.1994). Его обзоры-монографии с результатами мировых исследований начали выходить с 1945 г., пополняясь новыми данными о строении неорганических соединений: работы 1950, 1962, 1975, 1984 гг. завершились выходом скорректированного пятого издания [1] в 1986 г., когда автор в результате болезни потерял возможность трудиться. На русском языке вышли переводы первого обзора в 1948 г. и последнего в трех томах в 1987 г. [1], представленного редактором М.А. Порай-Кошицем как энциклопедия знаний.
А.Ф. Уэллс не только систематизировал опубликованную в мировой печати информацию, но и сам разрабатывал модное во второй половине прошлого века представление кристаллических структур неорганических соединений в форме сочетаний плоских сеток с различной геометрией узлов-атомов в них [1].
Трактовка кристаллического состояния как комплекса стоячих плоских упругих волн (механико-волновая концепция [2, 3]) подвела энергетическое обоснование под “решеточную” химию. Показано, что плоские атомные сетки – это максимально заполненные атомами координатные плоскости псевдотрансляционных подрешеток данных групп атомов при разнообразном сочетании вакантных и занятых узлов-пересечений данных плоскостей. Обзоры А.Ф. Уэллса показывают, что структуры неорганических соединений явно группируются по типам – пространственным шаблонам, обладающим обычно высокой симметрией взаимного расположения атомов. Это прямое следствие того, что процесс кристаллизации сопровождается потерей атомами их индивидуальных степеней свободы. Так, установление трансляционной симметрии означает, что вся информация о взаимном расположении атомов сводится к информации об объеме элементарной ячейки V0. Остальные элементы симметрии сокращают этот объем до фундаментального объема V*, равного V0/M, где М – порядок пространственной группы симметрии. Факт концентрации кристаллических структур в ряде высокосимметричных шаблонов (даже при существенных отклонениях стехиометрии от стандартной для данного структурного типа) – экспериментальное свидетельство ведущей роли симметрии в выборе наиболее стабильного варианта взаимного размещения данного набора атомов.
В последнем издании ”Structural inorganic chemistry” [1] Уэллс анализирует сходство структур кубических шпинелей (симметрия Fd$\bar {3}$m) и ряда гексагональных слоистых структур, включая политипы ферритов (симметрия P63/mmc). Основанием для такого объединения служит то, что в них имеют место плотноупакованные плоские слои анионов. Кристаллографический анализ шпинели и ряда родственных структур [4] показал, что определяющей для них является совместная (катионы + анионы) подрешетка на плотноупакованных плоскостях типa {440}, приводимая к кубической I-решетке (aI = 1/4а). Гексагональная симметрия P63/mmc кроме зеркальных плоскостей симметрии, параллельных оси 63 (что характерно и для кубической симметрии), имеет зеркальную плоскость, перпендикулярную этой оси (что запрещено в кубической симметрии). Проблема эта обсуждалась при анализе структур апатитов и турмалинов [5], и было показано, что кубические подрешетки атомов перестраиваются в гексагональные в случае структур с такими плоскостями. Руководствуясь тем, что кристаллическая структура образуется путем упорядочения позиций атомов системами параллельных плоскостей разных направлений (в том числе связанных симметрией), проведем кристаллографический анализ двух представителей, рассмотренных в [1]: SrAl12O19 и BaFe18O27.
КРИСТАЛЛОГРАФИЧЕСКИЙ АНАЛИЗ
Чтобы выявить кристаллографические плоскости, формирующие “скелет” структур SrAl12O19 (пр. гр. P63/mmc, Z = 2, a = 5.5766, c = 22.143 Å, V = = 595.35 Å3, M = 24 [6]) (структура I) и BaFe18O27 (пр. гр. P63/mmc, Z = 2, a = 5.88, c = 32.845 Å, V = = 983.46 Å3, M = 24 [7]) (структура II), были рассчитаны структурные амплитуды Fhkl для всех атомов (FΣ), только для катионов (Fкат), только для малых катионов (FFe, FAl), а также для анионов (FO) и анионов с крупным катионом, поскольку он может быть упорядочен в одной подрешетке с анионами (FSr + O), (FBa + O). Наиболее значимые величины этих амплитуд приведены в табл. 1 и 2, они выделяют плоскости с высокой плотностью заполнения соответствующими атомами – плоскости, создающие “скелет” структуры.
Таблица 1.
Наиболее плотноупакованные атомами семейства кристаллографических плоскостей в SrAl12O19: максимальные Fhkl для всех атомов (FΣ), для катионов (Fкат), для катионов Al (FAl) и Sr + O (FSr + O), для анионов O (FO)
| hkl | dhkl | FΣ | Fкат | FAl | FSr + O | FO |
|---|---|---|---|---|---|---|
| 017 | 2.65 | 133 | 146 | 93 | ||
| 114 | 2.49 | 163 | 175 | 115 | 49 | |
| 023 | 2.30 | 102 | 136 | 85 | 34 | |
| 0 0 10 | 2.21 | 142 | 53 | 111 | 253 | 195 |
| 025 | 2.12 | 153 | 60 | 143 | 93 | |
| 026 | 2.02 | 114 | 117 | 89 | ||
| 030 | 1.61 | 119 | 128 | 77 | 42 | |
| 0 0 14 | 1.58 | 152 | 178 | 128 | 26 | |
| 0 2 11 | 1.55 | 195 | 153 | 109 | 86 | 43 |
| 220 | 1.39 | 359 | 235 | 187 | 172 | 124 |
Таблица 2.
Наиболее плотноупакованные атомами семейства кристаллографических плоскостей в BaFe18O27: максимальные Fhkl для всех атомов (FΣ), для катионов (Fкат), для катионов Fe (FFe) и Ba + O (FBa + O), для анионов O (FO)
| hkl | dhkl | FΣ | Fкат | FFe | FBa + O | FO |
|---|---|---|---|---|---|---|
| 110 | 2.94 | 334 | 346 | 253 | ||
| 0 0 12 | 2.74 | 292 | 337 | 245 | 45 | |
| 116 | 2.59 | 419 | 430 | 340 | ||
| 024 | 2.43 | 246 | 315 | 226 | 68 | |
| 025 | 2.37 | 257 | 257 | 114 | 114 | |
| 0 0 14 | 2.35 | 321 | 409 | 373 | 285 | |
| 026 | 2.31 | 208 | 121 | |||
| 028 | 2.16 | 268 | 227 | 141 | ||
| 030 | 1.70 | 272 | 281 | 203 | ||
| 0 0 20 | 1.64 | 429 | 466 | 389 | 37 | |
| 036 | 1.62 | 345 | 353 | 276 | ||
| 0 2 16 | 1.60 | 368 | 323 | 247 | 120 | 45 |
| 220 | 1.47 | 826 | 632 | 559 | 267 | 194 |
| 2 2 14 | 1.25 | 158 |
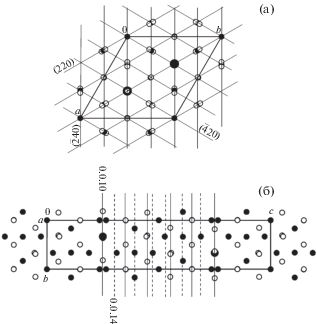
Анализ табл. 1 дает основание выбрать плоскость (114), упорядочивающую расположение катионов обоих сортов, плоскость (025) для упорядочения Sr совместно с кислородными атомами и, конечно, плоскость (220) для упорядочения всех атомов структуры. Также выделяются “слоевые” плоскости типа (00l), показывающие, что вдоль оси с структуры есть 10 слоев (Sr + O) и 14 слоев малых катионов Al. Поскольку у каждой плоскости (hkl) есть еще две, связанные с ней осью 3 – ($\overline {h + k} $, h, l) и (k, $\overline {h + k} $, l), они и будут координатными плоскостями подрешеток. Подрешетка катионов на плоскостях (114), ($\bar {2}$14), (1$\bar {2}$4) имеет размеры [8]: ar = br = cr = 2.62 Å, αr = βr = = γr = 75.85°. На 36 узлов этой подрешетки в элементарной ячейке имеется 26 катионов (матрица перехода к ней {1/3 1/3 1/12 ||–1/3 0 1/12||0 –1/3 1/12}). Подрешетка анионов и Sr на плоскостях (025), ($\bar {2}$05), (2$\bar {2}$5) имеет размеры: $a_{r}^{'} = b_{r}^{'} = c_{r}^{'} = {\text{2}}.{\text{18}}$ Å, $\alpha _{r}^{'} = \beta _{r}^{'} = \gamma _{r}^{'} = {\text{79}}.{\text{33}}^\circ $; в элементарной ячейке 60 узлов на 40 атомов О и Sr, матрица перехода {1/6 1/3 1/15 ||–1/3 –1/6 1/15||1/6 –1/6 1/15}). Наиболее интенсивная плоскость (220) с симметрично связанной ($\bar {4}$20) и с плоскостью (0 0 10) образуют гексагональную подрешетку анионов и Sr с ah = bh = 1.61 Å, ch = 1/10c = 2.21 Å, αh = βh = 90° γh = 60°; матрица перехода {1/6 1/3 0||–1/6 1/6 0||0 0 1/10}. Для катионов третьей плоскостью подрешетки будет (0 0 14), поэтому ch = = 1/14c = 1.58 Å при тех же остальных размерах. Сечения проекций структуры координатными плоскостями гексагональных подрешеток показаны на рис. 1.
Рис. 1.
Проекция структуры SrAl12O19: а – на плоскость xy и ее сечения плоскостями гексагональной подрешетки (220), ($\overline 4 $20), ($\overline 2 $40); б – на плоскость yz и ее сечения (в независимой части ячейки) плоскостями (0 0 10) в случае подрешетки Sr + O (сплошные линии) и (0 0 14) в случае подрешетки Al (штриховые). Крупный катион – большой черный кружок, Al – малый черный, О – малый пустой.
В случае структуры BaFe18O27 анализ табл. 2 дает основание для выбора плоскости (116) для катионной подрешетки, плоскости (028) для анионной с Ва и общей гексагональной (220), дополненной для анионов с Ва плоскостью (0 0 14), а для катионов Fe – плоскостью (0 0 20). Сделав расчеты по [8], имеем размеры катионной подрешетки на координатных плоскостях (116), ($\bar {2}$16), (1$\bar {2}$6): ar = br = cr = 2.68 Å, αr = βr = γr = 78.67° (матрица перехода {1/3 1/3 1/18 ||–1/3 0 1/18||0 –1/3 1/18}). Для анионной с Ва подрешетки на плоскостях (028), ($\bar {2}$08), (2$\bar {2}$8): $a_{r}^{'} = b_{r}^{'} = c_{r}^{'} = {\text{2}}.{\text{18}}$ = 2.18 Å, $\alpha _{r}^{'} = \beta _{r}^{'} = \gamma _{r}^{'} = {\text{84}}.{\text{78}}^\circ $ (матрица перехода {1/6 1/3 1/24 ||–1/3 –1/6 1/24||1/6 –1/6 1/24}). Для гексагональных подрешеток, определяемых плоскостями (220), ($\bar {4}$20) и (0 0 20) в случае катионов и (0 0 14) в случае анионов, получаем: ah = bh = 1.70 Å, ch = 1/20c для катионов и 1/14c для анионов.
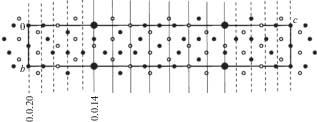
Поскольку в xy-проекции структура II не отличается принципиально от структуры I, на рис. 2 показана только ее yz-проекция.
Рис. 2.
Проекция структуры BaFe18O27 на плоскость yz и ее сечения в двух эквивалентных половинах ячейки плоскостями (0 0 14) подрешетки Ва + O (сплошные линии) и плоскостями Fe-подрешетки (0 0 20) (штриховые линии). Обозначения, как на рис. 1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Кроме представленных выше были рассмотрены кристаллические структуры BaFe12O19 (III) [9] и NaAl11O17 (IV) [10]. Структура III весьма близка к I, и обсуждать ее нет смысла. Структура IV имеет некоторые особенности в расположении катионов и анионов [10], но геометрия катионной матрицы близка к I и III (табл. 3), так что это все один политип.
Таблица 3.
Координаты базисных катионов для структур I–IV
| SrAl12O19 (I) | BaFe12O19 (III) | NaAl11O17 (IV) | BaFe18O27 (II) |
|---|---|---|---|
| 2 Sr 2/3 1/3 1/4 | 2 Ba 2/3 1/3 1/4 | 2 Na 2/3 1/3 1/4 | 2 Ba 0 0 1/4 |
| 2 Al1 0 0 0 | 2 Fe1 0 0 0 | 2 Al1 0 0 0 | 6 Fe1 1/2 1/2 0 |
| 4 Al2 0 0 ∼1/4 | 2 Fe2 0 0 1/2 | 4 Fe2 0 0 0.056 | |
| 4 Al3 1/3 2/3 0.028 | 4 Fe3 1/3 2/3 0.027 | 4 Al2 1/3 2/3 0.025 | 4 Fe3 2/3 2/3 0.073 |
| 4 Al4 1/3 2/3 0.188 | 4 Fe4 1/3 2/3 0.190 | 4 Al4 1/3 2/3 0.178 | 4 Fe4 1/3 2/3 0.093 |
| 12 Al5 0.169 0.339 0.89 | 12 Fe5 0.169 0.339 0.89 | 12 Al3 –0.166 0.166 0.106 | 12 Fe5 –1/6 1/6 0.150 |
| 4 Fe6 1/3 2/3 0.208 | |||
| 2 Fe7 2/3 1/3 1/4 |
Принципиальным в образовании политипов, кроме того, что это разные комбинации нескольких типов слоев [1], будет вопрос, что управляет этим образованием. Кристаллографический анализ двух политипов с 10 и 14 слоями анионов показал, что в них существуют “скелетные” подрешетки, практически идентичные для катионов и идентичные для анионов (последние совместно с крупным малочисленным катионом (Sr, Ba)). Элементарные ячейки этих подрешеток – деформированные ромбоэдры с острыми углами и длинной диагональю вдоль главной оси симметрии 63. Для катионной подрешетки структуры I эта диагональ равна 1/4с, для анионной 1/5с. У структуры II эти диагонали составляют 1/6с и 1/8с. В структуре шпинели MgAl2O4 соответствующий ромбоэдр правильный (ar = 2.85 Å, αr = = 60°), и он одинаков для катионной и анионной подрешеток [4]. Существенное по сравнению со шпинелью изменение соотношения числа катионов и анионов и размеров катионов приводит к тому, что параметры катионных и анионных подрешеток в структурах I и II становятся разными, структура лишается кубической симметрии, сохраняя только одну ось 63 из четырех. “Гексагонализация” структуры зеркальной плоскостью, перпендикулярной 63, выводит на первый план гексагональные подрешетки с большим количеством “запасных” (вакантных) узлов, допускающих разные взаимные сдвиги соседних по оси с слоев структуры. Таким образом, наиболее строгим регулятором образования структур политипов как в рассматриваемом случае, так и, возможно, в других случаях, будут подрешетки катионов и анионов с близкими размерами “ромбоэдрических” подъячеек обеих структур. То есть с длинными диагоналями ромбоэдров катионов и анионов, целое число раз укладывающихся в трансляцию с. Геометрия структур определяется максимально возможной симметрией данного набора атомов, причем этот достигнутый компромисс геометрии подрешеток с симметрией сохраняется при значительных вариациях атомного состава, о чем свидетельствует структура IV.
Полученные результаты еще раз показывают, что кристаллография – это не только математический аппарат с непривычными для математиков координатными системами. Кристаллография – это наука о кардинальном свойстве материального мира – симметрии. Симметрия определяет как преобразования энергии материальных частиц, так и преобразования пространства, в котором они находятся. Именно симметрия ответственна за то, что кристаллические структуры группируются в популярных структурных типах, поскольку она обеспечивает минимальную энергию атомных систем. Некоторые аспекты кристаллодинамики (“динамика порядка”) обсуждаются в [11]. Предложенные в [4] общие характеристики кристаллографической стабильности структур I и II – фундаментальные объемы V* = V0/M и отношения числа варьируемых координат базисных атомов структуры к числу всех атомов в примитивной ячейке S – будут такими: $V_{{\mathbf{I}}}^{*}$ = 596.3/24 = = 24.8 Å3; $V_{{{\mathbf{II}}}}^{*}$ = 983.5/24 = 41 Å3; SI = 12/64 = 0.188; SII = 16/92 = 0.173. Для сравнения у весьма стабильной структуры шпинели V* = 2.75 Å3 и S = = 1/14 = 0.071, у структуры апатита V* = 44 Å3 и S = 11/42 = 0.26, т.е. структуры I и II формально попадают в интервал между этими типами известных структур.
Список литературы
Уэллс А. Структурная неорганическая химия в 3-х т. М.: Мир, 1987.
Борисов С.В. // Журн. структур. химии. 1992. Т. 33. № 6. С. 123.
Борисов С.В., Магарилл С.А., Первухина Н.В. // Кристаллография. 2011. Т. 56. № 6. С. 1001.
Борисов С.В., Первухина Н.В., Магарилл С.А. // Журн. структур. химии. 2018. Т. 59. № 1. С. 119.
Борисов С.В., Первухина Н.В., Магарилл С.А. // Журн. структур. химии. 2017. Т. 58. № 8. С. 1691.
Li J., Medina E.A., Stalick J.R. et al. // Z. Naturforsch. B. 2016. B. 71. S. 475.
Braun P.B. // Philips Res. Rep. 1957. V. 12. P. 491.
Громилов С.А., Быкова Е.А., Борисов С.В. // Кристаллография. 2011. Т. 56. № 6. С. 1013.
Ounnunkad S., Winotai P. // J. Magn. Magn. Mater. 2006. V. 301. P. 292.
Zhu N.-J., Guo F., Li Y. et al. // Hua Hsueh Hsueh Pao. 1992. V. 50. P. 527.
Борисов С.В., Первухина Н.В., Магарилл С.А. // Журн. структур. химии. 2018. Т. 59. № 8. С. 1953.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


