Кристаллография, 2019, T. 64, № 4, стр. 654-658
Влияние добавок неэлектролитов с гидрофильной и гидрофобной гидратацией на рост кристаллов KDP из водных растворов
Е. П. Ефремова 1, Т. М. Охрименко 1, *, А. К. Лященко 2
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: kuznetsov@crys.ras.ru
Поступила в редакцию 25.06.2018
После доработки 24.10.2018
Принята к публикации 26.10.2018
Аннотация
Экспериментально исследовано влияние добавок неэлектролитов с гидрофильной и гидрофобной гидратацией на рост кристаллов дигидрофосфата калия KH2PO в кинетическом режиме при температурах насыщения растворов 323 и 303 K и относительном пересыщении 0.03. Установлено различное влияние добавок, зависящее от их вида, концентрации и индекса грани. Обнаружен эффект увеличения скорости роста граней {101} в присутствии добавок с гидрофильной гидратацией молекул и уменьшение скорости роста в случае гидрофобных добавок. Предложена модель, объясняющая различное влияние исследованных добавок на рост кристаллов. Влияние определяется изменениями структуры воды в приповерхностном слое кристаллизационного раствора, что следует учитывать при выращивании кристаллов из водных растворов в присутствии добавок неэлектролитов.
ВВЕДЕНИЕ
В настоящее время известны многочисленные экспериментальные результаты положительного влияния ряда органических добавок на кинетику роста и качество кристаллов дигидрофосфата калия (KDP): уменьшение ширины “мертвой” зоны, увеличение скорости роста, уменьшение концентрации рассеивающих центров, увеличение лазерной прочности кристаллов и другие [1–8]. Это объясняется в основном изменением характера адсорбции фоновых катионных примесей на гранях кристалла вследствие их комплексообразования и гидратации в растворе с участием добавок неэлектролитов, а также гидратационными процессами в объеме раствора и на поверхности граней [9–11]. Указанные факты связываются как с возможностью ускоренной десорбции с поверхности кристалла примесей неорганических ионов под воздействием органических молекул, так и с дегидратацией поверхности в присутствии низких концентраций органической добавки. Однако последний фактор, обусловленный изменением гидратации примеси и структурно-кинетическими изменениями воды, остается к настоящему моменту наименее изученным. Сюда относится влияние гидратационных процессов как в объеме раствора, так и на поверхности кристалла. Эти процессы тесно связаны со структурой раствора и молекулярно-кинетическим состоянием самой воды в растворах разного состава и концентраций.
Цель настоящей работы – исследовать роль структурно-кинетических изменений водных растворов неэлектролитов в механизме их воздействия на рост кристаллов KDP. Выбор в качестве примера добавок мочевины, диметилмочевины, изопропанола, этиленгликоля и муравьиной кислоты обусловлен различными особенностями гидратации молекул этих веществ.
МЕТОДИКА ЭКСПЕРИМЕНТА
Кристаллы KDP выращивали из растворов в кинетическом режиме в течение суток при относительном пересыщении σ = 0.025 по методике, описанной в [2], в кристаллизаторе объемом 1 л. Температура насыщения растворов составляла 323 и 303 K, величина рH = 4.0–4.1. Пересыщение достигалось в течение ~ 30 мин одномоментным снижением температуры воды в термостате кристаллизатора путем принудительного охлаждения до 320.5 и 300 К соответственно. Точность поддержания температуры в ростовом эксперименте ±0.05°. Изменение пересыщения в процессе роста составляло менее 0.1%, так как масса кристалла менялась незначительно. Скорости роста граней призмы {100} и пирамиды {101} измеряли в диапазоне концентраций добавок (Cдоб) в растворах KDP 1 × 10–5–1 × 10–2 моль добавки/моль KDP. Добавками являлись мочевина, диметилмочевина, изопропанол, этиленгликоль и муравьиная кислота. Указанные концентрации добавок изопропанола, муравьиной кислоты, мочевины и диметилмочевины в растворе достигались путем либо непосредственного введения в кристаллизационный раствор предварительно рассчитанных количеств этих веществ, либо введением их в виде разбавленных водных растворов требуемой концентрации. Растворы со всеми добавками, кроме изопропанола, перед постановкой ростового эксперимента вымешивались над кристаллическим осадком вещества в течение 2–3 сут при температуре насыщения 323 и 303 K. Изопропанол вводили перед началом опыта непосредственно в профильтрованный кристаллизационный раствор, который предварительно вымешивался в течение 3 сут над осадком вещества при соответствующих температурах насыщения. Для приготовления кристаллизационных растворов использовали партии реактива одинаковой квалификации “х.ч.” одного производителя (Ловозерский химический комбинат), близкие по времени изготовления, и тридистиллированную воду с концентрацией катионных примесей <10–7–10–8 мас. %. Каждой концентрации добавки соответствовали два–три ростовых опыта, по окончании которых проводили измерения суточного прироста каждой из четырех граней призмы {100} и пирамиды {101} на микроскопе МБС-9. Среднюю нормальную скорость роста граней R(Cдоб) рассчитывали из 8–12 измерений.
Затравками служили кристаллики KDP размером 5 × 5 × 5–7 мм по осям X, Y и Z соответственно, ограненные простыми формами {101} и {100}. Затравки предварительно выращивали в растворе KDP без добавок при огранении пластинок Z-среза в течение 2 сут в статическом режиме при температуре 323 К и относительном пересыщении σ = = 0.02 (т.е. в условиях “мягкой” регенерации). Затравки приклеивали в центр платформы из оргстекла, помещенной под центробежной помпой, которая использовалась для перемешивания раствора и обеспечивала кинетический режим роста (линейная скорость потока раствора была не менее 30 см/с).
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
Полученный экспериментальный материал представлен в виде совокупности кинетических зависимостей R(101)(Cдоб) и R(100)(Cдоб) при двух различных температурах насыщения раствора 323 и 303 K.
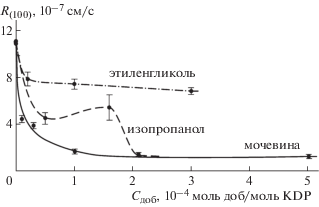
Для граней {100} кристаллов KDP экспериментальные зависимости скорости роста R(Cдоб) при температуре 323 K однотипны и сводятся к уменьшению скорости роста кристаллов во всем изученном диапазоне концентраций добавок. В качестве примера они приведены на рис. 1 для добавок мочевины, этиленгликоля и изопропанола в начальной области изученного интервала концентраций.
Рис. 1.
Влияние примесей мочевины, этиленгликоля, изопропанола на кинетику роста граней (100) призмы кристаллов KDP; температура насыщения 323 K, относительное пересыщение σ = 0.025.
Для граней {101} вид зависимостей R(Cдоб) более сложный. На рис. 2 полученные результаты (также для начальной области концентраций) представлены в виде зависимости ΔR(101)/R0(101) от Cдоб, где ΔR(101) = R(101)–R0(101), R(101) – средняя нормальная скорость роста грани (101) в растворе с концентрацией добавки Cдоб, R0(101) – средняя нормальная скорость роста грани (101) в контрольном растворе данной серии. Относительное изменение скорости роста граней выражено в процентах.
Рис. 2.
Относительное изменение скоростей роста граней (101) пирамиды кристаллов KDP при введении
в раствор добавок мочевины ( – 303 K и $\bigcirc $ – 323 K); муравьиной кислоты ($ \star $ – 323 K); этиленгликоля (
– 303 K и $\bigcirc $ – 323 K); муравьиной кислоты ($ \star $ – 323 K); этиленгликоля (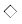 – 323 K); диметилмочевины ($\vartriangle $ – 323 K); изопропанола ($\blacksquare $ – 303 K и $\square $ – 323 K). Относительное пересыщение σ = 0.025.
– 323 K); диметилмочевины ($\vartriangle $ – 323 K); изопропанола ($\blacksquare $ – 303 K и $\square $ – 323 K). Относительное пересыщение σ = 0.025.
В случае добавок мочевины и муравьиной кислоты наблюдается максимум в начальной области концентраций добавок (~1 × 10–5 моль доб./моль KDP). При дальнейшем увеличении концентрации всех добавок до 1 × 10–2 моль доб./моль KDP (на рис. 2 эта часть диапазона представлена частично) экспериментальные зависимости описываются следующим образом. Для добавок мочевины скорость роста, пройдя через максимум при 1 × 10–5 моль доб./моль KDP, уменьшается и далее остается постоянной (несколько ниже скорости роста контрольных кристаллов) вплоть до концентрации ~ 1 × 10–2 моль доб./моль KDP. Характер воздействия добавок диметилмочевины и изопропанола противоположен действию мочевины и муравьиной кислоты – это кривые с минимумами в области концентраций 3 × 10–5 и 5 × 10–5 моль доб./моль KDP соответственно. Скорость роста кристаллов с добавками диметилмочевины при увеличении ее концентрации в растворе от 3 × 10–5 до 1 × 10–2 моль доб./моль KDP монотонно увеличивается, оставаясь при этом чуть ниже скорости роста контрольных кристаллов. В случае изопропанола скорость роста, пройдя через минимум при 5 × 10–5 моль доб./моль KDP, также несколько возрастает, оставаясь ниже скорости роста контрольных кристаллов вплоть до значений 1.5 × 10–4 моль доб./моль KDP. Последующее увеличение концентрации этой добавки до 1 × 10–2 моль доб./моль KDP приводит к падению скорости роста и значительному увеличению дефектности кристаллов из-за включений маточного раствора обеими пирамидами {101} и {100}, что делает некорректным кинетические измерения. В случае добавки этиленгликоля фиксируется увеличение скорости роста граней {101} до концентраций 3 × 10–4 моль доб./моль KDP, далее скорость роста постепенно снижается, приближаясь при значении 1 × 10–2 моль доб./моль KDP к скорости роста контрольных кристаллов.
При понижении температуры до 303 K характер зависимости R(Cдоб) для таких неэлектролитов, как мочевина и изопропанол, в целом не меняется, но в первом случае сопровождается смещением максимума зависимости R(Cдоб) для граней {101} в область бóльших концентраций добавки 4 × 10–5 моль доб./моль KDP (рис. 2). Грани {100} в аналогичных условиях не растут. Для кристаллов с добавками изопропанола снижение температуры уменьшает скорость роста граней обеих простых форм, но более существенно (~ в 6 раз) граней призмы. В этом случае наблюдается некоторое смещение минимума на кривой зависимости R(Cдоб) для граней {101} в область меньших концентраций добавки (порядка 2 × 10–5 моль доб./моль KDP).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Представленные результаты свидетельствуют о различном влиянии исследованных добавок на рост кристаллов KDP, зависящим от индекса грани, вида добавки и ее концентрации в растворе, температуры кристаллизации. Как видно из рис. 2, имеются характерные особенности влияния первых порций добавок на рост граней {101}, связанные, вероятно, с гидратацией молекул неэлектролитов в растворе. Влияние гидратации на структурно-кинетические свойства воды растворов неоднократно рассматривалось в [12–16]. В случае преобладания у молекул неполярных групп реализуются гидрофобная гидратация и стабилизация тетраэдрических конфигураций воды [12, 14, 15]. Влияние полярных групп в большинстве случаев ведет к ориентационным нарушениям исходной сетки водородных связей. Эти различия хорошо видны по данным СВЧ-диэлектрической релаксации в области максимума дисперсии молекул воды в растворе [12]. В первом случае величины энтальпии активации процесса диэлектрической релаксации $(\Delta H_{\varepsilon }^{{ + + }})$ растут, а во втором падают при переходе от воды к раствору. Такие эффекты отражают изменения степени связанности и структурированности исходной сетки H-связей при переходе от воды к раствору. У рассматриваемых в настоящей работе молекул добавок присутствуют именно такие противоположные эффекты. Для растворов мочевины характерна типичная гидрофильная гидратация [12, 13, 16], а для растворов диметилмочевины на первый план выступает роль ее неполярных групп [12]. То же самое наблюдается для растворов изопропанола. В случае растворов муравьиной кислоты (в отличие от других кислот этого ряда) влияние ее полярной группы преобладает, что ведет к падению величины $\Delta H_{\varepsilon }^{{ + + }}$ [12]. Растворы этиленгликоля показывают промежуточные и близкие к нулю изменения $\Delta H_{\varepsilon }^{{ + + }}$ и $\Delta S_{\varepsilon }^{{ + + }}$ (проявления противоположного знака компенсируются) [12, 14].
Отметим, что рассматриваемые эффекты влияния добавок на процессы роста кристаллов не полностью тождественны указанным выше данным. По данным диэлектрической релаксации (и других свойств растворов) изменения в растворах неэлектролитов отмечаются при значительно больших концентрациях (обычно больше 0.5 мол. % неэлектролита) [12–15]. Их влияния на другие процессы в растворах и гетерогенные равновесия также присутствуют в растворах средних концентраций [14]. При малых концентрациях добавок, которые рассматриваются в настоящей работе, изменения структуры воды в растворе вряд ли существенны. Так или иначе, в исходном рассмотрении речь идет об особенностях изменений сетки водородных связей, появляющихся в водно-неэлектролитной подсистеме при первых добавках молекул неэлектролитов. Таким бразом, рассматривается предельный наклон полученных в работе экспериментальных кривых. Он может быть описан в схеме взаимодействия собственных и примесных дефектов тетраэдрической структуры воды, выделяющей эффекты разного знака. Наиболее близко такому описанию (в том числе, по концентрациям) соответствуют растворы неполярных газов, где реализуется типичная гидрофобная гидратация [17]. Есть и другие примеры проявления подобных процессов в растворах невысоких концентраций [18]. Отметим, что указанные выше разнознаковые изменения сетки связей относятся к двойной системе вода–неэлектролит, а не к растворам солей, где возможны дополнительные эффекты. Значения времен релаксации растворов солей (τ) характеризуют изменения вращательной подвижности молекул воды в гидратных оболочках ионов. Для большинства растворов с гидрофильной гидратацией ионов характерно уменьшение τ в растворе соли [19, 20]. Поведение релаксационных характеристик отличает водные растворы фосфатов от других систем. Результаты исследований диэлектрической релаксации растворов KH2PO4 и NH4H2PO4 показывают, что ионы ${{{\text{H}}}_{{\text{2}}}}{\text{PO}}_{4}^{ - }$ в отличие от других анионов не нарушают (а возможно, даже стабилизируют) исходную структуру воды [19, 21]. Возможные структурные модели внедрения таких анионов в структуру воды были также рассмотрены в [14]. При этом в системе сохраняется исходный тетраэдрический порядок.
Как следует из данных [22], тетраэдрическая структура воды сохраняется и на поверхности граней (101) кристаллов KDP. Установлено наличие четырех адсорбированных слоев воды, два из которых имеют льдоподобную структуру. Таким образом, можно говорить о единой водно-электролитной сетке H-связей в объеме и на поверхности (без нарушенных переходных слоев), на динамику которой могут влиять находящиеся в ней молекулы неэлектролитов. Различия гидрофобной и гидрофильной гидратации молекул добавки вблизи растущей поверхности кристалла могут проявляться по знаку структурно-кинетических изменений воды. Это должно влиять на перенос ионов K+ к поверхности. Как известно, этот ион принадлежит к слабо гидратирующимся ионам (отрицательная молекулярно-кинетическая гидратация по Самойлову [23]). Соответственно, в случае рассмотренных добавок с гидрофильной гидратацией молекул, приводящей к нарушениям исходной сетки H-связей и увеличению подвижности молекул среды, возможно увеличение подвижности иона K+. В случае добавок, где преобладает гидрофобная гидратация неполярных групп (растворы диметилмочевины, изопропанола), происходит стабилизация исходной сетки, и перенос ионов K+ может быть замедлен. Это следует из экспериментальных данных по росту кристаллов KDP, где в начальной области концентраций наблюдаются соответствующие разнознаковые эффекты. Данная закономерность относится именно к начальной области концентраций примесей. В таком случае общие условия комплементарности, реализующиеся в приповерхностном слое в рамках единой сетки H-связей, не нарушены концентрационными эффектами агрегации молекул неэлектролитов на поверхности.
Снижение температуры насыщения раствора до 303 K во всех исследованных случаях уменьшает скорости роста граней обеих простых форм во всем изученном диапазоне концентраций добавок. При этом для граней {101} сохраняется положительный эффект от введения добавки с гидрофильной гидратацией (мочевина) и отрицательный – в случае добавки с гидрофобной гидратацией (изопропанол) (рис. 2). Следовательно, изменения, связанные с температурой, не меняют сущности рассматриваемых эффектов.
Отсутствие положительного эффекта влияния добавок с гидрофильной гидратацией (мочевина, этиленгликоль) на скорость роста граней {100} (рис. 1), возможно, связано с более прочным взаимодействием последних с молекулами воды кристаллизационного раствора (хемосорбция воды через образование водородных связей с группами PO4 на поверхности грани (100) [24]). В связи с этим отметим, что авторы [24, 25] наблюдали заметное влияние pH на структуру приповерхностного слоя кристаллизационного раствора, находящегося в контакте с гранью (101) кристалла KDP. В случае грани (100) такая зависимость отсутствует. Причину этого явления они видят в различной кристаллографической структуре граней и, как следствие, в различном характере их взаимодействия с раствором. Особенности возникающих при этом связей на границе кристалл–раствор и в проведенных экспериментальных исследованиях являются, по-видимому, основной причиной разницы в кинетике роста граней {101} и {100} кристаллов KDP.
ЗАКЛЮЧЕНИЕ
На основании полученного экспериментального материала установлено различное действие исследованных добавок, зависящее от вида добавки, ее концентрации и индекса грани. Для граней (100) наблюдается общее уменьшение скорости роста во всем диапазоне концентраций добавок. Для граней (101) обнаружена специфика, определяющаяся разным знаком влияния первых порций добавок неэлектролитов.
В начальной области концентраций при добавках мочевины, этиленгликоля и муравьиной кислоты наблюдается увеличение скорости роста этих граней. Эффект соответствует гидрофильной гидратации молекул неэлектролита и нарушению единой тетраэдрической сетки водородных связей в водном растворе и на поверхности кристалла, облегчающих диффузию ионов калия к растущей поверхности.
В случае добавок диметилмочевины и изопропанола наблюдается противоположный эффект – уменьшение скорости роста граней. Этот эффект соответствует гидрофобной гидратации и стабилизации структуры воды молекулами неэлектролитов. Таким образом, изменения структуры воды в приповерхностном слое необходимо учитывать в исследовательской и практической деятельности по выращиванию кристаллов KDP в присутствии добавок неэлектролитов.
Список литературы
Велихов Ю.Н., Демирская О.В., Пуляева И.В. // Кристаллография. 1992. Т. 37. Вып. 2. С. 509.
Барсукова М.Л., Кузнецов В.А., Охрименко Т.М. и др. // Кристаллография. 1992. Т. 37. Вып. 4. С. 1003.
Кузьмин С.П., Кузнецов В.А., Охрименко Т.М. и др. // Кристаллография. 1994. Т. 39. № 5. С. 914.
Kuznetsov V.A., Okhrimenko T.M., Rak M. // J. Cryst. Growth. 1998. V. 193. № 2. P. 164.
Кирьянова Е.В., Новожилова И.В. // Неорган. материалы. 1998. Т. 34. № 2. С. 218.
Yang Shangfeng, Su Genbo, Li Zhengbong et al. // J. Cryst. Growth. 1999. V. 197. № 4. P. 383.
Охрименко Т.М., Ефремова Е.П., Кузнецов В.А. // Кристаллография. 2000. Т. 45. № 5. С. 921.
Podder J. // J. Cryst. Growth. 2002. V. 237–239. № 1. P. 70.
Охрименко Т.М., Ефремова Е.П., Лященко А.К. и др. // Тез. докл. IV Междунар. конф. “Кинетика и механизм кристаллизации. Нанокристаллизация. Биокристаллизация”, Иваново, 9–22 сентября 2006. С. 107.
Охрименко Т.М., Ефремова Е.П., Лященко А.К. // Тез. докл. IV Междунар. симп. “Механизмы действия сверхмалых доз”. Москва, 28–29 октября 2008. С. 82.
Ефремова Е.П., Охрименко Т.М., Лященко А.К. // Кристаллография. 2012. Т. 57. № 3. С. 520.
Lyashchenko A.K., Lileev A.S., Novskova T.A. et al. // J. Mol. Liq. 2001. V. 93. P. 29.
Лященко А.К., Дуняшев В.С., Засецкий А.Ю. // Журн. физ. химии. 2017. Т. 91. № 5. С. 837.
Lyashchenko A.K. // Relaxation Phenomena in Condensed Matter / Ed. Coffey W. Advanced in Chem. Phys. Ser. 1994. V. LXXXVII. P. 379.
Лященко А.К., Новскова Т.А. // Структурная самоорганизация в растворах и на границе раздела фаз. М.: ЛКИ, 2008. С. 417.
Лященко А.К., Харькин В.С., Ястремский П.С. и др. // Журн. физ. химии. 1982. Т. 56. № 11. С. 2777.
Lyashchenko A.K. // J. Res. Institute for Catalysis, Hokkaido University. 1977. V. 25. № 3. P. 129.
Кулов Н.Н., Лилеев А.С., Лященко А.К. и др. // Докл. АН СССР. 1989. Т. 308. № 6. С. 1430.
Lyashchenko A., Lileev A. // J. Chem. Eng. Data. 2010. V. 55. P. 2008.
Lileev A., Lyashchenko A. // J. Mol. Liq. 2009. V. 150. P. 4. https://doi.org/10.1016/j.molliq.2009.08.008
Лященко А.К., Лоцманова Е.А., Лилеев А.С. // Журн. неорган. химии. 2014. Т. 59. № 7. С. 965.
Reedijk M.F., Arsik J., Hollander F.F.A. et al. // Phys. Rev. Lett. 2003. V. 90. № 6. P. 066103.
Самойлов О.Я. Структура водных растворов электролитов и гидратация ионов. М.: Изд-во АН СССР, 1957. 182 с.
Kaminsky D., Radenovic N., Deij M.A. et al. // Cryst. Growth Design. 2006. V. 6. № 2. P. 588.
Kaminsky D., Radenovic N., Deij M.A. et al. // Phys. Rev. B. 2005. V. 72. P. № 1–5. P. 245404.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


