Кристаллография, 2019, T. 64, № 4, стр. 632-637
Исследование нанолекарства “фосфолиповит” методом малоуглового рассеяния нейтронов
М. А. Киселев 1, 2, 7, *, Д. Н. Селяков 2, 1, И. В. Гапон 1, 3, А. И. Иваньков 1, 3, О. М. Ипатова 4, В. Л. Аксенов 1, 2, 5, М. В. Авдеев 1, 6
1 Объединенный институт ядерных исследований
Дубна, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Киевский национальный университет
Киев, Украина
4 Институт биомедицинской химии РАН
Москва, Россия
5 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
6 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
7 Дубненский университет
Дубна, Россия
* E-mail: kiselev@jinr.ru
Поступила в редакцию 04.06.2018
После доработки 29.11.2018
Принята к публикации 06.12.2018
Аннотация
Методом малоуглового рассеяния нейтронов исследована структура водных растворов лекарственного препарата “Фосфолиповит”, предназначенного для транспортировки молекул не растворимых в воде лекарств. “Фосфолиповит” может использоваться независимо, например, при острых отравлениях. Для обработки экспериментальных данных дополнительно с помощью нейтронной рефлектометрии определены рассеивающие характеристики буферных растворов мальтозы, в которых находится препарат. Показано, что “Фосфолиповит” образует в таких растворах устойчивые к температуре (диапазон 20–37°C) везикулы критически малого размера с сопоставимыми внутренним радиусом (~40 Å) и толщиной липидного бислоя (~31 Å). Определены чувствительность параметров везикул к росту концентрации препарата в растворе (до 25 мас. %) и характер взаимодействия везикул, указывающий на присутствие большого по величине заряда на их внешней поверхности.
ВВЕДЕНИЕ
Лекарственный препарат “Фосфолиповит” (разработка Научно-исследовательского института биомедицинской химии им. В.Н. Ореховича, Москва) представляет собой композицию соевых фосфолипидов, оказывающую терапевтическое воздействие на человеческий организм [1, 2]. Одновременно “Фосфолиповит” может использоваться как переносчик не растворимых в воде лекарств. Основной лекарственной субстанцией “Фосфолиповита” являются соевые фосфолипиды, терапевтическая эффективность которых доказана клинически. Препарат представляет собой лиофильно высушенный порошок, стабильный при комнатной температуре, хранящийся в порошке мальтозы в отношении 1 : 4. Молекулы мальтозы обеспечивают химическую стабильность лекарства. При регидратации “Фосфолиповита” образуется наноэмульсия с частицами очень малого размера. Подобные структуры (нанолекарства) составляют большую часть современного рынка бионанотехнологий, поэтому их изучение актуально не только с фундаментальной, но и с практической точки зрения.
Для успешного применения везикул и мицелл фосфолипидов как лекарственных препаратов и переносчиков нанолекарств, а также для детального понимания механизма их прохождения в организм человека необходимо знать их размеры и структуру. Ввиду малого размера данных объектов (менее 100 нм) методы малоуглового рассеяния тепловых нейтронов (МУРН) и рентгеновских лучей (в том числе синхротронного излучения) наиболее информативны для прояснения структурной организации ассоциатов (пространственных объединений) фосфолипдов как в модельных [3, 4], так и непосредственно в практических препаратах [5]. В настоящей работе приведены результаты изучения структуры “Фосфолиповита” в виде раствора методом МУРН. Для обеспечения достаточного контраста и уменьшения некогерентного фона исследуемые растворы приготавливали на основе тяжелой воды (D2O). Наличие дополнительного компонента (мальтозы) в практической системе усложняет структурный анализ. В частности, это потребовало дополнительного независимого определения плотности длины рассеяния (ПДР) буферных растворов мальтозы в D2O. Для этой цели использовали два подхода. Сначала применяли нейтронную рефлектометрию зеркального отражения на границе раздела раствора с кристаллическим кремнием. Пучок нейтронов направлялся через кремний на границу раздела с жидкой средой, которая из-за тяжелой воды как основного компонента является оптически более плотной для нейтронов. Такое сочетание позволяет наблюдать полное отражение нейтронного пучка от границы раздела, а из наблюдаемого критического значения проекции вектора рассеяния на перпендикулярное направление находить ПДР жидкой среды. Также ПДР определена из прецизионных измерений массовой плотности растворов при варьировании содержания мальтозы. В результате анализа данных МУРН изучены морфология и форма ассоциатов в растворе “Фосфолиповита”, а также характер их взаимодействия, и исследована чувствительность параметров формы к концентрации.
ОЦЕНКИ ПЛОТНОСТИ ДЛИНЫ РАССЕЯНИЯ РАСТВОРОВ МАЛЬТОЗЫ В ТЯЖЕЛОЙ ВОДЕ
Измерения ПДР растворов мальтозы (C12H22O11) в тяжелой воде необходимы для точной обработки данных малоуглового эксперимента по определению структуры ассоциатов лекарственного препарата “Фосфолиповит”, образующих взвесь в таком растворе. При приготовлении раствора порошок мальтозы добавляли в тяжелую воду, варьируя его массовую долю, которая составляла 4, 10 и 20%. Эксперимент по нейтронной рефлектометрии проводили на рефлектометре ГРЭИНС на импульсном реакторе ИБР-2 ЛНФ ОИЯИ (Дубна, Россия) [6]. Установка с горизонтальной ориентацией плоскости образца работает в режиме времени пролета. Коллимированный плоский пучок нейтронов направлялся в специальную ячейку через блок-подложку с низким поглощением (кристаллический кремний) и попадал на плоскую границу раздела с раствором мальтозы. Наклон пучка (~5 мрад) по отношению к поверхности контакта подложки с раствором обеспечивали с помощью отклоняющего нейтронного зеркала (длина зеркала 1 м, расстояние зеркало–образец 3 м). Зеркально отраженный пучок регистрировал двумерный позиционно-чувствительный детектор (размер 20 × 20 см, разрешение 2 × 2 мм, расстояние образец–детектор 3 м), усредняя отраженный пучок вдоль горизонтального направления. Интенсивность рассеяния измеряли как функцию проекции вектора рассеяния на перпендикулярное направление qz = = (4π/λ)sin θ ≈ 4πθ/λ, где θ – фиксированный (5 мрад) угол скольжения, а λ – длина волны нейтронов в диапазоне 0.1–0.6 нм (тепловой режим замедлителя на ИБР-2). Кривую отражения получали делением на спектр пустого пучка, измеряемого отдельно (без ячейки). Полученные кривые отражения обрабатывали с помощью программы Sasview 3.0.0. [7]. Калибровку установки проводили с использованием многослойных пленок-стандартов, которые предварительно были откалиброваны с помощью рентгеновской рефлектометрии (установка Bruker D8 DISCOVER, Центр рентгенодифракционных исследований СПбГУ, Санкт-Петербург, Россия). Также был откалиброван кремниевый кристалл-подложка, используемый в нейтронных экспериментах.
Для границы раздела двух полубесконечных сред (кремниевая подложка и жидкость) кривая зеркального отражения следует закону Френеля:
(1б)
$R({{k}_{z}}) = {{\left| {\frac{{1 - \sqrt {1 - {{{\left( {\frac{{{{k}_{{{\text{c}},12}}}}}{{{{k}_{z}}}}} \right)}}^{2}}} }}{{1 + \sqrt {1 - {{{\left( {\frac{{{{k}_{{{\text{c}},12}}}}}{{{{k}_{z}}}}} \right)}}^{2}}} }}} \right|}^{2}},\quad {{k}_{z}} > {{k}_{{\text{c}}}}_{{,12}},$При известной ПДР первой среды (кремний) из экспериментально найденных значений kc,12 оценивали плотность ρ2. Такая оценка не требует никаких допущений и является наиболее “прямым” способом определения искомой ПДР. На рис. 1 для сравнения представлены экспериментальные кривые отражения нейтронов и расчетные кривые Френеля; величины ρ2, полученные с использованием (2), даны на рис. 2 и собраны в табл. 1.
Рис. 1.
Экспериментальные (точки) кривые зеркального отражения нейтронов от границы раздела кремний–раствор мальтозы в тяжелой воде при разных концентрациях мальтозы (мас. %). Сплошные линии – аппроксимации законом Френеля (1).
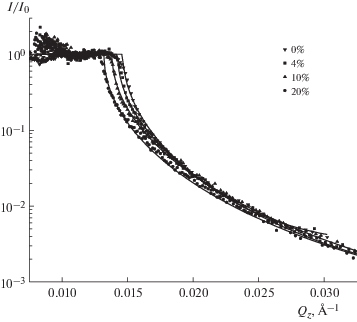
Рис. 2.
Два способа оценки зависимости ПДР раствора мальтозы в тяжелой воде от концентрации мальтозы (массовая доля nм): 1 – из экспериментов по нейтронной рефлектометрии (ошибки не превышают размер точек); 2 – из измерений массовой плотности раствора (ошибки не превышают толщину линии).
Таблица 1.
Сравнение значений ПДР растворов мальтозы в тяжелой воде, полученных двумя способами: из экспериментов по нейтронной рефлектометрии (ПДР1) и расчета с использованием значений измеренной массовой плотности (ПДР2)
| Концентрация мальтозы, мас. % | ПДР1, 10–6 Å–2 | ПДР2, 10–6 Å–2 | Относительное отклонение, % |
|---|---|---|---|
| 0 | 6.34 | 6.38 | 1 |
| 4 | 6.10 | 6.25 | 3 |
| 10 | 5.86 | 6.05 | 3 |
| 20 | 5.53 | 5.69 | 3 |
Альтернативный предыдущему способ оценки ПДР растворов при различных концентрациях мальтозы – измерение массовой плотности раствора ρ с последующим расчетом ПДР по формуле
(3)
${{{\rho }}_{n}} = {\rho }{{N}_{{\text{A}}}}\mathop \sum \limits_1^k \frac{{{{n}_{i}}{{b}_{i}}}}{{{{{\mu }}_{i}}}},$(4)
${{{\rho }}_{n}} = {\rho }({{n}_{{\text{м }}}}){{N}_{{\text{A}}}}\left( {\frac{{{{n}_{{\text{м }}}}{{b}_{{\text{м }}}}}}{{{{{\mu }}_{{\text{м }}}}}} + \frac{{(1 - {{n}_{{\text{м }}}}){{b}_{{{{{\text{D}}}_{2}}{\text{O}}}}}}}{{{{{\mu }}_{{{{{\text{D}}}_{2}}{\text{O}}}}}}}} \right),$(5)
$\begin{gathered} {\rho }({{n}_{{\text{м }}}}) = \frac{{\sum m}}{V} = \frac{{{{n}_{{\text{м }}}}{{m}_{{\text{м }}}} + (1 - {{n}_{{\text{м }}}}){{m}_{{{\text{D}}2{\text{O}}}}}}}{V} = \\ = \frac{{{{n}_{{\text{м }}}}({{m}_{{\text{м }}}} - {{m}_{{{{{\text{D}}}_{2}}{\text{O}}}}}) + {{m}_{{{{{\text{D}}}_{2}}{\text{O}}}}}}}{V}, \\ \end{gathered} $Для получения зависимости ρ(${{n}_{{\text{м }}}}$) на плотномере DMA 5000M (ЛНФ ОИЯИ) были измерены массовые плотности растворов с концентрациями 4, 8 и 20%, которые составили соответственно 1.118043, 1.131589, 1.173363 г/см3 (ошибка плотномера 10–6 г/см3). В результате получили зависимость
(6)
$\begin{gathered} {\rho (}{{n}_{{\text{м }}}}{\text{)}} = {\;}0.3463( \pm 0.002){{n}_{{\text{м }}}}{\text{ + }} \hfill \\ {\;} + \;1.10406( \pm 0.001)\;{\text{г /с }}{{{\text{м }}}^{3}}. \hfill \\ \end{gathered} $АНАЛИЗ ДАННЫХ МАЛОУГЛОВОГО РАССЕЯНИЯ НЕЙТРОНОВ
Ниже приведены результаты анализа структуры лекарства “Фосфолиповит” в растворах по данным малоуглового рассеяния нейтронов. Эксперименты проводили на времяпролетной малоугловой установке ЮМО на импульсном реакторе ИБР-2 ЛНФ ОИЯИ (Дубна, Россия) [8]. Интенсивность рассеяния (дифференциальное сечение рассеяния, приведенное к единичному объему образца), изотропную по радиальному углу φ на детекторе большой площади (размер ~90 см), получали как функцию модуля вектора рассеяния, q = (4π/λ)sin(θ/2), где θ – угол рассеяния, λ – длина волны нейтронов в диапазоне 0.05–0.5 нм. Для получения кривых рассеяния в диапазоне q = 0.08–4.0 нм–1 использовали два детектора, расположенные за образцом на расстояниях 4 и 16 м. Для калибровки интенсивности применяли ванадиевый стандарт. Все жидкие образцы помещали в кварцевые кюветы Hellmа (оптический путь 2 мм). Температуру на образце (диапазон 20–37°C) во время эксперимента поддерживали с помощью термостата с автоматическим контролем. Рассеяние на буферных растворах измеряли отдельно и вычитали из рассеяния на растворах. Первичную обработку данных выполняли с использованием программы SAS и режима сглаживания [9].
Интенсивность малоуглового рассеяния на ассоциатах в растворах моделировали стандартным образом [3, 4]:
где F(q) – формфактор ассоциата, S(q) – структурный фактор, определяемый характером взаимодействия ассоциатов между собой, A – объемная концентрация ассоциатов (число частиц в 1 см3), B – остаточный фон после вычитания рассеяния на буферном растворе.Формфактор ассоциата моделировали в однородном приближении, предполагая ПДР постоянной и рассматривая две возможные формы: анизотропную мицеллу и сферическую везикулу. В первом случае мицеллы представляли собой эллипсоиды вращения с формфактором рассеяния [10]:
(8)
$F(q) = \Delta {\rho }V\mathop \smallint \limits_0^1 J[qa\sqrt {1 + {{x}^{2}}({{\text{v}}^{2}} - 1)} ]dx.$Формфактор сферической везикулы, когда растворитель с мальтозой свободно проникает в ее полость при сборке, имеет вид
(9)
$F(q) = \Delta {\rho }\left[ {\left( {\frac{{3{{V}_{2}}J(q{{R}_{2}})}}{{q{{R}_{2}}}}} \right) - \left( {\frac{{3{{V}_{1}}J(q{{R}_{1}})}}{{q{{R}_{1}}}}} \right)} \right],$Зная значения ПДР раствора, можно с большей точностью определять параметры форм. В случае малой концентрации структурный фактор принимали равным единице. В случае больших концентраций (более 5%) для структурного фактора пробовали модель жестких сфер Hard Sphere Structure [11] и модель средней сферической аппроксимации Hayter MSA Structure [12, 13], представляемые программой Sasview 3.0.0. В первом случае потенциал взаимодействия описывается следующим образом:
(10)
${{U}_{{{hard\;spere}}}} = \left\{ \begin{gathered} 0,\quad r \geqslant 2R, \hfill \\ \infty ,\quad r < 2R. \hfill \\ \end{gathered} \right.$Во втором случае между сферическими объектами, находящимися в диэлектрической среде, действует кулоновское отталкивание из-за заряда на поверхности:
(11)
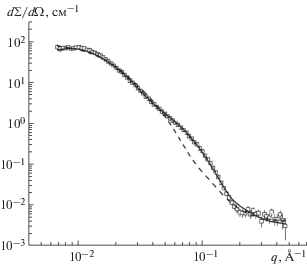
${{U}_{{{HAYTER\;MSA}}}} = \left\{ \begin{gathered} {\pi \varepsilon }{{{\varepsilon }}_{0}}{{D}^{2}}{\varphi }_{0}^{2}\frac{{{\text{exp}}( - k(r - 2R))}}{r}, \hfill \\ r \geqslant 2R, \hfill \\ \infty ,\quad r < 2R. \hfill \\ \end{gathered} \right.$Изменения кривой МУРН с ростом концентрации прослеживаются на рис. 3. Дополнительно проверяли температурную стабильность раствора. Относительные изменения кривых рассеяния при концентрациях лекарства 5 и 25% при температурах 20 и 37°С не превышают 5%, что говорит о том, что исследуемые объекты стабильны при изменении температуры в биологическом диапазоне. Сравнение подгоночных кривых с экспериментальными данными (рис. 4) для разных формфакторов с большой степенью достоверности позволяет говорить, что препарат находится в растворе в форме везикул.
Рис. 3.
Экспериментальные кривые малоуглового рассеяния нейтронов для растворов с различной концентрацией “Фосфолиповита” при разной температуре.
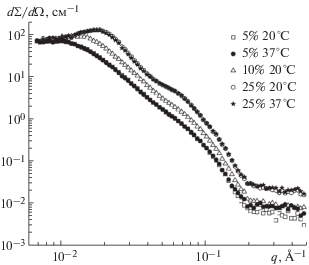
Рис. 4.
Выбор модели формфактора липидных ассоциатов в 5%-ном растворе “Фосфолиповита” (T = = 20°С) при подгонке моделей “мицелла” (χ2 = 209) (штриховая линия) и “везикула” (χ2 = 3.25) (сплошная линия).
Тип взаимодействия определяли, используя кривую рассеяния концентрированного раствора (концентрация препарата 25%), где эффект структурного фактора наибольшим образом проявляется в области малых значений q. Из двух обозначенных ранее моделей взаимодействия в используемой программе обработки (Hard Sphere Structure и Hayter MSA Structure) наилучшим образом экспериментальную кривую описывает вторая модель (рис. 5), которая учитывает дополнительное кулоновское отталкивание везикул из-за заряда, аккумулирующегося на поверхности ассоциатов. Экспериментальные и расчетные кривые рассеяния для всех концентраций представлены на рис. 6 для сравнения. Параметры везикул собраны в табл. 2. Видно, что везикулы имеют критически малый размер, когда внутренний радиус везикулы (~40 Å) сопоставим с толщиной липидного бислоя (~31 Å). Оба структурных параметра везикул слабо меняются с ростом концентрации препарата в растворе. В то же время точность определения толщины липидного бислоя везикулы позволяет говорить о ее слабом (~4%), но различимом увеличении с ростом концентрации. Четкое указание на то, что везикулы “Фосфолиповита” взаимодействуют между собой как заряженные шарообразные частицы, говорит о наличии заряда на поверхности везикул.
Рис. 5.
Выбор модели структурного фактора везикул в 25%-ном растворе “Фосфолиповита” (T = 20°С) при подгонке моделей Hard Sphere (χ2 = 38.9) (штриховая линия) и Hayter MSA Structure (χ2 = 2.25) (сплошная линия).
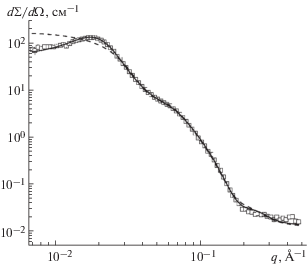
Рис. 6.
Лучшие аппроксимации (сплошные линии) экспериментальных кривых МУРН (точки) согласно выражениям (7), (9), (10), (11) при T = 20°С. Соответствующие параметры аппроксимаций собраны в табл. 2.
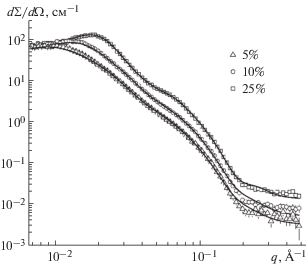
Таблица 2.
Полученные из модельных подгонок (с указанием χ2 значения внутреннего радиуса и толщины липидного бислоя везикул для разных концентраций “Фосфолиповита” в буфере на основе тяжелой воды при комнатной температуре (T = 20°C)
| Концентрация “Фосфолиповита” в растворе, мас. % | r, Å | d, Å | χ2 |
|---|---|---|---|
| 5 | 41.5 ± 0.3 | 30.8 ± 0.2 | 2.46 |
| 10 | 38.7 ± 0.3 | 31.2 ± 0.3 | 2.98 |
| 25 | 43.6 ± 0.2 | 32.0 ± 0.1 | 2.25 |
ЗАКЛЮЧЕНИЕ
Методом малоуглового рассеяния нейтронов исследованы растворы лекарственного препарата “Фосфолиповит” в тяжелой воде с дополнительно содержащейся в них мальтозой, что необходимо в практических применениях. Показано, что “Фосфолиповит” в диапазоне концентраций до 25 мас. % образует в таких растворах устойчивые к температуре (диапазон 20–37°C) везикулы с критически малым размером: внутренний радиус (~40 Å) везикул сопоставим с толщиной липидного бислоя (~31 Å). Толщина липидного бислоя везикул слабо увеличивается с ростом концентрации препарата. Выявлен зарядовый характер взаимодействия везикул в растворе, который предполагает наличие заряда на внешней поверхности везикул.
Список литературы
Кудинов В.А., Ипатова О.М., Федоров И.Г. и др. // Биомедицинская химия. 2016. Т. 62. № 6. С. 704.
Медведева Н.В., Прозоровский В.Н., Игнатов Д.В. и др. // Биомедицинская химия. 2015. Т. 61. № 2. С. 219.
Kučerka N., Nagle J.F. // Phys. Rev. E. 2004. V. 69. P. 051903.
Kiselev M.A., Zemlyanaya E.V., Aswal V.K., Neubert R.H.H. // Europ. Biophys. J. 2006. V. 35. № 6. P. 477.
Kiselev M.A., Zemlyanaya E.V., Ermakova E.V. // J. Pharm. Biomed. Analysis. 2015. V. 114. P. 288.
Авдеев М.В., Боднарчук В.И., Петренко В.И. и др. // Кристаллография. 2017. Т. 62. № 6. С. 986.
http://www.sasview.org/
Kuklin A.I., Islamov A.K., Gordeliy V.I. // Neutron News. 2005. V. 16. № 3. P. 16.
Soloviev A.G., Murugova T.N., Islamov A.H. // J. Phys. Conf. Ser. 2012. V. 351. P. 012027.
Свергун Д.И., Фейгин Л.А. Рентгеновское и нейтронное малоугловое рассеяние. М.: Наука, 1986. 279 с.
Percus J.K., Yevick J. // J. Phys. Rev. 1958. V. 110. P. 1.
Hayter J.B., Penfold J. // Mol. Phys. 1981. V. 42. P. 109.
Hansen J.P., Hayter J.B. // Mol. Phys. 1982. V. 46. P. 651.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


