Кристаллография, 2019, T. 64, № 4, стр. 569-576
Синтез и строение комплексов сукцината уранила с цианогуанидином и диэтилацетамидом
Л. Б. Сережкина 1, *, М. С. Григорьев 2, Е. Ф. Рогалева 1, В. Н. Сережкин 1
1 Самарский национальный исследовательский университет имени академика С.П. Королева
Самара, Россия
2 Институт физической химии и электрохимии РАН
Москва, Россия
* E-mail: Lserezh@samsu.ru
Поступила в редакцию 18.06.2018
После доработки 09.07.2018
Принята к публикации 15.07.2018
Аннотация
Осуществлен синтез и проведено ИК-спектроскопическое и рентгеноструктурное исследование кристаллов [UO2(suc)(C2N4H4)2] · 2H2O (I) и [UO2(Deaa)4(H2О)][(UO2)2(C4H4O4)3] · 2Deaa (II), где suc2– – сукцинат-ион, C2N4H4 – цианогуанидин, Deaa – N,N-диэтилацетамид С6Н13NO. Установлено, что структура I образована цепочками, принадлежащими кристаллохимической группе AQ02M12 (A = UO$_{2}^{{2 + }}$, Q02 = suc2–, M1 = C2N4H4) комплексов уранила. Структура II содержит два сорта комплексных группировок: одноядерные катионы [UO2(Deaa)4(H2О)]2+ и слоистые анионы [(UO2)2(suc)3]2–, которым соответственно отвечают кристаллохимические формулы AM$_{5}^{1}$ и A2Q$_{3}^{{02}}$ (A = UO$_{2}^{{2 + }}$, M1 = Deaa и Н2О, Q02 = suc2–). Методом молекулярных полиэдров Вороного–Дирихле проведен анализ невалентных взаимодействий в структуре II и его карбамидсодержащем аналоге.
ВВЕДЕНИЕ
Интерес к карбоксилатсодержащим координационным полимерам уранила связан с их полезными физико-химическими свойствами (способностью к ионному обмену, протонной проводимостью, фотокаталитической активностью и др.) [1]. К настоящему времени получены и структурно охарактеризованы 12 координационных полимеров, в кристаллах которых ион уранила координирует сукцинат-ионы (suc2– = C4H4O$_{4}^{{2 - }}$) и в ряде случаев электронейтральные лиганды [2–9]. Выяснилось, что даже при одинаковом соотношении suc2–:UO$_{2}^{{2 + }}$ образующиеся полимеры могут иметь разную размерность (1D, 2D или 3D) из-за различий в строении уранилсукцинатных комплексов, обусловленных разным координационным числом атомов U(VI), конформацией и/или типом координации сукцинат-ионов, а также вследствие топологической изомерии. Кроме того, в [6] обнаружено, что комплексы сукцината уранила с некоторыми электронейтральными лигандами L способны диспропорционировать по схеме 3UO2(suc) · nL → [UO2(L)х]2+ + [(UO2)2(suc)3]2– + + (3n – x)L.
В процессе исследования фазовых равновесий в системах UO2(suc)–L–H2O, где L – цианогуанидин (дициандиамид = C2N4H4) или N,N-диэтилацетамид (Deaa = С6H13NO), впервые получены кристаллические UO2(suc)(C2N4H4)2 · 2H2O (I) и (UO2)3(suc)3(Deaa)6 · H2O (II), исследованию строения которых посвящена данная работа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Для синтеза I к 0.35 г (1.15 ммоль) UO2(ОН)2 добавляли 6 мл водного раствора янтарной кислоты (0.54 г, 4.6 ммоль) и 4 мл водного раствора цианогуанидина (0.29 г, 3.45 ммоль). Исходное мольное соотношение реагентов составляло 1:4:3 (рН раствора равен 3). Полученный раствор оставляли для изотермического испарения на воздухе при комнатной температуре. Через 2–3 дня из раствора выпадали желтые кристаллы состава [UO2(suc)(C2N4H4)2] · 2H2O (I) (найдено, %: U, 39.9; вычислено, %: U, 40.34), выход – 71%.
Для синтеза II в качестве исходных веществ использовали оксид урана(VI), янтарную кислоту и диэтилацетамид. К 0.2 г (0.7 ммоль) UO3 добавляли 5 мл водного раствора янтарной кислоты (0.25 г, 2.1 ммоль) и нагревали на водяной бане до полного растворения. К полученному раствору приливали Deaa (0.48 г, 4.2 ммоль) и несколько капель соляной кислоты до рН раствора 4. Мольное соотношение реагентов составляло 1 : 3 : 6. Через 6–7 дней из раствора выделялись желтые пластинчатые кристаллы состава [UO2(Deaa)4(H2О)][(UO2)2(suc)3] · · 2Deaa (II) (найдено, %: U, 39.3; вычислено, %: U, 38.93), выход – 64%.
Рентгеноструктурный анализ. Кристаллографические характеристики, данные эксперимента и уточнения структур I и II приведены в табл. 1. Структуры расшифрованы прямым методом и уточнены полноматричным методом наименьших квадратов по F2 по всем данным. В структуре I все неводородные атомы уточняли в анизотропном приближении. Структуру II уточняли как рацемический двойник. В ней атом урана уточнен анизотропно, остальные неводородные атомы – изотропно. Атомы H органических лигандов в обеих структурах размещены в геометрически вычисленных позициях с изотропными температурными параметрами, равными 1.2Uэкв(C,N) для групп CH2 и NH2 и 1.5Uэкв(C) для групп CH3. Атомы H молекулы воды (разупорядоченной относительно плоскости зеркального отражения) в структуре I локализованы из разностного синтеза электронной плотности и уточнены с ограничением расстояний O–H и угла H–O–H. В структуре II координаты атомов H молекулы воды найдены с помощью компьютерной программы HYDROGEN [14], при уточнении структуры они были фиксированы.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур [UO2(suc)(C2N4H4)2] · · 2H2O (I) и [UO2(Deaa)4(H2О)] · [(UO2)2 (suc)3] · 2Deaa (II)
| Параметр | I | II |
|---|---|---|
| Сингония, пр. гр., Z | Моноклинная, C2/m, 2 | Моноклинная, P21, 2 |
| а, b, c, Å | 15.3408(6), 6.6618(2), 9.4655(3) | 7.5253(5), 17.1493(12), 25.8466(15) |
| β, град | 122.317(1) | 93.657(2) |
| V, Å3 | 817.51(5) | 3328.8(4) |
| Dx, г/см3 | 2.398 | 1.863 |
| Излучение, λ, Å | MoKα, 0.71073 | |
| μ, мм–1 | 9.986 | 7.356 |
| T, K | 100(2) | 100(2) |
| Размеры кристалла, мм | 0.40 × 0.14 × 0.12 | 0.14 × 0.06 × 0.04 |
| Дифрактометр | Bruker KAPPA APEX II | |
| Тип сканирования | φ и ω | |
| Учет поглощения, Tmin, Tmax | Полуэмпирический, 0.109, 0.380 | Полуэмпирический, 0.211, 0.456 |
| θmax, град | 34.99 | 30.00 |
| Пределы h, k, l | –24 ≤ h ≤ 24, –10 ≤ k ≤ 10, –14 ≤ l ≤ 15 | –4 ≤ h ≤ 10, –24 ≤ k ≤ 24, –36 ≤ l ≤ 35 |
| Число отражений: измеренных/независимых (N1), Rint/c I > 2σ(I) (N2) | 12 592/1919, 0.0193/1919 | 32 053/18 737, 0.0445/14531 |
| Метод уточнения | Полноматричный МНК по F 2 | |
| Число параметров | 84 | 345 |
| R1/wR2 по N1 | 0.0091/0.0221 | 0.0921/0.1545 |
| R1/wR2 по N2 | 0.0091/0.0221 | 0.0667/0.1415 |
| S | 1.089 | 1.038 |
| Δρmax/Δρmin, э/Ǻ3 | 0.938/–0.901 | 3.253/–4.866 |
| Программы | SAINT-Plus [10], SADABS [11], SHELXS-97 [12], SHELXL-2014 [13] | |
Основные длины связей и величины валентных углов в структурах I и II приведены в табл. 2 и 3. Характеристики основных связей и определение координационных чисел всех атомов в изученных кристаллах проводили методом пересекающихся сфер [15]. Координаты атомов и величины температурных параметров структур депонированы в Кембриджском банке структурных данных под номерами CCDC 1837224 и 1837225 соответственно.
Таблица 2.
Основные длины связей и величины валентных углов в структуре [UO2(suc)(C2N4H4)2] · 2H2O (I)
| Связь | d, Å | Ω, %* | Угол | ω, град |
|---|---|---|---|---|
| Гексагональная бипирамида UO6N2 | ||||
| U1–O1 | 1.7758(11) × 2 | 21.8 | O1–U1‒O1 | 180.0 |
| U1–O2 | 2.4997(10) × 2 | 8.8 | O2–U1‒O3 | 52.07(4) × 2 |
| U1–O3 | 2.4603(11) × 2 | 9.8 | O2–U1‒N1 | 63.76(4) × 2 |
| U1–N1 | 2.4738(12) × 2 | 10.0 | O3–U1‒N1 | 64.17(4) × 2 |
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| Сукцинат-анион | |||
| C1–O2 | 1.2566(17) × 2 | O2–C1–O3 | 118.67(13) × 2 |
| C1–O3 | 1.2746(18) × 2 | O2–C1–C2 | 122.29(13) × 2 |
| C1–C2 | 1.495(2) × 2 | O3–C1‒C2 | 119.04(13) × 2 |
| C2–C2 | 1.511(3) | C2–C2–C1 | 112.97(15) × 2 |
| Молекулы цианогуанидина | |||
| C3–N1 | 1.1595(17) | N1–C3–N2 | 175.19(16) |
| C3–N2 | 1.3041(17) | C3–N2–C4 | 118.21(13) |
| C4–N2 | 1.3518(18) | N2–C4–N3 | 123.17(12) |
| C4–N3 | 1.3358(19) | N3–C4–N4 | 121.21(13) |
| C4–N4 | 1.3288(17) | N2–C4–N4 | 115.62(13) |
Таблица 3.
Основные длины связей и величины валентных углов в структуре [UO2(Deaa)4(H2О)] [(UO2)2(suc)3] · 2Deaa (II)
| Связь | d, Å | Ω, % | Угол | ω, град |
|---|---|---|---|---|
| Пентагональная бипирамида UO7 | ||||
| U3–O5 | 1.727(16) | 21.8 | O5–U3–O10 | 177.2(9) |
| U3–O10 | 1.797(15) | 20.8 | O19–U3–O20 | 67.9(7) |
| U3–O19 | 2.343(15) | 11.0 | O20–U3–O22 | 76.2(8) |
| U3–O20 | 2.34(2) | 11.4 | O21–U3–O22 | 76.3(6) |
| U3–O21 | 2.347(13) | 11.8 | O21–U3–O25 | 70.5(6) |
| U3–O22 | 2.37(2) | 11.7 | O19–U3–O25 | 69.5(6) |
| U3–O25 | 2.33(2) | 11.58 | ||
| Гексагональная бипирамида UO8 | ||||
| U1–O1 | 1.768(14) | 22.0 | O1–U1–O2 | 179.1(7) |
| U1–O2 | 1.766(12) | 21.8 | O6–U1–O7 | 52.5(4) |
| U1–O6 | 2.484(13) | 9.5 | O6–U1–O12 | 69.8(4) |
| U1–О7 | 2.488(15) | 9.2 | O11–U1–O12 | 52.5(4) |
| U1–О11 | 2.457(14) | 9.5 | O11–U1–O14 | 67.2(5) |
| U1–О12 | 2.496(13) | 9.2 | O13–U1–O14 | 52.6(5) |
| U1–О13 | 2.471(14) | 9.3 | O7–U1–O13 | 65.6(5) |
| U1–О14 | 2.465(15) | 9.4 | ||
| Гексагональная бипирамида UO8 | ||||
| U2–О3 | 1.748(13) | 21.9 | O3–U2–O4 | 178.7(7) |
| U2–О4 | 1.792(13) | 21.7 | O8–U2–O9 | 53.3(5) |
| U2–О8 | 2.466(16) | 9.4 | O9–U2–O18 | 68.2(4) |
| U2–О9 | 2.487(14) | 9.4 | O17–U2–O18 | 53.4(5) |
| U2–О15 | 2.462(12) | 9.3 | O16–U2–O17 | 66.1(5) |
| U2–О16 | 2.466(16) | 9.2 | O15–U2–O16 | 52.9(5) |
| U2–О17 | 2.426(14) | 9.8 | O8–U2–O15 | 66.1(5) |
| U2–О18 | 2.487(14) | 9.4 | ||
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| Сукцинат-ион | |||
| С1–С2 | 1.56(3) | O6–С1–O7 | 121.5(18) |
| С2–С3 | 1.47(3) | O6–С1–С2 | 120.6(19) |
| С3–С4 | 1.52(3) | O7–С1–С2 | 117.9(19) |
| С1–О6 | 1.25(3) | С1–С2–С3 | 113.6(16) |
| С1–О7 | 1.27(2) | С2–С3–С4 | 110.3(17) |
| С4–О8 | 1.27(3) | O8–С4–С3 | 119.0(17) |
| С4–О9 | 1.28(3) | O9–С4–С3 | 119(2) |
| O8–С4–O9 | 120.6(18) | ||
| Молекула диэтилацетамида | |||
| С13–О19 | 1.27(3) | О19–С13–С14 | 120(2) |
| С13–С14 | 1.46(3) | О19–С13–N1 | 117.6(16) |
| С13–N1 | 1.31(2) | С14–С13–N1 | 121.3(17) |
| С17–N1 | 1.49(3) | С13–N1–С15 | 120.2(16) |
| С17–С18 | 1.49(3) | С16–С15–N1 | 113.4(17) |
| С15–N1 | 1.45(3) | С17–N1–С15 | 120.2(16) |
| С15–С16 | 1.51(3) | С18–С17–N1 | 110.3(17) |
ИК-спектроскопия. ИК-спектры записаны при комнатной температуре в диапазоне 400–4000 см–1 на ИК фурье-спектрометре Spectrum 100. Образцы готовили прессованием таблеток с KBr.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Атом урана в структуре I занимает частную позицию 2d с симметрией 2/m, а атомы кислорода уранил-иона – позиции 4h на оси 2. Остальные неводородные атомы (кроме атома кислорода разупорядоченной молекулы воды) занимают позиции 4i на плоскости зеркального отражения.
Координационным полиэдром (КП) единственного независимого атома урана в структуре I является гексагональная бипирамида UO6N2, в аксиальных позициях которой находятся атомы кислорода ионов UO$_{2}^{{2 + }}$. Четыре экваториальных атома кислорода принадлежат двум сукцинат-анионам с типом координации Q02. Согласно [16–18] символ “Q” обозначает общую дентатность лиганда, которая для сукцинат-анионов в структуре I равна четырем. Каждый сукцинат-анион связан с каждым атомом урана бидентатно, поэтому надстрочная цифра “2”, указывающая общее число таких атомов, стоит во второй позиции. Оставшиеся позиции в экваториальной плоскости бипирамиды UO6N2 занимают атомы азота двух монодентатных молекул цианогуанидина (тип координации M1, рис. 1), которые находятся в транс-положении друг относительно друга. Обозначения типов координации лигандов и кристаллохимические формулы (КХФ) комплексов даны в соответствии с [16–18]. За счет сукцинат-анионов атомы урана в структуре I объединены в бесконечные цепочки состава [UO2(suc)(C2N4H4)2] с КХФ AQ02M$_{2}^{1}$ (A = UO$_{2}^{{2 + }}$, Q02 = suc2–, M1 = C2N4H4) (рис. 1). Две молекулы воды находятся во внешней сфере комплекса и, участвуя в водородных связях (ВС) (табл. 4) и других межмолекулярных взаимодействиях, связывают 1D-комплексы, распространяющиеся в структуре вдоль [001], в трехмерный каркас. Диоксокатионы UO$_{2}^{{2 + }}$ в структуре кристаллов симметричны и линейны (оба расстояния U=O равны 1.7758(11) Å, угол O=U=O равен 180.0°). Объем полиэдров Вороного–Дирихле (ПВД) атомов урана, имеющих форму гексагональной призмы, в структуре равен 9.47 Å3, что хорошо согласуется со средним значением 9.6(2) Å3, установленным для атомов U(VI) в составе комплексов транс-UO6N2 [19].
Рис. 1.
Фрагмент цепочки [UO2(suc)(C2N4H4)2] в структуре I. Для атома урана на правом конце фрагмента показан КП в виде гексагональной бипирамиды, а на левом – соответствующий ПВД в виде гексагональной призмы.
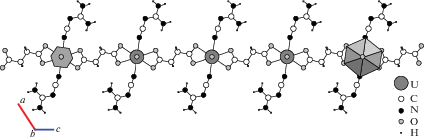
Таблица 4.
Параметры важнейших водородных связей в структурах I и II*
| Связь D–H···A (преобразование симметрии для A) | D···A, Å | D–H, Å | H···A, Å | D–H···A, град | Ω(H···A), % | Ранг для грани H···A |
|---|---|---|---|---|---|---|
| I | ||||||
| O4–H1···O3 (x – 1/2, y + 1/2, z) | 2.818(2) | 0.852(17) | 2.013(18) | 157.2(5) | 17.8 | 0 |
| O4–H2···O3 (–x + 1, ‒y + 1, ‒z + 1) | 3.3671(18) | 0.830(18) | 2.577(18) | 160.3(5) | 10.7 | 0 |
| N3–H3···O4 (–x + 1/2, y – 1/2, –z) | 3.062(2) | 0.88 | 2.26 | 151.6 | 14.3 | 0 |
| N3–H4···O2 | 3.5218(17) | 0.88 | 2.64 | 176.9 | 12.3 | 7 |
| N4–H5···O1 (x–1/2, y + 1/2, z – 1) | 3.0870(13) | 0.88 | 2.40 | 134.8 | 13.3 | 0 |
| N4–H6···N2 (–x, –y, –z) | 3.0858(19) | 0.88 | 2.22 | 169.3 | 15.5 | 0 |
| II | ||||||
| О25–Н1···O23 | 2.68(3) | 0.86(2) | 1.928(17) | 145.9(15) | 21.9 | 0 |
| О25–Н2···O24 | 2.66(3) | 0.86(2) | 1.890(19) | 148.8(15) | 22.6 | 0 |
В структуре II присутствуют два типа урансодержащих комплексов: катионные [UO2(Deaa)4(H2O)]2+ (G2+) и анионные [(UO2)2(suc)3]2– (G2–). В одноядерных комплексах G2+ КП атома урана является пентагональная бипирамида UO7, аксиальные позиции которой занимают атомы кислорода уранильной группы. Из пяти атомов кислорода экваториальной плоскости четыре принадлежат молекулам диэтилацетамида, а пятый – молекуле воды (рис. 2). Все пять экваториальных лигандов являются монодентатными с типом координации M1, поэтому катионным комплексам G2+ отвечает КХФ AМ$_{5}^{1}$, где A = UO$_{2}^{{2 + }}$, М1 = Deaa или H2O. Анионную функцию в структуре II выполняют слоистые комплексы G2–, два кристаллографически неэквивалентных атома урана в которых имеют КП в виде гексагональной бипирамиды UO8, сжатой вдоль главной оси, на которой находятся атомы кислорода иона уранила (табл. 3). Шесть экваториальных атомов принадлежат трем сукцинат-ионам, которые играют роль тетрадентатных лигандов с типом координации Q02, образующих с каждым из двух бидентатно координированных атомов урана четырехчленные металлоциклы. Поэтому анионные комплексы G2– относятся к кристаллохимической группе A2Q$_{3}^{{02}}$, где A = UO$_{2}^{{2 + }}$, Q02 = suc2–. Графитоподобные cлои G2– в кристаллах II (рис. 3) распространяются параллельно плоскости (10$\bar {1}$). Объем ПВД атомов урана, имеющих в структуре II форму гексагональной (U1 и U2) или пентагональной (U3) призмы, равен соответственно 9.45, 9.37, 8.82 Å3 и приемлемо согласуется со средним значением 9.3(2) Å3, установленным для 512 комплексов UVIOn при n от 5 до 9 [19].
Рис. 2.
Строение катионного комплекса [UO2(Deaa)4(H2O)]2+ (G2+) в структуре кристаллов II. Атомы водорода молекул диэтилацетамида не указаны.
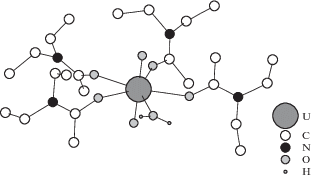
Рис. 3.
Фрагмент псевдогексагонального cлоя [(UO2)2(suc)3]2– в структуре кристаллов II. Для атомов U, расположенных по периметру фрагмента, указаны КП в виде гексагональных бипирамид, главная ось которых перпендикулярна плоскости рисунка, а для атомов U центрального шестиугольного цикла указаны ПВД, имеющие форму гексагональных призм. Атомы Н не показаны. Над каждым шестиугольным циклом анионного слоя (на рисунке охарактеризован только центральный цикл, окаймленный ПВД атомов U) располагаются одноядерный катионный комплекс [UO2(Deaa)4(H2O)]2+ и две внешнесферные молекулы Deaa, которые образуют ВС с атомами Н молекулы воды катионного комплекса. Эти две ВС показаны пунктиром в центре рисунка и охарактеризованы в табл. 4.
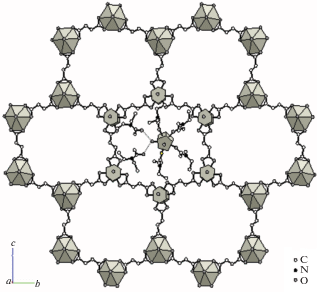
Отметим, что по стехиометрическому составу и строению кристаллы II аналогичны недавно изученному [UO2(Urea)4(H2O)] · [(UO2)2(suc)3] · · 2Urea (III), где Urea – карбамид [6]. Диаметр пустот в идентичных 2D-анионных комплексах G2– структур II и III составляет примерно 14 Å. Сходство строения анионов G2– неудивительно, так как в II и III все кристаллографически неэквивалентные сукцинат-ионы имеют одинаковую трансоидную (φ3) конформацию с торсионными углами в области 172°–180°. При этом в структуре III в каждой квазигексагональной пустоте анионного слоя размещаются один катионный комплекс [UO2(Urea)4(H2O)]2+ и две внешнесферные молекулы карбамида, атомы кислорода которых образуют ВС с атомами H молекул воды катиона [6]. Как видно из рис. 3, аналогичная картина наблюдается в структуре II, в которой на каждую квазигексагональную пустоту слоя G2– приходятся один катионный комплекс G2+ и две внешнесферные молекулы Deaa, атомы кислорода которых (O23 и О24) также образуют по одной ВС с атомами Н молекулы воды комплекса G2+. Принципиальное различие структур II и III состоит в том, что в III атомы U катионов G2+ лежат в плоскости, проходящей через атомы U слоистого аниона G2–, тогда как в II атом урана (соответствующий ему ПВД на рис. 3 имеет форму пентагональной призмы) каждого комплекса G2+ находится на расстоянии ∼3.5 Å от такой плоскости. Такое сильное отклонение является, по-видимому, следствием стерических затруднений. Они вызваны тем, что размеры комплекса [UO2(L)4(H2O)]2+ и двух связанных с ним молекул L, которые в случае восьмиатомного лиганда L = CO(NH2)2 способны одновременно разместиться в квазигексагональной пустоте слоя G2–, резко увеличиваются в II из-за замены CO(NH2)2 на Deaa, каждая молекула которого (СН3CON(C2H5)2) содержит более 20 атомов.
Кроме того, по данным метода молекулярных ПВД [20, 21] замещение молекул карбамида в III на Deaa в II приводит к значительному изменению характеристик межмолекулярных взаимодействий в структурах кристаллов. Наблюдающиеся различия, по-видимому, обусловлены разным химическим составом кристаллов II и III. Так, в II мольная доля атомов H и С резко увеличена (соответственно на ∼13 и 8%) по сравнению с III, а для остальных неметаллов, напротив, резко понижена (для O и N соответственно на ∼12 и 9%). Поэтому, как видно из рис. 4 и табл. 5, в структуре II основной вклад в связывание комплексов G2+ и G2– вносят дисперсионные взаимодействия H/H, которым отвечают ∼57% общей площади граней молекулярных ПВД (в III ΔHH ≈ 30%). При этом в II резко понижен парциальный вклад ВС (контакты H/O и H/N соответственно с ΔAZ ≈ 39 и 1%), которые в структуре III (для них ΔAZ ≈ 52 и 5%) являются важнейшим типом межмолекулярных взаимодействий. Парциальные вклады остальных типов межмолекулярных контактов (O/O, N/O, C/O и Н/C) в структуре II незначительны (для них ΔAZ не превышает 4%), а контакты C/N, имеющиеся в III, вообще отсутствуют.
Рис. 4.
Гистограмма со значениями парциальных вкладов ΔAZ для всех типов межмолекулярных контактов в структурах стехиометричеcки одинаковых кристаллов [UO2(L)4(H2O)] · [(UO2)2(suc)3] · 2L, где L = Deaa (II) или Urea (III). Численные значения ΔAZ для III, включая данные для контактов C/N, которые отсутствуют в структуре II, приведены в [6].
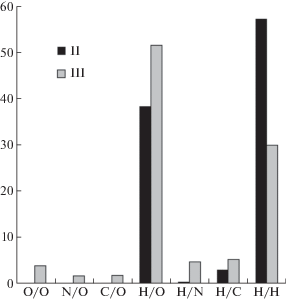
Таблица 5.
Основные параметры межмолекулярных взаимодействий в структуре II*
| Контакты A/Z | kAZ | d, Å | SAZ, Å2 | ΔAZ, % |
|---|---|---|---|---|
| O/O | 8 | 3.31–4.05 | 1.22 | 0.1 |
| N/O | 2 | 3.73 | 0.14 | <0.1 |
| C/O | 4 | 3.21–3.39 | 4.57 | 0.3 |
| H/O | 324 | 1.89–4.49 | 576.42 | 38.5 |
| H/N | 22 | 3.39–4.13 | 8.70 | 0.6 |
| H/C | 94 | 2.68–4.07 | 48.61 | 3.2 |
| H/H | 522 | 1.99–5.04 | 857.37 | 57.3 |
| Сумма | 976 | 1.89–5.04 | 1497.03 | 100.0 |
* kAZ – общее число всех граней с РГ = 0; d – диапазон соответствующих межатомных расстояний A–Z; SAZ – общая площадь всех граней указанного типа у ПВД атомов, содержащихся в одной формульной единице вещества; ΔAZ – парциальный вклад соответствующих невалентных контактов A/Z в величину интегрального параметра 0S = ΣSAZ молекулярного ПВД.
Характеристики наиболее значимых ВС, в том числе одной внутримолекулярной, указаны в табл. 4. В образовании ВС в структуре I участвуют атомы водорода молекул воды и групп –NH2 молекул цианогуанидина, а в качестве акцепторных – атомы кислорода ионов уранила, молекул воды или сукцинат-ионов, а также атомы азота группы –NCN. В соответствии с классификацией [22] выявленные ВС по прочности относятся к средним. К средним по силе следует отнести и ВС, образованные атомами водорода молекул воды и атомами кислорода некоординированных молекул диэтилацетамида в структуре II (рис. 2, табл. 4). В этой структуре имеются также многочисленные слабые меж- и внутримолекулярные ВС с участием атомов водорода групп –СН2 и –СН3 и атомов кислорода ионов уранила, координированных молекул диэтилацетамида или сукцинат-ионов. Для сокращения объема табл. 4 эти связи в ней не указаны.
В ИК-спектре I присутствуют полосы поглощения, соответствующие характеристическим колебаниям ионов UO$_{2}^{{2 + }}$, C4H4O$_{4}^{{2 - }}$, молекул цианогуанидина и воды (табл. 6). Валентные колебания (антисимметричное и симметричное) групп C4H4O$_{4}^{{2 - }}$ проявляются при 1650, 1527 и 1453, 1417 см–1, что согласуется с данными [23]. Антисимметричному валентному колебанию иона уранила [24] отвечает полоса 925 см–1. В ИК-спектре II кроме колебаний ионов UO$_{2}^{{2 + }}$, C4H4O$_{4}^{{2 - }}$ и молекул воды, появляющихся в областях, отвечающих их характеристическим колебаниям, присутствуют полосы поглощения, обусловленные колебаниями молекул диэтилацетамида (табл. 6). О координации молекул диэтилацетамида через атом кислорода карбонильной группы свидетельствует понижение частоты колебания ν(C=O) до 1608 см–1 в спектре комплекса по сравнению с поглощением при 1650 см–1 в ИК-спектре свободного амида [25]. Антисимметричное валентное колебание иона уранила (ν3) наблюдается в виде дублета при 926 и 916 см–1. Характер ИК-спектров (табл. 6) согласуется с результатами рентгеноструктурного анализа монокристаллов.
Таблица 6.
Волновые числа и отнесение колебаний в ИК-спектрах [UO2(suc)(C2N4H4)2] · 2H2O (I) и [UO2(Deaa)4(H2О)][(UO2)2(suc)3] · 2Deaa (II)
| Волновые числа, см–1* | Отнесение | Волновые числа, см–1* | Отнесение | ||
|---|---|---|---|---|---|
| I | II | ||||
| 3614 с. | ν(H2О) | 3442 с. | ν(H2О) | ||
| 3429 с. 3330 с. 3239 с. |
$\left. \begin{gathered} \hfill \\ \hfill \\ \hfill \\ \end{gathered} \right\}$ | ν(NH2) | 2980 ср. 2934 ср. |
$\left. \begin{gathered} \hfill \\ \hfill \\ \end{gathered} \right\}$ | ν(СH2) |
| 1608 с. | ν(C=O)Deaa, νаs(CОO), δ(H2О) | ||||
| 1589 с. 1547 с. 1498 с. |
$\left. \begin{gathered} \hfill \\ \hfill \\ \hfill \\ \end{gathered} \right\}$ | νаs(CОO) | |||
| 2932 сл. | ν(СH2) | ||||
| 2227 с. 2182 ср. |
$\left. \begin{gathered} \hfill \\ \hfill \\ \end{gathered} \right\}$ | νas(NC≡N) | |||
| 1449 с. 1384 ср. |
$\left. \begin{gathered} \hfill \\ \hfill \\ \end{gathered} \right\}$ | νs(CОO) | |||
| 1650 с. | νаs(CОO), δ(H2О) | ||||
| 1527 с. | νаs(CОO) | 1362 сл. | δ(СH2), δ(СH3) | ||
| 1453 с. 1417 с. |
$\left. \begin{gathered} \hfill \\ \hfill \\ \end{gathered} \right\}$ | νs(CОO) | 1312 сл. 1287 сл. |
$\left. \begin{gathered} \hfill \\ \hfill \\ \end{gathered} \right\}$ | ν(СС)suc |
| 1266 сл. | νs(NC≡N) | 1221 сл. | ν(N–С)N−С2H5 | ||
| 1230 cр. | νs(C–N)N–C–N | 1152 о.сл. 1099 сл. 1081 сл. 1041 сл. 1002 о.сл. |
$\left. \begin{gathered} \hfill \\ \hfill \\ \hfill \\ {}_{{{}_{{{}_{{{}_{{{}_{{}}}}}}}}}} \hfill \\ \end{gathered} \right\}$ | δ(С–O)suc | |
| 1099 сл. | r(NH2), δ(С–O)suc | ||||
| 949 сл. | ν(СС) | 956 сл. | ν(СС) | ||
| 925 с. | νas(UO$_{2}^{{2 + }}$) | 926 с. 916 с. |
$\left. \begin{gathered} \hfill \\ \hfill \\ \end{gathered} \right\}$ | νas(UO$_{2}^{{2 + }}$) | |
| 687 ср. | ω(СH2), ω(C–N)N-C–N | 677 ср. | ω(СH2)suc | ||
| 612 ср. | δ(ССС)suc | 593 сл. | ρ(СH2)suc | ||
Работа выполнена в рамках государственного задания Минобрнауки России по проекту 4.5037.2017/8.9. Рентгенодифракционные эксперименты выполнены в ЦКП ФМИ ИФХЭ РАН при частичном финансировании Министер-ством науки и высшего образования РФ (тема № АААА-А18-118040590105-4).
Список литературы
Guan Q.L., Bai F.Y., Xing Y.H. et al. // Inorg. Chem. Commun. 2015. V. 59. P. 36.
Bombiery G., Benetollo F. // J. Inorg. Nucl. Chem. 1979. V. 41. P. 201.
Kim Jong-Young, Norquist A. J., O’Hare D. // Dalton Trans. 2003. № 14. P. 2813.
Сережкин В.Н., Пересыпкина Е.В., Сережкина Л.Б. и др. // Журн. неорган. химии. 2014. Т. 59. № 12. С. 1684.
Щелоков Р.Н., Михайлов Ю.М., Орлова И.М. и др. // Координац. химия. 1985. Т. 11. № 7. С. 1010.
Сережкина Л.Б., Григорьев М.С., Селиверстова Н.В., Сережкин В.Н. // Кристаллография. 2017. Т. 62. № 4. С. 601.
Qing Lin Guan, Feng Ying Bai, Yong Heng Xing et al. // Inorg. Chem. Commun. 2015. V. 59. P. 36.
Novikov S.A., Grigoriev M.S., Serezhkina L.B., Serezhkin V.N. // J. Solid State Chem. 2017. V. 248. P. 178.
Jian-Ling Wang, Zhao-Yan Deng, Shi-Bo Duan, Yong-Heng Xing. // J. Coord. Chem. 2012. V. 65. P. 3546.
SAINT-Plus. Version 7.68. Bruker AXS Inc., Madison, Wisconsin, USA. 2007.
Sheldrick G.M. SADABS. Bruker AXS Inc., Madison, Wisconsin, USA. 2008.
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. № 1. P. 112.
Sheldrick G.M. // Acta Cryst. C. 2015. V. 71. № 1. P. 3.
Nardelli N. // J. Appl. Cryst. 1999. V. 32. P. 563.
Cережкин В.Н., Михайлов Ю.Н., Буслаев Ю.А. // Журн. неорган. химии. 1997. Т. 42. № 12. С. 2036.
Сережкин В.Н., Медведков Я.А., Сережкина Л.Б., Пушкин Д.В. // Журн. физ. химии. 2015. Т. 89. № 6. С. 978.
Сережкин В.Н., Полынова Т.Н., Порай-Кошиц М.А. // Координац. химия. 1995. Т. 21. № 4. С. 253.
Serezhkin V.N., Vologzhanina A.V., Serezhkina L.B. et al. // Acta Cryst. B. 2009. V. 65. № 1. P. 45.
Сережкин В.Н., Карасев М.О., Сережкина Л.Б. // Радиохимия. 2013. Т. 55. № 2. С. 97.
Сережкин В.Н., Пушкин Д.В., Сережкина Л.Б. // Кристаллография. 2010. Т. 55. № 4. С. 597.
Serezhkin V.N., Savchenkov A.V. // Cryst. Growth Des. 2015. V. 15. P. 2878.
Steiner T. // Angew. Chem. 2002. V. 41. № 1. P. 48.
Tarakeshwar P., Manogaran S. // J. Mol. Struct. 1996. V. 362. № 1. P. 77.
Nakamoto K. Infrared and raman spectra of inorganic and coordination compounds. Part A, B. Wiley, 2009.
Schmulbach C.D., Drago R.S. // J. Phys. Chem. 1960. V. 64. № 12. P. 1956.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


