Кристаллография, 2019, T. 64, № 5, стр. 739-746
Трехмерная структура мутанта карбоксипептидазы Т из Thermoactinomyces vulgaris с имплантированным S1'-субсайтом панкреатической карбоксипептидазы B в комплексе с аналогом продукта
В. Х. Акпаров 1, *, В. И. Тимофеев 2, 3, Д. А. Корженевский 3, И. П. Куранова 2, 3, Т. В. Ракитина 3, 4, **
1 Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов Национального исследовательского центра “Курчатовский институт”
Москва, Россия
2 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
3 Национальный исследовательский центр “Курчатовский Институт”
Москва, Россия
4 Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Москва, Россия
* E-mail: valery@akparov.ru
** E-mail: taniarakitina@yahoo.com
Поступила в редакцию 05.12.2018
После доработки 05.12.2018
Принята к публикации 06.12.2018
Аннотация
Мутант бактериальной карбоксипептидазы Т из Thermoactinomyces vulgaris (КПТ5) с заменами аминокислотных остатков в сорбционном S1'-участке активного центра на остатки, соответствующие S1'-участку панкреатической карбоксипептидазы В (Gly215Ser, Ala251Gly, Thr257Ala, Asp260Gly, Thr262Asp), закристаллизован в комплексе с N-BOC-L-Leu, который занимает S1-сайт активного центра и является аналогом продукта реакции. Дифракционный набор собран от кристалла КПТ5 на синхротроне SPring-8. Пространственная структура КПТ5 установлена при разрешении 1.40 Å и уточнена до Rfact = 13.6%, Rfree = 12.5%. Связывание N-BOC-L-Leu c S1-сайтом КПТ5 приводит к конформационным изменениям в белке, затрагивающим главным образом Сα-атомы пяти остатков подвижной петли, расположенной на границе S1- и S1'-сайтов, и боковые группы остатков Tyr255 и Leu254, участвующих в индуцированном соответствии. Кроме того, конформационные изменения затрагивают аминокислотные остатки активного центра Glu277 и Asp262 и боковые группы остатков, расположенных на поверхности молекулы. Наблюдаемые изменения отличаются от конформационных изменений, происходящих при связывании N-BOC-L-Leu с КПТ дикого типа, что говорит о взаимном влиянии S1- и S1'-субсайтов в металлокарбоксипептидазе Т.
ВВЕДЕНИЕ
Металлокарбоксипептидазами (МКП) называют пептидазы, отщепляющие аминокислотные остатки от С-конца пептидов и белков и имеющие цинк в составе активного центра. По роли в жизнедеятельности организмов МКП разделяют на пищеварительные и регуляторные. К пищеварительным МКП бактерий относится карбоксипептидаза Т (КФ 3.4.17.18, КПТ), выделенная из термофильного штамма Thermoactinomyces vulgaris. В отличие от панкреатических пищеварительных карбоксипептидаз А и В (КПА и КПВ), КПТ подобно другим бактериальным МКП обладает широкой субстратной специфичностью и способна отщеплять как гидрофобные (подобно КПА), так и положительно заряженные (подобно КПВ) остатки [1]. В связи с этим КПТ можно рассматривать в качестве шаблона для дизайна разнообразных промышленно важных термофильных МКП как с широкой, так и с узкой селективностью (КПА- или КПВ-подобной).
Большинство МКП имеет несколько сайтов связывания пептидных субстратов. В КПВ и КПА таких сайтов шесть [2]. Сайты связывания боковых цепей аминокислотных остатков, расположенных до расщепляемой связи, обозначаются по номенклатуре Шехтера и Бергера [3] как сайты S1, S2, S3 и т.д. по мере удаления от нее. Сайты связывания остатков субстрата, расположенных после расщепляемой связи, обозначаются соответственно как S1', S2', S3' и т.д. Соответствующие остатки субстрата обозначаются как Р1, Р2, Р3 и т.д. или Р1', P2', P3' и т.д. В МКП S1'-сайт называется сайтом (карманом) первичной специфичности. Считается, что первичную субстратную специфичность обеспечивает комплементарность остатков S1'-сайта и боковой группы субстрата [4]. Значение остатков S1'-сайта в распознавании субстрата неодинаково, ключевую роль здесь играет аминокислотный остаток, расположенный на дне S1'-сайта. Например, в КПВ [5], а также в карбоксипептидазах D и M (КПD [6] и КПМ [7]) – это 255-й (по нумерации КПА/КПВ) остаток аспарагиновой кислоты; все эти МКП распознают комплементарные положительно заряженные субстраты. КПА в 255-ой позиции имеет изолейцин, что обеспечивает комплементарность и специфичность к гидрофобным С-концевым остаткам [8].
В КПТ на дне S1'-сайта находится 260-й (253-й по КПА) остаток аспарагиновой кислоты и 262-й (255-й по КПА) остаток треонина [9]. Возможно, поэтому КПТ способна расщеплять как гидрофобные субстраты (как КПА), так и основные (положительно заряженные), как КПВ [9]. Было установлено, что двойная замена Asp260Gly, Thr262Asp не изменяет профиля субстратной специфичности КПТ, поэтому все пять остатков S1'-сайта КПТ были заменены на соответствующие остатки КПВ: Gly215Ser, Ala251Gly, Thr257Ala, Asp260Gly и Thr262Asp; такой мутант получил название КПТ5 [10]. Сравнение трехмерных структур КПТ5 и КПВ показало аналогичное строение их S1'-сайтов, однако КПТ5 сохраняет широкую субстратную специфичность [11]. Влияние удаленных структурных детерминант субстратной специфичности КПТ, в частности структурной роли ионов кальция в селективности КПТ [12], также не объясняет природу субстратной специфичности КПТ5. Известно, что важную роль в активности МКП играет S1-сайт [13]. Если S1-сайт не занят (как при гидролизе формил- или ацетил-аргинина КПВ), то фермент гидролизует субстрат с очень низкой эффективностью [13]. Только заполнение S1-сайта боковой цепью гидрофобного остатка в Р1-положении субстрата обеспечивает высокую скорость гидролиза.
Ранее была получена кристаллическая структура комплекса КПТ с N-(трет-бутилоксикарбонил)-L-лейцином (N-BOC-L-Leu) и показано, что остаток лейцина в этом комплексе занимает S1-сайт [14]. Для выяснения возможного взаимного влияния S1- и S1'-сайтов в настоящей работе исследована кристаллическая структура комплекса КПТ5 с аналогом продукта реакции N-BOC-L-Leu, которую сравнивали со структурами свободной КПТ5 [11] и комплекса КПТ5 с N-сульфамоил-L-фенилаланином (SPhe), имитирующего переходное состояние реакции [15].
МАТЕРИАЛЫ И МЕТОДЫ
Использованные материалы. В работе использовались деионизованная вода MilliQ (“Миллипор”, США) с сопротивлением 18 Мом/см, глицерин (“Химмед”, Россия) и мочевина квалификации х.ч. отечественного производства. Также были использованы 2-метил-2,4-пентадиол (MPD), L-цистин и L-цистеин, диизопропилфторфосфат (ДФФ), изопропил-бета-галактопиранозид (ИПТГ), N-(трет-бутилоксикарбонил)-L-лейцин (N-BOC-L-Leu), 3-(3-холамидопропил), диметиламмоний-3-пропансульфонат (CHAPS), 2-(N-морфолино)этансульфоновая кислота (Mes) фирмы “Sigma” (США), меркаптоэтанол, CaCl2, ZnSO4, NaCl фирмы “Merck” (Германия), мембраны для ультрафильтрации YM10 и ультрафильтрационные ячейки фирмы “Амикон” (США), патроны для микрофильтрации Сеntripack (“Миллипор”, США). Для кристаллизации КПТ5 использовали стеклянные капилляры фирмы “Confocal Science” (Япония) с длиной 60 мм и внутренним диаметром 0.5 мм. Аффинный сорбент p-аминобензилсукцинил-сефароза 4B (CABS-сефароза) приготовлен согласно [16].
Получение рекомбинантной КПТ5. Экспрессию гена proКПT5 проводили в клетках Еscherichia coli BL21(DE3)pLysS согласно инструкции производителя “Novagen” (США) [17]. После индукции экспрессии с помощью ИПТГ клетки разрушали ультразвуком.
Выделение КПТ5 из телец включения. Тельца включения осаждали центрифугированием и промывали 0.05%-ным раствором CHAPS, 2 M раствором NaCl и водой, а затем растворяли в 8 М мочевины, содержавшей 1 мМ меркаптоэтанола, до конечной концентрации белка 5 мг/мл. Раствор белка добавляли к 100-кратному объему буферного раствора (50 мМ Tris-HCl, 30% глицерина (V/V), 0.5 М NaCl, 10 мМ CaCl2, 3 мМ цистеина, 10 мМ цистина, pH 8.0), инкубировали 16 ч и удаляли неренатурированный белок центрифугированием. Раствор концентрировали ультрафильтрацией через мембрану YM10 до объема 200 мл, после чего с помощью ультрафильтрации заменяли среду буфером того же состава, но без глицерина. Для получения зрелого фермента к раствору proКПТ5 добавляли субтилизин в соотношении 200:1 (W/W) и инкубировали 1 ч при 37°C. Субтилизин инактивировали добавлением диизопропилфторфосфата до 1 мМ. Раствор с активированной КПТ5 снова концентрировали ультрафильтрацией до объема 2 мл и центрифугировали. После концентрирования раствор белка подкисляли до рН 6.2, добавляя буфер Мes-NaOH (100 мM, рН 6.0). Затем раствор белка наносили на колонку с CABS-cефарозой (объем колонки 20 мл), уравновешенной буфером (10 мM Mes-NaOH, 0.5 М NaCl, 10 мМ CaCl2, pH 6.0), и элюировали КПТ5 этим же буфером. Фракции, содержавшие активный белок, объединяли, концентрировали до 1 мл, проводили замену использованного буфера на буфер для кристаллизации (0.01 M Mes-NaOH, рН 6.0, содержавший 1 мМ CaCl2, 0.1 мM ZnSO4 и 0.25 M NaCl) трехкратной ультрафильтрацией на ячейке “Амикон” с десятикратным разбавлением, затем концентрировали белок до концентрации 10 мг/мл и стерильно фильтровали с помощью центрифужных патронов Centripack. Концентрацию белка определяли по методу Бредфорда [18]. Полученный раствор использовали для кристаллизации белка. Отсутствие субтилизиновой активности подтверждали с помощью специфического хромогенного субстрата ZAALpNA. ДСН-ПААГ-электрофорез проводили согласно Лэммли [19].
Выращивание кристаллов. Кристаллы комплекса КПТ5 с N-BOC-L-Leu выращены в невесомости методом встречной диффузии в капилляре на оборудовании японского аэрокосмического агентства (JAXA) по технологии, разработанной в JAXA и описанной в [20, 21]. Концентрация белка в 10 мМ буфере Mes-NaOH (рН 6.0), содержавшем 0.25 М NaCl, 0.1 мM ZnSO4 и 1 мМ СаCl2, составляла 11 мг/мл. В раствор осадителя, содержавший 1.6 M (NH4)2SO4, 5%-ный МPD в 50 мМ буфере Mes-NaOH (рН 6.0), добавляли 2.4 М N-BOC-L-Leu. Каплю белкового раствора объемом 10 мкл помещали на силиконированное стекло. Прикасаясь к капле концом капилляра, заполняли его раствором белка, после чего противоположный конец капилляра герметично закрывали пластилином. Конец капилляра с раствором вставляли в силиконовую трубку, содержавшую 1%-ный агарозный гель. Трубку укорачивали до 5 мм и погружали в пластиковый цилиндр объемом 180 мкл, заполненный раствором осадителя, в который добавляли 2.4 М N-BOC-L-Leu. Дно цилиндра закрывали пробкой с отверстиями для удаления избытка раствора, и оба входа в цилиндр герметизировали при помощи клея. Шесть таких кристаллизационных единиц, соединенных друг с другом, помещали в пластиковый пакет. Пакеты упаковывали в контейнеры для доставки на Международную космическую станцию, где контейнеры были помещены в термостат с температурой 20°. После окончания эксперимента и доставки образцов в лабораторию качество выросших в капиллярах кристаллов оценивали визуально под микроскопом. Для сбора дифракционных данных на источнике синхротронного излучения кристалл выгружали из капилляра в раствор осадителя, затем переносили в криораствор и замораживали в токе паров азота. Криораствор кроме компонентов осадителя содержал 20%-ный (V/V) глицерин.
Сбор и обработка дифракционных данных. Дифракционные наборы от выращенных кристаллов собраны на синхротроне SPring-8 (Япония) при температуре 100 К на станции BL41XU с CCD-детектором MAR225HE. Дифракционные данные от одного кристалла получены методом вращения. Длина волны составляла 0.8 Å. Расстояние кристалл–детектор 125 мм, угол качания 0.3°, угол вращения 180°. Обработку набора экспериментальных интенсивностей проводили с помощью программы HKL-2000 [22]. Набор обработан до разрешения 1.4 Å. В независимой части кристаллической ячейки (пр. гр. P6322) находится одна молекула фермента. Статистические характеристики набора приведены в таблице 1.
Таблица 1.
Статистические характеристики набора и уточнения структуры КПТ5 в комплексе с N-BOC-L-Leu
| Обработка набора | |
| Пространственная группа | P6322 |
| a = b, c, Å; α = β, γ, град | 158.2, 104.7; 90, 120 |
| Разрешение, Å | 30.0–1.4 (1.44–1.4)* |
| Количество независимых рефлексов | 150 364 |
| Полнота набора, % | 96.5 (95.51) |
| I/σ(I) | 29.3 (3.6) |
| Rmrgd-F, % | 8.9 (27.1) |
| Уточнение | |
| Разрешение, Å | 12.0–1.4 (1.44–1.4) |
| Количество рефлексов | 137 803 (9863) |
| Rcryst, % | 12.5 (16.1) |
| Rfree, % | 13.6 (17.9) |
| Средний B-фактор, A2 | 13.7 |
| Количество уточненных атомов | |
| Белка | 2577 |
| Растворителя | 433 |
| Лигандов | 26 |
| RMS | |
| По длинам связей, Å | 0.006 |
| По углам, град | 1.208 |
| Карта Рамачандрана | |
| Наиболее благоприятные области, % | 99.0 |
| Допустимые области, % | 1.0 |
| Запрещенные области, % | 0.0 |
Решение и уточнение структуры. Структура комплекса КПТ5/N-BOC-L-Leu установлена при разрешении 1.4 Å методом молекулярного замещения с использованием программы Phaser [23] и координат КПТ5 (PDB ID: 4IHM) в качестве стартовой модели. Для уточнения структуры использовали программу Refmac [24]. Ручную правку моделей проводили при помощи программы Coot [25], используя карты электронной плотности, рассчитанные с коэффициентами 2|Fo| – |Fc| и |Fo| – |Fc|. На картах электронной плотности локализованы молекулы воды, а в активном центре на разностных синтезах найдена электронная плотность, в которую вписаны лиганд N-BOC-L-Leu и ион сульфата. Статистические характеристики уточнения приведены в таблице 1.
Сравнительный структурный анализ. Анализ положения и контактов N-BOC-L-Leu в активном центре КПТ5 проводили с помощью программы PyMOL. Сравнение структуры комплекса КПТ5/N-BOC-L-Leu (PDB ID: 4IK2) с КПТ5 без лиганда (PDB ID: 4IHM) и комплексами КПТ/N-BOC-L-Leu (PDB ID: 4F8Z) [14], КПТ5/сульфамоил-L-фенилаланин (КПТ5/SPhe, PDB ID: 4IAV) [15] проводили путем совмещения структур по Cα-атомам с помощью программы PyMOL. Среднеквадратичные отклонения Сα-атомов при совмещении структур следующие: КПТ5/N-BOC-L-Leu и КПТ/N-BOC-L-Leu – 0.101 Å, КПТ5/N-BOC-L-Leu и КПТ5 – 0.169 Å, КПТ5/N-BOC-L-Leu и КПТ5/SPhe – 0.139 Å.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Наличие мутаций в гене proКПT, приводящих к аминокислотным заменам Gly215Ser, Ala251Gly, Thr257Ala, Asp260Gly и Thr262Asp, подтверждали с помощью автоматического секвенирования по Сэнгеру. При экспрессии в E. coli выход денатурированной proКПТ5 составлял 50% от общего белка телец включения. Эффективность рефолдинга и очистки рекомбинантного белка составила около 1.5%. После активации proКПТ5 субтилизином чистота фермента по данным ДСН-ПААГ-электрофореза составляла 95%. Кристаллизацию комплекса КПТ5/N-BOC-L-Leu проводили в условиях микрогравитации на Международной космической станции, сбор дифракционных данных с кристаллов – на синхротроне Spring-8 (Япония). Пространственная структура комплекса уточнена при разрешении 1.4 Å.
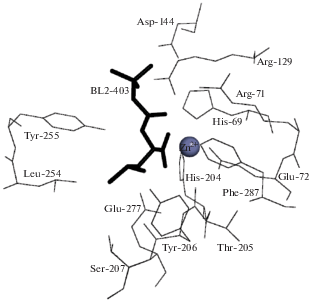
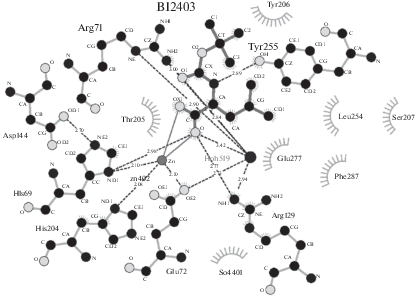
Положение N-BOC-L-Leu в активном центре КПТ5 и его контакты с аминокислотным окружением представлены на рис. 1, 2 соответственно. Ион Zn в активном центре связан с лигандом через С-концевой карбоксил лейцина; боковая цепь лейцина окружена боковыми цепями аминокислотных остатков Tyr255, Tyr206, Glu277, Thr205 и Ser207; трет-бутилоксикарбонильная группа – боковыми цепями Arg71, Arg129, Thr167 и Phe287.
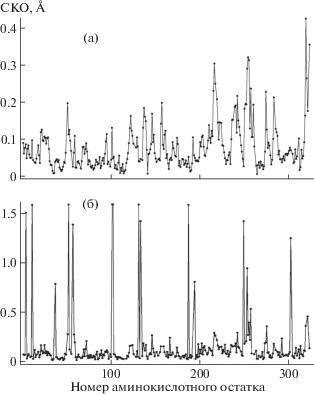
В результате сравнения структуры комплекса со структурой свободной КПТ5 показано, что связывание N-BOC-L-Leu в S1-сайте приводит к изменению конформации пяти остатков подвижной петли, формирующей активный центр, включая Tyr255 и Leu254 (рис. 3). Значительные изменения конформации претерпевают также боковые группы остатка каталитического центра Glu277 и остатка S1'-сайта Asp262, позиционно эквивалентного остатку Asp255 в КПВ, принимающему участие в связывании положительно заряженных субстратов (рис. 3). Это указывает на влияние конформации S1-сайта на S1'-сайт и всю молекулу КПТ5. Влияние связывания лиганда в S1-сайте на разные участки КПТ5 можно увидеть, оценивая изменения конформаций аминокислотных остатков в комплексе КПТ5/N-BOC-L-Leu по сравнению со свободной КПТ5 как среднеквадратичное отклонение (СКО) положения Сα-атомов (рис. 4а) и неводородных атомов боковых групп (рис. 4б). Наибольшие отклонения наблюдаются для Сα-атомов аминокислотных остатков S1'-сайта и неводородных атомов боковых групп аминокислотных остатков 101, 102, 131, 133, 187, 249, 254, 255, 262, 277, 284, 302.
Рис. 3.
Сравнение конформации S1-сайта и положения прилегающих аминокислотных остатков в комплексе КПТ5 с N-BOC-L-Leu и структуре свободной КПТ5 (светлые линии).
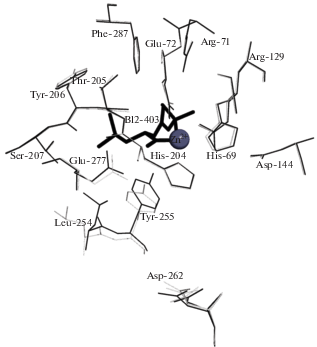
Рис. 4.
Среднеквадратичное отклонение (СКО) положения Сα-атомов (а и в) и неводородных атомов боковых групп (б и г) при совмещении аминокислотных остатков в структурах КПТ5 и комплекса КПТ5 с N-BOC-L-Leu (а и б); структурах комплекса КПТ5 с N-BOC-L-Leu и комплекса КПТ5 с N-сульфамоил-L-фенилаланином (в и г).
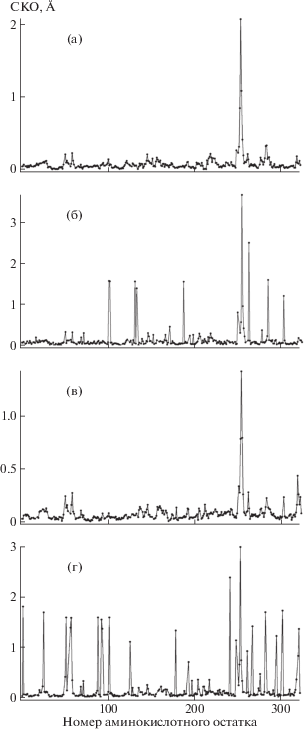
Сравнение полученной трехмерной структуры КПТ5 в комплексе с аналогом продукта реакции N-BOC-L-Leu со структурой КПТ5 в комплексе с другим аналогом (N-сульфамоил-L-фенилаланином), имитирующим переходное состояние реакции, позволило восстановить цепочку конформационных изменений, происходящих с ферментом в ходе реакции. На рис. 4в, 4г показано, что при переходе от комплекса с N-сульфамоил-L-фенилаланином, имитирующим переходное состояние реакции, к комплексу с аналогом продукта реакции Cα-атомы значительно смещаются у остатков подвижной петли активного центра КПТ5. Изменяют конформацию не только остатки активного центра Tyr255 и Leu254, остаток каталитического центра Glu277 и остаток Asp262 S1'-сайта, но и остатки на поверхности глобулы, находящиеся в позициях 2, 26, 51, 52, 57, 58, 89, 93, 94, 102 126, 179, 194, 242, 249, 253, 254, 255, 262, 268, 277, 283, 296, 303, 321, 322.
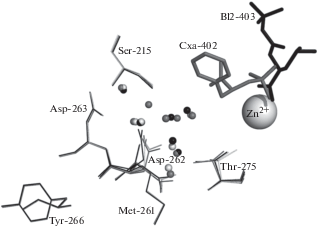
Как показано на рис. 5, при переходе от свободной КПТ5 к комплексу КПТ5/SPhe, имитирующему переходное состояние реакции, максимальные изменения конформации боковых групп тоже наблюдаются, во-первых, у остатков подвижной петли активного центра и, во-вторых, у каталитического остатка Glu277 и остатка Asp262 S1'-сайта. Изменение положения Asp262 можно отнести исключительно к перестройке структуры воды активного центра, так как окружающие аминокислотные остатки своей конформации не меняют (рис. 6).
Рис. 5.
Изменение конформации S1-сайта и прилегающих остатков при переходе от КПТ5 в свободном состоянии (светлые линии) к аналогу комплекса переходного состояния (более темные линии) и к аналогу комплекса с продуктом реакции (темные линии).
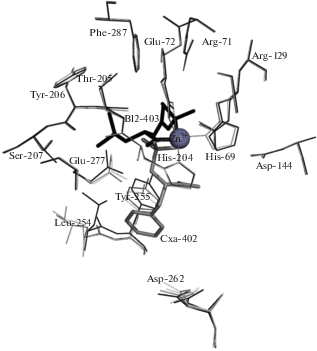
Рис. 6.
Изменение конформации боковой цепи Asp262 при движении по координате реакции. Светлые линии – КПТ5, серые – комплекс КПТ5 с SPhe (СХА-402), темные – комплекс КПТ5 с N-BOC-L-Leu (BL-402). Серой сферой показан ион Zn++, малыми сферами – молекулы воды.
При связывании SPhe боковая группа Tyr255 фермента вступает в стекинг-взаимодействие с боковой группой лиганда, а Leu254 из-за стерических препятствий со стороны лиганда меняет свою конформацию и положение (рис. 5). При дальнейшем переходе к комплексу КПТ5 с аналогом продукта реакции происходит существенный сдвиг подвижной петли, формирующей активный центр, внутрь молекулы. Гидроксильная группа остатка Tyr255 при этом вместо водородной связи с С-концевой карбоксильной группой лиганда N-BOC-L-Leu образует водородную связь с атомом азота лиганда. Одновременно с этим исчезает взаимодействие боковых групп N-сульфамоил-L-фенилаланина и Tyr255. Каталитически важный остаток Glu277 изменяет конформацию и теряет контакт с сульфамоильной группой N-сульфамоил-L-фенилаланина. Боковая группа Leu254 совершает движение в направлении лиганда и образует гидрофобный контакт с трет-бутильной группой N-BOC-L-Leu, имитирующей P2-остаток субстрата. Сближение Tyr255 и Leu254 способствует удалению уходящей группы субстрата из активного центра.
Сравнение пространственных структур комплексов КПТ и КПТ5 с N-BOC-L-Leu (рис. 7, 8) показывает, что замены в S1'-сайте существенно не влияют ни на конформацию N-BOC-L-Leu, ни на сам S1-сайт, так как конформация N-BOC-L-Leu в активном центре КПТ5 практически совпадает с его конформацией в активном центре КПТ дикого типа (CКО по всем атомам лиганда – 0.115 Å). Отклонения положения Сα-атомов аминокислотных остатков КПТ и КПТ5 в этих комплексах незначительны и наблюдаются в основном в районе подвижной петли активного центра (рис. 8а), лежащей на границе S1- и S1'-сайтов. Положения Сα-атомов и ОН-групп остатков Tyr255 различаются на 0.33 и 0.44 Å соответственно. Отклонения в положениях боковых групп, связанные с аминокислотными заменами в S1'-сайте КПТ5, более выражены и наблюдаются по всей первичной структуре КПТ (рис. 8б). Они касаются остатков 4, 11, 37, 52, 57, 101, 102, 131, 133, 187, 194, 249, 253, 257, 302.
Рис. 7.
Совмещение структур комплексов КПТ/N-BOC-L-Leu (светлые линии) и КПТ5/N-BOC-L-Leu (темные линии).
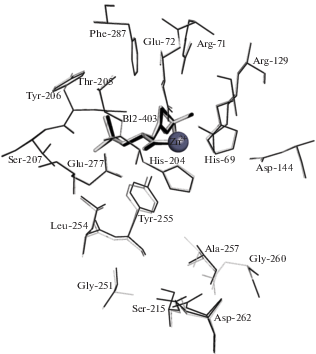
Рис. 8.
СКО положения Сα-атомов (а) и неводородных атомов боковых групп (б) при совмещении аминокислотных остатков комплексов КПТ5/N-BOC-L-Leu и КПТwt/N-BOC-L-Leu.
Таким образом, изучение кристаллической структуры КПТ с S1'-субсайтом КПВ показало, что мутации в S1'-сайте не приводят к изменению конформации аналога продукта реакции N-BOC-L-Leu в S1-сайте. С другой стороны, связывание аналога продукта в S1-сайте КПТ5 приводит к конформационным изменениям в белке, затрагивающим главным образом Сα-атомы пяти остатков подвижной петли, расположенной на границе S1- и S1'-сайтов, и боковые группы остатков Tyr255 и Leu254, участвующих в индуцированном соответствии. Кроме того, конформационные изменения затрагивают аминокислотные остатки активного центра Glu277 и Asp262, а также боковые группы остатков, расположенных на поверхности молекулы. Наблюдаемые изменения отличаются от конформационных изменений, происходящих в КПТ дикого типа при связывании с аналогом продукта реакции, что говорит о взаимном влиянии S1- и S1'-субсайтов в металлокарбоксипептидазе Т.
Работа выполнена при поддержке Российского научного фонда (грант № 17-14-01256) в части выделения, очистки, поиска условий кристаллизации белка, решения, уточнения и анализа структур; Федеральной космической программы 2016-2025 (ОКР “МКС (Наука)”) в части выращивания кристаллов в условиях невесомости, а также Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части получения рентгенодифракционных наборов.
Список литературы
Osterman A.L., Stepanov V.M., Rudenskaya G.N. et al. // Biokhimiia. 1984. V. 49. № 2. P. 292.
Sukenaga Y.M., Akanuma Y.H., Education G. // Biochem J. 1980. V. 87. № 6. P. 1691.
Schechter I., Berger A. // Biochem. Biophys. Res. Commun. 2012. V. 425. № 3. P. 497.
Stepanov V.M. // Methods Enzymol. 1995. V. 248. P. 675.
Adler M., Buckman B., Bryant J. et al. // Acta Cryst. D. 2008. V. 64. № 2. P. 149.
Aloy P., Companys V., Vendrell J. et al. // J. Biol. Chem. 2001. V. 276. № 19. P. 16177.
Reverter D., Maskos K., Tan F. et al. // J. Mol. Biol. 2004. V. 338. № 2. P. 257.
Christianson D., Lipscomb W. // Proc. Nat. Acad. Sci. US. 1986. V. 83(20). № 10. P. 7568.
Teplyakov A., Polyakov K.M., Obmolova G. et al. // Eur. J. Biochem. 1992. V. 208. № 2. P. 281.
Akparov V.K., Grishin A.M., Yusupov M.P. et al. // Biochemistry (Moscow). 2007. V. 72. № 4. P. 416.
Akparov V.Kh., Timofeev V.I., Kuranova I.P. et al. // Acta Cryst. F. 2018. V. 74. № 10. P. 638.
Grishin A.M., Akparov V.K., Chestukhina G.G. // Biochemistry (Moscow). 2008. V. 73. № 10. P. 1140.
Zisapel N., Kurn-Abramowitz N. // Eur. J. Biochem. 1973. V. 35. P. 507.
Timofeev V.I., Kuznetsov S.A., Akparov V.Kh. et al. // Biochemistry (Moscow). 2013. V. 78. № 3. P. 252.
Akparov V.Kh., Timofeev V.I., Khaliullin I.G. et al. // Biochemistry (Moscow). 2018. V. 83. № 12–13. P. 1594.
Cueni L.B., Bazzone T.J., Riordan J.F. et al. // Anal Biochem. 1980. V. 107. P. 341.
Novagen pET System Manual TB055 7th Ed. Novagen pET System Manual TB055, 7th ed. Novagen Madison W.I. 1997.
Bradford M.M. // Anal. Biochem. 1976. V. 72. P. 248.
Laemmli U.K. // Nature. 1970. V. 227. № 5259. P. 680.
Takahashi S., Tsurumura T., Aritake K. et al. // Acta Cryst. F. 2010. V. 66. № 7. P. 846.
Куранова И.П., Смирнова Е.А., Абрамчик Ю.А. и др. // Кристаллография. 2011. Т. 56. № 5. С. 944.
Otwinowski Z., Minor W. // Methods Enzymol. 1997. V. 276. P. 307.
McCoy A., Grosse-Kunstleve R.W., Storoni L.C. et al. // Acta Cryst. D. 2005. V. 61. Pt 4. P. 458.
Murshudov G.N., Vagin A.A., Dodson E.J. // Acta Cryst. D. 1997. V. 53. № 3. P. 240.
Emsley P., Cowtan K. // Acta Cryst. D. 2004. V. 60. Pt 12. Pt 1. P. 2126.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография