Кристаллография, 2019, T. 64, № 5, стр. 677-700
Кристаллографический подход к топохимическим реакциям [2 + 2]-фотоциклоприсоединения непредельных соединений с сохранением монокристалла
Л. Г. Кузьмина 1, *, А. И. Ведерников 1, 2, С. П. Громов 1, 2, М. В. Алфимов 1, 2
1 Институт общей и неорганической химии РАН
Москва, Россия
2 Центр фотохимии РАН, ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: kuzmina@igic.ras.ru
Поступила в редакцию 21.06.2018
После доработки 28.06.2018
Принята к публикации 29.07.2018
Аннотация
На основе результатов собственных исследований разработан подход к изучению топохимических реакций [2 + 2]-фотоциклоприсоединения (ФЦП) непредельных соединений, идущих в кристалле как с сохранением, так и с разрушением монокристалла под действием видимого света. Выявлены основные кристаллические упаковки, благоприятные для прохождения фотореакции в кристалле. Установлены условия осуществимости реакции ФЦП с сохранением монокристалла. Изучены факторы, повышающие вероятность осуществления в кристалле упаковочных мотивов, благоприятных для данной реакции, путем химической модификации структурных единиц. Получено объяснение необычного осуществления прямой и обратной (под действием УФ-излучения) фотореакций, идущих в одном и том же монокристаллическом образце.
ОГЛАВЛЕНИЕ
Введение
1. Кристаллохимический анализ структур этиленовых соединений, способных к реакции ФЦП в монокристаллах
1.1. Два подхода к изучению реакции ФЦП
2.1. Возможные кристаллические упаковки плоских сопряженных непредельных молекулярных систем
3.1. Выбор молекулярных систем для проведения реакции ФЦП в кристалле
4.1. Возможная симметрия стопок сопряженных непредельных молекул
5.1. Факторы, влияющие на осуществимость ФЦП в кристаллах
6.1. Влияние природы аниона на осуществимость ФЦП стириловых красителей
7.1. Полиморфизм стириловых красителей и реакции ФЦП
8.1. Влияние усиления π ··· π-стэкинг взаимодействия на ФЦП
9.1. Увеличение вероятности формирования в кристаллах стирилгетероциклов благоприятных упаковок
10.1. “Педальная” неупорядоченность этиленовых соединений и ее влияние на ФЦП
11.1. Осуществимость в кристалле реакции ретро-ФЦП
Заключение
ВВЕДЕНИЕ
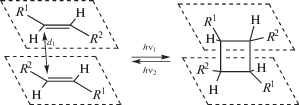
Многие этиленовые соединения при их облучении ультрафиолетовым или видимым светом способны вступать в реакцию [2 + 2]-фотоциклоприсоединения (ФЦП), которая заключается в одновременном образовании двух σ-связей C–C и приводит к получению производных циклобутана:
Реакция ФЦП, интенсивно исследовавшаяся с момента ее открытия в начале прошлого века [1], до настоящего времени вызывает большой интерес [1–34 ].
Эта реакция является одной из важнейших реакций фотохимии, поскольку в результате нее можно получить замещенные производные циклобутана, которые иными способами труднодоступны. Исследование реакции ФЦП важно для синтетической химии, для понимания химических процессов, происходящих в живой природе и лежащих в основе таких явлений как фотосинтез, фототаксис, зрение. Реакция ФЦП также имеет перспективу использования в материаловедении при создании новых систем оптической записи и хранения информации. Некоторые природные соединения с фрагментом циклобутана, которые проявляют фармацевтические свойства, можно синтезировать с использованием реакции ФЦП [35].
Реакция ФЦП имеет ряд характерных особенностей. Она относится к термически запрещенным процессам. Эта реакция фотохимически обратима: при облучении циклобутанового продукта более коротковолновым излучением он распадается на исходные компоненты. Обычно реакция ФЦП инициируется светом видимого диапазона или ближней УФ-области (340–430 нм), а обратная ей реакция (ретро-ФЦП) – более коротковолновым излучением (220–270 нм). Реакция ФЦП в растворе, как правило, не является регио- и стереоселективной.
Ранее было установлено, что для осуществления реакции ФЦП необходима определенная предорганизация структурных единиц, при которой фрагменты C=C двух молекул должны располагаться параллельно на расстоянии d, не превышающем ~4.2 Å в твердой фазе (критерий Шмидта [1]) и до 10 Å в растворе.
Реакция ФЦП может идти как в растворе, так и в твердой фазе, включая монокристалл. Поэтому ее можно исследовать в растворе методом ЯМР 1H-спектроскопии, а в монокристалле методом рентгеноструктурного анализа (РСА). Во многих случаях монокристалл в ходе ФЦП разрушается, переходя либо в аморфный порошок, либо в стеклообразное состояние. Но иногда эта реакция идет с сохранением монокристалла. Причины разрушения или сохранения монокристалла не всегда ясны, но в ряде случаев они становятся очевидными из анализа особенностей кристаллической упаковки исходного соединения.
Изучение процессов ФЦП ↔ ретро-ФЦП в монокристалле, не сопровождающихся его разрушением, представляет особый интерес, поскольку кристалл позволяет проводить процесс “туда–обратно” кристаллографически нелимитированное количество раз, что важно для создания систем оптической записи и хранения информации.
В настоящем обзоре обобщены результаты собственных рентгеноструктурных исследований реакции ФЦП, идущей в кристалле, и анализируются возможности ее прохождения без разрушения монокристалла.
1. КРИСТАЛЛОХИМИЧЕСКИЙ АНАЛИЗ СТРУКТУР ЭТИЛЕНОВЫХ СОЕДИНЕНИЙ, СПОСОБНЫХ К РЕАКЦИИ ФЦП В МОНОКРИСТАЛЛАХ
1.1. Два подхода к изучению реакции ФЦП
Для осуществления реакции ФЦП первоочередной задачей является априорное создание “предорганизованного димера”, для чего существуют два подхода.
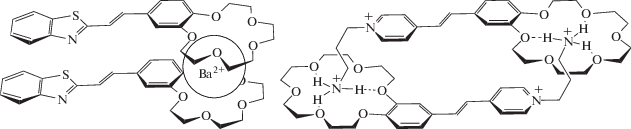
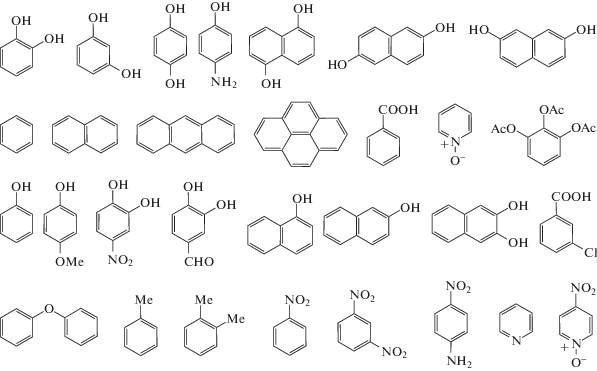
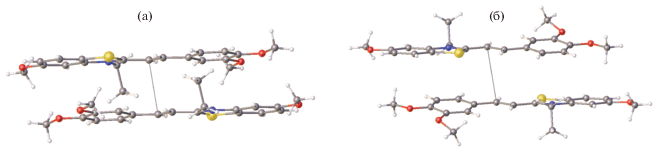
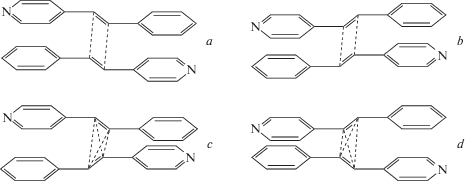
Первый подход состоит в супрамолекулярном дизайне, т.е. создании условий для возникновения в растворе “предорганизованного димера” за счет способности непредельных молекул димеризоваться в результате разного рода взаимодействий – ион-дипольных, образования водородных связей и т.д. [36–41]. Примерами такого подхода служат системы, изображенные на рис. 1.
Супрамолекулярный дизайн состоит во введении в исходную молекулу непредельного соединения или только краун-эфирного фрагмента (слева), или еще и короткой алкильной цепи, несущей на конце функциональную группу, такую как, например, аммониоалкильный заместитель при атоме N гетероциклического остатка (справа). Тогда в растворе формируется либо димерный комплекс за счет двух наборов водородных связей (справа), либо сэндвичевый комплекс при введении в раствор крупного катиона металла M2+ за счет ион-дипольных взаимодействий M2+ с двумя краун-эфирными фрагментами (слева). В этих двух случаях в результате реакции ФЦП образуются разные изомеры производных циклобутана, поскольку димер имеет разные организации – либо “голова-к-голове”, либо “голова-к-хвосту”.
Еще одним вариантом этого подхода является включение пары этиленовых молекул в полость кавитанда – кукурбитурила, циклодекстрина, каликсарена [42–47].
Вторым подходом является кристаллическая инженерия. В основу этого подхода положено предположение, что сама кристаллическая упаковка предорганизует исходные непредельные молекулы нужным для ФЦП образом. Этот подход применим к исследованию твердотельного ФЦП. При таком подходе возникают следующие вопросы:
– сколько вообще упаковочных мотивов может существовать для плоских непредельных молекулярных систем и каков вид благоприятных для ФЦП упаковочных мотивов кристалла;
– можно ли управлять выбором нужной упаковки;
– можно ли добиться такой предорганизации молекул, которая привела бы в результате реакции ФЦП к разным изомерам производных циклобутана;
– какие симметрические операции создают разные варианты предорганизации?
Успешная реализация второго подхода позволяет исключить сложный многостадийный синтез, а потому исследовать значительно бóльшую группу легко синтезируемых соединений, провести систематическое изучение топохимических процессов и на основе полученных знаний попытаться осуществить в монокристалле как прямую реакцию ФЦП при облучении исходных монокристаллов видимым светом, так и обратную ей реакцию (ретро-ФЦП) при УФ-облучении монокристаллов полученных производных циклобутана. Отметим, что обе реакции в одном монокристалле никому ранее наблюдать не удавалось. Использование монокристаллов для последовательного проведения в них прямой и обратной фотохимических реакций представляется актуальным, так как (1) кристаллическая решетка удерживает компоненты обеих реакций в определенных положениях, поэтому обе реакции могут происходить в кристалле кристаллографически нелимитированное количество раз и (2) любой, даже очень маленький, монокристалл может представлять собой готовое устройство.
Идея осуществления топохимического контроля реакции ФЦП в кристалле и возможности образования циклобутанового производного при разных способах взаимного расположения этиленовых структурных единиц в кристалле была сформулирована еще в 1984 г. [48]. Дальнейшее развитие этой идеи стало возможным лишь в более позднее время – после 1995 г., поскольку именно на этот период пришлись бурное развитие метода РСА и одновременно создание обширной базы структурных данных.
2.1. Возможные кристаллические упаковки плоских сопряженных непредельных молекулярных систем
Первый этап работы состоял в анализе большого количества кристаллических упаковок плоских непредельных молекул по данным Кембриджской базы структурных данных (КБСД) [49]. В результате были установлены следующие шесть канонических структур, характерных для этих соединений (рис. 2):
Рис. 2.
Канонические типы кристаллических упаковок плоских сопряженных непредельных молекул; отрезки изображают боковые проекции плоских сопряженных непредельных молекул, скобки показывают параллельные димерные пары.

Упаковки 1 и 2 являются параллельно-стопочной и паркетно-стопочной, 3 и 4 – паркетно-димерной и параллельно-димерной, 5 и 6 – лестничной и паркетной соответственно. Упаковки 1, 4, 5 (а также 2, 3, 6) генетически связаны между собой. Упаковка 5 (6) может быть получена из упаковки 1 (2) путем сдвига молекул в стопках в параллельных плоскостях до прекращения их взаимного проектирования, а упаковка 4 (3) может быть получена из упаковки 1 (2) путем аналогичного сдвига не одной, а пар молекул.
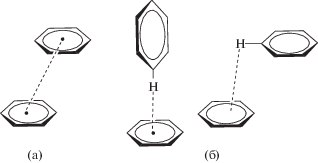
Только упаковки типа 1, 2, 3 и 4 могут поддерживать предорганизованную димерную пару; упаковки 5 и 6 несовместимы с реакцией ФЦП в кристалле. Формированием упаковок 1–4 управляют слабые направленные π ··· π-взаимодействия (стэкинг-взаимодействия) между сопряженными непредельными молекулами, тогда как формирование упаковок 5 и 6 обусловлено действием слабых направленных взаимодействий типа C–H ··· π-система [50]. Первое из взаимодействий требует параллельного или параллельно-сдвинутого, а второе – T-образного расположения молекул или параллельно-сдвинутого до отсутствия взаимного проектирования плоских сопряженных непредельных молекул (рис. 3).
Использование молекул c преобладанием стэкинг-взаимодействий приводит к возникновению стопочной, а молекул с преобладанием взаимодействий C–H ··· π-система – к паркетной и лестничной архитектурам. Эти два взаимодействия близки по энергии, поэтому небольшая модификация молекул с преобладанием взаимодействий C–H ··· π-система в кристалле, например введение гетероцикла вместо бензольного кольца, или π-заместителей, может привести к иной кристаллической упаковке модифицированных молекул, в которой начинают преобладать стэкинг-взаимодействия. При равенстве энергий двух взаимодействий могут возникать стэкингово-димерные архитектуры. Таким образом, второй подход может также включать в себя элементы молекулярного дизайна.
3.1. Выбор молекулярных систем для проведения реакции ФЦП в кристалле
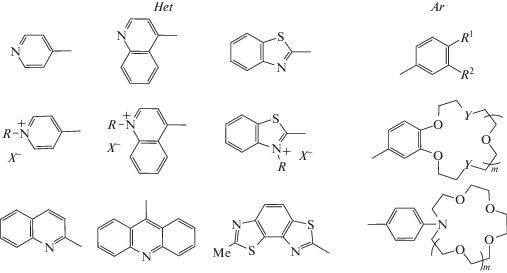
Для получения в кристалле предорганизованных к ФЦП димерных пар со сближенным расположением этиленовых фрагментов необходимо, чтобы геометрический центр сопряженного фрагмента непредельных молекул приблизительно приходился на этиленовый фрагмент. Тогда максимальное перекрывание π-систем двух молекул, расположенных в параллельных плоскостях, что важно для протекания ФЦП, будет достигаться при сближенном расположении их этиленовых фрагментов. Такому условию удовлетворяют молекулы стильбенов Ar–CH=CH–Ar (СТ), винилогов виологенов R–Het+–CH=CH–Het+–R 2X– (ВВ), стириловых красителей R–Het+–CH=CH–Ar X– (СК), нейтральных стирилгетероциклов Het–CH=CH–Ar (СГ) и бутадиенильных красителей R–Het+–CH=CH–CH=CH–Ar X– (БК) (Het – азотсодержащий гетероароматический остаток, Ar – арильный остаток, X – противоион). Перечисленные соединения исследованы со всевозможными комбинациями структурных фрагментов (рис. 4).
Рис. 4.
Формулы структурных фрагментов стириловых красителей, стирилгетероциклов и противоионов стириловых красителей: Х = ClO4, I, Br, BF4, PF6, BPh4, TsO, Pic; R = Alk, ${{({\text{C}}{{{\text{H}}}_{{\text{2}}}})}_{n}}{\text{NH}}_{3}^{ + }$, ${{({\text{C}}{{{\text{H}}}_{{\text{2}}}})}_{n}}{\text{SO}}_{3}^{ - }$ (n = 2, 3, 6); R1 и R2 – различные комбинации заместителей H, OMe, SMe, NMe2, Cl, NO2, N+Me2Et; Y = O, S; m = 0–2.
Эти соединения сравнительно легко синтезировать в широком ассортименте, их спектральные характеристики легко варьируются изменением типа гетероциклического остатка и природы заместителей в арильном остатке. В ходе ФЦП хромофор непредельного соединения разрушается, поэтому значительно изменяются спектральные характеристики вещества, включая окраску, что является одним из необходимых свойств фотопереключаемых материалов.
Непредельные соединения СТ и ВВ оказались бесперспективными с точки зрения осуществимости в их кристаллах реакции ФЦП, поскольку в них реализуются исключительно лестничный или паркетный упаковочные мотивы 5 и 6 (рис. 2), в которых отсутствует взаимное проектирование плоских сопряженных фрагментов [51–58]. Более благоприятная ситуация в кристаллах соединений СК [42, 59–77], СГ [67, 78–88] и БК [89–93].
Методом РСА определены кристаллические структуры несольватированных форм СК, СГ и их сольватов с различными малыми молекулами. Для тех из них, в кристаллических упаковках которых обнаружено благоприятное для ФЦП взаимное расположение структурных единиц, проведено облучение видимым светом отснятых монокристаллов и повторное рентгеноструктурное исследование образовавшихся в тех же монокристаллах продуктов реакции ФЦП – производных циклобутана.
В кристаллах СК и БК реализуются почти исключительно стопочные упаковки (1 и 2 на рис. 2), в основном благоприятные для ФЦП, а в СГ – остальные четыре, но только две из них (3 и 4) благоприятны для ФЦП. Таким образом, общая проблема непредсказуемости кристаллических упаковок органических соединений в случае СК, СГ и БК решается как следствие правильного выбора объектов исследования.
4.1. Возможная симметрия стопок сопряженных непредельных молекул
В большинстве случаев (~80%) в кристаллах СК с упаковками типов 1 и 2 (рис. 2) реализуются центросимметричные стопочные упаковочные мотивы с взаимным расположением несимметрично-замещенных непредельных молекул по типу “голова-к-хвосту” (рис. 5) [68, 69]. При таком расположении двойные связи любых двух соседних молекул оказываются строго антипараллельными, что благоприятно для осуществления ФЦП.
Рис. 5.
Два способа представления взаимного расположения молекулярных катионов СК в кристаллах со стопочной архитектурой; катионы в СК представлены линиями и овалами, Т – трансляция вдоль оси кристалла, черные кружки между плоскостями катионов – центры симметрии.
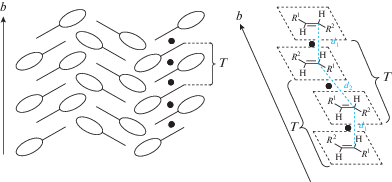
В общем случае расстояния d1 ≠ d2, поскольку два соседних центра симметрии принадлежат к разным кристаллографическим системам. Таким образом, стопка изначально разбивается на димерные пары. Если соблюдается условие d1 < 4.2 Å < d2, то в монокристалле может протекать реакция ФЦП с сохранением монокристалла. В случае, когда оба эти расстояния < 4.2 Å, реакция ФЦП чаще всего протекает в стопке статистически, т.е. не только между кристаллографически эквивалентными парами структурных единиц. Это приводит к нарушению общей симметрии кристалла и сопровождается его деградацией, выражающейся либо в сильном растрескивании кристалла, либо в сохранении его формы и блеска, но исчезновении дифракционной картины и “погасании” в поляризованном свете микроскопа.
Помимо центросимметричного стопочного упаковочного мотива, примерно в 15% случаев в СК формируются трансляционно связанные стопочные упаковочные мотивы, в которых непредельные фрагменты расположены по типу “голова-к-голове” (рис. 6) [68–70].
Рис. 6.
Трансляционно связанный упаковочный мотив; справа утолщенными линиями выделены “лишние” структурные единицы в ходе ФЦП в стопке.
Здесь этиленовые фрагменты любых двух соседних молекул расположены строго параллельно и все расстояния d идентичны. Осуществление одного акта ФЦП приведет к нарушению локальной симметрии и возникновению дефекта. Развитие реакции ФЦП по кристаллу должно сопровождаться нарушением его общей симметрии еще и потому, что пары, в которых может осуществляться ФЦП, возникают по стопке статистически, что с неизбежностью приведет к появлению “лишних”, непарных структурных единиц. Поэтому реакция ФЦП с сохранением монокристалла в структурах с трансляционно связанными стопками принципиально невозможна. Она не может протекать еще и потому, что расстояния d, как правило, превышают 5 Å, так как непредельные фрагменты сильно сдвинуты в параллельных плоскостях, что неблагоприятно для ФЦП. Такие монокристаллы устойчивы к действию света.
Существованию в кристалле стопочных структурных мотивов не противоречат и другие симметрические операции. Их рассмотрение необходимо для установления возможных изомеров циклобутана, образующихся в результате реакции ФЦП.
Такими операциями могут быть ось симметрии второго порядка 2 и плоскость зеркального отражения m. Отметим, что оба элемента симметрии не требуют строгой параллельности структурных единиц, однако для осуществления реакции ФЦП возможно нарушение параллельности этиленовых фрагментов до ~25°. Действие обоих этих элементов симметрии, равно как и центра симметрии, приводит к разбиению стопок на димерные пары.
Рассмотрим стопки, образованные действием плоскостей зеркального отражения (рис. 7).
Рис. 7.
Схема стопки, образованной через плоскости зеркального отражения m; справа показано взаимное проектирование пары структурных единиц.
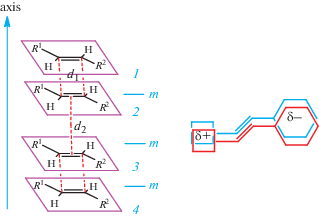
В таких стопках одноименно заряженные фрагменты структурных единиц оказываются сближенными. Это взаимное расположение не может осуществиться в процессе зародышеобразования и роста кристалла из-за электростатического отталкивания одноименно заряженных фрагментов молекул. Однако симметрия m димерных пар возможна в соединениях, полученных в результате молекулярного дизайна за счет разного рода взаимодействий, связывающих структурные единицы в димеры, – аргентофильных взаимодействий, водородных связей, взаимодействий C–H···π [94–98].
Рассмотрим стопки, в которых структурные единицы связаны осями второго порядка (рис. 8).
Рис. 8.
Стопки структурных единиц, образованные действием осей второго порядка; справа показано взаимное проектирование структурных единиц в парах, по-разному ориентированных относительно оси 2.
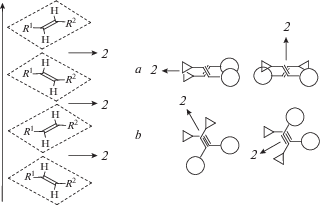
В общем случае эта симметрия означает или скрещенное взаимное расположение этиленовых фрагментов (случай а на рис. 8), или их примерно параллельное расположение (случай b). Скрещенное взаимное расположение, хотя и обеспечивает хорошее перекрывание π-систем структурных единиц, не оптимально для протекания реакции ФЦП. Однако симметрия оси 2 не ограничивает величину взаимного скручивания двух соседних этиленовых фрагментов в примерно параллельных плоскостях и поэтому может существовать случай b почти полного его отсутствия. Однако при этом π-перекрывание сопряженных фрагментов структурных единиц сводится только к перекрыванию их этиленовых фрагментов.
5.1. Факторы, влияющие на осуществимость ФЦП в кристаллах
Для установления факторов, влияющих на осуществимость ФЦП в кристалле без его разрушения, проводилось (1) варьирование аниона в красителе; (2) сокристаллизация СК и СГ с малыми органическими молекулами, конформационная и позиционная подвижность которых компенсирует внутренние напряжения, возникающие в кристалле в результате больших атомных смещений в ходе ФЦП; (3) введение конформационно гибкого фрагмента в состав непредельной молекулы.
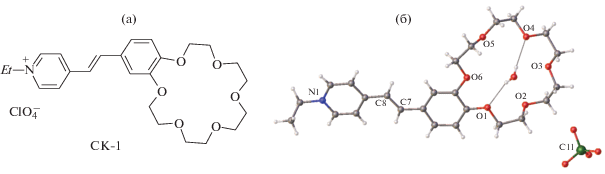
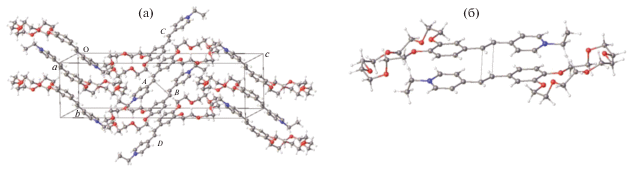
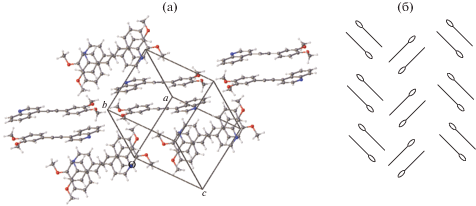
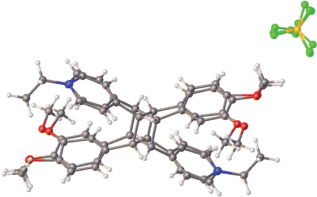
Кристаллическая структура ярко-желтого краунсодержащего СК-1 (рис. 9) имеет стопочный упаковочный мотив (рис. 10) типа 2 (схема на рис. 2) [65].
Органические катионы в стопке объединены центрами симметрии и имеют взаимное расположение “голова-к-хвосту”. Катионы А и В (а также С и D) центральной стопки проектируются друг на друга по всей сопряженной цепи, и расстояние d1 между их этиленовыми фрагментами равно 3.55 Å, т.е. оно удовлетворяет условию осуществимости ФЦП. Соседние пары катионов А–С и В–D проектируются друг на друга только по арильным остаткам, и в них расстояние d2 между этиленовыми фрагментами равно 6.61 Å (последовательность катионов в стопке C–A–B–D). Таким образом, стопка катионов разбивается на димерные пары, предорганизованные для ФЦП.
Облучение предварительно отснятого на дифрактометре монокристалла СК-1 видимым светом в течение суток сопровождается изменением его окраски (из ярко-желтого становится бледно-желтым) и превращением СК-1 в производное циклобутана (рис. 11) [65].
Стопочная димерная пара исходного соединения (рис. 12) непосредственно окружена ротационно-подвижными перхлоратными анионами и конформационно лабильными краун-эфирными фрагментами, которые создают подвижную оболочку, способную компенсировать большие смещения атомов в кристалле в ходе ФЦП, защищая тем самым кристалл от разрушения.
Наложение независимой части кристаллической ячейки исследованного кристалла до и после облучения показывает (рис. 13), что в результате ФЦП не происходит существенного изменения объема кристаллического пространства, приходящегося на структурные единицы.
Рис. 13.
Наложение структурных единиц в кристаллах СК-1 и его фотопродукта (сплошная линия – димер исходного соединения, штриховая – продукт реакции ФЦП).
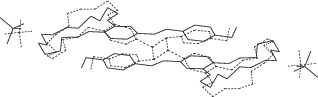
В ходе фотореакции происходит сближение центральных частей молекулярных катионов СК-1, завершающееся образованием двух σ-связей между атомами углерода этиленовых групп. Такому сближению не препятствует кристаллическая упаковка, поскольку оно направлено внутрь объема, приходящегося на димерную пару. В результате ФЦП происходят изменения конформации гибкого краун-эфирного фрагмента, а также положения и ориентации перхлоратных анионов, обусловленные “подстройкой” подвижных элементов структуры к изменившимся очертаниям образовавшегося дикатиона производного циклобутана.
Таким образом, для осуществления реакции ФЦП в кристалле без его разрушения необходимо наличие мягкой подвижной оболочки вокруг “предорганизованного” димера.
Реакция ФЦП типа монокристалл–монокристалл обнаружена также для СК, не содержащих краун-эфирного фрагмента, но кристаллы которых дополнительно включают в себя сольватные молекулы, способные выполнять функцию подвижной оболочки. Сокристаллизация стирилового красителя 4-пиридинового ряда Et–Py+–CH=CH–C6H4–OMe ${\text{ClO}}_{4}^{ - }$ (СК-2) c малыми ароматическими молекулами (рис. 14) в восьми случаях привела к соответствующим кристаллосольватам, а в остальных случаях к несольватированным формам СК-2 в двух кристаллических модификациях – моноклинной и триклинной [70].
Облучение несольватированных форм, образующих стопочную кристаллическую упаковку типа 2 (рис. 2), сопровождается растрескиванием исходного кристалла до порошка. Причиной этого является нарушение условия d1 < 4.2 Å < d2 или “жесткость” кристаллического окружения димерных пар, препятствующие взаимной подстройке формы молекул для снижения внутренних напряжений в кристалле в ходе ФЦП.
Для полученных сольватированных кристаллов проведено рентгеноструктурное исследование и последующее облучение светом видимого диапазона. В кристаллосольватах чередуются плотно упакованные слои, образованные стопками молекулярных катионов, и рыхлые слои, образованные анионами и сольватными молекулами. Стопки катионов организованы по типу “голова-к-хвосту”. Роль “рыхлых” слоев заключается в том, что они за счет подвижности образующих их компонентов выполняют функцию “мягкой” подвижной оболочки.
В кристаллосольватах СК-2 с пирокатехином, резорцином, 1,4-гидрохиноном, 4-аминофенолом формируются центросимметрично связанные стопки, в которых оба расстояния d оказались меньше 4.2 Å. Реакция ФЦП в них проходит, но с деградацией монокристалла. Во всех этих случаях исследуемый образец заметно обесцветился, но сохранил внешнюю форму и блеск. Однако он перестал давать дифракционную картину, превратившись в стекло [70].
В кристаллосольвате СК-2 с 1,5-дигидроксинафталином и ацетонитрилом, где также образуются центросимметрично связанные стопки и выполняется условие d1 < 4.2 Å < d2, реакция ФЦП проходит с сохранением монокристалла [70].
В кристаллосольвате СК-2 с бензолом образуются трансляционно связанные стопки (рис. 6), поэтому он устойчив к облучению.
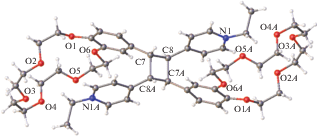
В кристаллосольватах СК-2 с 2,6- и 2,7-дигидроксинафталинами [70] реакция ФЦП проходит без разрушения монокристалла, хотя оба соседних в стопке расстояния оказываются меньше, чем 4.2 Å. Причина нарушения правила d1 < 4.2 Å < < d2 состоит в том, что в стопке чередуются кристаллографически независимые молекулы. Поэтому реакция ФЦП в них не приводит к нарушению общей симметрии кристалла, а потому и не сопровождается деградацией кристалла, хотя и приводит к образованию кристалла с сильной неупорядоченностью. В частности, в последнем кристаллосольвате содержатся три кристаллографически независимые формульные единицы красителя (А1, А2, А3), которые уложены в псевдоцентросимметричную стопку (…–А1–А2–А3–А1–А2–А3–…) с расстояниями d1, d2, d3 3.40, 3.38, 3.39 Å, меньшими, чем 4.2 Å, т.е. все они удовлетворяют геометрическому условию ФЦП. Реакция ФЦП здесь приводит к структуре с существенной неупорядоченностью (рис. 15).
Рис. 15.
Формула СК-2 (а) и неупорядоченная структура циклобутанового дикатиона (б), образовавшегося при облучении кристалла сольвата СК-2 с 2,7-дигидроксинафталином.
Центральная молекула СК-2 в стопке вступает в реакцию ФЦП как с “верхней”, так и с “нижней” молекулой. В результате возникает неупорядоченность, обусловленная как присутствием в одном кристалле исходных компонентов и продукта реакции, так и статистическим осуществлением реакции для центрального катиона в триаде. Реакция ФЦП между триадами А1–А2–А3 в стопке, т.е. между структурными единицами А3–А1, не идет вследствие скрещенности их этиленовых связей.
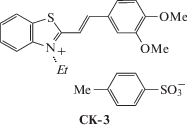
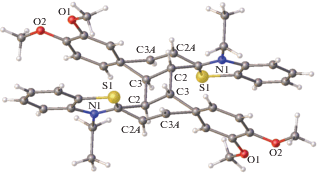
Исследована реакция ФЦП в кристаллических формах стирилового красителя ряда 2-бензотиазола CК-3 (рис. 16) в виде его сокристаллизатов с 1,4-гидрохиноном (HQ) состава CК-3 · 0.5HQ · H2O и CК-3 · HQ [99].
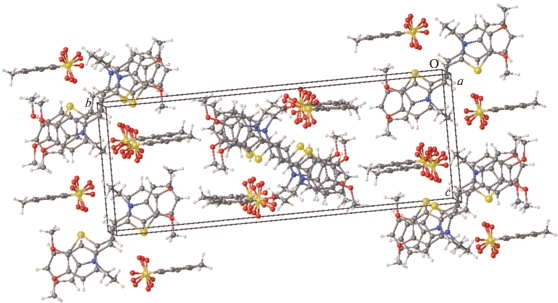
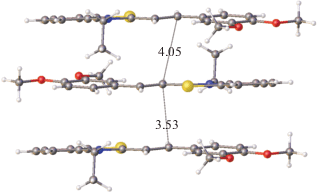
В кристалле несольватированной формы CК-3 тозилат-анион обнаруживает ротационную неупорядоченность заместителя ${\text{SO}}_{3}^{ - }$ по трем основным положениям и серии промежуточных, о существовании которых можно судить по высоким температурным параметрам атомов кислорода. Катионы CК-3 образуют центросимметрично связанные стопки, разделенные слоями тозилат-анионов, плоскости которых почти перпендикулярны плоскостям катионов (рис. 17). В стопке расстояния d1 и d2 удовлетворяют условию осуществимости ФЦП (рис. 18).
Однако расстояние d1 = 3.53 Å в одной паре катионов все же существенно короче, чем расстояние d2 = 4.05 Å в другой паре катионов. Кроме того, геометрические условия проектирования этиленовых фрагментов друг на друга, т.е. перекрывания их π-систем и, следовательно, эффективность π ··· π-взаимодействия в неэквивалентных парах катионов, различны (рис. 19).
Рис. 19.
Взаимное проектирование пар соседних катионов в стопке в CК-3; а – проекция с коротким расстоянием d1, б – с длинным d2.
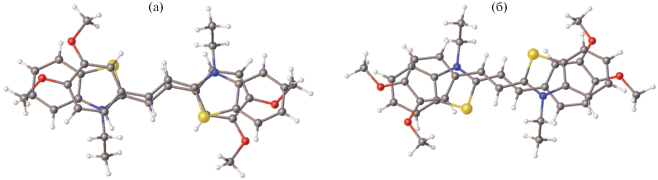
В левой паре катионов, где расстояние d1 = = 3.53 короче, взаимное проектирование весьма эффективно, тогда как в правой паре оно значительно хуже. Кроме того, в паре катионов с бóльшим расстоянием d2 (справа) этильные заместители при атомах азота направлены внутрь пары, что должно препятствовать взаимному сближению катионов в ходе ФЦП, а во второй паре эти заместители ориентированы во внешнюю сторону (рис. 18).
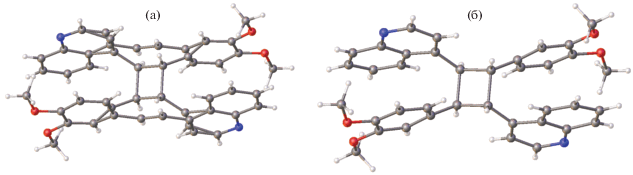
При облучении этого монокристалла в нем проходит реакция ФЦП с сохранением монокристалличности (рис. 20).
Таким образом, две последние структуры показывают разные случаи осуществления ФЦП с сохранением монокристалла, когда не выполняется требование d1 < 4.2 Å < d2.
Кристаллосольват СК-3 · 0.5HQ · H2O, содержащий молекулу воды в качестве дополнительного структурного блока упаковки, имеет аналогичные структурные особенности. В нем обнаружены центросимметрично связанные стопки катионов, разделенные слоями, заполненными тозилат-анионами, а также молекулами HQ и воды. Коренное различие упаковок СК-3 и его сольвата состоит в том, что присутствующие в кристалле СК-3 · 0.5HQ · H2O сольватные молекулы HQ и воды образуют водородные связи ОН · ОS с соседними тозилат-анионами. Поэтому в кристалле заторможено ротационное движение группы ${\text{SO}}_{3}^{ - }$ аниона – неупорядоченности этой группы не обнаружено.
Для того чтобы реакция ФЦП в этом кристалле началась, потребовалось его облучение в течение недели, хотя в кристаллах несольватированной формы СК-3 образование циклобутанового продукта происходит через 5 ч облучения. Более того, реакция прошла только на 80% даже при продолжительном, в течение месяца, последующем облучении. Таким образом, повышение “жесткости” структуры окружения стопок за счет системы слабых направленных взаимодействий приводит к замедлению реакции ФЦП в монокристалле.
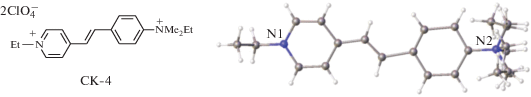
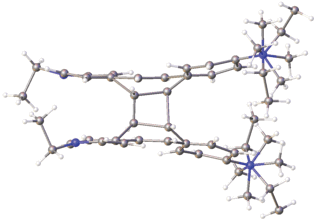
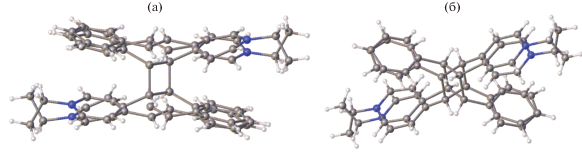
До сих пор мы рассматривали случаи образования центросимметрично связанных стопок этиленовых структурных единиц. Было упомянуто, что трансляционно связанные стопки реализуются в кристаллах довольно редко и что в таких стопках реакция ФЦП не может проходить без разрушения монокристаллов. Действительно, все исследованные стириловые соединения с такой организацией стопок оказываются устойчивыми к действию света. Также редко стопки организуются за счет действия осей второго порядка. Один такой случай наблюдался в кристаллах СК-4 [69] (рис. 21).
Заместитель бензольного кольца сильно неупорядочен. Введение в бензольное кольцо объемистого заместителя привело к невозможности осуществления способа а взаимного проектирования, а потому реализовался случай b (рис. 8). Строение “предорганизованного димера” СК-4 показано на рис. 22.
Рис. 22.
Строение предорганизованной пары катионов красителя СК-4 в двух проекциях; расстояния даны в Å.
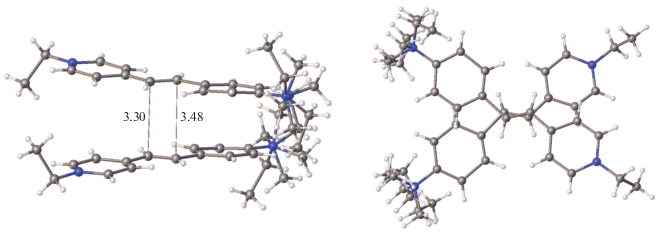
Этиленовые фрагменты “предорганизованного димера” почти параллельны, их взаимная скрученность составляет 24°. Отсутствие строгой параллельности этиленовых фрагментов не препятствует осуществлению ФЦП в монокристалле, которая прошла в кристалле на 34% и привела к получению иного изомера циклобутана (рис. 23).
6.1. Влияние природы аниона на осуществимость ФЦП стириловых красителей
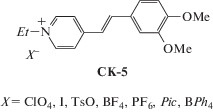
Влияние природы аниона на осуществимость реакции ФЦП в несольватированных монокристаллах исследовано для серии красителей СК-5 (рис. 24) [73].
Крупные органические анионы оказались малоподходящими для ФЦП из-за осуществления кристаллических мотивов СК-5, отличных от типов 1 и 2 (рис. 2). Для кристаллов СК-5 с ротационно или поступательно подвижными анионами ${\text{ClO}}_{4}^{ - }$, I–, ${\text{PF}}_{6}^{ - }$, ${\text{BF}}_{4}^{ - }$ установлен центросимметрично стопочный упаковочный мотив. Анионы ${\text{ClO}}_{4}^{ - }$, ${\text{PF}}_{6}^{ - }$ и ${\text{BF}}_{4}^{ - }$ обнаруживают ротационную неупорядоченность. Во всех этих соединениях реакция ФЦП идет. Однако только в кристаллах с анионом ${\text{BF}}_{4}^{ - }$ оказалось возможным протекание этой реакции с сохранением монокристалличности образца (рис. 25).
Рис. 25.
Структура красителя СК-5 (Х = BF4) (а) и циклобутана, образовавшегося из него в ходе ФЦП (б).
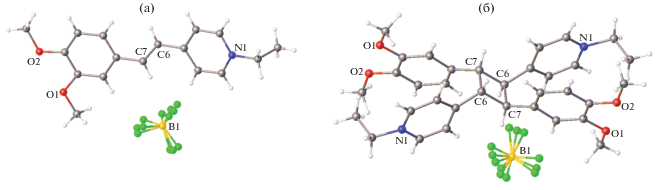
Анион ${\text{BF}}_{4}^{ - }$ в продукте реакции так же, как в исходном соединении, неупорядочен по трем положениям, однако соотношения заселенностей положений в исходном СК-5 и в фотопродукте разное – 0.5 : 0.3 : 0.2 и 0.6 : 0.2 : 0.2, что свидетельствует о ротационной динамике аниона в ходе ФЦП. Отметим, что в кристалле СК-5 с анионом ${\text{BF}}_{4}^{ - }$ подвижность только аниона оказалась достаточной для прохождения реакции с сохранением монокристалла; здесь не потребовалось включения в упаковку дополнительного строительного блока в виде сольватной молекулы.
Отметим, что реакция ФЦП СК-5 с анионом тетрафторбората оказалась самой быстрой среди исследованных реакций. Превращение исходного соединения в циклобутановый продукт становится заметным уже через 20 мин изучения кристалла под микроскопом по его стремительному обесцвечиванию – из ярко-желтого он быстро превращается в бесцветный. Полное превращение в продукт ФЦП произошло через 2 ч облучения.
7.1. Полиморфизм стириловых красителей и реакции ФЦП
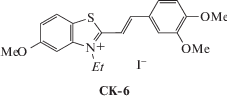
Изучение реакции ФЦП методом ЯМР 1Н-спектроскопии в поликристаллических пленках красителя СК-6 (рис. 26) показало отсутствие реакции ФЦП [77].
При кристаллизации этого соединения получены монокристаллы разного габитуса (а, б и в) с разной кристаллической ячейкой. В наибольшем количестве в кристаллах присутствует форма а и лишь небольшое количество представлено формами б и в. Вначале формируются кристаллы типа а в виде бесформенных пластинок и только при длительном стоянии в небольшом количестве получены хорошо ограненные кристаллы типа б и в.
Кристаллы типа а так же, как и поликристаллические пленки красителя СК-6, устойчивы к действию света, тогда как при облучении кристаллов б и в реакция ФЦП проходит полностью. Рентгеноструктурным анализом установлено, что во всех трех кристаллах сформированы центросимметрично связанные стопки, благоприятные для ФЦП. Расстояния d1 и d2 в них (3.54–3.75 и 4.61–4.68 Å) удовлетворяют правилу d1 < 4.2 Å < < d2. Однако в “предорганизованных димерах” кристаллов а этильные заместители ориентированы внутрь димера, тогда как в кристаллах б и в – наружу (рис. 27).
Таким образом, в красителе СК-6, как и в описанном выше красителе СК-3 с аналогичным катионом, препятствием для осуществления реакции ФЦП в “предорганизованном димере” явилась направленность этильных заместителей внутрь димера, препятствующая сближению этиленовых фрагментов формульных единиц димерной пары для осуществления реакции ФЦП.
Реакция ФЦП в кристаллах СК-6 (б и в) проходит как процесс монокристалл–монокристалл. Строение образовавшегося двухзарядного катиона такое же, как в фотопродукте из СК-3 (рис. 20).
Объяснением отсутствия ФЦП в поликристаллических пленках красителя СК-6 является наличие в них только кристаллической модификации а, которая формируется в ходе быстрой кристаллизации.
8.1. Влияние усиления π ··· π-стэкинг-взаимодействия на ФЦП
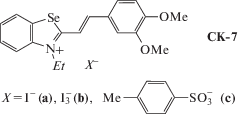
В красителях СК-7 (рис. 28), представляющих селеновые аналоги красителей СК-3 и СК-6, можно было ожидать появления новых эффектов, приводящих к новым особенностям кристаллических упаковок, например усилению π ··· π-стэкинг-взаимодействий или образованию вторичных связей I– ··· Se.
Кристаллизацией СК-7а из смесей разных растворителей получены три кристаллические формы – сокристаллизат с бензолом (СК-7a · 0.5C6H6), гидрохиноном (СК-7a · 0.5HQ), а также с этилацетатом и водой (СК-7a · 0.5AcOEt · 0.3H2O). Краситель СК-7b получен в бессольватной форме. Краситель СК-7с выделен в бессольватной форме и в виде сольвата с HQ и водой (СК-7с · · 0.5HQ · Н2О). Для всех полученных кристаллов проведены РСА и облучение исследованных образцов видимым светом [100].
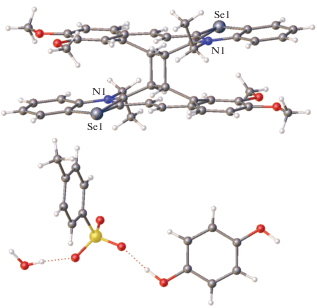
Для кристаллов СК-7с получены те же результаты, что и для серного аналога СК-3, т.е. реакция ФЦП протекает полностью с сохранением монокристалла и образованием продукта фотоциклоприсоединения. В кристаллах СК-7с · 0.5HQ · Н2О фотореакция протекает лишь на 25% (рис. 29).
Последующее облучение кристалла в течение месяца не привело к увеличению содержания циклобутановой компоненты, что обусловлено заторможенностью ротационной динамики группы ${\text{SO}}_{3}^{ - }$ тозилат-аниона вследствие его вовлеченности в водородные связи с сольватными молекулами HQ. Аналогичный эффект описан выше для красителя СК-3 · 0.5HQ · H2O.
Интересно, что реакция ФЦП, по-видимому, проходит и в кристаллах СК-7a · 0.5AcOEt · · 0.3H2O. В них выполняется правило d1 < 4.2 Å < < d2, а в “предорганизованном димере” этильные заместители ориентированы наружу. Однако одновременно с реакцией ФЦП идет разрушение монокристаллов вследствие улетучивания сольватного этилацетата. В результате получается рентгеноаморфный порошок. Согласно данным ЯМР 1Н-спектроскопии этот порошок представляет циклобутановый продукт.
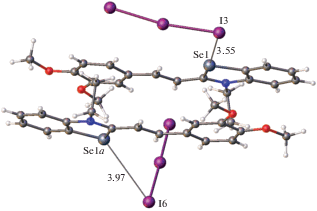
Кристаллы СК-7b оказались устойчивыми к облучению, хотя и в них выполняются условия, необходимые для протекания ФЦП. Это обусловлено возникновением вторичных связей атомов селена с атомами иода (рис. 30).
По-видимому, участие атома селена в этом взаимодействии фиксирует его положение в кристалле, препятствуя сдвигу внутрь димера, необходимому в ходе осуществления реакции ФЦП.
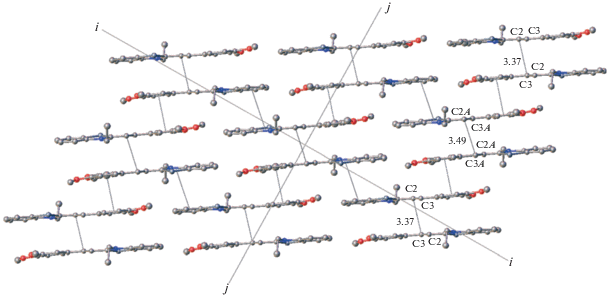
В кристаллах СК-7a · 0.5C6H6 и СК-7a · 0.5HQ обнаружен один и тот же упаковочный мотив, отличный от канонических структур 1–6 (рис. 2) и вообще не характерный для плоских сопряженных систем. На рис. 31 показан фрагмент такой кристаллической упаковки для кристаллов СК-7a · · 0.5C6H6.
В этой упаковке отсутствуют изолированные стопки: каждая структурная единица имеет π ··· π-перекрывание с соседними структурными единицами в стопках, развивающихся как вдоль направления ii, так и вдоль направления jj. Таким образом, в кристалле создается очень плотная упаковка. И хотя расстояния d1 в этих структурах очень короткие (3.36–3.50 Å), в стопках, развивающихся вдоль направления jj, участие структурных единиц в сильных π ··· π-взаимодействиях с соседними структурными единицами, развивающимися вдоль направления ii, препятствует осуществлению ФЦП.
Таким образом, включение селена в состав стирил-гетероцикла может приводить к неожиданным кристаллическим упаковкам, ранее не наблюдавшимся в плоских сопряженных системах.
9.1. Увеличение вероятности формирования в кристаллах стирил-гетероциклов благоприятных упаковок
Выше было упомянуто, что в кристаллах СГ может осуществляться четыре типа упаковочных мотивов (3–6 на рис. 2) и только в двух из них (3 и 4) может существовать благоприятная для ФЦП димерная пара.
Задача увеличения вероятности формирования в СГ упаковок, благоприятных для ФЦП, решается двумя способами: (а) модификацией молекул, при которой расширяется область π-сопряжения, что увеличивает вероятность формирования в процессе кристаллизации ассоциатов со стэкинг-взаимодействиями, т.е. стопок (упаковки 1 или 2) или димеров (упаковки 3 или 4); (б) протонированием молекул по атому азота, т.е. превращением нейтральных молекул СГ в электронные аналоги СК, для которых можно ожидать формирования кристаллических упаковок, аналогичных упаковкам, типичным для СК (упаковки 1 или 2).
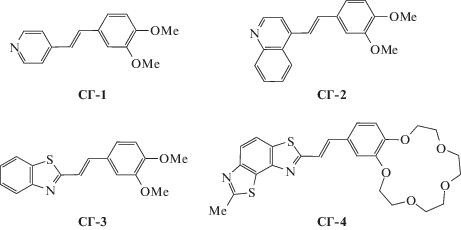
В серии соединений СГ-1–СГ-4 (рис. 32) с последовательно расширяющейся областью сопряжения усиливается тенденция к формированию стэкинговых элементов упаковки [83].
В кристалле СГ-1 существует паркетная упаковка (упаковка 6 на рис. 2), исключающая осуществление реакции ФЦП. Соединение СГ-2 с более обширной областью сопряжения кристаллизуется с паркетно-димерной упаковкой (упаковка 3 на рис. 2), благоприятной для ФЦП (рис. 33).
При облучении монокристалла СГ-2 через 6 ч фотореакция проходит на 70%, а через 30 ч она полностью завершается (рис. 34) [67].
Аналогичное поведение продемонстрировала пара соединений СГ-3 и СГ-4. Если кристаллы СГ-3 дали паркетную упаковку молекул, не подходящую для ФЦП, то СГ-4 закристаллизовался с паркетно-димерной упаковкой, где расстояние d в центросимметричных димерных парах равно 3.80 Å, что благоприятно для ФЦП [83].
Таким образом, путем расширения области сопряжения в плоских молекулах СГ можно увеличить вероятность формирования в кристалле упаковочных мотивов, благоприятных для ФЦП.
Для серии 4-стирил-пиридинов были получены протонированные формы НСГ+Х– (X = ClO4) (рис. 35) [84]. Внешняя форма и электронное строение НСГ+Х– и соответствующих им СК подобны, поэтому ожидалось подобие их кристаллических упаковок, т.е. преимущественное формирование первыми стопочных упаковочных мотивов.
Рис. 35.
Структурные формулы протонированных стирилгетероциклов НСГ+${\text{ClO}}_{4}^{ - }$ (R = H, OMe, SMe, NMe2, Cl, NO2; n = 1, 2).
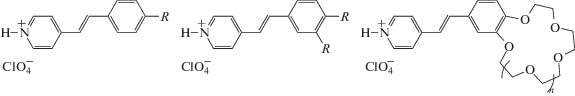
Предварительные исследования методом спектроскопии ЯМР 1H поликристаллических пленок НСГ+Х– после их облучения показали, что примерно половина исследованных образцов вступает в реакцию ФЦП, причем заметно медленнее, чем родственные СК.
В кристаллических упаковках НСГ+Х– в основном формируются стопочные архитектуры, сходные с архитектурами родственных СК. Многие из них, особенно центросимметрично связанные, благоприятны для твердофазной реакции ФЦП. Однако в отличие от СК в протонированных СГ столь же часто формируются трансляционно связанные стопочные архитектуры, при которых реакция ФЦП в кристалле невозможна. Это отличает протонированные СГ как от нейтральных СГ (упаковки 3–6 на рис. 2), так и от соответствующих СК, для которых преобладают центросимметрично связанные стопки (упаковки 1 и 2 на рис. 2) с укладкой молекул по типу “голова-к-хвосту”. Такое отличие обусловлено образованием водородных связей между фрагментом N+–H молекулярного катиона и анионом перхлората. Появление в кристаллической упаковке водородных связей также повышает общую “жесткость” структуры и приводит к замедлению реакции ФЦП в ней.
Несмотря на указанное повышение “жесткости” структур НСГ+Х–, практически во всех кристаллах с центросимметрично связанной стопочной упаковкой реакция ФЦП происходит. Однако этот процесс в НСГ+Х– чаще, чем в аналогичных красителях, завершается их разрушением вследствие невыполнения условия d1 ≤ 4.2 Å ≤ d2.
Предложенный подход в рамках кристаллического дизайна заданных упаковок СГ оказался правильным. Хотя СГ и их протонированные формы являются несколько менее благоприятными объектами для изучения твердотельной реакции ФЦП в монокристаллах, чем СК, они перспективны, поскольку позволяют существенно расширить круг изучаемых объектов за счет использования СГ в качестве лигандов в координационных соединениях [94–98].
10.1. “Педальная” неупорядоченность этиленовых соединений и ее влияние на ФЦП
В большинстве структур НСГ+Х– и несколько реже в структурах СК и СГ обнаружена так называемая “педальная” неупорядоченность азастильбеновых фрагментов, соответствующая их повороту на 180° вокруг длинной оси. Эта неупорядоченность является следствием динамического процесса твердофазной “педальной” изомеризации в кристалле, когда этиленовый фрагмент прокручивается вокруг своих одинарных связей, а ароматические заместители испытывают лишь незначительные смещения в собственных плоскостях [101–103].
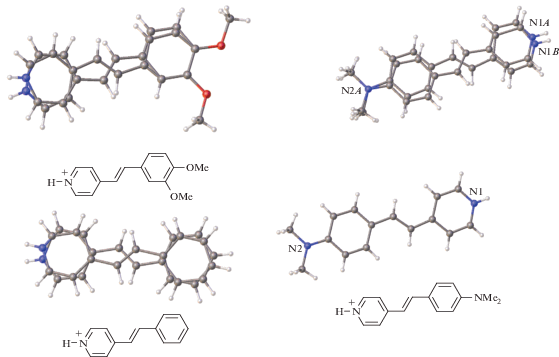
В РСА “педальная” изомеризация проявляется в виде неупорядоченности структуры [68, 84] (рис. 36). Особенно интересный случай представлен справа (протонированный стирилпиридин с заместителем NMe2) [84]. В кристалле имеются две кристаллографически независимые структурные единицы, только одна из которых подвержена “педальной” изомеризации. Их окружение в кристалле качественно одинаково. Это означает, что небольшое различие кристаллического поля вокруг этих двух катионов приводит к тому, что один из катионов проявляет динамическое поведение, а второй нет.
Рис. 36.
Примеры структур протонированных СГ с “педальной” неупорядоченностью; анионом во всех случаях является ${\text{ClO}}_{4}^{ - }$.
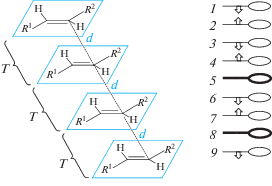
Динамический процесс “педальной” изомеризации неизбежно ведет к понижению вероятности протекания реакции ФЦП, т.е. к ее замедлению. Действительно, при осуществлении температурно зависимой “педальной” изомеризации в кристалле в каждый момент времени можно выделить четыре варианта взаимного расположения молекул в димерных парах (рис. 37).
Только два из них (a и b на рис. 37) удовлетворяют условию начала реакции, так как содержат антипараллельно ориентированные этиленовые фрагменты, тогда как в двух других вариантах (c и d) взаимное расположение этих фрагментов является скрещенным.
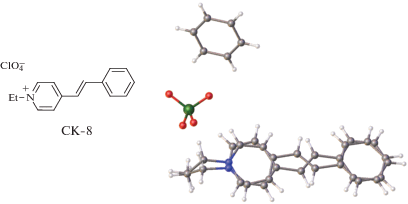
Отметим, что “педальная” изомеризация наблюдается не только в СГ и их протонированных формах, но и в других этиленовых соединениях, в частности в СК. Для СК 4-пиридинового ряда, несущего этильный заместитель при атоме азота (СК-8, рис. 38) и обнаруживающего соотношение “педальных” изомеров 0.7 : 0.3, был проведен мониторинг протекания реакции ФЦП, т.е. исследование продукта реакции после 5 и 20 ч облучения кристалла [69].
Через 5 ч облучения СК-8 получена неупорядоченная структура (рис. 39 слева), в которой сосуществуют как обе исходные “педальные” компоненты, так и циклобутан в соотношении 0.4 : : 0.3 : 0.3; наибольший вклад имеет циклобутановый компонент, причем тот, который получен из мажорного “педального” компонента. Через 20 ч реакция ФЦП полностью завершается, давая продукт, показанный на рис. 39 справа в виде двух “изомеров” циклобутана.
При облучении видимым светом в кристалле, помимо ФЦП, идет второй динамический процесс – “педальная” изомеризация. Поскольку вероятность осуществления в “предорганизованном димере” вариантов взаимного расположения структурных единиц, благоприятных для ФЦП (a и b на рис. 37), выше для мажорного компонента, чем для минорного, вначале начинает реагировать почти исключительно мажорный компонент.
Соотношение неупорядоченных компонентов циклобутана отлично от соотношения мажорного и минорного компонентов исходного СК-8 и составляет 0.8 : 0.2. Через 5 ч облучения, когда соотношение исходных “педальных” изомеров сравнялось, на дальнейшее протекание процесса ФЦП стал заметно влиять процесс “педальной” изомеризации. Только часть изначально минорного компонента СК-8 перешла в минорный “изомер” циклобутана. Остальная часть под влиянием “педальной” изомеризации перешла в изначально мажорный “педальный” компонент СК-8, тем самым повысив вероятность образования из него мажорного “изомера” циклобутана. В результате последнего стало больше, чем было мажорного компонента в исходной смеси “педальных” изомеров.
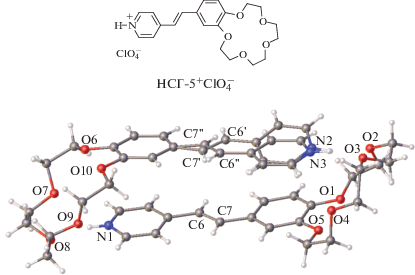
В кристалле протонированного 15-краун-5-содержащего НСГ-5+${\text{С lO}}_{4}^{ - }$ [84] существуют две кристаллографически независимые формульные единицы, образующие псевдоцентросимметричный димер (рис. 40), в котором только один из катионов обнаруживает “педальную” неупорядоченность с соотношением “педальных” изомеров 0.53 : 0.47, а вторая молекула находится в более “жестком” кристаллическом окружении, не допускающем “педальной” изомеризации.
Рис. 40.
Структура димерной пары в НСГ-5+${\text{ClO}}_{4}^{ - }$; расстояния С6…С7'' и C7…C6'' составляют 3.62 и 3.43 Å соответственно.
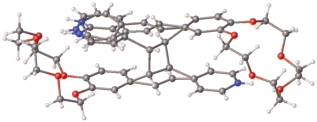
Интересно, что почти параллельное расположение этиленовых фрагментов имеют “нижний” катион и минорный “педальный” компонент верхнего катиона, что должно привести к существенному замедлению реакции ФЦП. Действительно, в течение девяти дней облучения никаких изменений в исходном кристалле не наблюдается. Однако на десятый день ярко-желтый кристалл существенно изменил окраску, став бледно-желтым, что указывало на протекание в нем реакции ФЦП. Рентгеноструктурное исследование установило строение образовавшегося продукта (рис. 41).
Рис. 41.
Строение продукта ФЦП в НСГ-5+${\text{ClO}}_{4}^{ - }$ после 10 дней облучения видимым светом.
В сильно неупорядоченной структуре сосуществуют исходный катион НСГ-5+ в виде обоих “педальных” изомеров и фотопродукт.
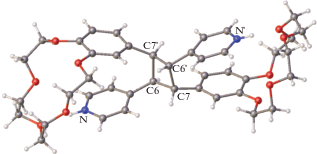
Облучение этого кристалла было продолжено, и на следующий день он полностью обесцветился. С помощью РСА установлено, что реакция ФЦП в этом соединении полностью завершилась (рис. 42).
Рис. 42.
Строение продукта реакции ФЦП в НСГ-5+${\text{ClO}}_{4}^{ - }$ после 11-дневного облучения видимым светом.
Этот факт еще раз подтверждает динамический характер “педальной” неупорядоченности, в результате чего доля расходующегося в ходе ФЦП минорного компонента исходного соединения постоянно восполняется за счет “педальной” изомеризации.
Таким образом, “педальная” изомеризация замедляет процесс ФЦП, но в отдельных случаях делает возможным его полное осуществление. Кроме того, можно ожидать, что педальная изомеризация сделает возможным осуществление ФЦП в стопках, организованных через оси 2 в случае а (рис. 8), когда этиленовые фрагменты димера находятся в скрещенной взаимной ориентации. Однако таких примеров пока не обнаружено.
11.1. Осуществимость в кристалле реакции ретро-ФЦП
Попытка осуществить в кристалле реакцию ретро-ФЦП предпринята для описанных выше красителей CК-3 [99] и СК-5 (анион ${\text{BF}}_{4}^{ - }$, рис. 24 [73]), для которых установлена высокая скорость прямой реакции ФЦП. Для красителя СК-5 реакция ФЦП сопровождается большим цветовым контрастом исходного соединения и образовавшегося продукта, что позволяет визуально отслеживать протекание обеих реакций.
Монокристалл каждого из циклобутановых продуктов (желто-оранжевый в случае циклобутана из CК-3 и бесцветный в случае циклобутана из СК-5) облучался нефильтрованным УФ-излучением от ртутно-ксеноновой лампы. Спектр этого излучения включал как длинноволновую компоненту, индуцирующую прямую реакцию ФЦП, так и коротковолновую, которая должна индуцировать обратную реакцию – ретро-ФЦП. Поэтому в качестве продукта реакции ретро-ФЦП в каждом из этих случаев ожидалась неупорядоченная структура, содержащая как циклобутановую компоненту, так и исходный краситель аналогично описанным ранее случаям неполного превращения исходного соединения в циклобутановое производное, показанным на рис. 23, 29 и 34. Более того, не следовало ожидать существенного вклада компоненты исходного красителя в общую неупорядоченную структуру, поскольку на коротковолновую область спектра УФ-лампы приходилось только 10% ее мощности. Однако представлялось важным решение вопроса о принципиальной возможности осуществления обеих реакций, как ФЦП, так и ретро-ФЦП, в одном и том же монокристалле.
Существование неупорядоченной системы, включающей в себя как циклобутановый продукт, так и исходный краситель, установлено для УФ-облученного кристалла циклобутана из красителя CК-3 (рис. 43).
Хотя соотношение вклада циклобутана и исходного красителя составило всего лишь 0.93 : 0.07, осуществление реакции ретро-ФЦП установлено надежно.
После 4 ч УФ-облучения кристалла из красителя СК-5 он приобрел желтую окраску исходного соединения. После этого кристалл вновь установили на дифрактометр и провели новый рентгеновский эксперимент. Результат оказался неожиданным (рис. 44).
Полученная картина напоминает изображенную на рис. 39 для двух ориентаций циклобутана из красителя СК-8, соответствующих “педальным” изомерам СК-8. Однако УФ-облучению подвергался кристалл, содержащий единственный “изомер” циклобутана, полученный при облучении видимым светом красителя СК-5, не проявляющего “педальной” изомеризации. В рассматриваемом случае переход одного “изомера” циклобутана в другой невозможен без разрыва двух σ-связей. Следовательно, реакция ретро-ФЦП здесь действительно осуществляется, причем как процесс монокристалл–монокристалл. Отметим, что соотношение “изомеров” циклобутана в этом случае составляет 0.9 : 0.1. По-видимому, при осуществлении обратной реакции меняется кристаллическое окружение структурных единиц, что приводит к появлению возможности “педальной” динамики во вновь образовавшихся структурных единицах СК-5. В свою очередь, получившиеся “педальные” изомеры под влиянием видимой компоненты излучения переходят в два “изомера” циклобутана. На изменение кристаллического окружения структурных единиц в ходе обеих реакций указывают два обстоятельства. Во-первых, в ходе реакций ФЦП и ретро-ФЦП изменение параметров элементарной ячейки достигает 7%. Во-вторых, соотношение ротамеров неупорядоченного аниона ${\text{BF}}_{4}^{ - }$ существенно меняется: 0.5 : 0.3 : 0.2 в красителе, 0.6 : 0.2 : 0.2 в циклобутане, 0.4 : 0.4 : 0.2 после УФ-облучения.
Следовательно, и в данном случае обе реакции – “туда” и “обратно” – могут осуществляться как процесс монокристалл–монокристалл.
ЗАКЛЮЧЕНИЕ
В результате исследования разработано кристаллохимическое описание топохимической реакции [2 + 2]-фотоциклоприсоединения плоских непредельных соединений, установлены причины отсутствия такой реакции для отдельных упаковочных мотивов и условия осуществления реакции без разрушения монокристалла. Предложены подходы для получения кристаллов с нужными упаковочными мотивами путем структурной модификации молекул непредельных соединений, сокристаллизации их с малыми сольватными молекулами, вариации природы аниона, а также доказана возможность осуществления как прямой, так и обратной фотохимических реакций в одном монокристалле.
Работа выполнена при финансовой поддержке Федерального агентства научных организаций (соглашение № 007-ГЗ/Ч3363/26).
Список литературы
Schmidt G.M.J. // Pure Appl. Chem. 1971. V. 27. P. 647.
Ramamurthy V., Venkatesan K. // Chem. Rev. 1987. V. 87. P. 433.
MacGillivray L.R. // Cryst. Eng. Commun. 2002. V. 4. P. 37.
Theocharis C.R., Jones W. // Organic Solid State Chemistry / Ed. Desiraju G.R. Amsterdam: Elsevier, 1987. P. 47.
Turowska-Tyrk I. // J. Phys. Org. Chem. 2004. V. 17. P. 837.
Huang C.-H., Bassani D.M. // Eur. J. Org. Chem. 2005. P. 4041.
Friščić T., MacGillivray L.R. // Supramol. Chem. 2005. V. 17. P. 47.
Nagarathinam M., Vittal J.J. // Macromol. Rapid Commun. 2006. V. 27. P. 1091.
Svoboda J., König B. // Chem. Rev. 2006. V. 106. P. 5413.
Bučar D.-K., Papaefstathiou G.S., Hamilton T.D. et al. // Eur. J. Inorg. Chem. 2007. P. 4559.
Громов С.П. // Изв. РАН. Сер. хим. 2008. № 7. С. 1299.
Hoffmann N. // Chem. Rev. 2008. V. 108. P. 1052.
MacGillivray L.R. // J. Org. Chem. 2008. V. 73. P. 3311.
MacGillivray L.R., Papaefstathiou G.S., Friščić T. et al. // Acc. Chem. Res. 2008. V. 41. P. 280.
Howard J.A.K., Mahon M.F., Raithby P.R. et al. // Acta Cryst. B. 2009. V. 65. P. 230.
Briceño A., Hill Y., González T. et al. // Dalton Trans. 2009. P. 1602.
Yamada S., Tokugawa Y. // J. Am. Chem. Soc. 2009. V. 131. P. 2098.
Chung J.W., You Y., Huh H.S. et al. // J. Am. Chem. Soc. 2009. V. 131. P. 8163.
Mir M.H., Koh L.L., Tan G.K. et al. // Angew. Chem. Int. Ed. 2010. V. 49. P. 390.
Liu D., Ren Z.-G., Li H.-X. et al. // Angew. Chem. Int. Ed. 2010. V. 49. P. 4767.
Elacqua E., MacGillivray L.R. // Eur. J. Org. Chem. 2010. P. 6883.
Bhogala B.R., Captain B., Parthasarathy A. et al. // J. Am. Chem. Soc. 2010. V. 132. P. 13434.
Clément S., Meyer F., De Winter J. et al. // J. Org. Chem. 2010. V. 75. P. 1561.
Linares M., Briceño A. // New J. Chem. 2010. V. 34. P. 587.
Овчинникова И.Г., Никулов Д.К., Барташевич Е.В. и др. // Изв. РАН. Сер. хим. 2011. № 5. С. 805.
Kole G.K., Tan G.K., Vittal J.J. // J. Org. Chem. 2011. V. 76. P. 7860.
Sonoda Y. // Molecules. 2011. V. 16. P. 119.
Bučar D.-K., Sen A., Mariappan S.V.S. et al. // Chem. Commun. 2012. V. 48. P. 1790.
Elacqua E., Kaushik P., Groeneman R.H. et al. // Angew. Chem. Int. Ed. 2012. V. 51. P. 1037.
Овчинникова И.Г., Никулов Д.К., Барташевич Е.В. и др. // Изв. РАН. Сер. хим. 2013. № 8. С. 1739.
Santra R., Garai M., Mondal D. et al. // Chem. Eur. J. 2013. V. 19. P. 489.
Bibal B., Mongin C., Bassani D.M. // Chem. Soc. Rev. 2014. V. 43. P. 4179.
Ramamurthy V., Mondal B. // J. Photochem. Photobiol. C: Photochem. Rev. 2015. V. 23. P. 68.
Ramamurthy V., Sivaguru J. // Chem. Rev. 2016. V. 116. P. 9914.
Bach T., Hehn J.P. // Angew. Chem. Int. Ed. 2011. V. 50. P. 1000.
Громов С.П. // Российские нанотехнологии. 2006. Т. 1. № 1. С. 29.
Громов С.П., Ушаков Е.Н., Ведерников А.И. и др. // Теорет. и эксперим. химия. 2009. Т. 45. С. 1.
Громов С.П. // Обзорный журнал по химии. 2011. Т. 1. С. 3.
Громов С.П., Лобова Н.А., Ведерников А.И. и др. // Изв. РАН. Сер. хим. 2009. № 6. С. 1179.
Ведерников А.И., Сазонов С.К., Кузьмина Л.Г. и др. // Изв. РАН. Сер. хим. 2009. № 9. С. 1893.
Громов С.П., Ведерников А.И., Сазонов С.К. и др. // Патент РФ № 2383571; Бюл. изобр. 2010. № 7.
Gromov S.P., Vedernikov A.I., Kuz’mina L.G. et al. // Eur. J. Org. Chem. 2010. P. 2587.
Pemberton B.C., Ugrinov A., Sivaguru J. // J. Photochem. Photobiol. A. 2013. V. 255. P. 10.
Asahara H., Iwamoto T., Kida T. et al. // Tetrahedron Lett. 2013. V. 54. P. 688.
Vallavoju N., Sivaguru J. // Chem. Soc. Rev. 2014. V. 43. P. 4084.
Ушаков Е.Н., Громов С.П. // Успехи химии. 2015. Т. 84. С. 787.
Petrov N.Kh., Ivanov D.A., Shandarov Yu.A. et al. // Chem. Phys. Lett. 2017. V. 673. P. 99.
Aldoshin S.M., Alfimov M.V., Atovmyan L.O. et al. // Mol. Cryst. Liq. Cryst. 1984. V. 108. P. 1.
Groom C.R., Bruno I.J., Lightfoot M.P. et al. // Acta Cryst. B. 2016. V. 72. P. 171.
Janiak C. // J. Chem. Soc. Dalton Trans. 2000. P. 3885.
Ведерников А.И., Басок С.С., Громов С.П. и др. // Журн. орган. химии. 2005. Т. 41. С. 864.
Кузьмина Л.Г., Чураков А.В., Ховард Дж.А.К. и др. // Кристаллография. 2005. Т. 50. № 2. С. 266.
Gromov S.P., Vedernikov A.I., Ushakov E.N. et al. // New J. Chem. 2005. V. 29. P. 881.
Kuz’mina L.G., Vedernikov A.I., Lobova N.A. et al. // New J. Chem. 2006. V. 30. P. 458.
Vedernikov A.I., Kuz’mina L.G., Lobova N.A. et al. // Mendeleev Commun. 2007. V. 17. P. 151.
Громов С.П., Ведерников А.И., Кузьмина Л.Г. и др. // Изв. РАН. Сер. хим. 2009. № 1. С. 108.
Gromov S.P., Vedernikov A.I., Lobova N.A. et al. // New J. Chem. 2011. V. 35. P. 724.
Vedernikov A.I., Ushakov E.N., Efremova A.A. et al. // J. Org. Chem. 2011. V. 76. P. 6768.
Громов С.П., Федорова О.А., Алфимов М.В. и др. // Докл. АН СССР. 1991. Т. 319. С. 1141.
Ткачев В.В., Атовмян Л.О., Громов С.П. и др. // Журн. структур. химии. 1992. Т. 33. С. 126.
Alfimov M.V., Churakov A.V., Fedorov Yu.V. et al. // J. Chem. Soc., Perkin Trans. 2. 1997. P. 2249.
Alfimov M.V., Gromov S.P., Fedorov Yu.V. et al. // J. Am. Chem. Soc. 1999. V. 121. P. 4992.
Fedorova O.A., Fedorov Yu.V., Vedernikov A.I. et al. // New J. Chem. 2002. V. 26. P. 543.
Кузьмина Л.Г., Чураков А.В., Ховард Дж.А.К. и др. // Кристаллография. 2003. Т. 48. № 4. С. 664.
Ведерников А.И., Громов С.П., Лобова Н.А. и др. // Изв. РАН. Сер. хим. 2005. № 8. С. 1896.
Громов С.П., Ведерников А.И., Лобова Н.А. и др. // Патент РФ № 2278134; Бюл. изобр. 2006. № 17.
Kuz’mina L.G., Vedernikov A.I., Lobova N.A. et al. // New J. Chem. 2007. V. 31. P. 980.
Ведерников А.И., Кузьмина Л.Г., Сазонов С.К. и др. // Изв. РАН. Сер. хим. 2007. № 9. С. 1797.
Кузьмина Л.Г., Ведерников А.И., Сазонов С.К. и др. // Кристаллография. 2008. Т. 53. № 4. С. 460.
Кузьмина Л.Г., Ведерников А.И., Ховард Дж.А.К. и др. // Российские нанотехнологии. 2008. Т. 3. № 7–8. С. 32.
Avakyan V.G., Kondratuk D.V., Vedernikov A.I. et al. // J. Mol. Struct. 2009. V. 935. P. 136.
Gromov S.P., Dmitrieva S.N., Vedernikov A.I. et al. // J. Org. Chem. 2013. V. 78. P. 9834.
Kuz’mina L.G., Vedernikov A.I., Churakov A.V. et al. // Cryst. Eng. Commun. 2014. V. 16. P. 5364.
Кузьмина Л.Г., Ведерников А.И., Ховард Дж.А.К. и др. // Журн. структур. химии. 2014. Т. 55. Приложение № 2. С. 308.
Gromov S.P., Vedernikov A.I., Lobova N.A. et al. // J. Org. Chem. 2014. V. 79. P. 11416.
Ушаков Е.Н., Ведерников А.И., Сазонов С.К. и др. // Изв. РАН. Cер. хим. 2015. № 3. С. 562.
Kuz’mina L.G., Vedernikov A.I., Howard J.A.K. et al. // Cryst. Eng. Commun. 2015. V. 17. P. 4584.
Fedorov Yu.V., Fedorova O.A., Andryukhina E.N. et al. // New J. Chem. 2003. V. 27. P. 280.
Андрюхина Е.Н., Машура М.М., Федорова О.А. и др. // Изв. РАН. Сер. хим. 2005. № 7. С. 1650.
Федоров Ю.В., Федорова О.А., Шепель Н.Э. и др. // Изв. РАН. Сер. хим. 2005. № 9. С. 2056.
Fedorov Yu.V., Fedorova O.A., Andryukhina E.N. et al. // J. Phys. Org. Chem. 2005. V. 18. P. 1032.
Кузьмина Л.Г., Федорова О.А., Андрюхина Е.Н. и др. // Кристаллография. 2006. Т. 51. № 2. С. 299.
Кузьмина Л.Г., Ведерников А.И., Лобова Н.А. и др. // Изв. РАН. Сер. хим. 2009. № 6. С. 1161.
Кузьмина Л.Г., Ведерников А.И., Сазонов С.К. и др. // Изв. РАН. Сер. хим. 2011. № 8. С. 1708.
Кузьмина Л.Г., Ситин А.Г., Гулакова Е.Н. и др. // Кристаллография. 2011. Т. 56. № 4. С. 656.
Федоров Ю.В., Черникова Е.Ю., Перегудов А.С. и др. // Изв. РАН. Сер. хим. 2011. № 2. С. 274.
Гулакова Е.Н., Ситин А.Г., Кузьмина Л.Г. и др. // Журн. орган. химии. 2011. Т. 47. С. 253.
Кузьмина Л.Г., Ситин А.Г., Гулакова Е.Н. и др. // Кристаллография. 2012. Т. 57. № 1. С. 91.
Громов С.П., Сергеев С.А., Дружинин С.И. и др. // Изв. РАН. Сер. хим. 1999. № 3. С. 530.
Gromov S.P., Vedernikov A.I., Ushakov E.N. et al. // Helv. Chim. Acta. 2002. V. 85. P. 60.
Ушаков Е.Н., Громов С.П., Кузьмина Л.Г. и др. // Изв. РАН. Сер. хим. 2004. № 7. С. 1491.
Ушаков Е.Н., Кузьмина Л.Г., Ведерников А.И. и др. // Изв. РАН. Сер. хим. 2006. № 1. С. 90.
Vedernikov A.I., Ushakov E.N., Kuz’mina L.G. et al. // J. Phys. Org. Chem. 2010. V. 23. P. 195.
Sinnwell M.A., Baltrusaitis J., MacGillivray L.R. // Cryst. Growth Des. 2015. V. 15. P. 538.
Santra R., Biradha K. // Cryst. Growth Des. 2010. V. 10. P. 3315.
Kole G.K., Tan G.K., Vittal J.J. // Cryst. Growth Des. 2012. V. 12. P. 326.
Kole G.K., Medishetty R., Koh L.L. et al. // Chem. Commun. 2013. V. 49. P. 6298.
Liu D., Lang J.-P., Abrahams B.F. // Chem. Commun. 2013. V. 49. P. 2682.
Кузьмина Л.Г., Ведерников А.И., Лермонтова Э.Х. и др. // Изв. РАН. Сер. хим. 2013. № 8. С. 1726.
Kuz’mina L.G., Vedernikov A.I., Howard J.A.K. et al. // Cryst. Eng. Commun. 2016. V. 18. P. 7506.
Harada J., Ogawa K. // J. Am. Chem. Soc. 2004. V. 126. P. 3539.
Harada J., Ogawa K. // Chem. Soc. Rev. 2009. V. 38. P. 2244.
Vande Velde C.M.L., Zeller M., Azov V.A. // Cryst. Eng. Commun. 2015. V. 17. P. 5751.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография