Кристаллография, 2019, T. 64, № 5, стр. 781-789
Электронная микроскопия поверхности дентальных имплантатов и наноразмерных металлсодержащих частиц, полученных в составе супернатантов
О. М. Жигалина 1, 2, *, Д. Н. Хмеленин 1, В. В. Лабис 3, Э. А. Базикян 3, С. В. Сизова 4, С. В. Хайдуков 4, В. Е. Асадчиков 1, А. В. Бузмаков 1, Ю. С. Кривоносов 1, Д. А. Золотов 1, И. Г. Козлов 5
1 Институт кристаллографии им. А.В. Шубникова РАН ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Московский государственный технический университет им. Н.Э. Баумана
Москва, Россия
3 Московский государственный медико-стоматологический университет им. А.И. Евдокимова
Москва, Россия
4 Институт биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН
Москва, Россия
5 ФНКЦ детской гематологии, онкологии и иммунологии им. Д. Рогачева Минздрава России
Москва, Россия
* E-mail: zhigal@crys.ras.ru
Поступила в редакцию 07.02.2019
После доработки 11.02.2019
Принята к публикации 25.02.2019
Аннотация
Проведено исследование поверхности двух систем дентальных имплантатов “Nobel Biocare” и “Alpha BiO”, а также наноразмерных металлсодержащих частиц, выделенных из тканей, окружающих дентальные имплантаты. Структуру поверхности имплантатов, элементный и фазовый состав частиц и их расположение в грануляционной ткани изучали методами рентгеновской томографии, просвечивающей и растровой электронной микроскопии, просвечивающей растровой микроскопии с z-контрастом, электронной дифракции и энергодисперсионного картирования с помощью микроскопов Quanta 200-3D, FEI Тechnai Osiris при ускоряющем напряжении 200 кВ и рентгеновского микротомографа “ТОМАС”. Анализ рельефа свидетельствует о том, что эмиссия наноразмерных частиц с поверхности имплантата “Alpha BiO” в прилегающие ткани более вероятна, чем с поверхности имплантата “Nobel Biocare”. Установлено, что частицы микронных и субмикронных размеров имплантатов “Nobel Biocare” представляют собой в основном диоксид титана обеих модификаций – рутил и анатаз, а в случае имплантатов “Alpha BiO” – помимо диоксида титана и нитрида титана присутствуют оксиды алюминия. Элементный состав наноразмерных частиц более разнообразен, встречаются такие элементы, как Fe, Ca, Na, Cl, S, Si, P и др. Выявлено, что микробная контаминация не всегда играет ведущую роль при возникновении срыва достигнутой ранее остеоинтеграции.
ВВЕДЕНИЕ
Возникновение воспалительных осложнений при долгосрочном периоде функционирования дентальных имплантатов (ДИ) связывают с развитием таких патологических состояний, как мукозит и периимплантит. Патогенез данных осложнений остается неизученным с точки зрения роли иммунологической составляющей в механизме развития острого и хронического воспаления, что требует исследований, направленных на выявление истинных, биологически обоснованных причин. При наличии стандартизованных технологий изготовления ДИ при практическом применении наблюдается персонифицированная клиническая картина их долгосрочного использования, что может проявляться неравномерной убылью костной ткани и требовать хирургических ревизий с проведением направленной костной регенерации и последующей реимплантации. Основные причины данных осложнений соотносят с бактериальным микроокружением, образующим биопленку на поверхности ДИ, неадекватным распределением функциональной нагрузки при изготовлении и использовании ортопедической конструкции, а также недостатком прикрепленной слизистой оболочки в области шеек ДИ и другими причинами [1–3].
Роль эмиссии наноразмерных металлических частиц, расположенных в оксидном слое ДИ, изготовленных из сплавов на основе титана, и их участие в долгосрочном межтканевом взаимодействии до сих пор практически не были изучены. Данный факт делает необходимым проведение исследований по изучению иммунологического аспекта тканевой репарации как на клеточном, так и на молекулярном уровнях, учитывая роль наноразмерных металлических частиц. При этом возникает новый взгляд на интерпретацию персонификации долгосрочного результата дентальной имплантации, что может стать обоснованием неравномерной убыли костной ткани. Накопление наноразмерных металлических частиц в тканях вызывает асептическое воспаление в костном ложе, связанное с неспособностью макрофагального звена иммунной системы к их адекватной утилизации, и делает возможным вторичное проникновение бактерий в зону периимплантатного ложа и, как следствие, возникновение бактериального инфицирования [4–7]. В связи с этим весьма актуальны изучение характера наноразмерных частиц, полученных при обработке поверхностей используемых сплавов титана, сравнительная характеристика систем ДИ, а также понимание персонификации в вероятности развития мукозитов и периимплантитов.
Целью настоящего исследования явилось изучение морфологии поверхности двух систем ДИ, а также характеризация наноразмерных металлических частиц, полученных с поверхности ДИ “Nobel Biocare” и “Alpha BiO” в растворе в лабораторных условиях.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Для приготовления супернатантов каждый ДИ помещали в пробирку с бидистиллированной водой. Инкубацию образцов проводили в течение пяти дней в CO2-инкубаторе при температуре 37.2°С. Пробирки с супернатантами, содержащими объекты исследования, подвергали ультразвуковому воздействию с рабочей частотой 35 кГц в течение нескольких минут с целью имитации механического воздействия на имплантат в процессе его использования. Более подробно методика получения частиц в составе супернатантов изложена в [4]. Приготовленные таким образом супернатанты с наноразмерными частицами, полученными с поверхности систем ДИ “Nobel Biocare” и “Alpha BiO”, наносили на медные сетки с тонкой подложкой из аморфного углерода для исследования в просвечивающем электронном микроскопе.
Структуру поверхности имплантатов изучали методами растровой электронной микроскопии (РЭМ), просвечивающей электронной микроскопии (ПЭМ), просвечивающей растровой микроскопии (ПРЭМ) с z-контрастом, электронной дифракции и энергодисперсионного анализа с использованием растрового электронного микроскопа Quanta 200-3D, просвечивающего электронного микроскопа с полевой эмиссией FEI Osiris при ускоряющем напряжении 200 кВ. Просвечивающий электронный микроскоп оборудован специальной системой детекторов, позволяющих получать карты распределения химических элементов большой площади за короткое время (несколько минут).
Микротомографические исследования проводили на рентгеновском микротомографе “ТОМАС” в ФНИЦ “Кристаллография и фотоника”. В качестве источника использовался GE ISOVOLT 3003 и стандартная рентгеновская трубка. Характеристическая линия MoKα (энергия 17.5 кэВ) выделялась с помощью кристалла-монохроматора. Излучение регистрировалось двумерным CCD-детектором прямого счета XIMEA xiRay11 с размером пикселя 9 × 9 мкм. Система формирования рентгеновского пучка состояла из блока щелей, кристалла-монохроматора и вакуумного коллиматора. В каждом эксперименте измеряли 400 проекций с шагом 0.5°. Обработку томографических данных проводили алгебраическим методом реконструкции (CGLS).
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕТА И ИХ ОБСУЖДЕНИЕ
Микротомографические исследования грануляционной ткани. Предпосылкой к исследованиям поверхности ДИ послужило обнаружение металлических включений в грануляционной ткани, окружающей имплантат [4, 5]. Результаты томографических измерений грануляционной ткани представлены на рис. 1. Объемная структура ткани однородна, однако обнаружены точечные включения высокой плотности (светлые области на рис. 1). Возникает вопрос о происхождении этих включений. Для выяснения данного вопроса необходимо изучить возможность эмиссии частиц с поверхности ДИ и их элементный и фазовый состав.
Рис. 1.
Трехмерные реконструкции грануляционной ткани, полученные методом рентгеновской микротомографии.

Структура поверхности ДИ “Nobel Biocare” и наноразмерных частиц, полученных в составе супернатантов. На рис. 2, 3 представлены результаты исследований поверхности ДИ “Nobel Biocare” методом РЭМ в режиме вторичных электронов и энергодисперсионного анализа (EDX). Исследования показали, что поверхность ДИ по всей площади имеет однородный рельеф (рис. 2а–2в). При большем увеличении видно, что рельеф представляет собой каверны округлой формы размером (диаметром) 1–8 мкм (рис. 2г). При этом основной элементный состав поверхности с таким рельефом: Ti, О, Ca, P, С (рис. 3а). Судя по количественному составу, представленному в табл. 1, основными элементами являются титан и кислород, образующие оксид титана. Кальций и фосфор содержатся в небольшом количестве (как примеси), а углерод, по-видимому, образуется на поверхности во время измерений.
Рис. 2.
РЭМ-изображения поверхности дентальных имплантатов: общий вид при малом увеличении (а), покрытие на поверхности (б), особенности рельефа (в).

Рис. 3.
РЭМ-изображение и соответствующие энергодисперсионные спектры от участков дентального имплантата с разным рельефом поверхности: а – участок без покрытия (пришеечная зона) – 1, участок с покрытием – 2; б, в – спектры от участков 1 и 2 соответственно.
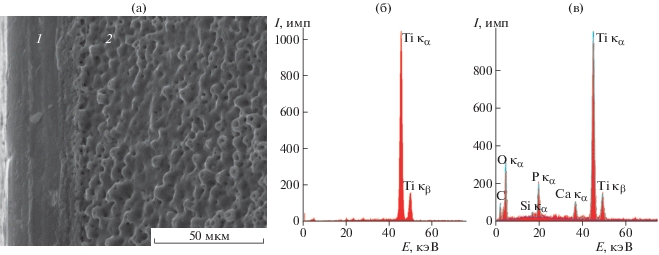
Таблица 1.
Элементный состав участка дентального имплантата “Nobel Biocare” с покрытием (рис. 3)
| Элемент (участок 2) | O | Si | P | Ca | Ti |
|---|---|---|---|---|---|
| ат. % | 68.4 | 0.6 | 3.5 | 1.7 | 25.8 |
На краю ДИ, в пришеечной зоне, описанный рельеф отсутствует, т.е. поверхность более гладкая. В этой области в составе EDX-спектров присутствует только титан (рис. 3б).
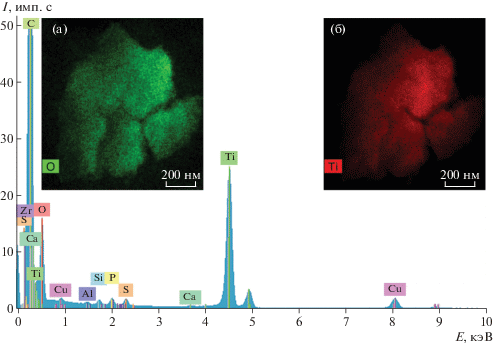
На рис. 4, 5 представлены результаты исследований частиц, полученных с поверхности имплантата. Размер частиц колеблется от десятков нанометров до одного микрона. В составе частиц обнаружены такие элементы, как титан, железо, алюминий, кремний, кислород. Отметим, что локализации Ti и O, а также Al, Si, Fe и О на приведенных картах в той или иной степени совпадают, Ni и Fe располагаются независимо друг от друга. По-видимому, данные пары элементов образуют химические соединения, наиболее вероятно – оксиды алюминия, кремния или железа. Таким образом, при изучении элементного состава наноразмерных частиц, полученных в составе супернатантов, выявлено несоответствие элементному составу поверхности самого сплава, используемого для производства ДИ “Nobel Biocare”.
Рис. 4.
ПРЭМ-изображение с z-контрастом (а) и карты распределения химических элементов (б–е), полученные от различных частиц с поверхности дентальных имплантатов “Nobel Biocare”.

Рис. 5.
Карты распределения химических элементов (а, б) и соответствующий энергодисперсионный спектр (в), полученные от частицы с поверхности дентальных имплантатов “Nobel Biocare”.
На рис. 5 представлены ПРЭМ-изображения с z-контрастом, карты распределения химических элементов и соответствующие EDX-спектры типичной крупной кристаллической частицы размером около одного микрона. В спектрах таких частиц основным элементом является титан. Исследования методами ПЭМ и электронной дифракции показали, что они представляют собой смесь оксидов титана – анатаза (TiO2, пр. гр. I4/amd) и рутила (TiO2, пр. гр. P42/mnm), о чем свидетельствуют соответствующие межплоскостные расстояния dhkl, представленные в табл. 2. Возможно, такие частицы, содержащие титан и кислород, являются фрагментами поверхностного слоя имплантата.
Таблица 2.
Результаты расшифровки микроэлектронограммы от отдельной частицы (рис. 5)
| Межплоскостные расстояния dhkl, нм | Фаза |
|---|---|
| 0.351 | анатаз (TiO2, I4/amd) |
| 0.256 | рутил (TiO2, P42/mnm) |
| 0.226 | Рутил |
| 0.189 | Анатаз |
| 0.146 | анатаз, рутил |
| 0.122 | анатаз, рутил |
Структура поверхности ДИ “Alpha Bio” и наноразмерных частиц, полученных в составе супернатантов. На рис. 6, 7 представлены результаты исследований поверхности ДИ “Alpha Bio” методом РЭМ в режиме вторичных электронов и EDX. Как и в первом случае, поверхность данного ДИ негладкая, рельеф однородный, однако имеются явные отличия от поверхности ДИ “Nobel Biocare”, а именно: округлые каверны отсутствуют, наблюдаются бороздки, ступеньки и трещины (рис. 6).
Рис. 6.
РЭМ-изображения поверхности дентального имплантата “Alpha BiO”: а – общий вид при малом увеличении, б, в – рельеф покрытия на поверхности.

Рис. 7.
РЭМ-изображение и соответствующие EDX-спектры от участков дентального имплантата “Alpha Bio” с разным рельефом поверхности: а – гладкий участок на краю ДИ в пришеечной зоне – 1; участок имплантата с микрорельефом – 2; б, в – спектры от участков 1 и 2 соответственно.
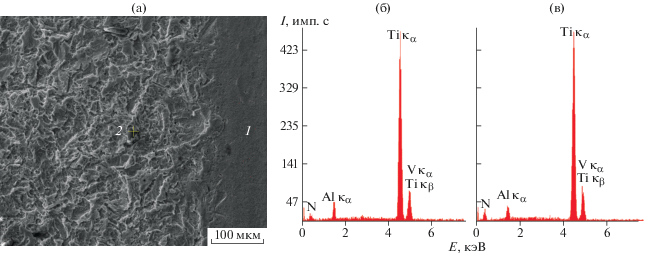
Наблюдаются различия и в соотношении химических элементов в исследованных зонах 1 и 2: EDX-спектры, полученные от участка с характерным рельефом (рис. 7а) и более гладкого участка, расположенного на краю ДИ в пришеечной зоне (рис. 7б), практически не различаются и содержат пики таких элементов, как титан (основной), алюминий, азот и ванадий.
На рис. 8–10 представлены результаты исследования металлсодержащих частиц, обнаруженных в тканях, окружающих поверхность ДИ “Alpha Bio”, – ПРЭМ-изображения с z-контрастом, карты распределения химических элементов и EDX-спектры. Как и в первом случае, наблюдали значительный разброс частиц по размерам, от десятков нанометров до нескольких микрон. Крупные частицы микронных и субмикронных размеров представляют собой титан, нитрид титана или диоксид титана (рис. 8). Как и в предыдущем случае с имплантатами системы “Nobel”, они являются, по-видимому, мелкими фрагментами поверхностного слоя имплантата.
Рис. 8.
ПРЭМ-изображение с z-контрастом (а), карты распределения химических элементов (б–д) и EDX-спектр (е), полученные при изучении Ti частиц в составе супернатантов с поверхности имплантатов “Alpha BiO”.
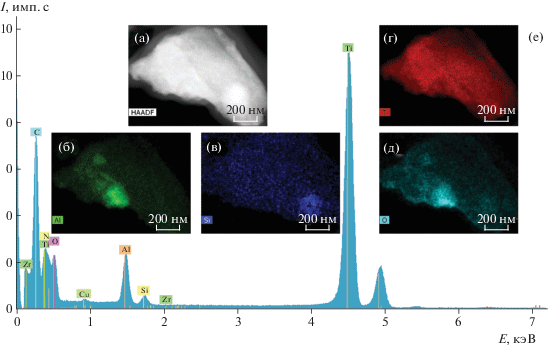
Рис. 9.
ПРЭМ-изображение с z-контрастом (а), микроэлектронограмма (б), карты распределения химических элементов (б–ж) и EDX-спектр (з), полученные при изучении наноразмерных частиц в составе супернатантов с поверхности имплантатов “Alpha BiO”.
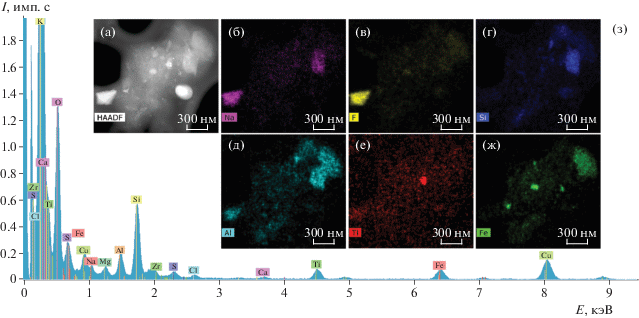
Рис. 10.
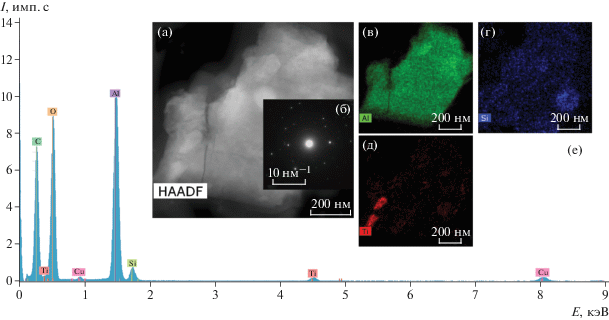
ПРЭМ-изображение с z-контрастом (а), микроэлектронограмма (б), карты распределения химических элементов (в–д) и EDX-спектр от частиц с Al (е), полученных в составе супернатантов с поверхности ДИ “AlphaBio”.
Химические элементы, наиболее часто присутствующие в спектрах мелких частиц, имеющих нанометровые размеры, – титан, алюминий, кислород, железо, кремний, натрий, кальций, встречаются также сера, магний, хлор, цирконий, фтор в небольших количествах (рис. 9). Пики Cu для всех спектров, полученных в просвечивающем электронном микроскопе, появляются из-за наличия медной сетки, на которую нанесены исследуемые частицы.
Отличительной особенностью этого образца является присутствие помимо диоксида титана крупных частиц размером до микрона, содержащих в спектре в основном или только алюминий и кислород в различных соотношениях и представляющих собой оксиды Al (рис. 10). Это подтверждает анализ микроэлектронограмм. При расчете электронограммы от такой частицы (рис. 10б) выявлены межплоскостные расстояния dhkl = = 0.160 и 0.41 нм, соответствующие наиболее сильным отражениям от плоскостей (123) и (103) α-Al2O3 с пр. гр. R3c. На электронограмме они соотносятся с яркими одиночными рефлексами. Более слабые рефлексы с dhkl = 0.244 и 0.211 нм можно отнести к нитриду титана с пр. гр. Fm3m. При расчете других электронограмм от такого рода частиц межплоскостные расстояния соответствовали различным модификациям оксида алюминия [8]. Полученные данные по фазовому составу согласуются с элементным составом материала имплантата системы «Alpha Bio», указанным в табл. 3, где присутствуют такие элементы, как Al, Ti, N.
Таблица 3.
Элементный состав участков дентального имплантата фирмы “Alpha Bio” (рис. 7)
| Элемент (участок 1) | ат. % | Элемент (участок 2) | ат. % |
|---|---|---|---|
| N | 29.8 | N | 35.3 |
| Al | 9.6 | Al | 10.8 |
| Ti | 57.7 | Ti | 53.9 |
| V | 2.9 |
Такие параметры, как размер частиц, их элементный состав, а также морфология, вероятно, могут быть персонифицированной причиной развития мукозита и периимплантита, что связано с накоплением их в клетках иммунной системы и ранней гибелью самих клеток, неспособных к своевременной утилизации повышенного количества конгломератов частиц. Такая ранняя гибель собственных клеток иммунной системы, содержащих повышенное количество металлических наноразмерных частиц, может быть соотнесена с понятием “предельно допустимой концентрации или критической массы” и с таким микробиологическим параметром, как диагностически значимый количественный параметр условно-патогенной микрофлоры. На сегодняшний день существуют параметры, характеризующие наноразмерные металлические частицы, используемые при их изучении методом динамического светорассеяния: размер, полидисперстность, частота встречаемости в растворе. По аналогии предполагаем целесообразность введения такого понятия, как “критическая доза наноразмерных частиц” – CDNanoMP (Critical Dose of NanoMetal Particles) для дальнейшего выявления биологических эффектов, связанных, возможно, со срывом иммунологической толерантности, обеспечивающей длительную остеоинтеграцию и функционирование ДИ в качестве опоры.
По сравнению с имплантатом “Nobel Replace” характер рельефа ДИ “Alpha Bio” таков, что эмиссия наноразмерных частиц с его поверхности более ожидаема, что также подтверждается исследованиями методом динамического светорассеяния с имитацией физической нагрузки [4]. В целом химический состав наноразмерных частиц отличается присутствием оксидов Al, что может служить обоснованием разной реакции клеток иммунной системы при взаимодействии с внедряемым ДИ в отдаленном периоде времени. Учитывая проведенные исследования, возникает вопрос, что является пусковым моментом к накоплению наноразмерных частиц в периимплантатных тканях, если известно об их способности к миграции, а следовательно, выведению, а не накоплению [5–7]. Наличие микрочастиц в грануляционной ткани в области имплантатов при проведении хирургических ревизий без удаления самих имплантатов указывает на возможность участия наноразмерных частиц не только в процессе остео- и фиброостеоинтеграции, но и дезинтеграции ДИ. Следовательно, образование комплексов (конгломератов) наноразмерных частиц и их укрупнение до микро- или субмикронных размеров при неспособности иммунокомпетентных клеток к своевременной утилизации и последующей миграции может приводить к их накоплению и провоцировать возникновение хронического асептического воспаления. В таком случае микробная контаминация становится на второе место в качестве этиологического фактора в возникновении срыва достигнутой ранее остеоинтеграции, т.е. тканевого гомеостаза, обеспечиваемого иммунотолерантностью.
ЗАКЛЮЧЕНИЕ
Методами растровой и просвечивающей электронной микроскопии, электронной дифракции и энергодисперсионного анализа проведено исследование поверхности двух систем дентальных имплантатов “Nobel Biocare” и “Alpha BiO”, а также структуры и элементного состава наноразмерных металлсодержащих частиц, выделенных из поверхностных слоев имплантатов.
Обнаружено, что морфология поверхности и элементный состав имплантатов обеих систем значительно различаются. Характер рельефа ДИ “Alpha Bio” таков, что эмиссия наноразмерных частиц с его поверхности в прилегающие ткани более вероятна, чем с поверхности имплантата “Nobel Biocare”. Найденные различия могут оказывать существенное влияние на биологические свойства поверхностей имплантатов.
Установлен фазовый состав частиц, входящих в состав супернатантов, полученных с поверхности оксидных слоев систем ДИ “Nobel Biocare” и “Alpha BiO”. Частицы микронных и субмикронных размеров имплантатов “Nobel Biocare” представляют собой в основном диоксид титана обеих модификаций – рутил и анатаз, а в случае имплантатов “Alpha BiO” – помимо диоксида и нитрида титана присутствуют оксиды алюминия. Элементный состав наноразмерных частиц более разнообразен, встречаются такие элементы, как Fe, Ca, Na, Cl, S, Si, P и др.
Таким образом, микробная контаминация не всегда играет ведущую роль этиологического фактора при возникновении срыва достигнутой ранее остеоинтеграции, т.е. тканевого гомеостаза, обеспечиваемого иммунотолерантностью.
Проведенные исследования расширяют круг объектов, доступных для визуализации с помощью рентгеновской томографии, и позволяют тем самым развивать существующие методики. Комплексное исследование с подключением возможностей аналитической просвечивающей и растровой электронной микроскопии позволило получить более подробную информацию о фазовом и элементном составе частиц с поверхности имплантатов, что может иметь значение при рассмотрении и оценке фактора безопасности и роли наночастиц в процессах остеоинтеграции.
Электронно-микроскопические и микротомографические исследования выполнены на оборудовании ЦКП ФНИЦ “Кристаллография и фотоника” РАН при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию (п.1.8) “ФНИЦ “Кристаллография и фотоника” РАН.
Список литературы
Fretwurst T., Nelson K., Tarnow D.P. et al. // J. Dent. Res. 2018. V. 97. № 3. P. 259.
Noronha O.M., Schunemann W.V.H., Mathew M.T. et al. // J. Periodontal Res. 2018. V. 53. № 1. P. 1.
Martinez A., Guitián F., López-Píriz R. et al. // PLoS One. 2014. V. 9. № 1. P. 86926.
Лабис В.В., Базикян Э.А., Сизова С.В. и др. // Бюллетень Оренбургского научного центра УрО РАН. 2016. Т. 2 С. 16.
Лабис В.В., Базикян Э.А., Осташко А.А. и др. // Российский иммунологический журн. 2017. Т. 11. № 2. С. 162.
Лабис В.В., Базикян Э.А., Сизова С.В. и др. // Медицинская иммунология. 2017. Т. 19. С. S329.
Лабис В.В., Базикян Э.А., Осташко А.А. и др. // Российский иммунологический журн. 2018. Т. 12. Вып. 21. № 3. С. 342.
Kapтoтeкa JCPDS. № 12-0539, 01-1305.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


