Кристаллография, 2019, T. 64, № 6, стр. 945-951
Возможности рентгеновской абсорбционной спектроскопии в геометрии полного внешнего отражения для исследования белковых пленок на жидкости
Н. Н. Новикова 1, *, С. Н. Якунин 1, М. В. Ковальчук 1, Э. А. Юрьева 2, Н. Д. Степина 3, А. В. Рогачев 1, М. А. Кременная 4, Г. Э. Яловега 4, О. В. Космачевская 5, А. Ф. Топунов 5
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Научно-исследовательский клинический институт педиатрии им. академика Ю.Е. Вельтищева
Москва, Россия
3 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
4 Южный федеральный университет
Ростов-на-Дону, Россия
5 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” РАН
Москва, Россия
* E-mail: nn-novikova07@yandex.ru
Поступила в редакцию 11.06.2019
После доработки 11.06.2019
Принята к публикации 25.06.2019
Аннотация
Впервые экспериментально получены XANES-спектры белковых пленок (гемоглобина и щелочной фосфатазы), сформированных на поверхности жидкой субфазы в ленгмюровской ванне. Возможности рентгеновской абсорбционной спектроскопии в геометрии полного внешнего отражения продемонстрированы на примере исследования белковой пленки на основе гемоглобина, подвергнутого действию мочевины. Установлено, что присутствие в субфазе 0.09 М раствора мочевины значительно усиливает способность гемоглобина связывать ионы цинка и железа. Получена информация о локальном атомном окружении ионов цинка, присоединенных к молекуле гемоглобина. Показано, что каждый ион цинка координируют четыре лиганда, два из которых – аминокислотные остатки цистеина и гистидина. Сформулированы общие представления о молекулярных механизмах накопления ионов металлов под действием повреждающих факторов.
ВВЕДЕНИЕ
Рентгеновская спектроскопия поглощения является одним из наиболее информативных методов изучения локальной структуры вещества. Рентгеновские спектры поглощения обычно делят на две части: околопороговая тонкая структура рентгеновского спектра поглощения (X-ray absorption near edge structure – XANES) и протяженная тонкая структура рентгеновского спектра поглощения (extended X-ray absorption fine structure – EXAFS). Анализ особенностей XANES-спектров позволяет определять координаты окружающих атомов, межатомные расстояния (длины химических связей), локальную симметрию окружения поглощающего атома (валентные углы химической связи). Также с помощью XANES-измерений можно получить информацию об энергии вакантных молекулярных орбиталей в молекулах или электронных зон в конденсированных веществах, лежащих выше уровня Ферми, распределении электронной плотности на атомах, а также степени окисления поглощающего атома [1, 2].
Метод XANES-спектроскопии неоднократно применялся для исследования локального окружения металлов в активных центрах металлопротеинов [3, 4]. Новые возможности для изучения объектов с крайне низкой концентрацией поглощающих атомов, таких как металлопротеины, открывают измерения XANES-спектров во флуоресцентной моде в условиях полного внешнего отражения (ПВО). В этом случае высокую чувствительность обеспечивает скользящая геометрия взаимодействия рентгеновского пучка с поверхностью: благодаря малой глубине проникновения рентгеновского излучения в подложку в условиях ПВО значительно снижается интенсивность фонового излучения подложки. Особый интерес представляют XANES-измерения для изучения белковых пленок, сформированных на поверхности жидкости, когда не нарушается нативная конформация белковых молекул, а следовательно, сохраняются их биологические функции.
В представленной работе метод XANES-спектроскопии был использован для изучения пленок гемоглобина, сформированных на поверхности водной субфазы в ленгмюровской ванне. Исследования посвящены выявлению механизмов изменения способности белковых молекул связывать металлы в условиях, моделирующих эндогенную интоксикацию в организме. Известно, что белки при нарушении пространственной структуры приобретают способность образовывать комплексы с переходными металлами (Zn, Fe, Cd, Ni), в результате в клетке могут возникать стабильные белковые агрегаты со сниженной функциональной активностью [5, 6]. Эндогенная интоксикация, сопровождающая хронические обменные заболевания, является важным фактором, оказывающим влияние на структурно-функциональные свойства белков в организме. Возникающие при тяжелых обменных заболеваниях посттрансляционные модификации белковых молекул, такие как нитрозилирование, гликирование, алкилирование, карбомоилирование и другие, могут запускать в организме целый каскад событий с риском развития разнообразных ассоциированных аутоиммунных заболеваний [7, 8].
В настоящей работе представлены результаты исследования действия одного из наиболее известных “уремических” токсикантов – мочевины – на гемоглобин. Выбор гемоглобина, который относится к важнейшим транспортным белкам крови, обусловлен тем, что при развитии синдрома эндогенной интоксикации в организме в той или иной степени нарушается функционирование практически всех его физиологических систем, причем в первую очередь это касается системы крови, выполняющей в организме интегративные функции.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Формирование белковых пленок на поверхности водной субфазы
В работе были использованы: гемоглобин человека в виде лиофилизированного порошка; щелочная фосфатаза из свиной почки в виде лиофилизированного порошка; мочевина; соль ZnCl2. Все реактивы производства Sigma, США.
Пленки на основе щелочной фосфатазы. Водный раствор щелочной фосфатазы (концентрация 4 мг/л) помещали в ленгмюровскую ванну. Рентгеновские измерения начинали через 1.5 ч, когда поверхностное давление достигло значения 15 мН/м.
Пленки на основе гемоглобина. Водный раствор гемоглобина (концентрация 9 мг/л) помещали в ленгмюровскую ванну. Рентгеновские измерения начинали через 1.5 ч, когда поверхностное давление достигло значения 23 мН/м.
Рентгеновские измерения
XANES-спектры белковых пленок, сформированных на поверхности жидкости, измеряли на станции “Ленгмюр” Курчатовского комплекса синхротронно-нейтронных исследований (Москва, Россия). В экспериментах использовано синхротронное излучение (СИ) из поворотного магнита, двухкристальный монохроматор Si(111) обеспечивал степень монохроматизации первичного пучка СИ на уровне спектральной ширины порядка 3 эВ. Наклон пучка к поверхности жидкости осуществляли при помощи двух плоских зеркал. Угол падения излучения на поверхность воды поддерживали постоянным, он составлял 0.8 от критического угла ПВО для воды θC. Флуоресцентное излучение регистрировали с помощью дрейфового детектора VORTEX, расположенного над поверхностью водной субфазы под углом 90°. Для обеспечения хорошей статистики при измерении сигнала от белковой пленки была использована многопроходная методика измерения с последующим усреднением серии спектров. Воспроизводимость энергетического положения монохроматора при многократном сканировании составила 0.18 эВ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изучение изменений элементного состава пленки гемоглобина
Пленки на основе гемоглобина, обработанного мочевиной. Обработку гемоглобина мочевиной проводили по следующей схеме: в раствор белка добавляли мочевину до конечной концентрации 0.09 М, смесь инкубировали при комнатной температуре в течение 12 ч. Затем раствор помещали в ленгмюровскую ванну. Были выполнены две серии измерений: в первом случае конечная концентрация мочевины в рабочем растворе составляла 0.09 М, во второй серии концентрация была выше – 0.2 М. В качестве контроля были проведены исследования пленки интактного гемоглобина. Характеристические спектры флуоресцентного излучения при фиксированном угле θ ≤ θC записывали непрерывно в течение 24 ч. За время измерений наблюдалось постепенное увеличение интенсивности выхода флуоресценции как ионов цинка, так и ионов железа.
Для количественной оценки содержания ионов металлов, связанных молекулами белка, удобно использовать в качестве реперного значения интенсивность выхода флуоресценции ионов серы, которые присутствуют в аминокислотных остатках цистеина и метионина. Относительное количество ионов металлов RMe/S можно определить из отношения металл–сера, сравнив интенсивность пика SKα и интенсивность пика металла (ZnKα или FeKα). В гемоглобине человека в одной молекуле (тетрамер) присутствуют 12 ионов серы и четыре иона железа, в соответствии с этим отношение количества ионов железа к количеству ионов серы должно быть 1 : 3 (RFe/S = 0.33). Максимальные значения параметра RFe/S, зафиксированные в конце измерений каждой серии, приведены в табл 1. Весьма примечательным является повышенное отношение железа к сере, которое оказалось больше номинального даже в случае интактного гемоглобина. Это наблюдение указывает на то, что в ходе экспериментов в молекулах гемоглобина появились дополнительные Fe-связывающие сайты (помимо простетической группы). Отметим, что в экспериментах, проведенных в присутствии мочевины, содержание ионов металлов (цинка или железа) зависело от концентрации мочевины – чем выше концентрация мочевины, тем выше количество связанных металлов.
Таблица 1.
Максимальное значение отношения металл–сера, зафиксированное за 24 ч измерений пленки гемоглобина, сформированного на границе воздух–жидкость
| Отношение металл–сера | Контрольные измерения | Концентрация мочевины | |
|---|---|---|---|
| 0.09 M | 0.2 M | ||
| RZn/S | 6.3 × 10–3 | 27.3 × 10–3 | 42.0 × 10–3 |
| RFе/S | 0.436 | 0.545 | 0.562 |
Были выполнены контрольные исследования лиофилизированного порошка гемоглобина, использованного в исследованиях, с помощью метода рентгенофлуоресцентного анализа в геометрии ПВО на лабораторном спектрометре PICOFOX (Bruker). Согласно этим результатам RFe/S = = 0.32, что соответствует номинальному значению. Отметим, что в этих измерениях сигнал Zn-флуоресценции не был обнаружен.
Пленки на основе гемоглобина, обработанного раствором соли ZnCl2. Проведенные исследования позволили сравнить скорость связывания цинка белковыми молекулами в водном растворе и на границе раздела воздух–вода. В этой серии измерений к раствору гемоглобина предварительно добавляли раствор соли ZnCl2. Конечная концентрация соли в белковом растворе составила 3 × × 10–7 М, смесь инкубировали при комнатной температуре в течение 24 ч. Половину этого раствора помещали в ленгмюровскую ванну, после формирования белковой пленки записывали характеристические спектры флуоресцентного излучения при фиксированном угле θ ≤ θC в течение 24 ч. За это время интенсивность пиков, соответствующих ионам цинка и железа, постепенно росла, и в конце эксперимента соотношение RZn/S и RFe/S достигло значения 67.2 × 10–3 и 0.470 соответственно. Оставшуюся часть раствора белка хранили в колбе при комнатной температуре 20 ч, в течение которых проводили измерения первой порции раствора. Затем из этого раствора формировали белковую пленку в ленгмюровской ванне и проводили измерения. Характеристические спектры флуоресцентного излучения при фиксированном угле θ ≤ θC записывали в течение 30 мин после формирования белковой пленки. Оказалось, что в этом случае RZn/S = 21 × 10–3 и RFe/S = = 0.344. Проведенные измерения позволили сравнить скорости связывания металла с гемоглобином в двух разных случаях: когда молекулы белка расположены в пленке на границе воздух–жидкость или присутствуют в объеме раствора. Согласно полученным результатам процесс накопления металла протекал значительно интенсивнее в пленке гемоглобина на границе. В частности, количество ионов цинка, связанных с молекулами гемоглобина на границе воздух–жидкость, увеличилось в 3 раза быстрее, чем в объеме за то же время.
Обсуждая представленные в разделе результаты, следует подчеркнуть, что во всех экспериментах для приготовления белковых растворов была использована вода высокой степени очистки (Millipore Corp). Таким образом, полученные экспериментальные данные свидетельствуют о том, что при обработке мочевиной гемоглобин приобретает свойство связывать ионы металлов, содержащиеся в воде в следовых количествах. Кроме того, исследования изменения элементного состава белковых пленок во времени позволили выявить еще один фактор, имеющий важное значение для связывания ионов металлов: пребывание белковых молекул на границе раздела воздух–вода значительно ускоряет этот процесс. Было отмечено накопление во времени ионов цинка и железа на интактном белке, не подверженном какой-либо обработке. Однако в случае предварительного воздействия на белок повреждающего фактора (мочевины) процесс присоединения ионов металлов на гемоглобине заметно ускорился.
Информацию о локальном окружении ионов цинка, связанных с молекулой гемоглобина, удалось получить в серии измерений с помощью метода рентгеновской абсорбционной спектроскопии в геометрии ПВО.
Исследования пленок гемоглобина и щелочной фосфатазы методом рентгеновской абсорбционной спектроскопии в геометрии ПВО
Пленки на основе гемоглобина, обработанного мочевиной. Сразу после формирования слоя гемоглобина на поверхности водной субфазы были проведены XANES-измерения за K-краем поглощения железа. Затем под сформированный слой гемоглобина добавляли раствор мочевины до концентрации 0.09 М. Слой инкубировали в течение 24 ч на поверхности водной субфазы, содержащей мочевину, после этого концентрацию мочевины в водной субфазе увеличили до 0.2 М. Спустя 24 ч после повторного введения мочевины были измерены XANES-спектры за K-краем поглощения железа и цинка. К началу этих измерений интенсивность пика цинка достигла достаточно высокого значения (отношение RZn/S составило 84 × 10–3), все зарегистрированные спектры XANES показали высокое отношение сигнал/фон и хорошо разрешенную тонкую структуру.
На рис. 1а представлены экспериментальные спектры XANES за K-краем поглощения железа для пленки гемоглобина на поверхности водной субфазы до (кривая 1) и после (кривая 2) введения мочевины. Форма XANES-спектра необработанного гемоглобина совпадает с экспериментальными данными [9, 10] для окисленных форм гемоглобина и миоглобина. На рис. 1а хорошо видна особенность, обозначенная как А'', которая соответствует метгемоглобину. После добавления в водную субфазу мочевины в спектре наблюдаются рост интенсивности и изменение формы “белой линии” А, а также перераспределение интенсивностей и изменение энергетического положения особенностей В и С. Наряду с этим остаются без изменений энергетическое положение края поглощения и энергетическое положение и интенсивность предкраевого пика А', а также пиков A'' и D. Известно, что энергетическое положение края поглощения (E0) спектров XANES часто используется для определения степени окисления атомов. Однако в случае гемоглобина и миоглобина использование E0 для определения степени окисления атомов железа не дает точных результатов, так как электронная структура атома железа в этих случаях сильно зависит от спинового состояния самого железа и химического характера лигандов [9, 11]. Поэтому только на основе идентичности энергетического положения края поглощения железа в гемоглобине до и после обработки мочевиной нельзя однозначно утверждать, что степень окисления железа в геме осталась неизменной. Предкраевая особенность А' образуется в результате смешивания молекулярных орбиталей 3d–4p. В этом случае разрешен квадрупольный переход 1s → 3d, запрещенный в октаэдрической координации, но разрешенный для тетраэдра и искаженного октаэдра [12]. На интенсивность предкраевого пика и его энергетическое положение влияют природа лигандов, симметрия окружения и степень окисления атомов железа. В спектрах необработанного и обработанного мочевиной гемоглобина наблюдаются эквивалентные по энергетическому положению и интенсивности предкраевые особенности. Кроме того, в [13] было показано, что простое синусоидальное поведение особенностей В и С соответствует искаженной октаэдрической симметрии первой координационной сферы атома железа. Если учесть, что исходный гемоглобин находится в аквамет-форме (Hb–FeIII–H2O), характеризующейся симметрией искаженного октаэдра, то можно предположить, что симметрия окружения атома железа в гемоглобине при обработке мочевиной не изменяется.
Рис. 1.
Экспериментальные XANES-спектры вблизи K-края поглощения железа (а) и цинка (б) пленки гемоглобина, сформированной в ленгмюровской ванне на поверхности водной субфазы, содержащей мочевину.
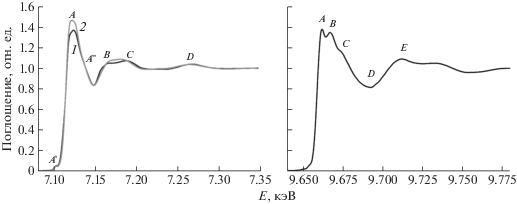
Однако остается открытым вопрос о причинах увеличения интенсивности белой линии и перераспределения интенсивностей пиков В и С после введения в субфазу мочевины. Возможно, наблюдаемые трансформации связаны с тем, что в присутствии мочевины изменяется локальная геометрия ионов железа в простетической группе. С другой стороны, увеличение интенсивности Fe-пиков в спектрах характеристической флуоресценции, обнаруженное в предыдущей серии измерений, свидетельствует о формировании на молекулах гемоглобина дополнительных центров связывания железа помимо гема, локальное окружение которых отличается от гемовой группы. Очевидно, что наблюдаемые различия в XANES-спектрах гемоглобина обусловлены тем фактом, что регистрируемые спектры представляют собой сумму вкладов ионов железа гемовой группы и дополнительных центров связывания.
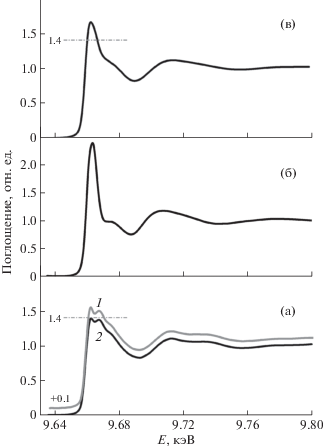
Анализ интенсивности “белой линии” XANES-спектра ионов цинка, связанных молекулами гемоглобина (рис. 1б), показывает, что координационное число (КЧ) Zn2+ в обработанном мочевиной гемоглобине соответствует четырем. Такой вывод может быть сделан из сравнения интенсивности белой линии экспериментального спектра XANES, полученного в настоящей работе, с данными [14, 15]. В этих работах на основе анализа интенсивности экспериментальных и теоретических XANES-спектров атомов Zn с КЧ 4, 5 и 6 в мононуклеарных модельных соединениях цинка было показано, что интенсивность белой линии возрастает с увеличением КЧ. Так, в случае тетраэдрического окружения цинка максимум интенсивности белой линии не превышает 1.5, а для КЧ = 5 и 6 интенсивность не опускалась ниже 1.6. В настоящем эксперименте интенсивность белой линии составила 1.4, что указывает на тетраэдрическое окружение ионов Zn2+.
Для определения наиболее вероятного места связывания цинка был использован метод “отпечатка пальца” – сравнение экспериментальных данных с XANES-спектрами Zn-комплексов в белках с известным лигандным окружением. Используя результаты измерений для мононуклеарных тетраэдрических Zn-комплексов [14–16], можно сделать следующие заключения: положение и форма двух наиболее интенсивных пиков (обозначены как А и В) в спектре, полученном в настоящем эксперименте, весьма схожи со спектрами в случае, когда ионы цинка координированы четырьмя цистеиновыми лигандами [15] или одним цистеином, двумя гистидинами и одним остатком аспартат-глутамата [16]. Возникновение четко выраженной особенности (обозначена как C) можно объяснить наличием остатка гистидина в локальном окружении ионов цинка. На основе приведенного выше качественного анализа можно предположить, что каждый ион цинка, связанный с гемоглобином в присутствии 0.2 М мочевины, координирован четырьмя лигандами, двумя из которых являются цистеин и гистидин. Отметим, что приведенные соображения основаны на качественном рассмотрении полученных экспериментальных данных, для более подробной информации о предлагаемой модели требуется теоретическое моделирование.
Пленки на основе гемоглобина, обработанного раствором соли ZnCl2. К раствору гемоглобина добавляли раствор ZnCl2 до конечной концентрации 3 × 10–7 М. Смесь инкубировали в течение 24 ч при комнатной температуре. Раствор помещали в ленгмюровскую ванну, после формирования белковой пленки записывали XANES-спектры за K-краем поглощения цинка. В качестве контрольных были выполнены измерения XANES-спектров раствора ZnCl2. Раствор соли концентрацией 10–3 М заливали в ленгмюровскую ванну, XANES-спектры записывали вблизи критического угла ПВО при θ ≥ θC в течение 24 ч. Сравнение XANES-спектров раствора белка, содержащего ZnСl2 (рис. 2а), и раствора ZnСl2 (рис. 2б) указывает на различный характер локального окружения цинка в этих случаях. В то же время хорошо видно, что спектр на рис. 2а практически идентичен спектру на рис. 1б.
Рис. 2.
Экспериментальные XANES-спектры за К-краем поглощения цинка: а – пленки на основе гемоглобина, обработанного раствором соли ZnCl2 (1), и пленки гемоглобина, сформированной в ленгмюровской ванне на поверхности водной субфазы, содержащей мочевину (2); б – раствора ZnCl2; в – пленки на основе щелочной фосфатазы.
Суммируя представленные в разделе результаты, можно сделать следующие выводы: известно, что в белках наиболее предпочтительными для связывания цинка являются остатки цистеина, константа связывания у которых на 4–5 порядков выше, чем у атома азота имидазола гистидина. Поэтому можно предположить, что связывание цинка происходит при обязательном участии цистеинов гемоглобина. В молекуле гемоглобина содержатся шесть остатков цистеина: по два в каждой β-цепи (Cys-93 и Cys-112) и по одному в каждой α-цепи (Cys-104). В интактном гемоглобине всего два реакционноспособных цистеина (Cys-93β), остальные “скрыты” в области субъединичных контактов. Реакционная способность цистеинов зависит от их доступности и состояния окисления.
Полученные данные свидетельствуют о том, что существенное увеличение способности белка связывать ионы металлов является результатом совместного действия двух факторов: повреждающих агентов и окислительного стресса. Оба фактора способствуют повышению доступности “скрытых” SH-групп и их активации. Демаскировка SH-групп происходит вследствие перехода белка из нативного состояния в состояние, подобное расплавленной глобуле [17, 18]. Активация SH-групп может происходить под действием активных форм кислорода (${\text{O}}_{2}^{{ \bullet - }}$, ${\text{H}}{{{\text{O}}}^{ \bullet }}$, ${\text{HO}}_{2}^{ \bullet }$, ${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}$), образующихся в процессе эксперимента, в том числе в результате радиолиза воды, вызванного СИ.
Известно, что скорость окисления цистеина в составе белков на несколько порядков превышает скорость окисления других аминокислот. При умеренном окислительном стрессе окисление цистеина происходит через образование интермедиатов окисления: тиолят-аниона (Cys-S–) и сульфеновой кислоты (Cys-SOH) [19]. Высокореакционный Cys-SOH в белке может стабилизироваться за счет реакции с близко расположенной амидной группой с образованием сульфенамида [20] или с гистидином с образованием соединения гипервалентной серы [21]. Вполне вероятно, что в связывании металлов принимают участие интермедиаты окисления Cys-SH: тиолят-анион, сульфеновая кислота и соединение гипервалентной серы. Известно, что тиолят-анион обладает высокой металлсвязывающей способностью, примерно в 20 раз превышающей протонированную форму (Cys-SH) [22]. Цистеинсульфеновая кислота также может связывать металлы с образованием металл-сульфенатных центров [23, 24].
Пленки на основе щелочной фосфатазы. Для сравнения были проведены дополнительные исследования белковой пленки на основе щелочной фосфатазы – металлофермента, содержащего ионы цинка. Щелочные фосфатазы представляют собой димерные ферменты, в активном центре которых присутствуют двухвалентные катионы магния и цинка, ответственные за связывание субстрата [25]. Известно, что катионы цинка принимают непосредственное участие в каталитическом акте [26].
XANES-спектры за K-краем поглощения цинка для пленки щелочной фосфатазы представлены на рис. 2в. Сопоставление спектров XANES различных белковых пленок – на основе гемоглобина и щелочной фосфатазы – позволяет утверждать, что спектры чувствительны к изменениям локальной структуры цинка в белках при регистрации в геометрии ПВО на поверхности жидкой субфазы. Это выражается, во-первых, в изменении формы спектров, во-вторых, в изменении интенсивности “белой линии”, которая, как было отмечено при исследовании гемоглобина, является индикатором КЧ ионов цинка в белках. В случае щелочной фосфатазы интенсивность белой линии достигает значения 1.6, что соответствует КЧ = 5 и 6.
ЗАКЛЮЧЕНИЕ
Впервые получены XANES-спектры белковых пленок (гемоглобина и щелочной фосфатазы), сформированных на поверхности жидкости. Измерения с помощью метода рентгеновской спектроскопии поглощения во флуоресцентной моде в геометрии ПВО проводили на станции “Ленгмюр” (Курчатовский комплекс синхротронно-нейтронных исследований).
Экспериментально обнаружено существенное усиление способности гемоглобина связывать ионы металлов (цинка и железа) в присутствии слабого раствора мочевины (0.09 М). Выявлена важная роль окислительных процессов в ускорении связывания металлов молекулами белка. Полученные данные свидетельствуют о том, что существенное увеличение способности белка связывать ионы металлов является результатом совместного действия двух факторов: повреждающих факторов (мочевины) и окислительного стресса. Под действием повреждающих факторов может происходить лабилизация конформации белка с демаскировкой “скрытых” цистеинов, а в результате окислительных процессов образуются интермедиаты окисления белковых тиолов, которые являются предпочтительными лигандами для формирования комплексов с цинком.
Проведенные экспериментальные исследования наглядно демонстрируют новые возможности рентгеновской абсорбционной спектроскопии для изучения белковых макромолекул: показана высокая чувствительность XANES-спектров к изменениям локальной структуры белков при регистрации во флуоресцентной моде в условиях ПВО. Дополнительные преимущества таких измерений связаны с возможностью проводить исследования in situ процессов, протекающих в белковых молекулах, в условиях, моделирующих различные патологические воздействия на клетку.
Список литературы
Bianconi A. // X-Ray Absorption: Principles, Applications and Techniques of EXAFS, SEXAFS and XANES. N.Y.: John Wiley& Sons, 1988. 573 p.
Bokhoven J.A., Lamberti C. X-Ray Absorption and X-Ray Emission Spectroscopy. Theory and Applications. N.Y.: John Wiley& Sons, 2016. 890 p.
Michael W.M., Ryan G.H., Marco E.R. et al. // Science. 2017. V. 356. P. 1276.
Boffi F., Ascone I., Della-Longa S. et al. // Eur. Biophys. J. 2003. V. 32. P. 329.
Reeg S., Grune T. // Antioxid Redox Signal. 2015. V. 23. P. 239.
Leal S.S., Cristóvão J.S., Biesemeier A. et al. // Metallomics. 2015. V. 7. P. 333.
Verbrugge F.H., Tang W.H.W., Hazen S.L. // Kidney Int. 2015. V. 88. № 3. P. 474.
Pieniazek A., Gwozdzinski K. // Oxidative Medicine and Cellular Longevity. 2015. I. 783073.
Lima F.A., Penfold T.J., Veen R.M. et al. // Phys. Chem. Chem. Phys. 2014. V. 16. P. 1617.
Wilsona S.A., Green E., Mathews I.I. et al. // PNAS. 2013. V. 110. № 41. P. 16333.
Hocking R.K., Wasinger E.C., Yan Y.-L. et al. // J. Am. Chem. Soc. 2007. № 129. P. 113.
Interpreting XANES. Illinois Institute of Technology Bunker G. // http://gbxafs.iit.edu/training/XANES_intro.pdf. Дата доступа 28 августа 2017.
Paola D.A., Maurizio B. // J. Phys. Chem. A. 2004. V. 108. P. 4505.
Feiters M.C., Eijkelenboom A.P.A.M., Nolting H.-F. et al. // J. Synchr. Rad. 2004. № 10. P. 86.
Giachini L., Veronesi G., Francia F. et al. // J. Synchr. Rad. 2010. V. 17. P. 41.
Veronesi G., Whitehead S.J., Francia F. et al. // Biochim. Biophys. Acta. 2010. V. 1797. P. 494.
Jennings P.A., Wright P.E. // Science. 1993. V. 262. P. 892.
Culbertson D.S., Olson J.S. // Protein Folding and Metal Ions: Mechanisms, Biology, Disease. London: Taylor and Francis, 2010. P. 97.
Jia P.W., Buehler R.A., Boykins R.M. et al. // J. Biol. Chem. 2007. V. 282. P. 4894.
Salmeen A., Andersen J.N., Myers M.P. et al. // Nature. 2003. V. 423. P. 769.
Nakamura T., Yamamoto T., Abe M. et al. // Proc. Natl. Acad. Sci. USA. 2008. V. 105. P. 6238.
Giles N.M., Watts A.B., Giles G.I. et al. // Chem. Biol. 2003. V. 10. P. 677.
Arakawa T., Kawano Y., Katayama Y. et al. // J. Am. Chem. Soc. 2009. V. 131. P. 14838.
Sieracki N.A., Tian S., Hadt R.G. et al. // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 924.
Poltorak O.M., Chukhray E.S., Torshin I.Y. et al. // J. Mol. Catalysis. B: Enzymatic. 1999. V. 7. P. 165.
Wang J., Steiglitz K.A., Kantrowitz E.R. // Biochemistry. 2005. V. 44. P. 8378.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


