Кристаллография, 2020, T. 65, № 1, стр. 49-53
Структура поликристаллических гидридов интерметаллического соединения CeNi3 при температуре 293 и 5 K
С. А. Лушников 1, *, Т. В. Филиппова 1, И. А. Бобриков 1, 2
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Объединенный институт ядерных исследований
Дубна, Россия
* E-mail: Lushnikov@hydride.chem.msu.ru
Поступила в редакцию 28.05.2018
После доработки 18.09.2018
Принята к публикации 27.11.2018
Аннотация
Исследована структура поликристаллических образцов гидридных фаз CeNi3Н3.0 при 5 и 293 K методом нейтронной дифракции. Гидриды имеют ромбическую решетку (пр. гр. Pmcn, № 62, Z = 12). Определены позиционные параметры атомов металлов и водорода. Установлено, что при 5 K распределение атомов водорода по позициям структуры гидрида близко к распределению водорода при комнатной температуре. Сравнение нейтронограмм, снятых при разных температурах, указывает на изменение микроструктуры образцов при охлаждении.
ВВЕДЕНИЕ
Интерметаллические соединения редкоземельных металлов являются перспективными материалами для компактного и безопасного хранения водорода и могут использоваться в водородной энергетике [1]. Интерметаллическое соединение принадлежит к группе соединений состава RT3 (R – редкоземельный металл, T = Fe, Co, Ni). Большинство соединений из этой группы кристаллизуется в двух структурных типах: PuNi3 (пр. гр. R$\bar {3}$m, № 166) и CeNi3 (пр. гр. P63/mmc, № 194). CeNi3 имеет блочное строение и состоит из фрагментов RT2 (структурный тип MgZn2) и RT5 (структурный тип CaCu5), которые послойно расположены перпендикулярно оси z. В [2] показано, что кристаллическая решетка RT3 содержит междоузлия, в которых возможно размещение атомов водорода. Эти междоузлия соответствуют тетраэдрическим (24l, 12k, 4f, 4e) и октаэдрическим (6h) кристаллографическим позициям. Подробное исследование взаимодействия CeNi3 с водородом было проведено в [3]. В этой работе было установлено, что в ходе реакции образуется гидридная фаза с составом, соответствующим CeNi3H3.0. Построенная изотерма абсорбции имеет плато при равновесном давлении 0.09 бар и температуре 50°C, что свидетельствует о высокой стабильности обнаруженной фазы. Рентгенографический анализ образца гидрида CeNi3H3.0 показал, что он имеет гексагональную кристаллическую решетку исходного интерметаллида, значительно расширенную вдоль оси z (около 30%). В [4] методом нейтронной дифракции исследовали структуру гидрида на основе CeNi3H2.8 с меньшим содержанием водорода. Было установлено, что водород в основном распределен в пустотах структурных блоков CeNi2 металлической матрицы. Большой объемный эффект этих структурных фрагментов (расширение составляет почти 60%), возникающий после заполнения их водородом, привел к значительному искажению кристаллической решетки и понижению ее симметрии от гексагональной до ромбической. В [5] с помощью дифракции нейтронов исследовали структуру гидридных фаз CeNi3 с большим содержанием водорода, соответствующим 3.3–5.0 атомам. Было обнаружено, что с увеличением концентрации водорода в гидриде CeNi3H3.0 произошло частичное заполнение междоузлий структурных блоков состава CeNi5. В гидриде CeNi3H5.0 с наибольшей концентрацией водорода происходит дальнейшее заполнение водородом пустот в структурных блоках CeNi5. Из-за увеличенных объемных эффектов в процессе гидридообразования наблюдается нарушение ближнего порядка кристаллической решетки гидрида, и образец синтезированного гидрида CeNi3H5.0 получается частично аморфизированным. В [6] отмечено, что образцы гидридных фаз интерметаллида CeNi3 демонстрируют различную стабильность после воздействия на них низкой температуры. Такое поведение, вероятно, связано с частичным упорядочением водорода в металлической подрешетке при понижении температуры. Аналогичное поведение водорода при понижении температуры было отмечено в хорошо изученных гидридах d-металлов [7]. В настоящей работе методом нейтронной дифракции исследована структура гидридной фазы CeNi3H3.0 при комнатной температуре и 5 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы CeNi3 выплавлены из церия и никеля высокой чистоты в электродуговой печи в инертной атмосфере. Полученные сплавы отжигали в вакуумированных кварцевых ампулах при температуре 873 K в течение 240 ч. Синтез гидридов проводили на установке типа Сивертса с рабочим диапазоном давления до 100 бар. Количество водорода в синтезированных гидридных фазах контролировали методом высокотемпературной экстракции водорода. Для этого образцы гидридов разлагали при повышенной температуре и определяли количество выделившегося водорода. Фазовый состав образцов контролировали с помощью рентгеновской дифракции. В настоящей работе для упрощения говорится о гидридных фазах, содержащих водород. Однако во всех нейтронографических экспериментах (как в литературе, так и в настоящей работе) использовали образцы с дейтерием для снижения некогерентного рассеяния нейтронов и улучшения качества нейтронодифракционных спектров. Съемку образцов (шесть порций) проводили при 293 и 5 K. Нейтронографические данные были получены на фурье-дифрактометре высокого разрешения на реакторе ИБР-2 в ОИЯИ (г. Дубна). Рентгенографические данные получены на дифрактометре Rigaku D/max-2500 (CuKα1-излучение). Структуру и фазовый состав образцов гидридов и интерметаллидов уточняли с помощью метода Ритвельда по программе Fullprof [8].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Рентгенографические данные показали, что образцы CeNi3 являются однофазными с параметрами решетки a = 4.953(3) и c = 16.49(2) Å, близкими к a = 4.940(3) и c = 16.53(2) Å (пр. гр. P63/mmc, № 194, Z = 6) [9]. Проведенный рентгенофазовый анализ показал, что гидриды имеют ромбическую решетку с параметрами a = 4.859(3), b = 8.556(3) и c = 21.57(2) Å (пр. гр. Pmcn, № 62, Z = 12). Параметры и тип решетки синтезированных образцов гидридных фаз близки к параметрам гидридной фазы CeNi3H2.8, исследованной в [4]. Содержание водорода в синтезированных гидридах CeNi3H2.8–3.0 также практически соответствует составу гидрида [4]. Полученные нейтронографические данные приведены на рис. 1 и в табл. 1 и 2. В процессе расчета при комнатной температуре уточняли заселенности позиций возможных типов, координат атомов водорода и атомов металлов. Наилучшее соответствие с экспериментальными данными (Rw = 7%) получено для модели структуры, в которой атомы водорода в основном расположены в междоузлиях фрагментов CeNi2 (табл. 1) и в незначительном количестве на границе структурных блоков CeNi2 и CeNi5. Такое распределение водорода также согласуется с данными [4] для гидрида с ромбической решеткой (рис. 2). Уточнение параметров структуры образца гидрида при 5 K показало, что наилучшее согласие (Rw = 5%) достигается для модели, в которой атомы водорода также распределены в структурных фрагментах кристаллической решетки CeNi2 (табл. 2). Параметры кристаллической решетки образцов гидридов при комнатной температуре a = 4.867(3), b = 8.551(3) и c = 21.55(1) Å соответствуют объему ячейки V = 896.9(1) Å3. При 5 K параметры a = 4.857(3), b = 8.535(3) и c = = 21.50(1) Å меньше и соответствуют объему ячейки V = 891.3(1) Å3. Уменьшение объема элементарной ячейки образцов гидридных фаз при снижении температуры составило 5.6 Å3. Эта величина примерно соответствует относительному уменьшению объема ΔV/V = 0.6%, которое близко к данным [7] для гидридов d-металлов и интерметаллических соединений. В этой работе было установлено, что при понижении температуры до 4.2 K для гидридов характерно уменьшение объема кристаллической решетки, которое косвенно свидетельствует о металлическом характере связи между атомами металла и водорода. В рассматриваемом случае аналогичное изменение объема указывает на металлический характер связи в изученных гидридах.
Рис. 1.
Дифрактограммы образцов гидрида интерметаллического соединения CeNi3, измеренные на нейтронном дифрактометре и обработанные методом Ритвельда при температуре: а – 293 K (Rw = 7%), б – 5 K (Rw = 5%). Показаны экспериментальный (точки), расчетный (верхняя линия) профили и разность между ними (нижняя линия), штрихи соответствуют углам Брэгга.
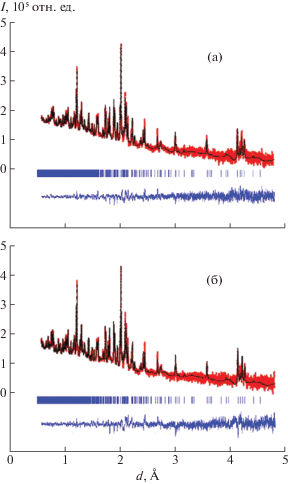
Таблица 1.
Структурные данные образца гидрида CeNi3 при 293 K
| Атом | Позиция | Координаты | Заселенность | Окружение междоузлий | ||
|---|---|---|---|---|---|---|
| x | y | z | ||||
| Ce1 | 4c | 0.25 | 0.439(2) | 0.255(2) | 1.0 | |
| Ce2 | 4c | 0.25 | 0.372(3) | 0.056(3) | 1.0 | |
| Ce3 | 4c | 0.25 | 0.089(2) | 0.938(2) | 1.0 | |
| Ni1 | 4c | 0.25 | 0.754(3) | 0.530(2) | 1.0 | |
| Ni2 | 4c | 0.25 | 0.927(2) | 0.335(2) | 1.0 | |
| Ni3 | 4c | 0.25 | 0.746(2) | 0.248(2) | 1.0 | |
| Ni4 | 4c | 0.25 | 0.087(3) | 0.251(3) | 1.0 | |
| Ni5 | 4c | 0.25 | 0.939(3) | 0.155(3) | 1.0 | |
| Ni6 | 8d | 0.003(2) | 0.823(3) | 0.838(2) | 1.0 | |
| Ni7 | 8d | 0.501(2) | 0.177(2) | 0.357(3) | 1.0 | |
| H1 | 4c | 0.25 | 0.746(2) | 0.886(2) | 1.0 | Ce22Ni2Ni62 |
| H2 | 4c | 0.25 | 0.087(3) | 0.110(3) | 1.0 | Ce22Ce3Ni5Ni62 |
| H3 | 4c | 0.25 | 0.919(3) | 0.478(3) | 1.0 | Ce23Ni1 |
| H4 | 4c | 0.25 | 0.234(3) | 0.648(2) | 1.0 | Ce1Ce2Ni62 |
| H5 | 8d | –0.001(2) | 0.167(2) | 0.007(3) | 1.0 | Ce2Ce32Ni1 |
| H6 | 4c | 0.25 | 0.786(2) | 0.103(3) | 1.0 | Ce32Ni1Ni5Ni72 |
| H7 | 4c | 0.25 | 0.940(2) | 0.377(3) | 1.0 | Ce22Ni2Ni72 |
| H8 | 4c | 0.25 | 0.416(3) | 0.184(3) | 0.9 | Ce1Ce2Ni72 |
Таблица 2.
Структурные данные образца гидрида CeNi3 при 5 K
| Атом | Позиция | Координаты | Заселенность | Окружение междоузлий | ||
|---|---|---|---|---|---|---|
| x | y | z | ||||
| Ce1 | 4c | 0.25 | 0.438(2) | 0.256(3) | 1.0 | |
| Ce2 | 4c | 0.25 | 0.371(3) | 0.056(3) | 1.0 | |
| Ce3 | 4c | 0.25 | 0.088(2) | 0.937(2) | 1.0 | |
| Ni1 | 4c | 0.25 | 0.752(3) | 0.531(2) | 1.0 | |
| Ni2 | 4c | 0.25 | 0.928(3) | 0.336(2) | 1.0 | |
| Ni3 | 4c | 0.25 | 0.747(2) | 0.249(2) | 1.0 | |
| Ni4 | 4c | 0.25 | 0.088(3) | 0.252(3) | 1.0 | |
| Ni5 | 4c | 0.25 | 0.938(2) | 0.156(3) | 1.0 | |
| Ni6 | 8d | 0.003(2) | 0.824(3) | 0.837(2) | 1.0 | |
| Ni7 | 8d | 0.501(2) | 0.178(3) | 0.358(3) | 1.0 | |
| H1 | 4c | 0.25 | 0.746(2) | 0.886(2) | 1.0 | Ce22Ni2Ni62 |
| H2 | 4c | 0.25 | 0.087(3) | 0.109(3) | 1.0 | Ce22Ce3Ni5Ni62 |
| H3 | 4c | 0.25 | 0.918(3) | 0.477(3) | 1.0 | Ce23Ni1 |
| H4 | 4c | 0.25 | 0.233(3) | 0.650(2) | 1.0 | Ce1Ce2Ni62 |
| H5 | 8d | –0.001(2) | 0.166(2) | 0.007(3) | 1.0 | Ce2Ce32Ni1 |
| H6 | 4c | 0.25 | 0.785(2) | 0.102(3) | 1.0 | Ce32Ni1Ni5Ni72 |
| H7 | 4c | 0.25 | 0.940(2) | 0.376(3) | 1.0 | Ce22Ni2Ni72 |
| H8 | 4c | 0.25 | 0.418(3) | 0.184(3) | 0.9 | Ce1Ce2Ni72 |
Рис. 2.
Структура CeNi3 (а) и CeNi3D2.8 (б) [4]. Элементарная ячейка CeNi3 состоит из фрагментов CeNi2 (структурный тип MgZn2) и CeNi5 (структурный тип CaCu5). Атомы дейтерия в CeNi3D2.8 локализованы в пустотах фрагментов CeNi2 и между фрагментами CeNi2 и CeNi5, фрагменты CeNi5 не заняты дейтерием.

Нейтронографические данные позволили установить, что в образце гидрида при 5 K практически не наблюдается перераспределения атомов водорода по междоузлиям. Такое поведение водорода вызвано тем, что как ранее было показано в [4], уже при комнатной температуре в гидриде с ромбической решеткой атомы водорода практически полностью упорядочены по междоузлиям подрешеток. Поэтому понижение температуры не приводит к какому-либо их перераспределению, за исключением незначительной части неупорядоченного водорода в пустотах на границе структурных фрагментов CeNi2 и CeNi5. Тем не менее синтезированные образцы гидридов демонстрируют различную стабильность после выдерживания при комнатной температуре и после низкотемпературной закалки. В обычных условиях (комнатной температуре и на воздухе) образцы гидридов разлагаются и полностью десорбируют водород примерно в течение нескольких дней. После низкотемпературной обработки – закалке в жидком азоте при температуре 77 K – и последующем нагреве образцов гидридов до комнатной температуры разложение проходит быстрее, в течение нескольких часов. В данном случае одним из факторов, влияющих на такое поведение водорода в образованных гидридных фазах, по-видимому, является процесс его упорядочения, возникающий при понижении температуры. В рассматриваемом случае из-за достаточно низкой концентрации водорода в гидридной фазе и предпочтительного заполнения пустот в структурных фрагментах CeNi2 гидридная фаза с упорядоченным водородом образовалась уже при комнатной температуре. Однако, как было обнаружено в [5], при увеличении концентрации водорода (более трех атомов на формульную единицу) происходит частичное заполнение междоузлий структурных фрагментов CeNi5, которое влечет их расширение и соответственно сжатие структурных блоков CeNi2. Из-за особенностей строения решетки гидрида – последовательного чередования фрагментов CeNi2 и CeNi5 – расширение фрагментов CeNi5 и сжатие структурных блоков CeNi2 приводят к трансформации кристаллической решетки из ромбической в гексагональную. В гексагональной решетке доля неупорядоченного водорода увеличена, так как при повышении симметрии решетки появляются новые узлы и междоузлия, и число частично вакантных водородных подрешеток возрастает. В этом случае при понижении температуры и упорядочении водорода возможно его перераспределение по междоузлиям подрешеток. Если упорядочение водорода происходит только в некоторой части подрешеток, то другие подрешетки из-за миграции атомов водорода могут остаться вакантными, в этом случае возможно появление фазы интерметаллида CeNi3. Дальнейшее заполнение междоузлий структурных фрагментов CeNi5 при понижении температуры может привести к распаду гидрида на несколько фаз и образованию гидридной фазы с максимальным содержанием водорода. Таким образом, понижение температуры оказывает значительное влияние на поведение водорода в кристаллических решетках со сложной структурой и часто приводит к образованию новых гидридных фаз.
Качественное сравнение нейтронограмм образцов гидридов показало, что при 5 K наблюдаются более узкие пики в области меньших значений межплоскостных расстояний, чем при комнатной температуре. Это позволяет предположить, что образец при 5 K лучше закристаллизован. Различие микроструктуры образцов также может повлиять на перераспределение водорода в подрешетках гидрида при понижении температуры. Как известно, некоторые виды термообработки металлов, например закалка, приводят к изменению размера зерен поликристаллитов в металлическом слитке. В рассматриваемом случае исходное интерметаллическое соединение CeNi3 представляет собой слиток. После взаимодействия с водородом и формирования гидридной фазы образец из слитка превращается в мелкодисперсный порошок. Такое изменение микроструктуры интерметаллида вызвано прежде всего значительными объемными эффектами гидридообразования – относительное увеличение объема кристаллической решетки гидрида при сравнении с объемом решетки интерметаллида достигает почти 30% [3]. Образец гидридной фазы с увеличенной концентрацией водорода CeNi3H5.0 по рентгенографическим данным получается частично аморфизированным. Из-за высокого содержания водорода в гидриде в кристаллической решетке этого образца нарушается ближний порядок, и образец получается мелкокристаллическим. В [7] отмечено, что в гидридах d-металлов процесс упорядочения атомов водорода одновременно сопровождается их диффузией по междоузлиям решетки. При диффузии атомы водорода перемещаются на макроскопические расстояния, а в процессе их упорядочения требуются перемещения на значительно меньшие расстояния. При понижении температуры диффузионная подвижность атомов водорода существенно снижается из-за кинетических факторов, т.е. преобладает процесс упорядочения. В рассматриваемом случае в образованных гидридных фазах на основе CeNi3 при понижении температуры также происходят аналогичные процессы – диффузия и упорядочение атомов водорода. Изменение морфологии металлического порошка после низкотемпературной закалки, по-видимому, оказывает влияние на процесс диффузии в подрешетках. Возможно, мелкокристаллическое состояние образцов способствует более легкой диффузии атомов водорода и дальнейшей его рекомбинации в молекулярный водород. Этот процесс ускоряет разложение гидридной фазы и таким образом способствует ее нестабильности. Для подтверждения такого предположения необходимо исследовать морфологию образцов гидридных фаз после низкотемпературной закалки.
ВЫВОДЫ
Проведено нейтронографическое исследование поликристаллических образцов гидридных фаз интерметаллического соединения CeNi3H3.0 (пр. гр. Pmcn, № 62, Z = 12) при 293 и 5 K. Определены позиционные параметры атомов металлов и водорода в структуре образцов. Установлено, что распределение водорода в междоузлиях металлической матрицы практически не меняется при понижении температуры до 5 K.
Список литературы
Latroche M., Percheron-Guegan A. // J. Alloys Compd. 2003. V. 356–357. P. 461.
Яртысь В.А. // Координац. химия. 1992. Т. 18. № 4. С. 401.
Van Essen R.H., Bushow K.H.J. // J. Less-Common. Met. 1980. V. 70. P. 189.
Yartys V.A., Isnard O., Raybov A.B., Akselrud L.G. // J. Alloys Compd. 2003. V. 356–357. P. 109.
Лушников С.А., Балагуров А.М., Бобриков И.А. и др. // Неорган. материалы. 2007. Т. 43. № 7. С. 1.
Лушников С.А., Филиппова Т.В. // Неорган. материалы. 2013. Т. 49. № 4. С. 1.
Somenkov V.A., Shilshtein S.S. // Prog. Mater. Sci. 1980. V. 24. P. 267.
Rodríguez-Carvajal J. // Newslett. 2001. V. 26. P. 12.
Тейлор К. Интерметаллические соединения редкоземельных металлов. М.: Мир, 1974. 221 с.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


