Кристаллография, 2020, T. 65, № 1, стр. 87-93
Дефектная структура карбида циркония
1 Объединенный институт высоких температур РАН
Москва, Россия
* E-mail: evg-pakhomov@yandex.ru
Поступила в редакцию 24.09.2018
После доработки 27.11.2018
Принята к публикации 13.06.2019
Аннотация
Для минимизации энергии решетки в равновесном состоянии вакансии углерода в кристаллической решетке карбида циркония располагаются упорядоченно (на максимальном удалении друг от друга), что делает строение решетки слоистым, когда вакансии располагаются в каждом втором слое решетки. При выходе на поверхность кристалла такого ослабленного слоя при достижении определенного уровня температуры происходит распад данного слоя с образованием жидкой фазы соответствующего состава. Это определяет ступенчатый вид левой границы области гомогенности решетки, что не противоречит имеющимся экспериментальным и расчетным данным. Предполагается, что расплав карбида циркония в определенной области стехиометрии может быть молекулярным и образовывать одну или более областей несмешиваемости.
ВВЕДЕНИЕ
Карбид циркония является одним из наиболее высокотемпературных неоксидных материалов, сочетающих в себе такие качества, как высокая температура плавления, хорошая термостойкость, прочность, электро- и теплопроводность в сочетании с высокой химической стойкостью, что перспективно для его применения, в частности, в ядерной технике. Но при том что такие работы ведутся сравнительно давно, его свойства исследованы далеко не полно. Подробная информация об актуальности исследования, областях применения и характеристиках карбида циркония содержится в [1, 2]. Роль упорядочения атомов в металлических сплавах детально рассмотрена в [3]. В [4] исследованы влияние упорядочения дефектов на свойства карбида циркония и условия достижения такого упорядочения.
Задача данной работы – анализ влияния упорядочения размещения дефектов в решетке на форму границ области гомогенности карбида циркония (на вид диаграммы состояния).
СТРОЕНИЕ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ КАРБИДА ЦИРКОНИЯ
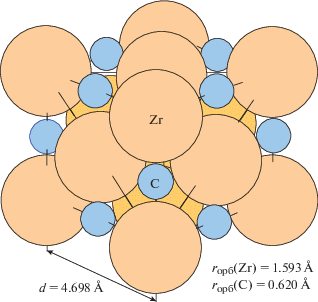
Кристаллическая решетка (КР) карбида циркония типа NaCl (рис. 1) состоит из двух гранецентрированных подрешеток, сдвинутых на полпериода по диагонали ячейки. При 300 K атомы Zr и C в КР чередуются по всем направлениям с периодом d ≈ 4.696 Å. В рамках модели жестких сфер атомы Zr размещаются с зазором ΔZr = 0.135 Å, зазор между атомами Zr и C равен ΔZr–С = 0.445 Å [5, 6] (орбитальные радиусы Zr и C равны 1.593 и 0.62 Å соответственно).
При удалении атома углерода из соответствующего узла решетки образуется полость (вакансия) с радиусом вписанного шара 0.755 Å, которую окружают шесть атомов циркония, а при удалении атома циркония – вакансия с радиусом вписанного шара 1.728 Å, окруженная шестью атомами углерода.
Энтальпия образования карбида циркония из простых веществ (кристаллического циркония и графита) Е(обр. ZrС) = –205 кДж/моль [7]. Энергия образования ZrС из свободных атомов по реакции Zr(г) + С(г) = ZrС(кр) равна Е(субл.Zr) + + Е(субл.С) – Е(обр. Zr С) = 598 + 711 – (–205) = = 1514 кДж/моль [6, 7]. Это энергия связи атомов в данном кристалле.
Грубая оценка показывает, что вклад энергии взаимодействия цирконий–цирконий составляет около 600 кДж/моль, углерод–углерод – около 300 кДж/моль и цирконий–углерод – около 600 кДж/моль, т.е. слабым звеном в решетке является именно подрешетка углерода.
При 300 K, когда в решетке практически нет термических дефектов, размер элементарной ячейки при C/Zr = 0.84 согласно экспериментальным данным максимален [1, 2]. При увеличении и уменьшении числа «химических» вакансий углерода в решетке этот размер уменьшается на 0.2–0.4%.
Расчетная оценка теплоты плавления Q [8] КР карбида циркония, согласующаяся с экспериментальными данными [9], дает по [10] величину температуры плавления бездефектного кристалла Тпл = Q/R (при R = 8.3 Дж/K⋅моль) около 9000–11 000 K, т.е. термические и химические дефекты уменьшают температуру распада КР карбида циркония почти втрое.
Замещение атомов углерода в узлах решетки или заполнение углеродных вакансий возможно только атомами H, He, Ne, N, O, F, Ar, имеющими орбитальные радиусы меньше радиуса углеродной вакансии.
ОСОБЫЕ ЗНАЧЕНИЯ ВЕЛИЧИНЫ НЕСТЕХИОМЕТРИИ х
Принцип минимизации энергии решетки требует, чтобы в равновесном состоянии вакансии располагались в КР упорядоченно и на максимальном удалении друг от друга.
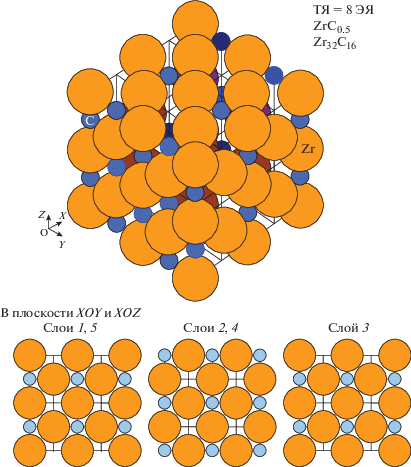
При Т = 0 K в идеальной кубической подрешетке циркония все узлы должны были бы быть заполненными, а в такой же подрешетке углерода при синтезе материала с заданной величиной нестехиометрии происходило бы образование «химических» вакансий из-за его нехватки. В равновесном состоянии такого кристалла максимально возможное число упорядоченных “химических” вакансий в подрешетке углерода было бы равно 0.5, когда вакансии и атомы углерода чередовались бы в решетке по всем направлениям. Это соответствует величине соотношения С/Zr = 0.5 и составу ZrC0.5.
В результате образуется ZrC – структура, в которой по одной из осей чередуются полностью заполненные слои (без вакансий, с ххим = 1) и слои, в которых нет углерода (ххим = 0) (рис. 2). Вдоль этой оси связь между полностью заполненными слоями осуществляется только атомами циркония.
Рис. 2.
Вид трансляционной ячейки (ТЯ), состоящей из восьми элементарных ячеек (ЭЯ), кристаллической решетки карбида состава ZrC0.5 и строение ее слоев в плоскостях XOY и XOZ. В плоскости ZOY первый, третий и пятый слои полностью заполнены, а второй и четвертый не содержат углерода.
При случайном перемещении вакансий по диагоналям граней в результате обменных перемещений (перескоков) типа атом–вакансия слои заполненные и слои без углерода меняются местами. Когда слой из атомов циркония (без углерода) оказывается на поверхности, что соответствует максимуму энергии взаимодействия в решетке, т.е. минимуму ее потенциальной энергии, он становится адсорбционным слоем. Такой слой при любом возмущении перекристаллизуется в металлический цирконий – происходит выпадение второй фазы.
Важно, что для образования одиночной элементарной ячейки из девяти атомов металлического циркония, имеющего при Т > 1150 K ОЦК-решетку, нужно чтобы на поверхности кристалла карбида циркония появилась компактная группа без углерода также из не менее девяти атомов циркония. На примере кубической группы из восьми элементарных ячеек (ЭЯ) размером 2d × × 2d × 2d видно, что для предотвращения распада ее поверхностного слоя из восьми атомов циркония, оказавшегося без углерода, достаточно введения в этот слой одного атома углерода.
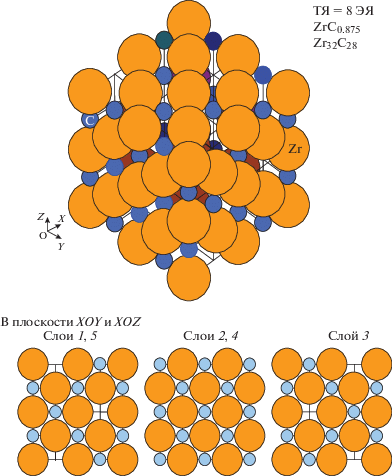
Следующее возможное упорядоченное расположение “химических” вакансий соответствует их расположению в углеродной подрешетке через один углеродный узел (через три узла общей решетки) по всем направлениям (рис. 3). При этом образуется трансляционная элементарная ячейка (ТЯ) с размером ребра 2d, состоящая из восьми ЭЯ, которая может смещаться вдоль диагоналей ЭЯ и поворачиваться. В каждой такой ТЯ, содержащей по 32 углеродных и циркониевых узла решетки, располагаются четыре вакансии, которые образуют гранецентрированный куб с величиной ребра 2d. В этом случае ххим = С/Zr = 28/32 = 0.875 согласно экспериментальным данным, имеющим существенный разброс, температура плавления максимальна, как и величина периода решетки d при 300 K.
Рис. 3.
Вид трансляционной ячейки (ТЯ), состоящей из восьми элементарных ячеек (ЭЯ), кристаллической решетки карбида состава ZrC0.875 и строение ее слоев в плоскостях XOY и XOZ. В плоскости ZOY первый, третий и пятый слои полностью заполнены, а второй и четвертый содержат по две вакансии углерода.
В такой решетке по всем осям чередуются полностью заполненные слои и слои, содержащие вакансии, которые могут меняться местами, т.е. “химические” вакансии оказываются размещенными в половине объема решетки (в каждом втором слое) и соответственно их концентрация в этой половине объема удваивается и составляет 0.25.
Далее возможно расположение вакансий через три узла решетки, что дает наличие четырех вакансий в каждом объеме 3 × 3 × 3 = 27 ЭЯ со 108 углеродными узлами, что соответствует величине ххим = 104/108 = 0.963. При расположении вакансий через четыре узла решетки ххим = 0.9844 и так далее.
Важно, что особенность КР нестехиометрического карбида циркония – образование слоистой структуры с удвоенной концентрацией вакансий в каждом втором слое – действует во всей области 0.5 < ххим < 0.875.
Упорядоченное состояние не может быть стабильным при высоких температурах. Именно поэтому рентгенофазовое исследование при заданной температуре или после «замораживания», как правило, не может его обнаружить (это удается только для относительно невысоких температур (ниже 1000–1500 K) после медленного отжига [4].
Важно другое. При постоянном случайном переборе обратимых перемещений атом углерода–вакансия и реализации в результате этого всех возможных пространственных распределений вакансий в решетке рано или поздно реализуется такое распределение, при котором в каком-то участке поверхности кристалла появляется поверхностный слой КР, не способный выдержать данную температуру и поэтому распадающийся с выделением второй фазы. Если температура для сосуществования второй фазы с основной фазой выше равновесной, то этот процесс продолжается до освобождения КР ото всех «слабых» участков решетки, если ниже – выделившаяся вторая фаза кристаллизуется обратно. Таким образом, именно стремление КР к упорядоченному состоянию определяет положение границ ее устойчивости.
ДЕФЕКТЫ В РЕШЕТКЕ КАРБИДА ЦИРКОНИЯ И ЕГО ДИАГРАММА СОСТОЯНИЯ
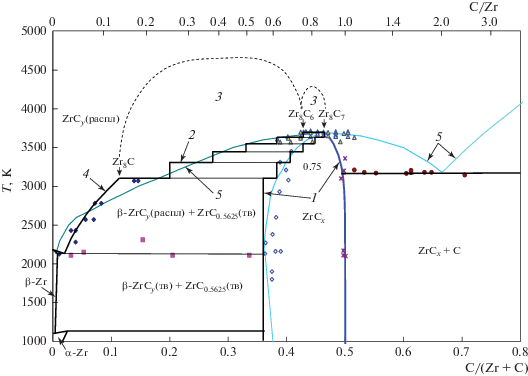
Диаграмма состояния карбида циркония приведена на рис. 4.
Рис. 4.
Диаграмма состояния карбида циркония: точки – имеющиеся экспериментальные данные о положении границ; кривые – полученные границы устойчивости: 1 – твердый ZrCx, 2 – расплав ZrСх, 3 – область несмешиваемости расплавов, 4 – экстраполяция экспериментальных данных о пределе растворимости углерода в жидком цирконии, 5 – результаты термодинамического расчета положения границ по [1].
В любой КР всегда есть “термические” дефекты, количество которых зависит от температуры. Их образование происходит при случайном уходе атомов из своих узлов решетки (с образованием в ней вакансий) в междоузельное пространство или на поверхность кристалла.
Принципиально важно, что в КР карбида циркония между тремя гранецентрирующими атомами циркония и атомом циркония в вершине ЭЯ нет междоузельных полостей с радиусом вписанной окружности больше 0.32 Å, что исключает возможность образования в ней междоузельных дефектов (дефектов Френкеля, когда один из атомов решетки переходит в междоузлие).
Рассмотрим возможность образования дефектов Шоттки в результате случайного выхода атомов на поверхность кристалла ZrC. В бинарных соединениях образующиеся при этом в поверхностном слое пары вакансий дрейфуют в объем кристалла, уменьшая его плотность, а вышедшие на поверхность пары атомов достраивают решетку, увеличивая размер кристалла.
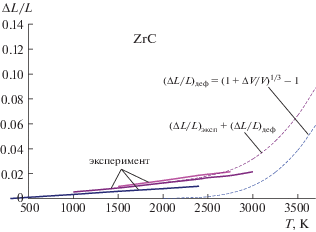
Простая оценка для экстремального состояния карбида циркония (Т = 3700 K и х = 0.875) с выходом требуемых (как будет видно из нижеследующего анализа) для обеспечения распада КР 6/32 = 0.1875 ат. % пар атомов (Zr + C) дает относительное увеличение объема ΔV/V = 0.1875. Это соответствует увеличению размера образца 1 + + ΔL/L = (1 + ΔV/V)1/3 = 1.059 сверх его увеличения в результате усиления тепловых колебаний атомов в узлах решетки, равного по экстраполяции имеющихся экспериментальных данных (до 3000 K) примерно 2.5–3% [1] (рис. 5). По имеющимся экспериментальным данным этого явно не может быть, т.е. в карбиде циркония образования классических дефектов Шоттки, видимо, не происходит.
Рис. 5.
Сравнение экспериментальных данных [1] о зависимости размера образца от температуры с оценкой вклада увеличения его размера, если бы образовывались дефекты Шоттки.
Правая граница устойчивости. Так как в подрешетке циркония нет вакансий, возможны только случайные переходы атом углерода в узле–вакансия углерода и обратно, которые не изменяют состояния кристалла пока при увеличении температуры число таких переходов – концентрация термических дефектов – не становится больше концентрации имеющихся химических вакансий. После этого происходит выброс атомов углерода из решетки, что ведет к образованию на поверхности монокристаллов (кристаллитов) новой фазы – твердого графита или расплава с большим его содержанием. В объеме кристалла при этом увеличивается концентрация вакансий углерода. Следовательно, стехиометрический карбид циркония может быть устойчив только при Т = 0 K.
Согласно экспериментальным данным [1], при Т ≈ 3200–3100 K граница устойчивости лежит между значениями 0.992 ≤ ххим ≤ 0.972. Примем, что ххим = 0.98 для 3200 K, что вместе с граничным значением xхим = 0.875 для Т = 3700 K дает зависимость концентрации термических вакансий VC углерода в объеме КР от температуры: VCтерм = = 15 507exp(–43 395/T) с величиной энергии активации 360 кДж/моль (3.74 эВ), определяющую положение правой границы устойчивости карбида циркония (рис. 4). Отметим, что эта величина близка к оценке энергии взаимодействия углерод–углерод в КР ZrC (∼300 кДж/моль).
Левая граница устойчивости. Выше отмечалось, что для обеспечения устойчивости КР без термических дефектов с ххим = 0.5 при Т = 0 K достаточно в каждую ТЯ (группу из восьми ЭЯ с 32 атомами циркония и 16 атомами углерода и с двумя слоями без углерода) ввести минимум два атома углерода (по одному атому в каждый слой без углерода), чтобы предотвратить ее распад. Это соответствует составу Zr32C18 = ZrC0.5625, т.е. х = = 0.5625 является пределом устойчивости данной КР. При уменьшении содержания углерода ниже этого предела (в области 0 ≤ х ≤ 0.5625) в структуре кристалла появляются ТЯ, содержащие слои без углерода, которые при своем случайном выходе на поверхность распадаются с выделением чистого циркония, что определяет в этой области х горизонтальное положение границы устойчивости при Т = 0 K (рис. 4).
Для начала выделения второй фазы из состава с х ∈ [0.5625, 0.625], когда в каждом слое с вакансиями в ТЯ число атомов углерода либо один, либо два, нужно удалить (хотя бы временно) из поверхностного слоя с вакансиями, содержащего восемь атомов циркония и один атом углерода, этот углерод (3.125 ат. % С от состава ТЯ). Только повышением температуры можно инициировать случайный обратимый выход этого атома углерода наружу из поверхностного слоя состава ZrC0.125 (внутрь ТЯ нельзя, так как в следующем, полностью заполненном слое, углеродных вакансий нет).
В результате в поверхностном слое кристалла появятся ТЯ, поверхностный слой которых временно не содержит углерода и поэтому вместе с одним атомом углерода над ним распадается. Соответственно в расплав переходят восемь атомов циркония этого слоя плюс один атом углерода над ним, что дает состав второй фазы (расплава) ZrC0.125, равный исходному составу поверхностного слоя.
Отметим, что такой состав расплава ZrC0.125 или Zr8C может соответствовать образованию молекул со строением “примитивный циркониевый куб, объемно-центрированный углеродом” (подобное строение имеет изолированная ЭЯ кристалла чистого циркония Zr9).
Максимальная растворимость углерода в твердом α-цирконии не превышает 3 ат. % при Т = = 1150 K, а в β-цирконии – 1.4% при Т = 2100 K. Значит, граница устойчивости состава ZrC0.5625 (Т ≈ 3100 K) должна подниматься вертикально (рис. 4) выше температуры плавления циркония до достижения требуемого состава жидкой фазы ZrC0.125 (по положению экспериментальной кривой – кривая 4 на рис. 4 – предела растворимости углерода в расплаве циркония). В области Т < < 3100 K граница устойчивости раствора углерода в цирконии соответствует выпадению из него карбида циркония постоянного состава ZrC0.5625, в то время как состав жидкой фазы определяется пределом растворимости углерода в жидком цирконии.
В области х ∈ [0.5625, 0.625] при Т ≈ 3100 K происходит выделение из кристалла всех слоев, содержащих по одному атому углерода (с увеличением содержания углерода в остающейся твердой фазе), в результате граница устойчивости твердой фазы горизонтальна.
При охлаждении расплава при х ∈ [0.125, 0.125] ниже Т ≈ 3100 K при х = 0.5625 происходит выпадение твердой фазы, т.е. граница устойчивости жидкой фазы здесь также горизонтальна.
В области х ∈ [0.625, 0.6875], с количеством атомов углерода от двух до трех в каждом слое с вакансиями, для инициирования выделения второй фазы нужно удалить из поверхностного слоя с вакансиями уже минимум два атома углерода, что требует своего, более высокого уровня температуры и приводит к выделению расплава состава ZrC0.25. Граница устойчивости при х = 0.625 вертикальна, а в области х ∈ [0.625, 0.6875] это Т = = const (рис. 4).
В идеально равновесных условиях (при бесконечно медленном изменении температуры) с полным упорядочением размещения дефектов могли бы формироваться упорядоченные структуры с наличием в ТЯ большего размера (n + 0.25), (n + + 0.5) и (n + 0.75) атомов углерода, что привело бы к образованию на линиях солидус и ликвидус ступенек через каждые Δх = 0.03125. Однако достижение таких упорядоченных равновесных состояний при расстоянии между дефектами больше ∼10 Å скорее всего недостижимо (не существует молекул и кристаллов с расстоянием между взаимодействующими атомами больше 6–10 Å). При конечной скорости изменения температуры реализуется, по-видимому, некоторое сглаженное изменение границ устойчивости твердой и жидкой фаз.
Далее в областях 0.6875 ≤ х ≤ 0.75 с количеством атомов углерода в каждом слое с вакансиями от трех до четырех и 0.75 ≤ х ≤ 0.8125 с количеством атомов углерода от четырех до пяти в каждом слое с вакансиями аналогично получаем составы расплава ZrC0.375 и ZrC0.5 соответственно.
Наконец, для области 0.8175 ≤ х ≤ 0.875 с количеством атомов углерода в каждом слое с вакансиями от пяти до шести аналогично получаем состав расплава ZrC0.625 с соответствующим положением границ устойчивости, а для х = 0.875 – состав расплава ZrC0.75.
При х = 0.875 пересекаются две границы устойчивости – левая и правая. Положение второй, правой границы устойчивости, определяется, как отмечалось выше, превышением концентрации термических вакансий углерода над концентрацией имеющихся химических вакансий углерода. Это приводит к выходу в расплав с поверхности ТЯ еще одного атома углерода, что изменяет состав расплава на ZrC0.875. При этом состав твердой фазы возвращается к исходному и продолжается ее полный распад по тому же механизму, т.е. при х = 0.875 карбид циркония плавится конгруэнтно (без изменения состава).
Таким образом, максимальной температуре потери устойчивости 3700 K (температуре конгруэнтного плавления) соответствуют два разных равновесных значения состава расплава – ZrC0.75 и ZrC0.875 (или Zr8C6 и Zr8C7). Логично предположить, что это несмешивающиеся молекулярные расплавы, состоящие из молекул Zr8C6 (со строением “примитивный циркониевый куб, гранецентрированный углеродом”) и молекул Zr8C7 (со строением “примитивный циркониевый куб, гране- и объемно-центрированный углеродом”) и образующие на диаграмме состояния купол несмешиваемости (кривая 3 на рис. 2). Возможно, расплавы Zr8C – примитивный циркониевый куб с атомом углерода в центре и Zr8C6 – также образуют область несмешиваемости.
Для ZrC0.875 при 3700 K обратимый случайный одновременный выход из поверхностного слоя ТЯ шести атомов углерода соответствует образованию в поверхностном слое ТЯ, содержащем восемь углеродных узлов решетки, 75 ат. % термических углеродных вакансий. Для ZrC0.5625 при 3100 K удаление одного из восьми атомов углерода в поверхностном слое для обеспечения распада состава соответствовало образованию 12.5% термических вакансий. Это дает зависимость от температуры концентрации в КР термических вакансий углерода в поверхностном слое VCтерм = = 7861.6exp(–34252.5/T) с величиной энергии активации 285 кДж/моль (2.95 эВ). Данная величина близка к оценке энергии образования вакансий в объеме КР для правой границы устойчивости (360 кДж/моль).
На рис. 4 приведены экспериментальные и расчетные данные о положении границ устойчивости циркония, карбида циркония и углерода [1] в сравнении с результатами, полученными из анализа особенностей пространственного строения КР нестехиометрического карбида циркония.
Видно, что полученная картина не противоречит экспериментальным и термодинамическим расчетным данным и предлагает ряд новых особенностей, в частности ступенчатый вид границ устойчивости при реализации равновесных состояний, возможность существования молекулярного состава расплавов и соответственно наличие куполов их несмешиваемости.
Влияние примесей. Качественно внедрение в решетку нестехиометрического карбида циркония небольшого числа атомов кислорода, азота или фтора соответствует уменьшению в ней при заданном количестве углерода числа химических вакансий. В результате границы устойчивости должны смещаться влево в соответствии с уменьшением числа вакансий.
ВЫВОДЫ
Анализ дефектной структуры кристаллической решетки чистого карбида циркония в равновесном состоянии с упорядочением пространственного размещения дефектов дал принципиально другой, ступенчатый вид диаграммы состояния, не противоречащий имеющимся экспериментальным и расчетным данным. Определен вид термических дефектов в его кристаллической решетке, получено их количественное описание, предположена возможность существования разных молекулярных расплавов, образующих области несмешиваемости.
Приведенное рассмотрение применимо также к карбидам титана и гафния.
Список литературы
Jackson H.F., Lee W.E. // Comprehensive Nuclear Materials / Ed. Konnings Rudy J.M. London: Elsevier Ltd., 2012. P. 339.
Katch Y., Vasudevamurthy G., Nozawa T., Snead L.S. // J. Nucl. Mater. 2013. V. 441. P. 718.
Кривоглаз М.А., Смирнов А.А. Теория упорядочивающихся сплавов. М.: ГИФМЛ, 1958. 388 с.
Ремпель А.А. Эффекты упорядочения в нестехиометрических соединениях внедрения. Екатеренбург: Наука, 1992. 231 с.
Миркин Л.И. Справочник по рентгеноструктурному анализу поликристаллов. М.: ГИФМЛ, 1961. 863 с.
Ефимов А.И., Белорукова Л.П., Василькова И.В., Чечев В.П. Свойства неорганических соединений. Спр. Л.: Химия, 1983. 389 с.
Свойства элементов. Часть 1. Физические свойства. / Под ред. Самсонова Г.В. М.: Металлургия, 1976. 599 с.
БрыкинМ.В. // Теплофизика высоких температур. 2015. Т. 53. № 6. С. 851.
Savvatimskiy A.I., Onufriev S.V. // J. Mater. Res. 2017. V. 32. № 7. P. 1287.
Пахомов Е.П. // Теплофизика высоких температур. 2014. Т. 52. № 4. С. 637.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография