Кристаллография, 2020, T. 65, № 1, стр. 59-61
Прототропная таутомерия салицилидениминов: кристаллическая структура 3,5-дихлорсалицилиденаллилимина
В. С. Сергиенко 1, 2, *, В. Л. Абраменко 3, Ю. Е. Горбунова 1
1 Институт общей и неорганической химии РАН
Москва, Россия
2 Всероссийский институт научной и технической информации РАН
Москва, Россия
3 Луганский национальный университет
Луганск, Украина
* E-mail: sergienko@igic.ras.ru
Поступила в редакцию 28.05.2018
После доработки 28.05.2018
Принята к публикации 21.11.2018
Аннотация
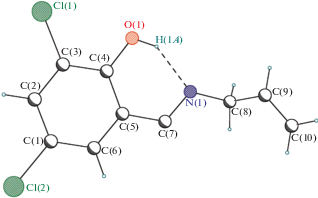
Проведены синтез и рентгеноструктурный анализ азометина, производного 3,5-дихлорсалицилового альдегида и аллиламина. В соединении реализуется енолиминная таутомерная форма (атом водорода локализован рядом с атомом кислорода). Структура стабилизирована внутримолекулярной водородной связью О(1)–Н(1А)···N(1) (О–Н 0.82 Å, H···N 1.91 Å, O···N 2.580 Å, угол О–H–N 138°).
ВВЕДЕНИЕ
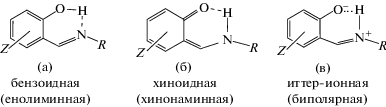
Результаты многочисленных исследований показали, что в растворах органических растворителей салицилиденимины (о-оксиазометины) существуют в виде равновесной смеси различных таутомеров (а–в), соотношение между которыми зависит от природы растворителей и азометинов [1–3]. При их кристаллизации из растворов возможна фиксация следующих таутомерных форм:
В некоторых случаях салицилиденимины кристаллизуются в виде смеси равновесных таутомерных ОН- и NH-форм, содержание каждой из которых колеблется при изменении температуры [4, 5].В настоящем сообщении представлены результаты синтеза и рентгеноструктурного анализа (РСА) азометина, производного 3,5-дихлорсалицилового альдегида и аллиламина (I).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез I. К раствору 1.91 г (0.01 моль) 3,5-дихлорсалицилового альдегида в 20 мл этанола добавляли 0.57 г (0.01 моль) аллиламина. Смесь кипятили в течение 10 мин и оставляли для кристаллизации в холодильнике на сутки. Выпавшие кристаллы желтого цвета фильтровали с помощью фильтра Шотта, промывали холодным этанолом и сушили в токе сухого аргона, Тпл = 54–55°C.
ИК-спектр I регистрировали на спектрометре ИКС-29 в суспензии вазелинового масла. ИК-спектр представлял собой набор полос: 1645, 1627, 1600, 1575, 1320, 1300, 1280, 1220, 1180, 1100, 1030, 990, 930, 880, 868, 852, 820, 740, 710, 640, 562, 460 см–1.
Рентгеноструктурный анализ
Экспериментальный материал для кристаллов I получен на автоматическом дифрактометре Enraf Nonius CAD-4. Структура расшифрована прямым методом и уточнена методом наименьших квадратов в полноматричном анизотропном приближении тепловых смещений всех атомов, кроме атомов водорода (SHELXL-97) [6]. Позиции атомов водорода рассчитаны геометричеcки и уточнены с использованием модели “наездника”. Aтом H(1A) в структуре I найден из разностного синтеза Фурье и уточнен в изотропном приближении тепловых смещений. Параметры элементарной ячейки и основные характеристики эксперимента приведены в табл. 1, межатомные расстояния и валентные углы – в табл. 2. Полные кристаллографические характеристики депонированы в Кембриджский банк структурных данных (ССDС № 1844695; http://www.ccdc.cam.ac.uk/deposit/).
Таблица 1.
Кристаллографические данные, основные характеристики эксперимента и результаты уточнения параметров структуры I
| Брутто-формула | C10H8Cl2NO |
|---|---|
| M | 229.07 |
| Цвет | Желтый |
| Размер кристалла, мм | 0.13 × 0.11 × 0.03 |
| Сингония, пр. гр. | Моноклинная, P21/c |
| a, b, c, Å | 4.2575(1), 12.177(1), 20.734(1) |
| β, град | 93.24(1) |
| V, Å3 | 1073.2(3) |
| Z | 4 |
| ρвыч, г/см3 | 1.418 |
| μ, мм–1 | 5.166 |
| F(000) | 468 |
| Т, K | 293(2) |
| Излучение; λ, Å | CuKα; 1.54178 |
| Тип сканирования | ω |
| θ, град | 4.21–64.94 |
| Пределы h, k, l | –1 ≤ h ≤ 5, –14 ≤ k ≤ 14, –24 ≤ l ≤ 24 |
| Поправка на поглощение Тmin, Тmax | Полуэмпирическая 0.5532, 0.8604 |
| Число отражений: измеренных/независимых (N1)/с I ≥ 2σ(I) (N2), Rint | 2920/1419/711, 0.2269 |
| Метод уточнения | по F 2 |
| Число уточняемых параметров | 132 |
| S | 1.037 |
| R1/wR2 по N1 | 0.0738/0.2016 |
| R1/wR2 по N2 | 0.1422/0.2590 |
| Коэффициент экстинкции | 0.009(2) |
| Δρmin, Δρmax, э/Å3 | –0.321, 0.321 |
Таблица 2.
Длины связей и валентные углы в структуре
| Cвязь | d, Å | Связь | d, Å | Угол | ω, град | Угол | ω, град |
|---|---|---|---|---|---|---|---|
| Cl(1)–C(3) | 1.722(7) | C(2)–C(3) | 1.374(9) | C(4)–O(1)–H(1A) | 105(5) | O(1)–C(4)–C(5) | 120.7(7) |
| Cl(2)–C(1) | 1.731(7) | O(1)–C(4) | 1.339(7) | C(7)–N(1)–C(8) | 118.1(7) | C(3)–C(4)–C(5) | 118.9(6) |
| C(3)–C(4) | 1.388(10) | C(4)–C(5) | 1.425(9) | C(6)–C(1)–C(2) | 120.9(7) | C(6)–C(5)–C(4) | 117.5(7) |
| O(1)–H(1A) | 0.82(7) | C(5)–C(6) | 1.399(9) | C(6)–C(1)–Cl(2) | 120.4(6) | C(6)–C(5)–C(7) | 121.1(7) |
| N(1)–C(7) | 1.277(8) | C(5)–C(7) | 1.456(10) | C(2)–C(1)–Cl(2) | 118.7(7) | C(4)–C(5)–C(7) | 121.3(6) |
| N(1)–C(8) | 1.460(11) | C(8)–C(9) | 1.476(12) | C(1)–C(2)–C(3) | 119.8(8) | C(1)–C(6)–C(5) | 121.5(7) |
| C(1)–C(6) | 1.360(10) | C(9)–C(10) | 1.292(13) | C(2)–C(3)–C(4) | 121.2(6) | N(1)–C(7)–C(5) | 120.8(7) |
| C(1)–C(2) | 1.362(10) | C(2)–C(3)–Cl(1) | 119.3(6) | N(1)–C(8)–C(9) | 110.4(9) | ||
| C(4)–C(3)–Cl(1) | 119.5(5) | C(10)–C(9)–C(8) | 123.1(10) | ||||
| O(1)–C(4)–C(3) | 120.3(6) |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Подавляющая часть рентгеноструктурных исследований обсуждаемого класса соединений относится к салицилиден-N-(арил- или гетарил-)иминам (R-производным ароматических или гетероциклических аминов). Салицилиденалкилиминам (R-алкилам) посвящено значительно меньше публикаций. В частности, авторы [7] методом РСА определили, что 2,3-дигидроксибензилиденаллилимин кристаллизуется в енолиминной форме. Проведенный РСА о-оксиазометинов, производных замещенных салициловых альдегидов, и 2-фурфуриламина (R = СН2С4Н4О) показал, что в зависимости от природы и положения заместителя в альдегидном фрагменте в кристалле азометина реализуется либо енолиминная (Z = = 3-OMe) (II) [8], либо биполярная цвиттер-ионная (Z = 4-OН) (III) таутомерная форма [9]. Хинонаминная форма с вкладом биполярной определена в структуре 3-нитро-5-бромсалицилиден-2-фурфурилимина (IV) [10].
В описанной в настоящей работе кристаллической структуре соединения I, как и в II, реализуется енолиминная таутомерная форма (а) (атом водорода Н(1А) локализован рядом с атомом кислорода О(1)). Длины связей в структуре I (O(1)–C(4) 1.339(7), N(1)–C(7) 1.277(8) Å) сопоставимы с аналогичными величинами в структуре II (О–С 1.352(2), N–C 1.275(2) Å). В структуре IV, в которой связи N–C 1.278(7) ± 0.014 Å, как и в I, II, имеют повышенную кратность, существенен вклад хинонаминной формы (атом Н локализован рядом с атомом N). Тем не менее длинная связь N–H 1.07(9) Å в структуре IV свидетельствует о значительной доле цвиттер-ионной биполярной таутомерной формы. В структуре III обе кристаллографически неэквивалентные молекулы имеют цвиттер-ионную форму (О–Н 0.91(8) ± ± 0.04 Å, N–С 1.301(7) ± 0.003 Å, O–C 1.349(7) ± ± 0.001 Å). Отметим, что связи О–С в структуре III существенно длиннее, чем в I, II, IV.
В структуре I, как и в II–IV, замыкается шестичленный Н-цикл NC3OH за счет прочной внутримолекулярной водородной связи O(1)–H(1A)···N(1) (O–H 0.82(7) Å, H···N 1.91(7) Å, O···N 2.580(9) Å, угол O–H–N 138(7)°).
Список литературы
Брень В.А., Минкин В.И. // Изв. вузов. Химия и хим. технол. 1982. Т. 25. № 6. С. 665.
Minkin V.I., Olekhnovich L.P., Zhdanov Yu.A. Molecular Design of Tautomeric Compounds. Doldrecht, Boston, Tokio: D. Reidel, 1988. 271 p.
Гарновский А.Д., Гарновский Д.А., Васильченко И.С. и др. // Успехи химии. 1997. Т. 66. № 5. С. 434.
Ogawa K., Fujiwara T., Harada J. // Mol. Cryst. Liq. Cryst. Sci. Technol. A. 1999. V. 344. № 1. P. 169.
Elerman Y., Kabak M., Kavlakoglu E. et al. // J. Mol. Struct. 1999. V. 510. № 1–3. P. 207.
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. № 1. P. 112.
Rudbari H.A., Khorshidifard M., Askari B. et al. // Polyhedron. 2015. V. 100. P. 180.
Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е., Чураков А.В. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 180.
Сергиенко В.С., Абраменко В.Л, Горбунова Ю.Е. // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1043.
Сергиенко В.С., Абраменко В.Л., Горбунова Ю.Е. // Кристаллография. 2019. Т. 64. № 1. С. 68.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография