Кристаллография, 2020, T. 65, № 1, стр. 94-102
Оптимизация составов твердых электролитов Pb1 – xRxF2 + x co структурой флюорита по проводимости и термической устойчивости
Н. И. Сорокин 1, *, Б. П. Соболев 1
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
* E-mail: nsorokin1@yandex.ru
Поступила в редакцию 21.05.2018
После доработки 28.06.2018
Принята к публикации 28.06.2018
Аннотация
Оптимизация составов нестехиометрических фаз Pb1 – xRxF2 + x (тип CaF2, R – редкоземельные элементы) по ионной проводимости и термической устойчивости основана на температурных измерениях электропроводности монокристаллов и сплавов в зависимости от их ионного радиуса R3+ и содержания RF3 и на исследовании фазовых диаграмм систем PbF2–RF3. Показано, что среди фаз Pb1 – xRxF2 + x максимальные значения проводимости σ500 К = 9.3 × 10–3 и 2.0 × 10–2 См/см и σ293 К = 1.4 × 10–6 и 1.5 × 10–4 См/см имеют кристаллы Pb0.95Yb0.05F2.05 и Pb0.9Sc0.1F2.1 соответственно. Твердый электролит Pb0.9Sc0.1F2.1 обладает величиной σ293 K, достаточной для использования во фтор-ионных сенсорах и источниках тока, функционирующих при комнатной температуре.
ВВЕДЕНИЕ
В [1–3] рассматривался прием нарушения стехиометрии гетеровалентными изоморфными замещениями M2+ (M = Ca, Sr, Ba, Cd) на R3+ (R – редкоземельные элементы Sc, Y, La–Lu – РЗЭ) в катионном мотиве структурного типа флюорита (СaF2, пр. гр. $Fm\bar {3}m$) для оптимизации качественного (M, R) и количественного (x – мольная доля RF3) состава фаз M1 – xRxF2 + x по максимальной величине ионной проводимости σdc (dc – direct current) и термической устойчивости монокристаллов. Полученные значения σdc при 500 K для наиболее проводящих составов флюоритовых фаз M1 – xRxF2 + x (M = Ca, Sr, Ba, Cd) достигают σ500 K = = 10–4–10–3 См/см [4–11], поэтому они являются фтор-проводящими твердыми электролитами (ФТЭЛ) для решения практических задач [12, 13] в области средних (200–500°С) и высоких (>500°С) температур.
При комнатной температуре (293 K) для всех оптимизированных составов M1 – xRxF2 + x (M = = Ca, Sr, Ba, Cd) проводимость σ293 K не превышает 10–7 См/см [4–11]. Отсюда следует вывод о непригодности использования при 293 K в качестве ФТЭЛ для химических сенсоров и твердотельных источников тока ни одного изученного состава этих нестехиометрических флюоритовых фаз. Таким образом, нарушения стехиометрии во всех кристаллических флюоритовых матрицах MF2 (M = Ca, Sr, Ba, Cd) с перечисленными выше катионными замещениями M2+ на R3+ не решают задачу получения проводящих при комнатной температуре флюоритовых ФТЭЛ.
В структурном типе флюорита кристаллизуется также дифторид свинца PbF2. Кондуктометрические данные в ряду флюоритовых матриц CaF2–SrF2–BaF2–CdF2–PbF2 [14, 15] свидетельствуют, что уменьшение степени ионности химической связи от CaF2 к PbF2 сопровождается ростом фтор-ионной проводимости. Эта тенденция направляет дальнейший поиск новых ФТЭЛ, обладающих высокими значениями σdc, на семейство флюоритовых фаз Pb1 – xRxF2 + x.
Во всех 16 системах PbF2–RF3 (R = 16 РЗЭ Sc, Y, La–Lu, система с Pm не изучалась) образуются широкие поля устойчивости флюоритовых нестехиометрических фаз Pb1 – xRxF2 + x. Области гомогенности фаз меняются по ряду РЗЭ, как и склонность к распаду при понижении температуры. Для оценки характеристик, определяющих условия получения монокристаллов и возможного практического применения флюоритовых фаз Pb1 – xRxF2 + x, будут использованы данные из фазовых диаграмм систем PbF2–RF3 [16, 17].
Ранее проводимость фаз Pb1 – xRxF2 + x (R – РЗЭ) практически всегда исследовалась на поликристаллических образцах, полученных методом твердофазного синтеза [18–23]. В [18] в поликристаллы PbF2 вводили до 2 мол. % YF3 при 850°С с эффектом роста σdc. В [19, 22] определены предельные растворимости RF3 в PbF2 для R = La (45 ± 3 мол. %), Gd (30 мол. %), Lu (25 мол. %), Y (25 мол. %) при 750–850°С и изучена ионная проводимость этих флюоритовых фаз (на поликристаллах).
О недостатках поликристаллической формы ФТЭЛ сказано в [24]: наличие пористости, существование протяженных границ зерен (способствуют пирогидролизу фторидов), необходимость технологической операции формования порошков и разделение вкладов внутризеренной (объемной) и межзеренной (поверхностной) проводимостей. Отметим, что в исследованиях [18–23] необходимое для поликристаллов Pb1 – xRxF2 + x разделение вкладов внутри- и межзеренной проводимостей, как правило, не делалось. В результате полученные на таких образцах данные по ионной проводимости фаз Pb1 – xRxF2 + x (например, Pb1 – xYxF2 + x [19–21, 23]) противоречивы.
Получение монокристаллов Pb1 – xRxF2 + x осложняется рядом факторов, отсутствующих для кристаллов на основе фторидов щелочноземельных элементов (ЩЗЭ). Основную технологическую сложность вносит высокая упругость паров PbF2 в сочетании с высокими температурами плавления RF3 цериевой подгруппы и скандия. Также особенностью поведения расплавов дифторида свинца в контакте с графитовым тиглем при росте кристаллов является его частичное восстановление до металлического свинца. В свою очередь загрязнение кислородом исходных RF3 и пирогидролиз в процессе роста кристаллов из расплавов на основе фторида свинца проявляются не в сильной степени. Это вызвано самоочисткой расплава, с учетом которой при промышленном росте кристаллов фторидов ЩЗЭ принято применять к фторидным расплавам добавку PbF2 в количестве 2–5 мас. %. Дифторид свинца реагирует с примесями оксидов:
Ранее была изучена ионная проводимость слаболегированных монокристаллов PbF2 с 0.01 до 0.5 мол. % трифторидами Pr, Sm, Eu, Tb, Er (рост кристаллов из расплава) [26] и небольших (1 × 1 × × 1 мм3) монокристаллов концентрированных твердых растворов Pb1 – xYxF2 + x (x = 0.1, 0.2) [27], полученных методом твердофазного синтеза.
Систематическое выращивание монокристаллов нестехиометрических фаз Pb1 – xRxF2 + x [28] проводили из расплава методом направленной кристаллизации Бриджмена только в Институте кристаллографии РАН в рамках программы по получению многокомпонентных фторидных материалов и исследования их структуры и свойств. Проведенные кондуктометрические исследования флюоритовых фаз Pb1 – xRxF2 + x [7, 11, 29, 30] базируются на измерениях широкого круга монокристаллов (в некоторых случаях сплавов) из областей гомогенности этих фаз в рамках этой исследовательской программы. Полученные результаты позволили впервые предпринять систематический поиск кристаллов и оптимизацию состава флюоритовых ФТЭЛ на основе матрицы α-PbF2, обладающих высокими значениями σdc.
Целью работы является оптимизация составов семейства флюоритовых нестехиометрических фаз Pb1 – xRxF2 + x (R – РЗЭ) по проводимости и термической стабильности для выбора перспективных ФТЭЛ для полностью твердотельных электрохимических устройств в среднетемпературной области и при комнатной температуре.
ФЛЮОРИТОВАЯ МОДИФИКАЦИЯ α-PbF2
Свинец принадлежит IV группе (главной подгруппе) Периодической системы элементов, однако его типичным валентным состоянием во фторидах является 2+. Электронное строение катиона Pb2+ отличается от других ионов М2+ (M = = Ca, Sr, Ba, Cd) наличием неподеленной электронной пары. Это является причиной его высокой поляризуемости.
Существенная ковалентизация химических связей в PbF2 (по сравнению с фторидами ЩЗЭ и Cd) сопровождается резким понижением температуры плавления (826 ± 5°С). Она примерно на 640°С ниже, чем у наиболее тугоплавкого из фторидов ЩЗЭ SrF2 (1464 ± 5°C). Структурный тип флюорита резко теряет термическую стабильность при переходе от фторидов ЩЗЭ (II группа, главная подгруппа Периодической системы элементов) и фторида кадмия (II группа, побочная подгруппа) к фториду свинца (IV группа, главная подгруппа).
Фторид свинца является единственным MF2, имеющим полиморфный переход при нормальном давлении. Низкотемпературная модификация кристаллизуется в типе котуннита PbCl2 (ромбическая сингония, пр. гр. Pmna). При 335–360°С ([16] и ссылки в ней) она переходит в высокотемпературную модификацию типа CaF2. В литературе ее принято обозначать как β-PbF2. Будем придерживаться мнения, что модификация, существование которой ограничивается плавлением, должна обозначаться первой буквой греческого алфавита (α-PbF2) и будем пользоваться этим в дальнейшем.
Модификация α-PbF2 легко переохлаждается и сохраняется в метастабильном состоянии при комнатной температуре. Параметр решетки α-PbF2 зависит от условий охлаждения и меняется в интервале а = 5.920–5.940 Å. Как и другие флюоритовые MF2, PbF2 имеет “размытый” фазовый переход, выражающийся в частичном разупорядочении анионной подрешетки, с которым связана фтор-ионная проводимость. Максимум аномалии теплоемкости, соответствующий «размытому» переходу, по разным данным приходится на 705 [31], 710 [32], 715 [33], 718 [34], 721 K [35] (среднее значение ∼715 K) с шириной пика 150–200 K. По геометрии решетки α-PbF2 с а = 5.940 Å располагается в гомологическом ряду MF2 между SrF2 (5.800 Å) и BaF2 (6.200 Å).
ОПТИМИЗАЦИЯ ФТЭЛ Pb1 – xRxF2 + x ПО ТЕРМИЧЕСКОЙ СТАБИЛЬНОСТИ И ПРОВОДИМОСТИ
Термическая стабильность
Системы PbF2–RF3, несмотря на высокую упругость паров компонента PbF2, были изучены в приближении конденсированных систем при ограничении содержаниями RF3 от 0 до 60 мол. %. Фазовые диаграммы систем PbF2–RF3 публиковались в разное время: PbF2–YF3 [20], PbF2–YbF3 [36], участки систем PbF2–RF3 с содержанием от 0 до 60 мол. % RF3 c R = Nd, Tb, Dy, Ho, Lu [37], данные по системам PbF2–HoF3 и PbF2–YbF3 представлены в [38]. Нами суммированы опубликованные и неопубликованные данные по этому ряду систем. Построенные фазовые диаграммы всего ряда систем PbF2–RF3 собраны в [16, 17].
На рис. 1а точками 1 (перечеркнутые кружки) представлено изменение областей гомогенности насыщенных твердых растворов Pb1 – xRxF2 + x по ряду РЗЭ. На рис. 1б положение точки 1 показано на фазовой диаграмме системы PbF2–YF3. Изменение термической устойчивости (температур плавления) фаз Pb1 – xRxF2 + x по ряду РЗЭ является единственным для всех M1 – xRxF2 + x примером, когда она не монотонно падает от La к “тяжелым” РЗЭ с уменьшением ионного радиуса R3+ (например, у Sr1 – xRxF2 + x и Ba1 – xRxF2 + x), а имеет экстремум. Хотя точность определения температур перитектик низкая, прохождение их через максимум по ряду РЗЭ очевидно.
Рис. 1.
Флюоритовые нестехиометрические фазы Pb1 – xRxF2 + x в системах PbF2–RF3: 1 – области гомогенности при перитектических (R = La–Gd) и эвтектических (R = Tb–Lu, Y, Sc) температурах; 2 – составы с конгруэнтным плавлением (R = Tb–Y); 3 – составы флюоритовых фаз, насыщенных при 600°С [16, 17]; 4 – составы с изученными электрофизическими характеристиками (табл. 1). Римскими цифрами обозначены морфотропные подгруппы RF3 (а); фазовая диаграмма системы PbF2–YF3 [20] и точки на рис. а (б).
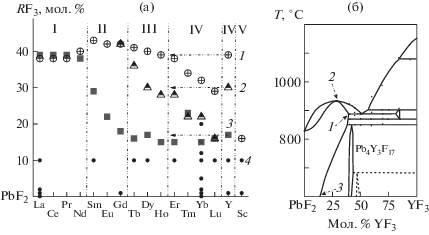
Таблица 1.
Значения A и ΔHσ для кристаллов Pb1 – xRxF2 + x в уравнении Аррениуса–Френкеля σdcT = = Aexp(‒ΔHσ/kT)
| Образец | Состав кристалла | T, K | A, См/смK | ΔHσ, эВ |
|---|---|---|---|---|
| α-PbF2 | 590–700 573–713 |
1.3 × 109 [41] 6.7 × 109 [42] |
1.04 [41] 1.05 [42] |
|
| 1 | Pb0.9995La0.0005F2.0005 | 293–489 | 6.3 × 104 | 0.53 |
| 2 | Pb0.999La0.001F2.001 | 293–489 | 8.5 × 104 | 0.53 |
| 3 | Pb0.99La0.01F2.01 | 293–489 | 1.3 × 106 | 0.60 |
| 4 | Pb0.98La0.02F2.02 | 293–489 | 2.4 × 105 | 0.56 |
| 5 | Pb0.9La0.1F$_{{2.1}}^{*}$ | 293–490 | 2.0 × 105 | 0.49 |
| 6 | Pb0.9Sm0.1F$_{{2.1}}^{*}$ | 293–490 | 2.7 × 104 | 0.44 |
| 7 | Pb0.99Gd0.01F2.01 | 293–489 | 2.4 × 105 | 0.51 |
| 8 | Pb0.9Tb0.1F$_{{2.1}}^{*}$ | 293–490 | 2.3 × 105 | 0.51 |
| 9 | Pb0.9Dy0.1F$_{{2.1}}^{*}$ | 293–490 | 5.2 × 104 | 0.47 |
| 10 | Pb0.9Er0.1F$_{{2.1}}^{*}$ | 293–490 | 4.1× 104 | 0.45 |
| 11 | Pb0.9995Yb0.0005F2.0005 | 291–487 | 1.1 × 104 | 0.43 |
| 12 | Pb0.999Yb0.001F2.001 | 292–454 | 1.8 × 104 | 0.44 |
| 13 | Pb0.99Yb0.01F2.01 | 293–489 | 1.5 × 105 | 0.50 |
| 14 | Pb0.98Yb0.02F2.02 | 294–539 | 1.0 × 106 | 0.56 |
| 15 | Pb0.95Yb0.05F2.05 | 294–539 | 2.4 × 106 | 0.57 |
| 16 | Pb0.9Yb0.1F2.1 | 292–454 | 5.2 × 104 | 0.46 |
| 17 | Pb0.88Yb0.12F2.12 | 294–539 | 3.9 × 104 | 0.44 |
| 18 | Pb0.85Yb0.15F2.15 | 292–454 | 3.5 × 104 | 0.44 |
| 19 | Pb0.8Yb0.2F2.2 | 294–539 | 1.2 × 105 | 0.49 |
| 20 | Pb0.9Lu0.1F$_{{2.1}}^{*}$ | 293–490 | 2.7 × 104 | 0.42 |
| 21 | Pb0.99Y0.01F2.01 | 293–489 | 1.6 × 105 | 0.52 |
| 22 | Pb0.9Y0.1F$_{{2.1}}^{*}$ | 293–490 | 3.5 × 104 | 0.46 |
| 23 | Pb0.99Sc0.01F2.01 | 293–489 | 1.6 × 105 | 0.52 |
| 24 | Pb0.9Sc0.1F2.1 | 293–490 | 2.1 × 104 | 0.33 |
Такое поведение плавления флюоритовых фаз Pb1 – xRxF2 + x по ряду РЗЭ приводит к изменению характера плавления с инконгруэнтного (R = La–Gd с температурами перитектик от 960°С для системы PbF2–LaF3 до 1033°С для системы PbF2–GdF3) на конгруэнтный (R = Tb–Lu, Y). На кривых плавления последних имеются максимумы с температурами конгруэнтного плавления от 999°С для системы PbF2–TbF3 до 885°С для системы PbF2–LuF3. Переходное состояние наблюдается в системе PbF2–GdF3.
Термическая стабилизация флюоритовой структуры α-PbF2 изоморфным введением в него ионов R3+ является рекордной по абсолютному значению среди всех флюоритовых фаз M1 – xRxF2 + x (M = Ca, Sr, Ba, Cd, Pb). Температуры плавления фаз Pb1 – xRxF2 + x проходят по ряду РЗЭ через максимум в районе неодима. Состав Pb0.6Nd0.4F2.4 плавится инконгруэнтно (Tinc ≈ 1085°С) выше, чем α-PbF2 (TPbF2 = 826 ± 5°С) на величину ΔTstab = = Tinc – TPbF2 = 259°С.
Для фаз M1 – xRxF2 + x (M = Ca, Sr, Ba, Cd) максимальное превышение у Ba0.69La0.31F2.31 составляет ΔTstab = 130°С. В абсолютном выражении эффект термической стабилизации флюоритовой структуры у Pb0.6Nd0.4F2.4 вдвое превышает аналогичный эффект у Ba0.69La0.31F2.31.
Еще больше относительное (к температурам плавления MF2) превышение, поскольку температура плавления PbF2 (826°С) намного ниже, чем BaF2 (1354°С). Относительный эффект термической стабилизации флюоритовой структуры у нестехиометрических фаз Pb1 – xRxF2 + x более чем втрое превышает стабилизирующее влияние R3+ на BaF2.
Объяснить исключительно высокую термическую стабилизацию флюоритовой структуры в системах PbF2–RF3 чисто геометрическим фактором (увеличение степени заполнения пространства при образовании нестехиометрических фаз) нельзя. В этом случае эффект стабилизации у PbF2 должен был бы быть средним между эффектами для BaF2 и SrF2, между которыми по параметрам решетки и плотности упаковки располагается фторид свинца. Для ряда систем SrF2–RF3 наиболее тугоплавкий состав Sr0.69La0.31F2.31 (1570°С) имеет превышение ΔTstab = 106°С над плавлением компонента SrF2 (1464°С). Таким образом, эффект стабилизации флюоритовой структуры в ряду систем PbF2–RF3 в 2–3 раза выше, чем в аналогичных рядах SrF2–RF3 и BaF2–RF3. Возможная причина этого в электронном строении и поляризующем действии иона Pb2+.
Температурная и концентрационная устойчивость фаз Pb1 – xRxF2 + x изменяется в зависимости от их качественного и количественного состава. Предельные растворимости RF3 в PbF2, представленные на рис. 1 точками 1, проходят по ряду РЗЭ через максимум на Sm, Gd (43 и 42 мол. % RF3), понижаясь до 38 и 29 мол. % RF3 для La и Lu соответственно (при нормальном давлении).
Склонность к распаду при понижении температуры показана на рис. 1 точками 2, отвечающими составам флюоритовых фаз, насыщенных по отношению к RF3 при 600°С. По поведению растворимости RF3 в PbF2 при понижении температуры системы делятся на две группы.
В первой группе с R = La–Nd растворимость не меняется от перитектических температур до нижнего изучавшегося предела (600°С). Ко второй группе относятся системы со всеми остальными РЗЭ. Для них характерно значительное уменьшение содержания RF3 во флюоритовых фазах при понижении температуры. Возникновение сильной зависимости протяженности областей гомогенности фаз Pb1 – xRxF2 + x от температуры связано с появлением упорядоченных фаз Pb4R3F17 (состав PbF2 : RF3 = 4 : 3, образование фазы Pb4Y3F17 на рис. 1б). Это подтверждает правило Юм-Розери [39]: появление фазы с узкой областью гомогенности приводит к резкому уменьшению областей гомогенности соседней (в данном случае нестехиометрической Pb1 – xRxF2 + x) фазы.
Изменение термической стабильности фаз Pb1 – xRxF2 + x по ряду РЗЭ однозначно связано с появлением упорядоченных фаз Pb4R3F17. Выше температур распада упорядоченных фаз растворимость RF3 в Pb1 – xRxF2 + x мало зависит от температуры (рис. 1б).
Относительно низкие температуры распада фаз Pb1 – xRxF2 + x не позволили изучить эти процессы методом термического анализа при исследованиях фазовых диаграмм PbF2–RF3 (нижняя граница исследования фазовых диаграмм составляет 600°C) [16, 26].
Таким образом, из данных рис. 1а следует, что фазы Pb1 – xRxF2 + x с РЗЭ второй половины ряда имеют высокий температурный коэффициент уменьшения растворимости. Для достаточно большого числа флюоритовых фаз Pb1 – xRxF2 + x уменьшение области гомогенности с понижением температуры приводит к частичному распаду фазы. Это необходимо иметь в виду при выборе составов фаз для роста кристаллов, исследования их свойств и проводимости.
Использование кристалла ФТЭЛ (независимо от его величины σdc) зависит от его устойчивости в температурной области эксплуатации. Неустойчивость кристаллов флюоритовых фаз Pb1 ‒ xRxF2 + x приводит к невоспроизводимости σdc-данных при изучении температурной зависимости σdc(T) [40].
Ионная проводимость
Из общего числа 15 парных сочетаний Pb–R, дающих 15 флюоритовых фаз Pb1 – xRxF2 + x (R – РЗЭ, за исключением Pm, Eu), на сегодняшний день изучена ионная проводимость для 10 фаз с разным качественным составом (R = La, Sm, Gd, Tb, Dy, Er, Yb, Lu, Y и Sc) [7, 11, 24, 25], что составляет 67% от общего числа парных Pb-R-сочетаний. Исследование σdc флюоритовых фаз Pb1 ‒ xRxF2 + x (монокристаллы и сплавы) с разным количественным составом (x) увеличивает число изученных кристаллов до 24 (таблица). На рис. 1а точками 4 показаны составы, изученные нами. Наиболее представительной является изоконцентрационная серия кристаллов Pb0.9R0.1F2.1. Наиболее глубоко по составу прослежена нестехиометрическая фаза Pb1 – xYbxF2 + x (до 20 мол. % YbF3). Ограничения по высоким содержаниям RF3 в кристаллах Pb1 – xRxF2 + x связаны с распадными явлениями. Таблица суммирует объем проведенного в ИК РАН эксперимента по росту нестехиометрических кристаллов на основе высокотемпературной флюоритовой модификации α-PbF2 для их характеризации как потенциальных ФТЭЛ.
Фтор-ионная проводимость нестехиометрических кристаллов Pb1 – xRxF2 + x увеличивается по сравнению с матрицей α-PbF2 (рис. 2). Это достигается путем последовательных изменений состава и дефектной структуры. Катионный состав флюоритовых кристаллов Pb1 – xRxF2 + x оказывает влияние на ионный транспорт в анионной (фторной) подрешетке, благодаря чему и становится возможной оптимизация составов Pb1 – xRxF2 + x по σ293 K.
Кристаллы Pb1 – xLaxF2 + x
Энтальпия активации ионного переноса в монокристаллах Pb1 – xLaxF2 + x при x = 5 × 10–4, 1 × × 10–3, 0.01 и 0.02 практически не меняется и составляет ΔHσ = 0.5–0.6 эВ. Значения σ500 K сначала возрастают от 5.7 × 10–4 См/см (x = 5 × 10–4) до 2.3 × 10–3 См/см (x = 0.01), а затем уменьшаются до 1.2 × 10–3 См/см (x = 0.02). Величина σ500 K для монокристалла Pb0.99La0.01F2.01 превышает σ500 K для собственной проводимости флюоритовой матрицы α-PbF2 в ∼6 раз.
Кристаллы Pb1 – xYbxF2 + x
Энтальпия активации ΔHσ в концентрационной серии монокристаллов Pb1 – xYbxF2 + x (x = 5 × × 10–4, 1 × 10–3, 0.01, 0.02, 0.05, 0.1, 0.12, 0.15 и 0.2) изменяется немонотонно: 0.43–0.44 эВ для x = = 5 × 10–4–1 × 10–3, 0.50–0.57 эВ для x = 0.01–0.05 и 0.44–0.49 эВ для x = 0.1–0.2. Значения σ500 K возрастают от 1 × 10–3 См/см (x = 5 × 10–4) до 9.3 × × 10–3 См/см (x = 0.05), затем падают и практически не меняются (2.5–3) × 10–3 См/см (x = 0.1–0.2). При этом величина σ500 K для монокристалла Pb0.95Yb0.05F2.05 превышает σ500 K флюоритовой матрицы α-PbF2 в ∼25 раз.
Кристаллы Pb1 – xRxF2 + x (x = 0.01 и 0.1)
В ряду монокристаллов Pb0.99R0.01F2.01 (R = La, Gd, Yb, Y, Sc) с 1 мол. % RF3 величина энтальпии ионного переноса сохраняется (ΔHσ = 0.5 эВ), а значения проводимости σ500 K равны (2–3.5) × × 10–3 См/см. Введение 1 мол. % RF3 во флюоритовую матрицу α-PbF2 дает рост σ500 К в 5–10 раз.
Дальнейшее десятикратное увеличение концентрации RF3 в кристаллах (сплавах) Pb0.9R0.1F2.1 при изменении R по ряду La → Lu, Y не приводит к значительному росту проводимости. Величина ΔHσ = 0.46 ± 0.05 эВ, значения σ500 К соответствуют диапазону (2–5) × 10–3 См/см.
Однако при переходе от Lu к Sc для кристаллов Pb0.9R0.1F2.1 наблюдаются значительное снижение энтальпии активации ионной проводимости (ΔHσ = 0.33 эВ) и резкий рост проводимости σ500 K = 2.0 × 10–2 См/см. Превышение уровня ионной проводимости по сравнению с матрицей α-PbF2 составляет ∼55 раз.
Практическое применение
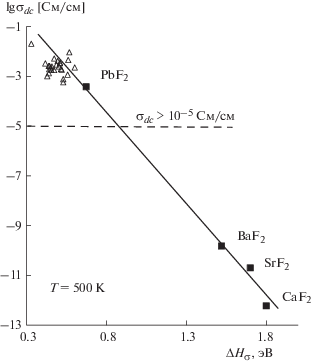
На рис. 2 показаны изменения σ500 K двухкомпонентных кристаллов Pb1 – xRxF2 + x с разным качественным (R) и количественным составом (x) в координатах “lg σ500 K–ΔHσ”. Пунктирная горизонталь отмечает условную границу lg[σdc] = –5, ниже которой применение ФТЭЛ в электрохимических устройствах считается нежелательным из-за их недостаточной проводимости. На рис. 2 для сравнения приведены значения σ500 K для собственной проводимости номинально предельно чистых флюоритовых матриц CaF2, SrF2, BaF2 и α-PbF2 по данным [41–45].
Проводимость σ500 К всех изученных кристаллов Pb1 – xRxF2 + x находится выше условной границы lg[σdc] = –5 для применения ФТЭЛ в электрохимических устройствах. Кристаллы Pb1 ‒ xRxF2 + x пригодны для ФТЭЛ, работающих в среднетемпературном диапазоне (200–300°С).
На рис. 3 представлена зависимость проводимости σ293 K при комнатной температуре от энтальпии ΔHσ для изученных кристаллов Pb1 ‒ xRxF2 + x. Можно видеть, что, за исключением кристалла Pb0.9Sc0.1F2.1, ионная проводимость при 293 K для кристаллов Pb1 – xRxF2 + x не превышает σ293 K < 10–5 См/см. При переходе от Lu к Sc для кристалла Pb0.9Sc0.1F2.1 наблюдается резкий рост проводимости (в ∼102 раз), она достигает σ293 K = 1.5 × 10–4 См/см.
Рис. 3.
Зависимость проводимости σ293 K от энтальпии активации ионного переноса ΔHσ для флюоритовых ФТЭЛ Pb1 – xRxF2 + x.
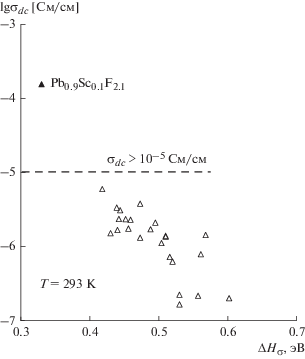
Таким образом, среди изученных составов Pb1 – xRxF2 + x (R – РЗЭ) только проводимость монокристалла Pb0.9Sc0.1F2.1 превышает (в ∼10 раз) условный предел σ293 K ≈ 10–5 См/см. Монокристаллы Pb0.9Sc0.1F2.1 пригодны для ФТЭЛ, работающих при комнатной температуре. Однако на данный момент задача создания стабильного ФТЭЛ с σ293 K > 10–3 См/см для работы источника тока или сенсора в условиях пониженных температур (до –30°С) остается нерешенной.
ФТЭЛ на основе флюоритовой модификации α-PbF2 уже находят практическое применение в твердотельных электрохимических устройствах (потенциометрический сенсор [46] для определения концентрации фтора в газовых средах (pF2 = = 10–1–103 Па), твердотельные фтор-ионные источники тока [47–50]). Их преимущества перед литий-ионными источниками тока в высокой плотности энергии, взрыво- и пожаробезопасности [51]. Однако предложенные макеты сенсоров и гальванических элементов требуют нагрева до 100–150°С для увеличения σdc, что усложняет их эксплуатацию.
ЗАКЛЮЧЕНИЕ
Продолжено изучение оптимизации состава флюоритовых ФТЭЛ по проводимости и термической устойчивости для кристаллов в семействе флюоритовых нестехиометрических фаз Pb1 ‒ xRxF2 + x. Изменение качественного катионного состава кристаллов приводит к росту их проводимости и позволяет провести оптимизацию новых ФТЭЛ.
Изменения характера химической связи в PbF2 сопровождаются (по сравнению с фторидами ЩЗЭ) радикальными изменениями физико-химических характеристик: понижением температуры плавления и ростом упругости паров.
Структурный тип флюорита термически стабилизируется у кристаллов Pb1 – xRxF2 + x, характер плавления которых меняется по ряду РЗЭ с перитектического (от 960°С для PbF2–LaF3 до 1033°С для PbF2–GdF3) на эвтектический (от 991°С для PbF2–TbF3 до 807°С для PbF2–LuF3). Рост кристаллов фаз, плавящихся с разложением (перитектически), осложнен повышенной дифференциацией компонентов по объему кристалла. Стабилизация флюоритовой структуры у фаз Pb1 – xRxF2 + x в системах с R = Tb–Lu, Y сопровождается появлением максимумов на кривых плавкости. Из составов с конгруэнтным плавлением возможно получение высокооднородных (по составу) кристаллов. Такие нестехиометрические флюоритовые фазы Pb1 – xRxF2 + x с R = Tb–Lu, Y, Sc могут быть получены в монокристаллической форме.
Склонность к распаду при понижении температуры мала у фаз с РЗЭ начала ряда (R = La–Nd). Она начинает повышаться в системах с РЗЭ второй половины ряда, начиная с европия. Понижение устойчивости вызвано образованием упорядоченных фаз Pb4R3F17.
По сравнению с кристаллами M1 – xRxF2 + x на основе фторидов ЩЗЭ ухудшаются механические свойства кристаллов Pb1 – xRxF2 + x, растет растворимость в воде, падает химическая стабильность в возможных условиях эксплуатации, растет склонность к пирогидролизу, затрудняющая эксплуатацию кристаллов и измерения проводимости. Получение кристаллов из расплава и исследования температурных зависимостей проводимости могут сопровождаться частичным восстановлением Pb2+ до металлического свинца.
В однокомпонентном кристалле α-PbF2 дефектность анионной (проводящей) подрешетки задается термическими дефектами (антифренкелевские пары вакансия фтора–межузельный фтор) и зависит от термической предыстории исследуемых образцов. В двухкомпонентных кристаллах Pb1 – xRxF2 + x (на фоне термостимулированных дефектов) дефектность задается изменением состава гетеровалентными изоморфными замещениями в катионном мотиве. Концентрация “конституционных” дефектов на порядки выше концентрации термостимулированных, и этот тип дефектов может стабилизироваться по температуре (сохраняться при охлаждении кристалла).
Использование в качестве флюоритовой матрицы α-PbF2 по сравнению с матрицами CaF2, SrF2, BaF2 приводит к снижению температур, при которых реализуется высокая ионная проводимость. При поиске составов кристаллов Pb1 ‒ xRxF2 + x со значениями σdc > 10–5 См/см (нижний предел проводимости для ФТЭЛ) показал свою эффективность метод “конституционных” изменений стехиометрии в структурном типе флюорита. Все кристаллы Pb1 – xRxF2 + x пригодны как ФТЭЛ, работающие в среднетемпературном диапазоне (200–300°С). Максимальные значения σ500 K = = 9.3 × 10–3 и 2.0 × 10–2 См/см имеют кристаллы Pb0.95Yb0.05F2.05 и Pb0.9Sc0.1F2.1 соответственно.
Наибольший практический интерес как ФТЭЛ представляет флюоритовая фаза Pb1 ‒ xScxF2 + x. Значения σ293 К монокристаллов Pb0.9Sc0.1F2.1 c конгруэнтным плавлением составляют ∼1.5 × × 10–4 См/см и превышают в 10 раз условный предел 10–5 См/см. Они пригодны в качестве ФТЭЛ в твердотельных приборах, функционирующих при комнатной температуре, но не достаточны для их работы в условиях пониженных температур (до –30°С).
Работа выполнена при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН.
Список литературы
Соболев Б.П., Сорокин Н.И. // Кристаллография. 2014. Т. 59. № 6. С. 891.
Сорокин Н.И., Голубев А.М., Соболев Б.П. // Кристаллография. 2014. Т. 59. № 2. С. 275.
Сорокин Н.И., Соболев Б.П. // Кристаллография. 2019. Т. 64. № 5. С. 757.
Ivanov-Shits A.K., Sorokin N.I., Fedorov P.P., Sobolev B.P. // Solid State Ionics. 1989. V. 31. № 4. P. 253.
Ivanov-Shits A.K., Sorokin N.I., Fedorov P.P., Sobolev B.P. // Solid State Ionics. 1989. V. 31. № 4. P. 269.
Ivanov-Shits A.K., Sorokin N.I., Fedorov P.P., Sobolev B.P. // Solid State Ionics. 1990. V. 37. № 1–2. P. 125.
Сорокин Н.И. // Электрохимия. 2006. Т. 42. № 7. С. 828.
Sobolev B.P., Sorokin N.I., Bolotina N.B. // Photonic & Electronic Properties of Fluoride Materials. V. 1. Meждyнap. cб. Progress in Fluorine Science / Eds. Tressaud A., Poeppelmeier K. Amsterdam: Elsevier, 2016. P. 465.
Сорокин Н.И., Федоров П.П., Иванов-Шиц А.К., Соболев Б.П. // ФТТ. 1988. Т. 30. № 5. С. 1537.
Сорокин Н.И., Сульянова Е.А., Бучинская И.И., Соболев Б.П. // Кристаллография. 2005. Т. 50. № 4. С. 750.
Сорокин Н.И., Соболев Б.П., Брайтер М. // ФТТ. 2002. Т. 44. № 8. С. 1506.
Fergus J.W. // Sensors & Actuators. B. 1997. V. 42. P. 119.
Сорокин Н.И., Соболев Б.П. // Кристаллография. 2007. Т. 52. № 5. С. 870.
Chadwick A.V. // Solid State Ionics. 1983. V. 8. P. 209.
Сорокин Н.И. // Журн. физ. химии. 2002. Т. 76. № 3. С. 391.
Sobolev B.P. The Rare Earth Trifluorides. Part 1. The High Temperature Chemistry of Rare Earth Trifluorides, Institute of Crystallography, Moscow, and Institut d’Estudis Catalans, Barcelona: Institut d’Estudis Catalans, Spain, 2000. 520 p.
Бучинская И.И., Федоров П.П. // Успехи химии. 2004. Т. 73. № 4. С. 404.
Liang C.C., Joshi A.V. // J. Electrochem. Soc. 1975. V. 122. P. 466.
Мурин И.В. // Изв. СО АН СССР. Сер. хим. наук. 1984. № 2. Вып. 1. С. 53.
Reau J.M., Fedorov P.P., Rabardel L. et al. // Mater. Res. Bull. 1983. V. 18. P. 1235.
Rhandour A., Reau J.M., Matar S.F., Hagenmuller P. // J. Phys. Chem. Solids. 1986. V. 47. № 6. P. 587.
Ten Eicken J., Gunsser W., Chernov S.V. et al. // Solid State Ionics. 1992. V. 53–56. P. 843.
Patwe S.J., Balaya P., Goyal P.S., Tyagi A.K. // Mater. Res. Bull. 2001. V. 36. P. 1743.
Сорокин Н.И., Соболев Б.П. // Кристаллография. 2016. Т. 61. № 2. С. 468.
Stockbarger D.S. // J. Opt. Soc. Am. 1949. V. 39. № 9. P. 31.
Архангельская В.А., Бакланова В.Н., Иванова И.А. и др. // Труды ГОИ (Гос. опт. ин-та). 1983. Т. 54. № 188. С. 129.
Ito Y., Koto K. // Solid State Ionics. 1986. V. 18–19. P. 1202.
Sobolev B.P. The Rare Earth Trifluorides. Part 2. Introduction to Materials Science of Multicomponent Metal Fluoride Crystals, Institute of Crystallography, Moscow, and Institut d’Estudis Catalans, Barcelona: Institut d’Estudis Catalans, Spain, 2001. 460 p.
Сорокин Н.И., Федоров П.П., Соболев Б.П. // Неорган. материалы. 1997. Т. 33. № 1. С. 5.
Сорокин Н.И., Щавлинская Г.А., Бучинская И.И., Соболев Б.П. // Электрохимия. 1998. Т. 34. № 9. С. 1031.
Derrington C.E., Navrotsky A., O’Keeffe M. // Solid State Commun. 1976. V. 18. P. 47.
Goff J.P., Hayes W., Hull S., Hutchings M.T. // J. Phys.: Condens. Matter. 1991. V. 3. P. 3677.
Kosacki I., Litvinchuk A.P., Tarasov J.J., Valakh M. Ya. // J. Phys.: Condens. Matter. 1989. V. 1. P. 929.
Volodkovich L.M., Petrov G.S., Vecher R.A., Vecher A.A. // Termochim. Acta. 1985. V. 88. P. 497.
Den Hartog H.W., van der Veen J. // Phys. Rev. B. 1988. V. 37. № 4. P. 1807.
Федоров П.П., Зибров И.П., Соболев Б.П., Шишкин И.В. // Журн. неорган. химии. 1987. Т. 32. № 7. С. 1794.
Федоров П.П., Зибров И.П., Тарасова Е.В. и др. // Журн. неорган. xимии. 1988. Т. 33. № 12. С. 3222.
Федоров П.П., Трновцева В., Мелешина В.А. и др. // Неорган. материалы. 1994. Т. 30. №. 3. С. 406.
Юм-Розери В., Рейнор Г.В. Структура металлов и сплавов. М.: Металлургиздат, 1959. 392 с.
Ten Eicken J., Gunsser W., Karus M. et al. // Solid State Ionics. 1994. V. 72. P. 7.
Bonne R.W., Schoonman J. // J. Electrochem. Soc. 1977. V. 124. P. 28.
Мурин И.В., Глумов А.В., Глумов О.В. // Электрохимия. 1979. Т. 15. № 8. С. 1119.
Bollmann W., Reimann R. // Phys. Status Solidi A. 1973. V. 16. P. 187.
Schoonman J., den Hartog H.W. // Solid State Ionics. 1982. V. 7. P. 9.
Figueroa D.R., Chadwick A.V., Strange J.H. // J. Phys. C. 1978. V. 11. P. 55.
Алейников А.Н., Алейников Н.Н., Вершинин Н.Н. // Тез. докл. IX Всесоюз. симпоз. по химии неорган. фторидов. Череповец. 3–6 июля 1990. С. 31.
Kennedy J.H., Hunter J.C. // J. Electrochem. Soc. 1976. V. 123. № 1. P. 10.
Hagenmuller P., Reau J.M., Lucat C. et al. // Solid State Ionics. 1981. V. 3–4. P. 341.
Kosacki I. // Appl. Phys. A. 1989. V. 49. P. 413.
Закиров Р.Н., Маринин А.С. // Тез. докл. IX Всесоюз. симпоз. по химии неорган. фторидов. Череповец. 3–6 июля 1990. С. 136.
Потанин А.А. // Журн. Всерос. хим. о-ва им. Д.И. Менделеева. 2001. Т. 45. № 5–6. С. 58.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография