Кристаллография, 2020, T. 65, № 1, стр. 79-86
Сравнение упаковки молекул в двух кристаллических модификациях фосфопантетеинаденилилтрансферазы Mycobacterium tuberculosis
В. И. Тимофеев 1, 2, Н. Е. Жухлистова 1, И. П. Куранова 1, 2, *
1 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: inna@crys.ras.ru
Поступила в редакцию 15.04.2019
После доработки 15.04.2019
Принята к публикации 23.05.2019
Аннотация
Кристаллы фосфопантетеинаденилилтрансферазы Mycobacterium tuberculosis (РРАТMt), выращенные с использованием в качестве осадителя 2-метил-2,4-пентандиола (МПД) или сульфата аммония, принадлежали пр. гр. R32 и Р32 соответственно. При сокристаллизации фермента с функциональными субстратами только кристаллы, выращенные в присутствии МПД (пр. гр. R32), содержали связанный в активном центре лиганд. В присутствии сульфата аммония включения лиганда в активный центр не было, и образовывались только кристаллы апо-формы (пр. гр. Р32). Чтобы объяснить особенности связывания лигандов в разных кристаллических модификациях, сравнивали упаковку молекул и строение апо-формы РРАТMt в обеих кристаллических структурах. Показано, что в кристаллах модификации P32 молекулы упакованы более плотно, чем в кристаллах модификации R32, а доступ к активному центру молекулы ограничен межмолекулярными контактами.
ВВЕДЕНИЕ
Бактериальные фосфопантетеинаденилилтрансферазы (PPAT) участвуют в пятистадийном биосинтезе кофермента А (CoA) из пантотената (витамин В5), цистеина и аденозинтрифосфата (АТФ) [1]. РРАТ катализируют четвертую, предпоследнюю стадию этого процесса – образование дефосфокофермента А (dPCoA) из 4'-фосфопантетеина и АТФ (обратимый перенос аденилильной группы с АТФ на 4'-фосфопантетеин с освобождением пирофосфата и образованием dPCoA [2]). Фосфорилирование dPCoA на последней стадии процесса приводит к образованию СоА. Катализируемая PPAT реакция является ключевой; при избыточной концентрации СоА образует комплекс с РРАТ и тем самым ингибирует дальнейшее течение процесса. Поскольку биосинтез кофермента А в бактериях и в организмах млекопитающих протекает различно, РРАТ из патогенных организмов могут служить мишенями для разработки лекарств против болезней, вызываемых патогенами.
Пространственная структура одного из таких ферментов-мишеней – РРАТ из Mycobacterium tuberculosis (РРАТMt) – была установлена как для свободного фермента, так и для ряда его комплексов с функционально важными лигандами (АТФ, CoA, dPCoA, PhP), отражающими состояние фермента на разных стадиях катализируемой реакции [3–8]. По результатам исследования был предложен структурный механизм катализируемой реакции [7].
Кристаллы РРАТMt, использованные для рентгеновского исследования, были выращены в разных условиях и относились к разным пространственным группам симметрии: R32 и Р32. Кристаллы апо-фермента и комплексов с функционально важными лигандами (СоА, dРСоА, АТФ), выращенные в присутствии осадителя 1-метил-4-пентандиола (МПД), относились к пр. гр. R32. Кристаллы, полученные с сульфатом аммония в качестве осадителя, принадлежали пр. гр. Р32 и, несмотря на присутствие в кристаллизационном растворе функционального лиганда (например, АТФ), содержали молекулу фермента только в апо-форме.
В настоящей работе проведено сравнение упаковок молекул фосфопантетеинаденилилтрансферазы из M. tuberculosis (РРАТMt) в двух кристаллических структурах (пр. гр. R32, P32, PDB_ID: 4E1A, 4R0N соответственно). На основе анализа внутримолекулярных и межмолекулярных контактов рассмотрены возможные причины, препятствующие связыванию функциональных лигандов в активном центре кристаллической модификации P32.
МАТЕРИАЛЫ И МЕТОДЫ
Рекомбинантный фермент РРАТMt получен и очищен по методике [6]. Кристаллы РРАТMt выращены методом встречной диффузии в капилляре в условиях невесомости, как описано в [5, 9, 10]. Кристаллы модификации R32 получены при использовании в качестве осадителя МПД в следующих условиях. Раствор белка (концентрацией 12 мг/мл) в буфере HEPES концентрацией 10 мM, pH 8.0, содержал 0.15 M NaCl, 1 мМ дитиотреитола. Состав осадителя: какодилатный буфер концентрацией 40 мМ, pH 5.5, содержащий 10 мМ MgCl2, 0.15 мМ NaCl, 20 мМ гексамина кобальта и 15% МПД. При получении комплекса с АТФ в раствор белка добавляли 14 мМ АТФ. Кристаллы модификации Р32 получены из раствора белка, содержащего 10 мг/мл PPATMt, 10 мM HEPES, pH 8.0, 0.15 M NaCl и 14 мM АТФ. В раствор осадителя (0.1 M NaAc, pH 5.0, 10 мM MgCl2, 5 мM HEPES, pH 8.0, 0.075 M NaCl, 14 мM АТФ) добавляли 1.1 M сульфата аммония в качестве осаждающего агента [8].
Координаты атомов пространственных структур, установленных с использованием кристаллов модификации R32 – апо-форма РРАТMt, комплексы с СоА, АТФ, dРСоА – представлены в банке данных белков (PDB_ID: 4E1A, 3RHS, 3UC5, 3RBA соответственно). Пространственная структура РРАТMt, установленная с использованием кристаллов модификации Р32, представляет апо-форму фермента (PDB_ID: 4R0N). При той же концентрации АТФ в растворах, что и при выращивании кристаллов комплекса фермента с АТФ (пр. гр. R32) [5], молекулы АТФ не вошли в активный центр, в нем был локализован ион сульфата (PDB_ID: 4R0N).
Сравнение структур выполнено посредством их совмещения по Сα-атомам с использованием программы Lsqkab комплекса ССР4 [11]. Анализ кристаллической упаковки, межмолекулярных и внутримолекулярных контактов в молекуле РРАТMt проводили с использованием программы PISA [12].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кристаллы РРАТMt, использованные при рентгеновском исследовании свободного фермента и его комплексов, принадлежали двум кристаллическим модификациям (пр. гр. R32 и Р32). Было обнаружено, что при использовании полиэтиленгликоля в качестве осадителя методом сокристаллизации комплексы РРАТMt с функциональными лигандами кристаллизуются только в пр. гр. R32, в то время как сокристаллизация в присутствии соответствующих лигандов с осадителем – сульфатом аммония – позволяет вырастить кристаллы, относящиеся к модификации Р32 и представляющие собой апо-форму фермента. Для изучения особенностей упаковки молекул фермента в обеих кристаллических модификациях были проанализированы строение молекулы РРАТMt, внутримолекулярные и межмолекулярные контакты молекул в обеих пространственных группах.
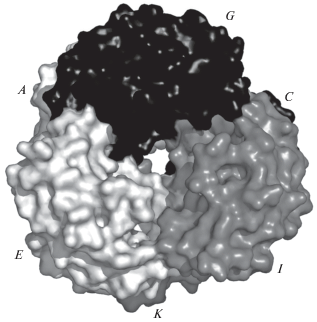
Биологически активной формой фермента является гексамерная молекула РРАТ, состоящая из одинаковых субъединиц [6, 13]. Точечная группа симметрии молекулы 32; субъединицы связаны попарно осями второго порядка, а осью третьего порядка объединены в два тримера. В центре гексамерной молекулы фермента имеется заполненный растворителем канал диаметром более 20 Å (оценка проведена по расстояниям между Сα-атомами остатков, формирующих канал) у поверхности молекулы и 10 Å в зоне контакта тримеров гексамерной молекулы. Активный центр в каждой субъединице занимает большую полость, обращенную внутрь заполненного растворителем канала и несколько удаленную от области контакта тример–тример. Широкий вход в канал со стороны растворителя обеспечивает беспрепятственный доступ субстрата к связывающему участку активного центра. По периметру вход в канал ограничен подвижными петлями 36–46 и аминокислотными остатками спирали 128–136 каждой из субъединиц тримера [6]. В независимой части ячейки кристалла в пр. гр. R32 находится одна субъединица; гексамерная молекула фермента формируется операторами симметрии этой группы. В кристаллической структуре с пр. гр. P32 независимая часть ячейки содержит всю гексамерную молекулу, сохраняющую точечную псевдосимметрию 32 (рис. 1).
Cравнение молекул апо-фермента в двух кристаллических модификациях (пр. гр. R32 и P32, структуры 4E1A и 4R0N соответственно) проведено путем совмещения Сα-атомов. Среднеквадратичное отклонение составило 0.406 Å. Сравнение межсубъединичных взаимодействий в молекулах позволяет предположить, что нарушение симметрии молекулы в модификации Р32 связано с разными характерами этих взаимодействий в обеих группах. Межсубъединичные контакты в молекулах апо-формы фермента в обеих кристаллических структурах приведены в табл. 1.
Таблица 1.
Межсубъединичные контакты в димерах молекул апо-фермента в кристаллических структурах 4R0N (пр. гр. P32) и 4E1A (пр. гр. R32)
| Контакты | Расстояние, Å | |||
|---|---|---|---|---|
| 4R0N, пр. гр. P32 | 4E1A, пр. гр. R32 | |||
| Димер | Димер | |||
| KE | CI | AG | AA | |
| NE2_GLN27…O_THR83 | 3.50 | 3.18 | 3.40 | 3.14 |
| NE2_GLN27…OG1_THR83 | 2.76 | 2.77 | 3.17 | 2.81 |
| NE2_GLN27…OD1_ASP112 | 3.06 | 3.33 | 3.19 | 3.31 |
| NE_ARG23…OD2_ASP112 | 3.13 | 2.81 | 3.06 | |
| N_PHE115…O_PHE115 | 2.71 | 2.85 | 2.88 | 2.79 |
| OD2_ASP112…NE_ARG23 | 2.87 | 2.91 | 3.00 | |
| O_THR83…NE2_GLN27 | 3.03 | 3.18 | 3.47 | 3.14 |
| OG1_THR83…NE2_GLN27 | 2.83 | 2.90 | 2.75 | 2.81 |
| OD1_ASP112…NE2_GLN27 | 3.10 | 3.01 | 3.25 | 3.31 |
| O_THR118…NE2_GLN103 | 2.95 | 2.97 | 2.91 | |
| O_PHE115…N_PHE115 | 2.82 | 2.76 | 2.80 | 2.79 |
| OG1_THR2…OG1_THR2 | 3.83 3.50 | |||
| OG1_THR2…O_GLN27 | 3.75 3.05 | |||
| OG1_THR2…OD2_ASP29 | ||||
| NE2_GLN103…O_THR 118 | 2.94 | |||
| O_GLN27…N_THR2 | 3.35 | |||
| OE1_GLN27…N_THR2 | 3.59 | |||
| OE1_GLN27…OG1_THR83 | 3.61 | |||
| NH1_ARG23…OD2_ASP112 | 2.99 | |||
| OD2_ASP112…NH1_ARG23 | 2.99 | |||
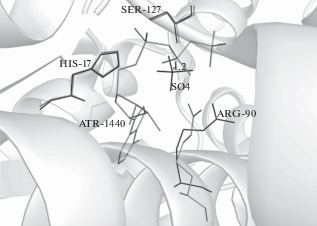
Молекулы фермента в апо-форме в обеих пространственных группах кроме молекул воды содержат молекулы глицерина (4E1A) или ионы SO4 (4R0N). Молекула глицерина (Gol) в структуре 4E1A, расположенная вблизи активного центра, попадает в фермент из криораствора, используемого при замораживании кристаллов в процессе съемки. В кристаллах модификации Р32 каждая субъединица молекулы содержит ион SO4, координированный аминокислотными остатками активного центра Arg90, His17, Ser127. Кроме того, в субъединицах G и C, принадлежащих разным тримерам молекулы, локализованы ионы SO4, контактирующие с остатком Arg121. Эти ионы связаны между собой псевдоосью второго порядка и расположены вблизи друг друга (рис. 2). Связывание дополнительных ионов сульфата, входящих в состав осадителя в высокой концентрации, нарушает симметрию молекулы и может способствовать изменению характера кристаллической упаковки. Кроме того, ионы сульфата, являющиеся структурными аналогами фосфата, занимают в активном центре положение, которое в комплексе РРАТMt с АТФ занимают ионы фосфата [5] (рис. 3). Конкуренция между ионами сульфата из осадителя и фосфатами молекулы АТФ также затрудняет связывание функционального лиганда.
Рис. 2.
Ион SO4, расположенный в активном центре субъединицы G, и ионы SO4, дополнительно локализованные в субъединицах G (черный цвет) и C (серый цвет), находящихся в разных тримерах молекулы РРАТMt (4R0N) и связанных псевдоосью симметрии 2.
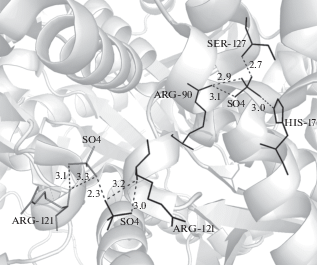
Рис. 3.
Совмещение пространственных структур 4R0N и комплекса PPATMt с АТФ (PDB_ID: 3UC5) по Сα-атомам. Ион SO4 (4R0N) показан черным цветом, молекула АТФ (3UC5) – серым, одну из фосфатных групп этой молекулы координируют те же аминокислотные остатки Arg90 и His17, что и ион сульфата в 4R0N.
В кристаллической модификации R32 при межмолекулярных взаимодействиях все субъединицы молекулы имеют одинаковые контакты с соседями, так как молекула имеет точечную симметрию 32, элементы которой совпадают с элементами симметрии пр. гр. R32. В кристаллической модификации Р32, когда в независимой части ячейки содержится асимметричная гексамерная молекула, все субъединицы молекулы вовлечены в межмолекулярные контакты в разной степени. Межмолекулярные полярные контакты в двух кристаллических модификациях представлены в табл. 2. Наибольшее количество межмолекулярных полярных связей образуется между субъединицами молекулы (x, y, z) и субъединицами, связанными с ней следующими преобразованиями симметрии: –y + 1, x – y + 1, z – 1/3 (K–E*, A–I*, K–I*, звездочкой отмечены субъединицы соседней молекулы); –y, x – y, z – 1/3 (A–G*, C–G*) (табл. 2). Субъединицы I и C* исходной молекулы и молекулы, связанной с ней оператором симметрии –y, x – y + 1, z + 2/3, образуют две пары антипараллельных водородных связей (табл. 2). На рис. 4 представлена независимая молекула фермента кристаллической модификации Р32 в окружении молекул, связанных с ней преобразованиями симметрии: –y + 1, x – y + 1, z – 1/3; –y, x – y, z – 1/3; –y, x – y + 1, z + 2/3. По одной H-связи (табл. 2) формируется также между субъединицей G молекулы (x, y, z) и A*, связанной с исходной преобразованием симметрии –y, x – y, z + 2/3, и субъединицами E (x, y, z) и K* (–y + 1, x – y + 1, z + + 2/3). В межмолекулярных контактах преимущественно участвуют аминокислотные остатки спиралей 15–28, 46–58, 72–80, концевой спирали 147–156, остатки ленты 65–69, петель 36–46, 68–72, 135–140. На рис. 5а представлена независимая молекула кристаллической модификации P32, на которой выделены аминокислотные остатки, способные образовывать полярные и гидрофобные контакты с соседними молекулами в кристаллической ячейке. В табл. 3 приведены некоторые величины, отражающие разную степень взаимодействия между субъединицами независимой молекулы PPATMt и молекулами из ее ближайшего окружения, сформированного в результате преобразований симметрии, приведенных в табл. 3.
Таблица 2.
Полярные контакты между молекулами в кристаллических структурах 4R0N (пр. гр. P32) и 4E1A (пр. гр. R32)
| 4R0N | ||
|---|---|---|
| Молекула (x, y, z) | Расстоя-ние, Å | Молекула (–y + 1, x – y + 1, z – 1/3) |
| N_Thr2/K | 3.68 | OE1_Gln67/E |
| N_Thr2/K | 3.89 | O_Val68/E |
| NH2_Arg78/K | 3.08 | OD1_Asp75/E |
| NH1_Arg65/K | 3.45 | O_Ser79/E |
| OE1_Glu30/K | 3.55 | NE2_Gln67/E |
| OE2_Glu30/K | 3.18 | NH2_Arg65/E |
| OE2_Glu142/A | 2.39 | ND2_Asn157/I |
| NH2_Arg78/K | 3.07 | O_Leu136/I |
| Молекула (x, y, z) | Молекула (–y, x –y, z – 1/3) | |
| NH2_Arg65/A | 3.20 | OE1_Glu30/G |
| NE2_Gln67/A | 2.96 | OE2_Glu30/G |
| OE1_Gln67/A | 3.38 | OG1_Thr2/G |
| OD1_Asp75/A | 3.43 | NH2_Arg78/G |
| O_Arg78/A | 3.47 | NH2_Arg65/G |
| O_Ser79/A | 3.45 | NH1_Arg65/G |
| O_Ser79/A | 3.29 | NH2_Arg65/G |
| NH2_Arg65/A | 3.64 | OE2_Glu30/G |
| O_Leu136/C | 3.00 | NH2_Arg78/G |
| Молекула (x, y, z) | Молекула (–y, x – y + 1, z + 2/3) | |
| N_Leu47/I | 2.47 | OD2_Asp48/C |
| N_Asp48/I | 3.02 | OD2_Asp48/C |
| OD2_Asp48/I | 2.79 | N_Leu47/C |
| OD2_Asp48/I | 2.71 | N_Asp48/C |
| Молекула (x, y, z) | Молекула (–y, x – y, z + 2/3) | |
| OG1_Thr59/G | 2.88 | OD2_Asp154/A |
| Молекула (x, y, z) | Молекула (–y, x – y + 1, z + 2/3) | |
| OD2_Asp154/E | 3.05 | OG1_Thr59/K |
| 4E1A | ||
| Молекула (x, y, z) | Молекула (x – y, –y, –z) | |
| OG_Ser79/A | 3.71 | O_Asp75/A* |
| OG_Ser79/A | 3.06 | OG_Ser79/A* |
| O_Asp75/A | 3.71 | OG_Ser79/A* |
Рис. 4.
Независимая молекула фермента кристаллической модификации Р32 в окружении молекул, связанных с ней преобразованиями симметрии: –y + 1, x – y + 1, z – 1/3; –y, x – y, z – 1/3; –y, x – y + 1, z + 2/3. Водородные и гидрофобные контакты с соседними молекулами выделены темными сферами.
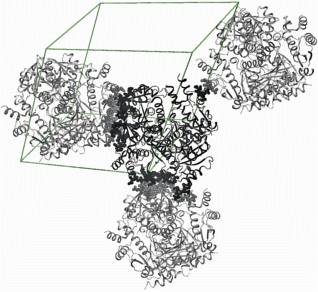
Рис. 5.
Области молекулы: а – 4R0N, аминокислотные остатки которой могут образовывать водородные и гидрофобные контакты с соседними молекулами; б – 4E1A, образующие водородные и гидрофобные контакты с соседними молекулами. Зоны контактов выделены темными сферами.
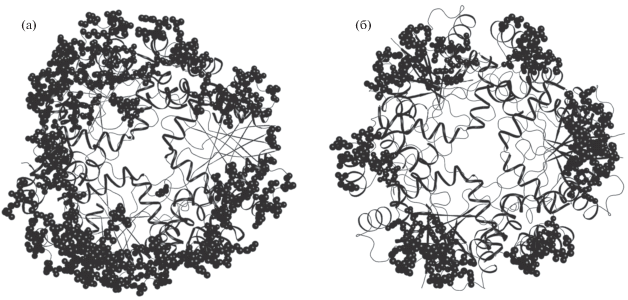
Таблица 3.
Характеристики межмолекулярных контактов в кристаллической структуре 4R0N (пр. гр. P32)
| Оператор симметрии | Число остатков, участвующих в контактах | Число полярных связей | Площадь контактов, Å2 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| A | G | K | E | C | I | A | G | K | E | C | I | A | G | K | E | C | I | |
| –y + 1, x – y +1, z – 1/3 | 3 | 16 | 12 | 1 | 7 | 95.2 | 452.8 | 291.6 | ||||||||||
| –y, x – y, z – 1/3 | 22 | 9 | 8 | 1 | 648.0 | 176.8 | ||||||||||||
| –y, x – y + 1, z – 1/3 | 7 | 5 | 8 | 150.1 | 70.1 | 175.7 | ||||||||||||
| –y, x – y, z + 2/3 | 7 | 1 | 244.4 | |||||||||||||||
| –y + 1, x–y + 1, z + 2/3 | 7 | 1 | 240.7 | |||||||||||||||
| –y, x – y + 1, z + 2/3 | 4 | 4 | 139.9 | |||||||||||||||
| x, y, z – 1 | 2 | 38.1 | ||||||||||||||||
В кристаллах модификации R32, в которых независимая часть кристаллической ячейки содержит только одну субъединицу, гексамерная молекула фермента, построенная с помощью операторов симметрии пр. гр. R32, контактирует с соседними молекулами в области ленты 64–69, петли 70–72, нерегулярного участка 139–146, спирали 72–81, концевой спирали 147–156 (рис. 5б). Молекула PPATMt (пр. гр. R32) образует контакты с соседними молекулами, связанными с исходной преобразованиями симметрии x – y, –y, ‒z и y, x, –z. В полярные и гидрофобные межмолекулярные взаимодействия вовлечены по 16 остатков каждой субъединицы, два из которых образуют водородные связи (табл. 2). Сравнение полярных контактов (табл. 2) для двух кристаллических модификаций показывает, что в кристаллах фермента, принадлежащих разным пространственным группам, в межмолекулярные полярные взаимодействия вовлечены два общих остатка Asp75 и Ser79, но эти аминокислотные остатки образуют разные межмолекулярные контакты.
Упаковки молекул в обеих кристаллических модификациях представлены на рис. 6. В кристаллах R32, в которых тройная ось симметрии гексамерной молекулы совпадает с кристаллографической осью симметрии 3 (параллельна оси 31), а двойные ее оси – с кристаллографическими двойными осями, гексамерные молекулы фермента уложены вдоль оси третьего порядка кристаллической ячейки. В результате внутренние каналы молекул образуют сплошные каналы вдоль оси c кристаллической решетки (гексагональная установка ромбоэдрической ячейки кристалла), и доступ лигандов в активный центр остается открытым (рис. 6а). В кристаллах модификации P32 псевдоось симметрии третьего порядка молекулы наклонена к оси 32 кристаллической ячейки. Гексамерные молекулы уложены таким образом, что входы во внутренний канал молекулы оказываются частично перекрытыми из-за межмолекулярных контактов, в которых участвуют некоторые аминокислотные остатки подвижной петли, расположенной по периметру канала (рис. 6б). В структуре 4R0N в гидрофобных взаимодействиях между молекулами, связанными преобразованиями симметрии x, y, z – 1, участвуют остатки Lys41, Thr42, принадлежащие подвижной петле 36–46, по периметру ограничивающей вход в канал молекулы [6]. Другие преобразования симметрии вовлекают в межмолекулярные взаимодействия Asp46 из той же петли и Leu136 спирали 128–136, которая также ограничивает вход в молекулярный канал [6].
Рис. 6.
Упаковка молекул в кристаллических структурах: а – 4E1A, пр. гр. R32; б – 4R0N, пр. гр. P32.

Упаковка молекул в кристаллах модификации Р32 (4R0N) более компактная, чем в модификации R32 (4E1A). Коэффициенты Метьюса [14] для структур 4R0N и 4E1A соответственно равны 2.28 и 3.08 Å3/Да, что свидетельствует о большей доли растворителя в ромбоэдрической структуре 4E1A – 59.27%. Доля растворителя в структуре 4R0N составляет 46.16%.
ЗАКЛЮЧЕНИЕ
Кристаллы фосфопантетеинаденилилтрансферазы Mycobacterium tuberculosis (РРАТMt), выращенные с использованием в качестве осадителя 2-метил-2,4-пентандиола, принадлежат пр. гр. R32, а выращенные в присутствии осадителя сульфата аммония – пр. гр. Р32. Сравнение строения молекул апо-формы РРАТMt в двух кристаллических модификациях показало различия между молекулами, которые могут привести к изменению упаковки, например нарушению точечной симметрии молекулы 32 из-за связывания молекулой иона сульфата. Сравнение упаковок молекул РРАТMt в разных кристаллических модификациях показало, что в кристаллах пр. гр. P32 молекулы упакованы более плотно, а доступ к активному центру молекулы ограничен межмолекулярными контактами. Независимая гексамерная молекула в кристаллах пр. гр. P32 образует большее количество полярных межмолекулярных контактов (табл. 2), чем симметричная молекула в кристаллической структуре 4E1A (пр. гр. R32). Количество остатков, вовлекаемых в межмолекулярные взаимодействия, также разное (102 в кристаллической модификации Р32, 96 в R32).
Работа выполнена в рамках Федеральной космической программы 2016-2025 (ОКР “МКС (Наука)”) в части решения и уточнения структуры белка, а также при поддержке Министерства науки и высшего образования в рамках Государственного задания ФНИЦ “Кристаллография и фотоника” РАН в части сравнения упаковок белковых молекул.
Список литературы
Robinshaw J.D., Neely J.R. // Am. J. Physiol. 1985. V. 248. P. E1.
Dreckhammer D.G. // Biochem. Biopys. Res. Commun. 1993. V. 192. P. 1135.
Wubben T.J., Mesecar A.D. // J. Mol. Biol. 2010. V. 404. P. 202.
Wubben T., Mesecar A.D. // Acta Cryst. F. 2011. V. 67. P. 541.
Timofeev V.I., Smirnova E.A., Chupova L.A. et al. // Acta Cryst. D. 2012. V. 68. P. 1660.
Тимофеев В.И., Смирнова Е.А., Чупова Л.А. и др. // Кристаллография. 2010. Т. 55. № 6. С. 1058.
Тимофеев В.И., Смирнова Е.А., Чупова Л.А. и др. // Кристаллография. 2012. Т. 57. № 1. С. 102.
Тимофеев В.И., Чупова Л.А., Есипов Р.С., Куранова И.П. // Кристаллография. 2015. Т. 60. № 5. С. 745.
Takahashi S., Tsurumura T., Aritake K. et al. // Acta Cryst. F. 2010. V. 66. P. 846.
Куранова И.П., Смирнова Е.А., Абрамчик Ю.А. и др. // Кристаллография. 2011. Т. 56. № 5. С. 944.
Collaborative Computational Project, Number 4. 1994. The CCP4 Suite: Programs for Protein Crystallography // Acta Cryst. D. 1994. V. 50. P. 760.
Krissinel E., Henrick K. // J. Mol. Biol. 2007. V. 372. P. 774.
Morris V.K., Izard T. // Protein Sci. 2004. V. 13. P. 2547.
Matthews B.W. // J. Mol. Biol. 1968. V. 33. P. 491.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография