Кристаллография, 2020, T. 65, № 2, стр. 292-300
Молекулярно-динамическое моделирование структурных и транспортных свойств твердых растворов двойных перовскитов на основе PrBaCo2O5.5
М. З. Галин 1, А. К. Иванов-Шиц 2, 3, *, Г. Н. Мазо 4
1 Институт проблем химической физики РАН
Черноголовка, Россия
2 МГИМО Университет МИД России
Москва, Россия
3 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
4 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: alexey.k.ivanov@gmail.com
Поступила в редакцию 09.07.2019
После доработки 09.07.2019
Принята к публикации 29.08.2019
Аннотация
Проведено молекулярно-динамическое моделирование диффузии кислорода в твердых растворах двойных перовскитов на основе PrBaCo2O5.5: PrBa0.5Sr0.5Co2O5.5 со случайным замещением половины атомов Ba атомами Sr, PrBa0.5Sr0.5CoFeO5.5 со случайным замещением Ba → Sr и Co → Fe, PrBa0.5Sr0.5CoCuO5.5 со случайным замещением Ba → Sr и Co → Cu, PrBa0.5Sr0.5CuFeO5.5 со случайным замещением Ba → Sr и атомов Co атомами Fe и Cu. Показано, что варьируя кислородную нестехиометрию и/или химический состав твердых растворов на основе PrBa0.5Sr0.5Co2O5.5, можно значительно изменять коэффициент теплового расширения материалов. Впервые установлено, что максимальная разница между подвижностями атомов кислорода различных типов, наблюдаемая в PrBa0.5Sr0.5Co2O5.5, значительно уменьшается при частичных замещениях кобальта на железо и медь. В твердом растворе PrBa0.5Sr0.5CuFeO5.5 подвижность атомов кислорода в слоях (Cu,Fe)–O становится несколько выше подвижности атомов кислорода в слоях Pr–O.
ВВЕДЕНИЕ
Начиная с 90-х годов прошлого века активно ведутся работы по поиску и исследованию новых материалов со смешанной ионно-электронной проводимостью, которые могут использоваться в качестве катодов в среднетемпературных (600–800°C) твердооксидных топливных элементах [1, 2]. Среди таких катодных материалов – оксиды типа перовскита на основе кобальта La1 ‒ xSrxCoO3 – δ с x ≤ 0.5 [3, 4] и различного типа замещений как редкоземельного элемента, так и кобальта [5–7]. Однако многие материалы имеют коэффициенты термического расширения (КТР) (КТР > 20 × × 10–6 K–1), значительно превышающие КТР стандартных электролитов в твердооксидных топливных элементах (КТР ∼ 10 × 10–6 K–1).
Другая группа материалов со смешанной ионно-электронной проводимостью для катодов в среднетемпературных твердооксидных топливных элементах представляет собой серию оксидных фаз Раддлесдена–Поппера An + 1BnO3n + 1, где A – ион щелочноземельного или редкоземельного элемента, B – ион переходного металла, n = 1–3. Например, La2NiO4 + δ (n = 1) показывает высокую диффузию кислорода по межузельным позициям и имеет значения КТР, отвечающие значениям КТР стандартных электролитов [8]. Оксиды типа (Sr1 – xLax)3(Fe1 – yCoy)2O7 – δ (n = 2) и (Sr1 ‒ xLax)4(Fe1 – yCoy)3O10 – δ (n = 3) характеризуются высокой активностью реакции восстановления кислорода, что связано с возрастанием электронной и ионной проводимости при увеличении числа n слоев перовскита, однако при этом ухудшаются (увеличиваются) значения КТР [9–11].
В последние годы возрастает интерес к слоистым, так называемым двойным перовскитам LnBaCo2O5 + δ (Ln – редкоземельный ион либо Y3+) [12–15], в которых катионы упорядочены по А-позициям. Общая формула этого семейства может быть записана как AA´BB2O5 + δ. Для А-катиона даже при δ = 0 координационное число равно восьми за счет наличия вакансий в позициях атомов кислорода. Несмотря на ограниченность сведений о стабильности электрохимических характеристик, материалы со структурой двойного перовскита могут стать достойными конкурентами существующих катодных материалов для среднетемпературных твердооксидных топливных элементов. Действительно, для материалов LnBaCo2O5 + δ характерны высокие значения как электронной проводимости (до 103 См/см), так и коэффициентов диффузии кислорода (до 10–7 см2/с при 873 K) [16]. Однако в случае соединений LnBaCo2O5 + δ отмечаются высокие значения КТР (что типично для кобальтитов), и хотя при уменьшении радиуса редкоземельного иона наблюдается тенденция к снижению КТР, даже в случае GdBaCo2O5 + δ значение КТР (∼(16–17) × 10–6 К–1) существенно превышает целевые показатели [17]. Для повышения проводимости, улучшения химической стабильности и электрохимических свойств осуществляли частичное замещение иона Ba2+ меньшим по радиусу ионом Sr2+ [18, 19], но легирование стронцием, как правило, приводит к увеличению КТР, поэтому предлагается использование других переходных металлов для уменьшения КТР [17, 20, 21]. В семействе LnBa0.5Sr0.5Co2O5 + δ (Ln = Pr, Nd, Sm, Gd, Y) наибольшие значения проводимости наблюдаются, когда Ln = Pr и Gd [17].
Как и в случае кобальтитов La1 – xSrxCoO3 – δ, замещение кобальта в LnBaCo2O5 + δ другим переходным металлом (Fe, Ni, Mn или Cu) используют для снижения КТР [22, 23]. Дополнительным положительным эффектом замещения является некоторое улучшение электрокаталитической активности кобальтитов. Так, при замещении кобальта на железо (x = 0.5) в LnBaCo2 – xFexO5 + δ и в LnBa0.5Sr0.5Co2 – xFexO5 + δ наблюдается снижение поляризационного сопротивления, однако дальнейшее увеличение содержания железа приводит к росту поляризационных потерь на катоде вследствие снижения электронной и ионной составляющих проводимости [24]. Оказалось, что наименьшие величины поляризационного сопротивления демонстрируют Pr- и Sm-содержащие кобальтиты с различными замещениями в B-позиции [17, 25, 26]. Помимо кобальтитов среди двойных перовскитов практический интерес представляют ферриты LnBaFe2O5 + δ [27, 28].
При прогнозировании и дизайне новых материалов методы численного эксперимента позволяют не только сократить время проведения реального физико-химического эксперимента, но и изучить структурные и транспортные особенности моделируемых кристаллов. В [29, 30] с использованием метода молекулярной статики было показано, что в LnBaCo2O5.5 (Ln = Gd, La, Y) энергетически наиболее выгодная кристаллическая конфигурация связана с одновременным упорядочением катионов Ln и Ba вдоль оси с и случайным распределением кислородных вакансий в плоскости Ln–O. Квантово-механические расчеты PrBa0.5Sr0.5Co1.5Fe0.5O5 + δ [31] (в рамках теории функционала плотности) свидетельствуют о преимущественном создании вакансий атомов кислорода вблизи ионов Со3+.
При изучении явлений переноса ионов кислорода логичным выглядит использование метода молекулярной динамики (МД). В ряде случаев за счет подбора потенциалов взаимодействия МД-моделирование двойных перовскитов LnBaCo2O5.5 (Ln = Gd, Pr, La, Y) [29, 32–35] привело к значениям энергии активации и коэффициентам диффузии, сопоставимым с экспериментальными данными. Замещение катионов в А-позиции (Ba → Sr) приводит к возрастанию диффузии (почти в 3 раза) в PrBa0.5Sr0.5Co2O5.5 [35]. В ходе изучения влияния легирования в B-позициях GdBa0.5Sr0.5Co2 – xFexO5.5 было показано [36], что коэффициент диффузии кислорода линейно возрастает при увеличении концентрации железа и достигает значения DO = 7.5 × 10–8 см2/с при 923 K и 50%-ном замещении Co → Fe.
Важно подчеркнуть, что компьютерный эксперимент позволяет изучить возможные механизмы ионного транспорта на микроскопическом уровне. Так, анализ карт плотности распределения кислорода в LnBaCo2O5.5 однозначно указывает на высокую анизотропию переноса ионов кислорода – транспорт осуществляется в плоскостях (слоях) Co–O и Ln–O и практически отсутствует в плоскостях Ba–O [33, 34, 36]. Для NdBaCo2O5.5 [37] была предложена перколяционная модель, связывающая перескоки в плоскостях Nd–O и Co–O, что также согласуется с данными нейтронной дифракции. В [29] удалось показать, что хотя большая часть кислородных вакансий, необходимых для ионного переноса, расположена вплоскостях Ln–O, для эффективной диффузии необходимо наличие вакансий и в плоскостях Co–O. В [38] для PrBaCo2O5.5 с использованием кластерного анализа удалось рассчитать заселенность различных позиций атомов кислорода при разных температурах и определить энтальпию миграции перескоков ионов. Полученные результаты еще раз подтверждают тот факт, что диффузия кислорода в этом материале анизотропна.
В настоящей работе моделирование методом МД проведено для твердых растворов на основе PrBaCo2O5.5 с целью уточнения как особенностей транспорта ионов кислорода в кобальтитах со структурой двойного перовскита, так и поиска соединений наиболее перспективных составов, обладающих необходимыми значениями КТР, электронной и ионной проводимости (замещения Ba → Sr, Сo→Fe, Co → Cu, Co2 → Fe, Cu).
КОМПЬЮТЕРНЫЙ ЭКСПЕРИМЕНТ
Построение расчетной ячейки. Кристаллическая структура рассматриваемого класса сложных оксидов LnBaCo2O5.5 базируется на структуре перовскита ABO3: в случае заполнения А-позиций катионами двух сортов с сильно различающимися ионными радиусами простая кубическая структура перовскита перестраивается в слоистую структуру из-за упорядочения катионов различного сорта по A-позициям. Упорядочение катионов в А-подрешетке приводит к тому, что элементарная ячейка изученных оксидов становится удвоенной вдоль оси с по сравнению с кубической ячейкой перовскита. Поэтому такую структуру называют структурой двойного перовскита (рис. 1).
Рис. 1.
Тетрагональная структура LnBaCo2O5 + δ. Атомы кобальта расположены в пирамидах CoO5 и октаэдрах CoO6.
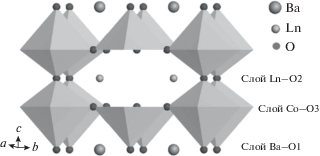
Структурные особенности двойных перовскитов обусловливают особенности анионного транспорта: в анионной подсистеме транспорт обусловлен наличием кислородных вакансий в слоях Ln–O (кислород типа О2) и в слоях Co–O (кислород типа О3), в то время как кислород типа О1, расположенный в слоях Ba–O, практически не участвует в трансляционном движении.
По результатам рентгеновской и нейтронной дифракции сложные оксиды LnBaCo2O5 + δ (где Ln = La, Pr, Nd, Sm, Gd, Y) могут быть описаны с помощью тетрагональной (ap × ap × 2ap) элементарной ячейки (где ар – параметр решетки кубического перовскита), пр. гр. P4/mmm, которая отвечает так называемой структуре “112” [39–41]. Для PrBaCo2O5.5 начальные параметры ячейки задавали как а = 3.952 и с = 7.687 Å при 300 K.
В настоящей работе помимо базового состава PrBaCo2O5.5 был изучен двойной перовскит PrBa0.5Sr0.5Co2O5.5, в котором половина атомов бария была замещена атомами стронция. На его базе были смоделированы твердые растворы со случайным замещением половины атомов Co → Fe – PrBa0.5Sr0.5CoFeO5.5, твердые растворы со случайным замещением половины атомов Co → Cu – PrBa0.5Sr0.5CoCuO5.5 и твердые растворы со случайным замещением половины атомов Co → Cu и второй половины атомов Co → Fe – PrBa0.5Sr0.5FeCuO5.5. Размер тетрагональной элементарной ячейки в твердых растворах был неизменным, и параметры составляли: a = 3.8852, c = 7.72 Å при температуре 573 K [42].
Для МД-моделирования был создан расчетный бокс с размерами 12 × 12 × 6 элементарных ячеек вдоль кристаллографических направлений a, b и с соответственно. Расчетная система содержала 8208 атомов. Для твердых растворов моделировали случайное замещение половины атомов Ba → Sr, Co → Fe, Co → Cu. Все кислородные вакансии, отвечающие составу δ = 0.5, также случайным образом были распределены в слое Pr–O.
МД-расчеты. Для расчетов методом МД использовали пакет DL_POLY 4 [43]. Расчеты проводили в рамках модели эффективных парных потенциалов (приближение жестких ионов), а потенциальную энергию системы (U) задавали в виде суммы кулоновского (электростатического) и короткодействующего парного потенциала:
Таблица 1.
Параметры потенциалов близкодействующего межионного взаимодействия в кристаллах PrBa0.5Sr0.5M2O5.5 (M = Co, Fe, Cu) [32, 36, 44]
| Пара ионов i–j | Aij, эВ | ρij, Å | Cij, эВ · Å6 |
|---|---|---|---|
| Pr3+–O2– | 2049.95 | 0.3438 | 23.88 |
| Ba2+–O2– | 905.7 | 0.3976 | 0 |
| Sr2+–O2– | 1950.86 | 0.3252 | 0 |
| Co3+–O2– | 1226 | 0.3087 | 0 |
| Fe3+–O2– | 1156.36 | 0.3299 | 0 |
| Cu3+–O2– | 583.93 | 0.35402 | 0 |
| O2––O2– | 9547.396 | 0.3430 | 32 |
При расчете короткодействующей составляющей потенциальной энергии ограничивались рассмотрением пар типа катион–анион и анион–анион [45, 46]. Для вычисления движения атомов в рамках изотермо-изобарического (NPT) ансамбля (фиксированы число частиц в боксе, давление и температура) был задействован модифицированный алгоритм Верле, а для расчета кулоновской составляющей потенциальной энергии использовали метод Эвальда. Шаг интегрирования уравнений движения по времени 10–15 с обеспечивал стабильность полной энергии системы с точностью 0.03%. В начальный момент времени скорости частиц в боксе полагали равными нулю, после чего температуру системы выводили на заданный уровень. Длительность периода термализации составляла 20 пс. По окончании расчета траекторий частиц при каждой температуре был получен большой массив данных, содержавший координаты и скорости всех частиц в боксе за период времени 200 пс (2 × 105 итераций). Расчеты проводили в интервале температур 573–1373 K.
Подвижность частиц в кристаллической решетке характеризовали с помощью функций среднеквадратичных смещений:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Базовый состав и замещения в А-подрешетке (слои Ba–O). Одним из важных технологических параметров, связанных с практическим использованием материалов в качестве катода твердооксидных топливных элементов, является величина КТР, которая должна согласовываться с КТР твердого электролита и материала коннекторов. Во введении было указано, что различные замещения в катионной и анионной подрешетках базового материала PrBa0.5Sr0.5Co2O5.5 влияют на параметры кристаллической решетки. МД-расчеты в рамках NPT-ансамбля позволяют определить параметры элементарной ячейки при разных температурах и разном содержании кислорода, что, в свою очередь, дает возможность определить КТР. Результаты таких расчетов для PrBa0.5Sr0.5Co2O5.5 и твердых растворов на его основе с замещением в А-подрешетке приведены в табл. 2. Укажем, что МД-расчеты свидетельствуют о практически изотропном термическом расширении исследуемых материалов.
Таблица 2.
Значения линейного КТР для PrBa1 – хSrхCo2O5 + δ (х = 0, 0.5)
Для твердых растворов PrBa0.5Sr0.5Co2O5.5 значения КТР близки к значениям КТР твердого электролита на основе диоксиода циркония, стабилизированного иттрием. Отметим, что рассчитанные значения КТР для PrBaCo2O5.5 выше экспериментально определенных величин, в то время как для PrBa0.5Sr0.5Co2O5.5 тенденция противоположная. Отмеченные расхождения могут быть связаны с тем, что в реальном эксперименте при повышении температуры указанные фазы теряют часть кислорода, в то время как в компьютерном эксперименте их состав (по кислороду) не меняется. Поэтому были проведены расчеты для кристаллов модельных двойных перовскитов PrBa0.5Sr0.5Co2O5 + δ с различной нестехиометрией δ по кислороду от 0.3 до 0.8 с одновременным увеличением заряда кобальта до +3.3 (для сохранения электронейтральности ячейки в целом): значения КТР действительно зависят от содержания кислорода, как это показано в табл. 2.
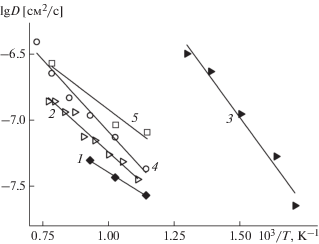
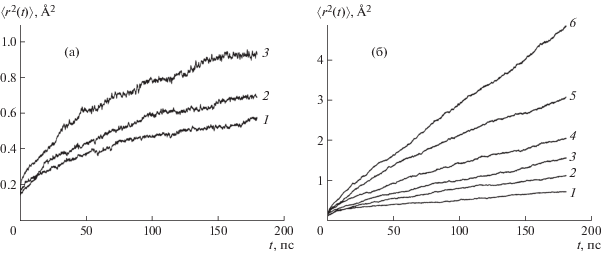
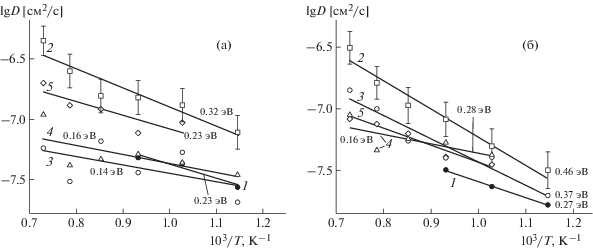
Транспортные (диффузионные) характеристики исследованных материалов находили из анализа временных зависимостей $\left\langle {r_{{\text{O}}}^{2}(t)} \right\rangle $ для всех ионов кислорода в расчетной ячейке. На рис. 2 в качестве примера показаны кривые $\left\langle {r_{{\text{O}}}^{2}(t)} \right\rangle $ для PrBaCo2O5.5 и PrBa0.5Sr0.5Co2O5.5 при разных температурах. Укажем, что для PrBaCo2O5.5 начальная стадия плавления наблюдается при T > 1100 K. Температурные зависимости рассчитанных коэффициентов диффузии приведены на рис. 3. Как видно из рисунка, для PrBaCo2O5.5 значения коэффициентов диффузии несколько ниже величин D, полученных методом МД в [34]. Энергия активации диффузии составляет 0.25 эВ, что также меньше значения 0.35 эВ, приведенного в [34]. Отметим, что МД-расчеты дают существенно меньшие значения коэффициентов диффузии, чем величины D, рассчитанные из данных эксперимента по измерению коэффициентов химической диффузии с одновременным учетом термодинамического фактора [48]. Расхождение значений D в случае МД-расчетов связано, по-видимому, с разным набором параметров короткодействующего потенциала в настоящей работе и в [34]. Как отмечалось ранее, замена Ba → Sr в PrBaCo2O5.5 приводит не только к уменьшению КТР, но и к заметному возрастанию коэффициента диффузии анионов кислорода. Из рис. 3 следует, что наблюдается неплохое согласие полученных результатов с данными МД-расчетов [36].
Рис. 2.
Среднеквадратичные смещения для PrBaCo2O5.5 (а) и PrBa0.5Sr0.5Co2O5.5 (б) при температуре: 1 – 873, 2 – 973, 3 – 1073, 4 – 1173, 5 – 1273, 6 – 1373 K.
Замещения в В-подрешетке (слои Cо–O). Проводимость (электронная и ионная) является одной из важнейших характеристик электродных материалов. Для варьирования электронной составляющей проводимости можно замещать кобальт элементами с переменной валентностью. Например, замена части кобальта медью должна способствовать повышению электронной проводимости, а частичное замещение железом – ее уменьшению. Метод МД не позволяет исследовать электронную составляющую проводимости, однако результаты моделирования позволяют рассмотреть поведение ионной составляющей σ, что также сказывается на электродных характеристиках материала. Помимо этого, можно рассчитать КТР. Для твердых растворов PrBa0.5Sr0.5CoFeO5.5, PrBa0.5Sr0.5CoCuO5.5 и PrBa0.5Sr0.5CuFeO5.5 были изучены термодинамические и диффузионные характеристики. На рис. 4 показана зависимость параметров кристаллической решетки от температуры. Видно, что при частичном замещении Co → Cu в образующемся твердом растворе PrBa0.5Sr0.5CoCuO5.5 значительно повышается КТР (табл. 3). Кроме того, твердый раствор данного состава плавится при меньшей температуре по сравнению с другими твердыми растворами на основе PrBa0.5Sr0.5M2O5.5. Введение атомов меди приводит к существенному увеличению КТР (табл. 3). В то же время замещение Co → Fe незначительно изменяет КТР, что также отмечается при замещении Co2 → (Cu,Fe). Таким образом, варьируя нестехиометрию по кислороду (табл. 2) и/или химический состав (табл. 3) твердых растворов на основе PrBa0.5Sr0.5Co2O5.5, можно значительно изменить КТР материалов, чтобы подобрать необходимые значения для согласования параметров электрохимических ячеек.
Рис. 4.
Зависимость параметров элементарных ячеек а (1, 3, 5) и с (2, 4, 6) твердых растворов PrBa0.5Sr0.5CuFeO5.5 (1, 2), PrBa0.5Sr0.5CoCuO5.5 (3, 4) и PrBa0.5Sr0.5CoFeO5.5 (5, 6) от температуры.
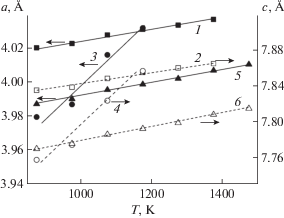
Таблица 3.
Значения КТР твердых растворов на основе PrBaCo2O5.5
| Состав | КТР, 10–6 K–1 (вдоль осей а, b) |
КТР, 10–6 K–1 (вдоль оси с) |
Примечание |
|---|---|---|---|
| PrBa0.5Sr0.5Co2O5.5 | 9.85 | 9.85 | МД-расчет |
| PrBa0.5Sr0.5CoFeO5.5 | 9.86 | 9.86 | МД-расчет |
| PrBa0.5Sr0.5CoCuO5.5 | 25.7 | 24.7 | МД-расчет |
| PrBa0.5Sr0.5CuFeO5.5 | 8.08 | 8.47 | МД-расчет |
| PrBaCoCuO5.5 | 15.2 | Эксперимент [23] | |
| PrBaCo2O5.5 | 24.1 | Эксперимент [23] | |
| PrBa0.5Sr0.5Co1.5Fe0.5O5 + δ | 28.3 | 14.1 | Эксперимент [31] |
Температурные зависимости рассчитанных коэффициентов диффузии кислорода приведены на рис. 5. Как видно из рисунка, замещение Co → → Cu и Co → Fe не дает увеличения ионной проводимости, что находится в противоречии с данными МД-расчетов [36] при замещении Co → Fe. Расхождение в последнем случае может быть связано с использованием различных параметров в расчетах парных взаимодействий.
Рис. 5.
Рассчитанные коэффициенты диффузии кислорода в твердых растворах: 1 – PrBa0.5Sr0.5Co2O5.5, 2 – PrBa0.5Sr0.5CoCuO5.5, 3 – PrBa0.5Sr0.5CuFeO5.5, 4 – PrBa0.5Sr0.5CoFeO5.5, 5 – PrBa0.5Sr0.5Co1.5Fe0.5O5.5 [36], 6 – PrBa0.5Sr0.5CoFeO5.5 [36]. Цифры возле прямых – значения энергии активации диффузии.
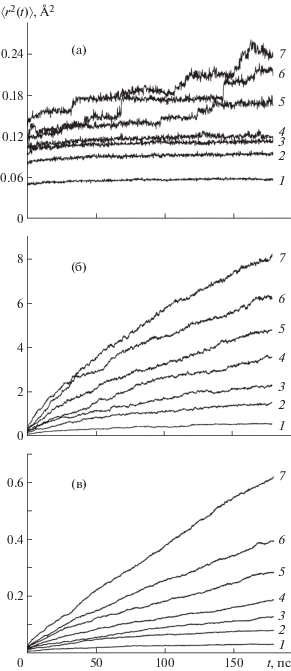
Как уже отмечалось выше, структурные особенности двойных перовскитов обусловливают особенности анионного транспорта – перенос ионов кислорода различен в различных слоях (Ln–O, Co–O, Ba(Sr)–O) анионной подсистемы. На рис. 6 в качестве примера показаны временные зависимости $\left\langle {r_{{\text{O}}}^{{\text{2}}}(t)} \right\rangle $ для ионов кислорода разных типов в PrBa0.5Sr0.5Co2O5.5, которые указывают на различный характер поведения различных подрешеток кислорода и подтверждают сказанные выше утверждения. Как следует из рисунка, наиболее подвижными (что отвечает максимальным значениям среднеквадратичных смещений) являются ионы кислорода, находящиеся в позициях О2, т.е. расположенные в слоях Pr–O. Меньшей подвижностью обладают ионы кислорода в плоскостях, содержащих Со. Такие результаты вполне ожидаемы, поскольку именно в слоях Pr–O находится максимальное число вакансий. Ионы кислорода, занимающие позиции О1 в слоях Ba(Sr)–O, практически не участвуют в трансляционном движении – среднеквадратичные смещения не превышают 0.25 Å2.
Рис. 6.
Среднеквадратичные смещения ионов кислорода типа О1 (а), О2 (б), О3 (в) в моделируемой системе PrBa0.5Sr0.5Co2O5.5 при температуре: 1 – 573, 2 – 873, 3 – 973, 4 – 1073, 5 – 1173, 6 – 1273, 7 – 1373 K.
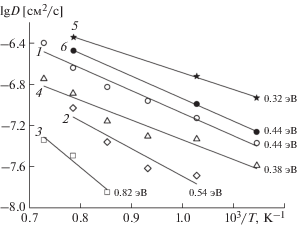
Температурные зависимости рассчитанных коэффициентов диффузии кислорода (как с учетом всех анионов в ячейке, так и отдельно по слоям) показаны на рис. 7. Из сравнения коэффициентов диффузии кислорода О2 в слоях Pr–O и кислорода О3 в слоях Co–O следует, что максимальная разница в подвижности ионов кислорода различных типов, наблюдаемая в PrBa0.5Sr0.5Co2O5.5, значительно уменьшается при частичных замещениях кобальта железом и медью. Для твердого раствора с полным замещением Co на Cu и Fe (PrBa0.5Sr0.5CuFeO5.5) подвижность ионов кислорода в слоях (Cu,Fe)–O становится несколько выше подвижности ионов кислорода в слоях Pr–O.
Рис. 7.
Коэффициенты диффузии ионов кислорода типа О2 (а) и О3 (б) в твердых растворах: 1 – PrBaCo2O5.5, 2 – PrBa0.5Sr0.5Co2O5.5, 3 – PrBa0.5Sr0.5CoFeO5.5, 4 – PrBa0.5Sr0.5CuFeO5.5, 2 – PrBa0.5Sr0.5CoCuO5.5. Цифры возле прямых – значения энергии активации диффузии.
В LnBa1 – ySryCo2 – xFexO5 (Ln = Pr, Nd, Gd) возрастание диффузии при легировании Fe связывали [35, 36] с увеличением объема элементарных ячеек в результате размещения более крупных ионов Fe. Наблюдаемое расхождение МД-расчетов с экспериментальными данными ожидалось изначально, поскольку моделирование осуществлялось при фиксированном значении δ = 0.5 (за исключением специальной серии расчетов), тогда как в реальном физическом эксперименте нестехиометрия двойных перовскитов LnBaCo2O5 + δ по кислороду изменяется в зависимости от температуры и парциального давления кислорода в достаточно широких пределах: 0 ≤ δ ≤ 1. Поэтому кристаллическая и дефектная структура, общая и ионная проводимость, проницаемость ионов кислорода, электрохимическая и каталитическая активность этих оксидов находятся в критической зависимости от нестехиометрии.
ЗАКЛЮЧЕНИЕ
Таким образом, варьируя химический состав или нестехиометрию по кислороду твердых растворов на основе PrBa0.5Sr0.5Co2O5.5, можно значительно изменять КТР материалов, чтобы подобрать необходимые значения для согласования параметров электрохимических ячеек. Кроме того, замещение Co → Сu приводит к небольшому уменьшению ионной проводимости, однако в этом случае возможно изменение электронного переноса за счет изменения валентности меди.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 17-03-00650).
Список литературы
Steele B.C.H., Heinzel A. // Nature. 2001. V. 414. P. 345.
Wachsman E.D., Lee K.T. // Science. 2011. V. 334. P. 935.
Yang Y.L., Jacobson A.J., Chen C.L. et al. // Appl. Phys. Lett. 2001. V. 79. P. 776.
Peters C., Weber A., Ivers-Tiff´ee E. // J. Electrochem. Soc. 2008. P. 155. P. B730.
Shao Z.P., Haile S.M. // Nature. 2004. V. 431. P. 170.
Kan C.C., Kan H.H., van Assche F.M. et al. // J. Electrochem. Soc. 2008. V. 155. P. B985.
Li M., Zhao M., Li F. et al. // Nat. Commun. 2017. V. 8. P. 13990.
Smith J.B., Norby T. // J. Electrochem. Soc. 2006. V. 153. P. A233.
Kim J.-H., Lee K.-T., Kim Y. N. et al. // J. Mater. Chem. 2011. V. 21. P. 2482.
Prado F., Kim J.-H., Manthiram A. // Solid State Ionics. 2011. V. 192. P. 241.
Kim J.-H., Manthiram A. // Chem. Mater. 2010. V. 22. P. 822.
Taskin A.A., Lavrov A.N., Ando Y. // Prog. Solid State Chem. 2007. V. 35. P. 481.
Chang A., Skinner S.J., Kilner J.A. // Solid State Ionics. 2006. V. 177. P. 2009.
Tarancón A., Morata A., Dezanneau G. et al. // J. Power Sources. 2007. V. 174. P. 255.
Tarancón A., Peña-Martínez J., Marrero-López D. et al. // Solid State Ionics. 2008. V. 179. P. 2372.
Orera A., Slater P.R. // Chem. Mater. 2010. V. 22. P. 675.
Kim J.-H., Manthiram A. // J. Mater. Chem. A. 2015. V. 3. P. 24195.
Zhang X., Jin M. // J. Power Sources. 2010. V. 195. P. 1076.
Kim J.H., Irvine J.T.S. // Int. J. Hydrog. Energy. 2012. V. 37. P. 5920.
Hu Y., Bogicevic C., Bouffanais Y. et al. // J. Power Sources. 2013. V. 242. P. 50.
Che X.L., Shen Y., Li H. et al. // J. Power Sources. 2013. V. 222. P. 288.
Zhan Z., Świerczek K., Yoshikura N. et al. // Solid State Ionics. 2014. V. 262. P. 645.
Zhao L., Nian Q., He B. et al. // J. Power Sources. 2010. V. 195. P. 453.
Jun A., Yoo S., Ju Y.-W. et al. // J. Mater. Chem. A. 2015. V. 3. P. 15082.
Jiang X., Shi Y., Zhou W. et al. // J. Power Sources. 2014. V. 272. P. 371.
Yoo S., Shin J.Y., Kim G. // J. Mater. Chem. 2011. V. 21. P. 439.
Chen D., Wang F., Shi H. et al. // Electrochim. Acta. 2012. V. 78. P. 466.
He Z., Xia L., Chen Y. et al. // RSC Adv. 2015. V. 5. P. 57592.
Hermet J., Dupe B., Dezanneau G. // Solid State Ionics. 2012. V. 216. P. 50.
Seymour I.D., Chroneos A., Kilner J. et al. // Phys. Chem. Chem. Phys. 2011. V. 13. P. 15305.
Choi S., Yoo S., Kim J. et al. // Sci. Rep. 2013. V. 3. P. 2426.
Hermet J., Geneste G., Dezanneau G. // Appl. Phys. Lett. 2010. V. 97. P. 174102.
Parfitt D., Chroneos A., Tarancon A. et al. // J. Mater. Chem. 2011. V. 21. P. 2183.
Seymour I.D., Tarancon A., Chroneos A. et al. // Solid State Ionics. 2012. V. 216. P. 41.
Anjum U., Vashishtha S., Sinha N. et al. // Solid State Ionics. 2015. V. 280. P. 24.
Anjum U., Vashishtha S., Agarwal M. et al. // Int. J. Hydrogen Energy. 2016. V. 41. P. 7631.
Hu Y., Hernandez O., Broux T. et al. // J. Mater. Chem. 2012. V. 22. P. 18744.
Chen C., Chen D., Ciucci F. // Phys. Chem. Chem. Phys. 2015. V. 17. P. 7831.
Maignan A., Martin C., Pelloquin D. et al. // J. Solid State Chem. 1999. V. 142. P. 247.
Chen Y.-C., Yashima M., Peña-Martínez J. et al. // Chem. Mater. 2013. V. 25. P. 2638.
Cox-Galhotra R.A., Huq A., Hodges J.P. et al. // Solid State Ionics. 2013. V. 249–250. P. 34.
Azad A.K., Kim J.H., Irvine J.T.S. // J. Solid State Chem. 2014. V. 213. P. 268.
Smith W., Todorov I.T., Leslie M. // Z. Kristallogr. 2005. B. 220. S. 563.
Islam M.S., Leslie M., Tomlinson S.M. et al. // J. Phys. C: Solid State Phys. 1988. V. 21. P. L109.
Computer Modelling in Inorganic Chemistry / Ed. Catlow C.R.A., London: Academic Press, 1997.
Chaplot S.L. // Phys. Rev. B. 1990. V. 42. P. 2149.
Tietz F. // Ionics. 1999. V. 5. P. 129.
Kim G., Wang S., Jacobson A.J. et al. // J. Mater. Chem. 2007. V. 17. P. 2500.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография