Кристаллография, 2020, T. 65, № 2, стр. 229-233
Образование двух форм кристаллов тетрагидрата протонированного бис(1-гидроксиэтилиден)дифосфоната эрбия в реакции карбоната эрбия с (1-гидроксиэтилиден)дифосфоновой кислотой. Выделение пластинчатых кристаллов
В. В. Семенов 1, *, Н. В. Золотарева 1, О. В. Новикова 1, Б. И. Петров 1, Е. Н. Разов 2, 3
1 Институт металлоорганической химии им. Г.А. Разуваева РАН
Нижний Новгород, Россия
2 Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
3 Институт проблем машиностроения РАН
Нижний Новгород, Россия
* E-mail: vvsemenov@iomc.ras.ru
Поступила в редакцию 30.01.2019
После доработки 17.02.2019
Принята к публикации 20.02.2019
Аннотация
Получающийся в реакции карбоната эрбия Er2(CO3)3 · 4H2O с избытком (1-гидроксиэтилиден)дифосфоновой кислоты СН3(ОН)С[P(O)(OH)2]2 (H4L) труднорастворимый тетрагидрат протонированного бис(1-гидроксиэтилиден)дифосфоната эрбия HEr(H2L)2 · 4H2O состоит из двух типов кристаллов – игольчатых и пластинчатых. Соединение медленно растворяется в водной среде при добавлении органических аминов: 2-аминоэтанола, 2-амино-2-(гидроксиметил)пропан-1,3-диола и 2,2'-(этилидендиокси)бис(этиламина). Последние присоединяются к периферии молекулы комплекса, т.е. к свободным –Р(О)ОН-группам, давая фрагменты аминиевой соли –Р(О)О–+NH3–CH2–. Первая координационная сфера комплекса не изменяется, вследствие чего энергии f–f-переходов катиона Er3+ в электронных спектрах поглощения остаются неизменными после присоединения разных аминов – промоторов растворимости. Взаимодействие суспензии тетрагидрата протонированного бис(1-гидроксиэтилиден)дифосфоната эрбия с эквимолярными количествами аминов приводит к селективному растворению мелкодисперсных иголок и позволяет выделить в чистом виде фракцию пластинчатых кристаллов.
ВВЕДЕНИЕ
Многие соединения редкоземельных металлов (РЗМ) с органическими и фосфорорганическими кислотами не растворяются в водной среде или обладают очень малой растворимостью. Так, производные (1-гидроксиэтилиден)дифосфоновой кислоты LnHL · nH2O (Ln = Ce, Pr, Nd, Sm; n = 5, 6) [1] и HLn(H2L)2 · 6H2O (Ln = La, Ce, Pr, Nd, Eu, Gd, Tb, Dy, Er, Yb, Lu) [2] в воде не растворяются. В [3, 4] был предложен эффективный способ увеличения растворимости труднорастворимых комплексов d-элементов посредством присоединения к ним органических аминов (промоторов растворимости): 2-аминоэтанола H2NCH2CH2OH, 2-амино-2-(гидроксиметил)пропан-1,3-диола H2NC(CH2OH)3 и 2,2'-(этилидендиокси)бис(этиламина) H2NCH2CH2OCH2CH2OCH2CH2NH2. В настоящей работе на примере координационного соединения эрбия показано, что данный метод является эффективным и в приложении к РЗМ. Данные сканирующей электронной микроскопии (СЭМ) свидетельствуют об образовании в синтезе двух кристаллографических форм исследуемого соединения. Обработка их промоторами растворимости позволила выделить одну из форм в чистом виде.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методы анализа. ИК-спектры соединений в виде суспензии в вазелиновом (область 1400–400 см–1) и фторированном (4000–1400 см–1) маслах между пластинами KBr регистрировали на ИК фурье-спектрометре ФСМ 1201. Электронные спектры поглощения (ЭСП) водных растворов измеряли на спектрофотометре Perkin-Elmer Lambda 25. Рентгенографические исследования выполнены на рентгеновском дифрактометре Shimadzu XRD-7000. Электронная микроскопия выполнена на сканирующем электронном микроскопе Tescan VEGA II. Микрорельеф исследовали при увеличениях от 500× до 50000×. Съемку проводили при ускоряющем напряжении 20 кВ и рабочем расстоянии 2–8 мм, использовали детекторы вторичных электронов и обратно рассеянных электронов. В работе использовали эрбий(III) углекислый квалификации “ч.” производства Новосибирского завода редких металлов МРТУ 6-09-4495-67, (1-гидроксиэтилиден)дифосфоновую кислоту H4L · H2O квалификации “ч.” производства ПАО “Химпром”, г. Новочебоксарск, ТУ 2439-363-05783441-2002, 2-аминоэтанол квалификации “ч.” производства ООО “Синтез ОКА”, г. Дзержинск, ТУ 2423-002-78722668-2010, 2,2'-(этилидендиокси)бис(этиламин) Sigma – Aldrich Chemie Gmbh.
Получение тетрагидрата протонированного бис(1-гидроксиэтилиден)дифосфоната эрбия. Раствор 25.67 г (1.14 × 10–1 моль) (1-гидроксиэтилиден)дифосфоновой кислоты H4L · H2O в 100 мл дистиллированной воды приливали к суспензии 16.8 г (2.86 × 10–2 моль) карбоната эрбия Er2(CO3)3 · · 4H2O. Реакционную смесь перемешивали при нагревании до 80–90°С 20 ч, фильтровали, промывали водой, сушили на воздухе и затем в сушильном шкафу при 100°С. Получено 21.5 г (3.32 × × 10–2 моль, 58%) комплекса эрбия HEr(H2L)2 · · 4H2O в виде светлого розово-фиолетового порошка. ИК-спектр (см–1): 3461, 3271, 3190, 2722 пл, 2481, 1638, 1405, 1155, 1084, 1045, 988, 938, 911, 827, 807, 675, 652, 553, 530 пл, 464. Найдено (%): С 6.71; H 3.40; Er 25.94; P 19.22. C4H21O18ErP4. Вычислено (%): С 7.41; H 3.26; Er 25.80; P 19.10.
Реакция HEr(H2L)2 · 4H2O с 2-аминоэтанолом. К суспензии 0.80 г (1.23 × 10–3 моль) HEr(H2L)2 · · 4H2O в 22 мл дистиллированной воды приливали при перемешивании раствор 2.86 г (4.68 × × 10–2 моль) H2NCH2CH2OH в 20 мл воды. Смесь нагревали 15 ч при 70–80°С до полного растворения суспензии (растворение наблюдалось также при длительном – 15–17 сут – выдерживании реакционной смеси при 25°С). Раствор декантировали, упаривали, остаток сушили при 100–110°С, нагревали в вакууме до 125°С. Получено 0.90 г (1.09 × 10–3 моль, 89%) аминиевого комплекса HEr(H2L)2 · 4H2NCH2CH2OH в виде светло-коричневой массы, легко размалывающейся до порошка. ИК-спектр (см–1): 3172 ш, 2725, 2100, 1626, 1525, 1069, 1003, 958, 812, 664, 568, 473. Найдено (%): С 17.10; H 4.94; Er 20.98; P 15.54. C12H41N4O18ErP4. Вычислено (%): С 17.56; H 5.03; Er 20.38; P 15.10.
Реакция HEr(H2L)2 · 4H2O с 2,2'-(этилидендиокси)бис(этиламином). Аналогично из 1.30 г (2.00 × × 10–3 моль) HEr(H2L)2 · 4H2O и 2.82 г (1.90 × × 10–2 моль) H2NCH2CH2OCH2CH2OCH2CH2NH2 получили 1.70 г (1.45 × 10–3 моль, 73%) аминиевого комплекса HEr(H2L)2 · 4H2NCH2CH2OCH2CH2 OCH2CH2NH2 коричневого цвета. ИК-спектр (см–1): 3348, 3285, 3169, 2725, 2684, 2150, 1623, 1584, 1525, 1352, 1304, 1090, 1042, 994, 958, 810, 667, 589, 565, 473. Найдено (%): С 28.22; H 6.58; Er 14.37; P 10.79. C28H77N8O22ErP4. Вычислено (%): 28.77; H 6.64; Er 14.31; P 10.60.
Выделение пластинчатых кристаллов. К суспензии 1.25 г HEr(H2L)2 · 4H2O (1.83 × 10–3 моль) в 10 мл Н2О прибавили раствор 0.22 г (3.65 × 10–3 моль) H2NCH2CH2OH в 20 мл Н2О, перемешивали 3 ч. Через 20 дней реакционную смесь фильтровали, осадок промывали водой, сушили на воздухе. Получено 0.33 г (26%) HEr(H2L)2 · 4H2O в виде белой с фиолетовым оттенком чешуи. ИК-спектр (см–1): 3378, 3208, 2722, 2520, 1653, 1638, 1614, 1531, 1143, 1120, 1057, 1006, 965, 938, 887, 822, 676, 559, 476. Найдено (%): С 7.11; H 3.69; Er 26.04; P 19.29. C4H21O18ErP4. Вычислено (%): С 7.41; H 3.26; Er 25.80; P 19.10.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Протонированный тетрагидрат бис(1-гидроксиэтилиден)дифосфоната эрбия HEr(H2L)2 · 4H2O синтезировали из карбоната эрбия Er2(CO3)3 · · 4H2O и четырехкратного избытка (1-гидроксиэтилиден)дифосфоновой кислоты. Ранее данное соединение было получено [2] из хлорида эрбия. Для него сообщалась формула HEr(H2L)2 · 6H2O. Синтезированные аналогичные производные РЗМ HМ(H2L)2 · 6H2O [2] от лантана до гадолиния имели вид игольчатых кристаллов, а от тербия до лютеция – призматических кристаллов. Авторы [2] сообщали также, что HEr(H2L)2 · 6H2O может быть получен из карбоната эрбия в виде мелких кристаллов не обозначенной формы. По данным элементного анализа синтезированное соединение содержит четыре молекулы кристаллизационной воды. Оно представляет собой светлый мелкодисперсный порошок с фиолетовым оттенком нерастворимый в воде. Известно [2], что соединения HМ(H2L)2 · 6H2O не растворяются также в этиловом спирте, уксусной кислоте, водном аммиаке, гидроокиси лития, но переходят в раствор при действии сильных минеральных кислот. Отметим, что при таком растворении строение и состав комплекса будут полностью разрушены, в растворе фактически будет присутствовать неорганическая соль эрбия. В связи с этим сделать какие-либо заключения о влиянии исходного координационного окружения катиона на электронные переходы будет невозможно. Наиболее эффективным подходом следует считать переведение комплекса в раствор за счет присоединения молекул промотора растворимости к его периферии и сохранения первой координационной сферы металла. Такого рода эффект продемонстрирован в настоящей работе.
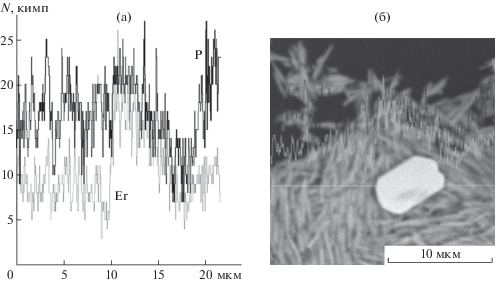
Данные СЭМ (рис. 1) показали, что получающееся в реакции карбоната эрбия с (1-гидроксиэтилиден)дифосфоновой кислотой соединение состоит из двух форм: игольчатых и пластинчатых кристаллов.
Рис. 1.
СЭМ-изображение бис(1-гидроксиэтилиден)дифосфоната эрбия до (а) и после (б) обработки 2-аминоэтанолом.

Размеры игольчатых кристаллов: длина 2–10 мкм, толщина 0.2–0.5 мкм; пластинчатых: длина 10–40 мкм, ширина 10–20 мкм, толщина 1–2 мкм. Рентгеновский микроанализ (рис. 2) свидетельствует о более высокой вариабельности в содержании элементов на отрезках линии, проходящей через участки, заполненные иголками. Это может, в частности, объясняться наличием примесей, сконцентрированных в местах скопления микронных частиц.
Рис. 2.
Энергодисперсионный рентгеновский микроанализ бис(1-гидроксиэтилиден)дифосфоната эрбия в режиме сканирования по линии: а – относительное содержание элементов, б – электронная микрофотография, (кимп – килоимпульсы).
Возможность отделения более крупных и массивных пластин от мелких игл появилась после проведения реакций бис(1-гидроксиэтилиден)дифосфоната эрбия с органическими аминами – промоторами растворимости.
Обработка водной суспензии HEr(H2L)2 · 4H2O органическими аминами вызывает его растворение только при длительном (10–15 ч) нагревании до 80–90°С. При этом амин следует брать в пяти-, семикратном избытке. Получающиеся растворы приобретают цвет исходного комплекса эрбия. На рис. 3 представлены их электронные спектры поглощения.
Рис. 3.
ЭСП водных растворов аминиевых комплексов протонированного тетрагидрата бис(1-гидроксиэтилиден)дифосфоната эрбия. 1 – HEr(H2L)2 · · 4H2NCH2CH2OH, 2.78 × 10–2 М; 2 – HEr(H2L)2 · · nH2NC(CH2OH)3, 1.6 × 10–2 М; 3 – HEr(H2L)2 · · 4H2NCH2CH2OCH2CH2OCH2CH2NH2, 4.75 × 10–2 М.
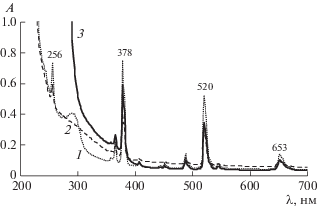
Спектры являются типичными для координационных соединений эрбия [5] и содержат ряд узких полос f–f-переходов в катионе Er3+ 256 (4I15/2 – 4D7/2), 378 (4I15/2 – 4G11/2), 520 (4I15/2 – 2H11/2), 653 (4I15/2 – 4F9/2) нм. При наличии сверхчувствительных переходов вид спектра должен изменяться в зависимости от лиганда. Спектры трех комплексов имеют идентичный вид (рис. 3). Это свидетельствует о том, что первая координационная сфера катиона не изменяется. Такое возможно, когда дополнительный аминный лиганд присоединяется не к катиону металла, а к свободным кислотным группам фосфоновой кислоты.
Медленное растворение и необходимость использования избытка амина позволили предположить, что в случае эквивалентного соотношения компонентов или небольшого избытка амина прежде всего подвергнется растворению мелкодисперсная игольчатая форма. В связи с исчерпанием промотора растворимости процесс будет остановлен и в первоначальной смеси останутся только более крупные пластинки. Для проверки этого предположения были проведены реакции бис(1-гидроксиэтилиден)дифосфоната эрбия с 2-аминоэтанолом и 2,2'-(этилидендиокси)бис(этиламином) в соотношении 1 : 1 и 1 : 2. Полного растворения комплекса не наблюдалось ни в одном случае. Наименьшее количество осадка получалось в эксперименте с двукратным мольным избытком дифункционального амина H2NCH2CH2OCH2CH2OCH2CH2NH2. Не растворившуюся часть многократно промывали дистиллированной водой для исключения примеси аминиевого соединения. Анализ СЭМ-изображений бис(1-гидроксиэтилиден)дифосфоната эрбия до и после обработки 2-аминоэтанолом (рис. 1) показал, что в результате реакции с промотором растворимости произошла очистка пластинчатых кристаллов от игольчатых.
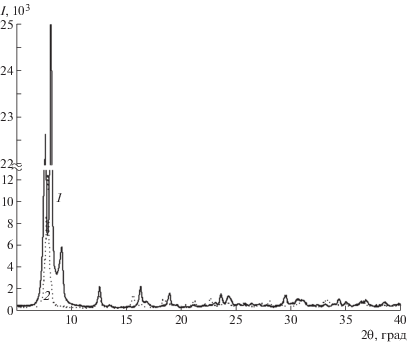
Дифрактограммы смеси после синтеза и чистых пластинчатых кристаллов (рис. 4) существенно различаются. Большое количество отражений в спектре смеси свидетельствует о наличии в ней двух или более кристаллографических форм.
ИК-спектры в целом идентичны, но в спектре очищенного соединения отсутствуют полосы поглощения 1405, 1084, 911, 807, 652 см–1, обусловленные наличием примесей. Данные элементного анализа свидетельствуют о том, что элементный состав различается незначительно. Полученное в результате синтеза соединение содержит примеси, заметно занижающие содержание углерода.
Работа выполнена в рамках госзадания (Тема № 45.8 Химия функциональных материалов, рег. № 0094-2016-0012), поддержана Российской академией наук, Программа № 35 Президиума РАН “Научные основы создания новых функциональных материалов”. При выполнении работы использовались приборы Центра коллективного пользования ННГУ Научно-образовательного центра “Физика твердотельных наноструктур” и Аналитического центра Института металлоорганической химии РАН.
Список литературы
Храмов В.П., Кольцов А.А. // Журн. неорган. химии. 1973. Т. 18. С. 2947.
Афонин Е.Г., Печурова Н.И. // Журн. неорган. химии. 1987. Т. 32. С. 1021.
Семенов В.В., Золотарева Н.В., Петров Б.И. Патент РФ 2015110362/04 (016255).
Семенов В.В., Золотарева Н.В., Петров Б.И. и др. // Журн. общей химии. 2015. Т. 85. С. 822. 10. 1134/S1070363215050199.
Полуэктов Н.С., Кононенко Л.И., Ефрюшина Н.П., Бельтюкова С.В. Спектрофотометрические и люминесцентные методы определения лантаноидов. Киев: Наукова думка, 1989. 254 с.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография