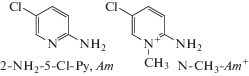Кристаллография, 2020, T. 65, № 2, стр. 244-248
Кристаллическая структура анион-радикальной соли (N–CH3–2–NH2–5Cl–Py)(TCNQ)(CH3CN)
Т. Н. Стародуб 1, *, Д. Фенске 2, 3, 4, О. Фур 3, 4, О. Н. Кажева 5, В. А. Стародуб 1, *
1 Институт химии Университета Яна Кохановского
Кельце, Польша
2 Институт неорганическуой химии Технологического института
Карлсруэ, Германия
3 Институт нанотехнологии и Карлсруэ нано-микроотделение Технологического института Карлсруэ
Еггенштайн-Леопольдсгафен, Германия
4 Лен-Институт функциональных материалов Института химии и химической инженерии
Университета Сунь-Ят-Сена
Гуанчжоу, Китай
5 Институт проблем химической физики РАН
Черноголовка, Россия
* E-mail: starodub@ujk.edu.pl
* E-mail: starodub@ujk.edu.pl
Поступила в редакцию 14.03.2019
После доработки 14.03.2019
Принята к публикации 22.05.2019
Аннотация
Представлена структура анион-радикальной соли (АРС) 7,7.8,8-тетрацианохинодиметана (TCNQ) с катионом на основе 2-амино-5-хлоро-пиридина (2–NH2–5–Cl–Py, Am) – (N–CH3–2–NH2–5Cl–Py)(TCNQ)(CH3CN) (I). В отличие от большинства АРС TCNQ, которые содержат стопки плоских частиц TCNQ, в АРС I содержатся практически изолированные π-димеры (TCNQ)$_{2}^{{2 - }}$ с необычно коротким межплоскостным расстоянием между анион-радикалами в димере 3.24 Å. В ИК-спектре АРС I проявляются особенности, связанные с вибронным взаимодействием молекулярных колебаний.
ВВЕДЕНИЕ
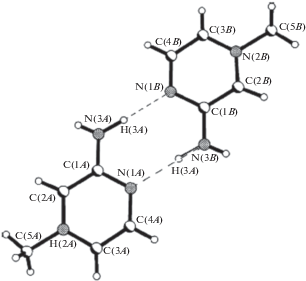
Создание многофункциональных органических материалов является перспективным направлением современной микро- и наноэлектроники. Для решения этой проблемы перспективно использование анион-радикальной соли (АРС) 7,7.8,8-тетрацианохинодиметана (TCNQ) с катионами, способными к образованию водородных связей с анион-радикалом [1]. Наличие таких связей способствует образованию каналов косвенного магнитного обменного взаимодействия. В [2] была описана АРС (N–Me–2–NH2–Pz)(TCNQ)2 (где Pz – пиразин), содержащая катион, способный к образованию водородных связей с анион-радикалом. Однако в этом случае аминогруппа катиона (N–Me–2–NH2–Pz)+ связана не с атомом азота нитрильной группы TCNQ, а с некватернизованным атомом азота соседнего катиона, что приводит к образованию димеризованного катиона (рис. 1).
Рис. 1.
Димеризованный катион (N–Me–2–NH2–Pz)$_{2}^{{2 + }}$ в структуре АРС (N–Me–2–NH2–Pz)(TCNQ)2.
В работе описана впервые синтезированная АРС TCNQ с катионом на основе 2-амино-5-хлоропиридина (2–NH2–5–Cl–Py, Am):
В этом случае можно ожидать образования водородных связей между атомами азота аминогруппы катиона N–CH3–Am+ и анион-радикалами TCNQ$^{{ \bullet - }}$.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез и кристаллизация. Амин Am растворяли в метил-иодиде и раствор перемешивали на магнитной мешалке до образования осадка иодида (N–CH3–Am+)I–. Выход в пересчете на амин – 100%. АРС I синтезировали по реакции
Осадок АРС отфильтровывали, промывали эфиром и гексаном и сушили в вакууме. Для получения монокристаллов и очистки использовали перекристаллизацию в ацетонитриле. Образуются темно-фиолетовые иглы длиной до 5 мм. Выход АРС составляет 55%.
Элементный анализ АРС проводили с использованием анализатора VarioMICRO Superuser. Вычислено, %: C – 62.16, N – 24.16, H – 3.48, Cl – 10.19; найдено, %: C – 62.31, N – 24.21, H – 3.57, Cl – 10.23.
Состав АРС определяли спектрофотометрически, как описано в [3]. Он соответствует формуле (N–CH3–Am)+(TCNQ)$^{{ \bullet - }}$ (I).
ИК-спектр поглощения таблетированных образцов I регистрировали в интервале от 600 до 4000 см–1 при комнатной температуре на спектрометре Thermo Scientific Nicolet is10 с приставкой Smart MIRacle.
Определение кристаллической и молекулярной структуры. Рентгеноструктурное исследование I проведено на дифрактометре StadiVari при 180 К (CuKα-излучение). Для эмпирической коррекции поглощения экспериментальных интенсивностей использовали STOE X-Red32, коррекции поглощения с помощью гауссовской интеграции, подобной P. Coppens, “The Evaluation of Absorption and Extinction in Single-Crystal Structure Analysis”, опубликованной в [4]. Вычисление интенсивностей отражения, также как и сферические коррекции поглощения, провели с использованием STOE LANA [5]. Кристаллическая структура решена прямыми методами и последующими фурье-синтезами по программе SHELXS-97 [6] и уточнена методом наименьших квадратов по программе SHELXL-97 в анизотропном полноматричном приближении для всех неводородных атомов [7].
Основные кристаллографические и экспериментальные данные: C20H15ClN7, M = 388.84, моноклинный, P21/c, a = 9.2556(4), b = 16.8791(6), c = 13.0972(5) Å, β = 106.804(3)°, V = 1958.7(1) Å3, Z = 4, Dвыч = 1.32 г⋅см–3, μ = 1.891 мм–1, 2θmax = = 137.02°, общее число отражений 7945, независимых отражений 3004, 314 уточняемых параметров, диапазон h, k, l: –10 → h → 10, –19 → k → 12, –14 → l → 15, R = 0.046 для 2691 отражений с [F0 > > 4σ(F0)]. Длины связей и валентные углы приведены в табл. 1.
Таблица 1.
Длины связей (Å) и углы между связями (град)
| Cl1–C5 | 1.728(2) | C16–C18 | 1.410(3) |
| N1–C2 | 1.357(2) | C16–C17 | 1.420(2) |
| N1–C6 | 1.369(2) | N7–C19 | 1.135(3) |
| N1–C1 | 1.469(3) | C19–C20 | 1.445(3) |
| N2–C2 | 1.326(2) | C2–N1–C6 | 121.1(2) |
| C6–C5 | 1.352(3) | C2–N1–C1 | 119.5(1) |
| C5–C4 | 1.407(3) | C6–N1–C1 | 119.4(1) |
| C4–C3 | 1.356(3) | C5–C6–N1 | 121.0(2) |
| C3–C2 | 1.416(3) | C6–C5–C4 | 119.5(2) |
| N3–C14 | 1.153(2) | C6–C5–Cl1 | 120.0(1) |
| N4–C15 | 1.150(2) | C4–C5–Cl1 | 120.4(1) |
| N5–C17 | 1.155(2) | C3–C4–C5 | 119.4(2) |
| N6–C18 | 1.157(3) | C4–C3–C2 | 120.5(2) |
| C7–C13 | 1.413(3) | N2–C2–N1 | 119.9(2) |
| C7–C12 | 1.420(2) | N2–C2–C3 | 121.6(2) |
| C7–C8 | 1.422(2) | N1–C2–C3 | 118.5(2) |
| C8–C9 | 1.357(3) | C13–C7–C12 | 121.6(2) |
| C9–C10 | 1.427(2) | C13–C7–C8 | 121.2(1) |
| C10–C16 | 1.412(2) | C12–C7–C8 | 117.2(2) |
| C10–C11 | 1.417(2) | C9–C8–C7 | 121.7(2) |
| C11–C12 | 1.364(3) | C8–C9–C10 | 121.1(2) |
| C13–C14 | 1.413(3) | C16–C10–C11 | 121.6(1) |
| C13–C15 | 1.422(2) | C16–C10–C9 | 121.1(2) |
| C11–C10–C9 | 117.3(2) | N4–C15–C13 | 178.5(2) |
| C12–C11–C10 | 121.5(2) | C18–C16–C10 | 120.9(1) |
| C11–C12–C7 | 121.2(2) | C18–C16–C17 | 117.1(2) |
| C14–C13–C7 | 122.0(1) | C10–C16–C17 | 121.8(2) |
| C14–C13–C15 | 116.3(2) | N5–C17–C16 | 178.9(2) |
| C7–C13–C15 | 121.6(2) | N6–C18–C16 | 177.9(2) |
| N3–C14–C13 | 179.1(2) | N7–C19–C20 | 178.9(2) |
Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDC № 1850699) и могут быть получены через www.ccdc.cam.uk.conts/retrieving (CCDC, 12 Union Road, Cambridge CB21EZ, UK; факс: +44 1223 336 033; deposit@ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кристаллическая структура АРС I образована анион-радикалом TCNQ•–, катионом (N–CH3–2–NH2–5–Cl–Py)+ и молекулой растворителя – ацетонитрила, расположенными в общих позициях элементарной ячейки. Особенность кристаллической структуры – наличие межмолекулярного бифуркационного H-взаимодействия с участием аминогруппы катиона со следующими параметрами: N2···N3 = 2.899(3), N3···H2B = 2.04(2) Å, N2–H2B···N3 = 163(2)°, N2···N7 = 3.009(3), N7···H2A = 2.12(2) Å, N2–H2A···N7 = = 173(2)° (сумма Ван-дер-Ваальсовых радиусов: N···N = 3.10, N···H = 2.75 Å [8]) (рис. 2). Геометрия анион-радикала и катиона максимально близка к плоской: максимальное отклонение атомов от соответствующей средней плоскости, проведенной через все неводородные атомы молекулы, равны 0.07 Å (атом N3) и 0.01 Å (атом Cl1) соответственно.
Рис. 2.
Структура и водородные связи между анион-радикалом, катионом и молекулой ацетонитрила в I (эллипсоиды тепловых колебаний показаны с 50%-ным уровнем вероятности).
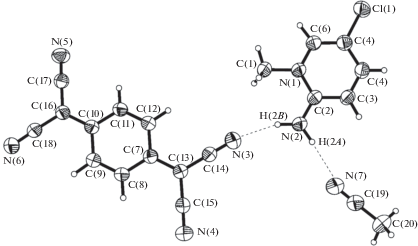
Вероятно, можно говорить о наличии существенного супрамолекулярного сопряжения катиона с анион-радикалом – максимальное отклонение неводородных атомов от средней плоскости, проведенной через все неводородные атомы катиона и анион-радикала, не превышает 0.27 Å (атом С1), и двугранный угол между плоскостями этих частиц равен 172.3°.
На основании молекулярной структуры частиц TCNQ можно определить их заряд [9, 10]. Он находится в пределах 0.91–0.95 электрон/молекулу. Это означает отсутствие заметного переноса заряда от анион-радикала к катиону (N–CH3–2–NH2–5–Cl–Py)+ – супрамолекулярное сопряжение между ними проявляется лишь в понижении локальной симметрии анион-радикала.
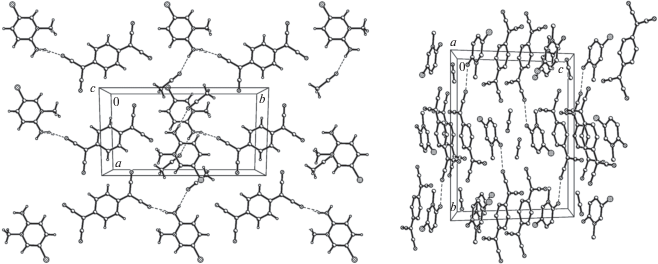
Молекулы в структуре I организованы в слои (рис. 3). В структуре можно выделить смешанные стопки, образованные катионами и π-димерами анион-радикалов, между стопками располагаются молекулы растворителя (рис. 3). Межплоскостное расстояние в димерах равно 3.24 Å, диэдральный угол по условиям симметрии равен 0° (рис. 4). Заметим, что межплоскостное расстояние в димере такое же, как и в низкотемпературной фазе АРС K+(TCNQ)$^{{ \bullet - }}$, где, однако, причиной димеризации является Пайерлсовская неустойчивость стопок TCNQ [11].
Рис. 4.
Перекрывание анион-радикалов TCNQ$^{{ \bullet - }}$ в димере (атомы водорода не показаны для наглядности).
Примечательно наличие в структуре I необычных π-димеров (TCNQ)$_{2}^{{2 - }}$ – в большинстве известных АРС TCNQ такие димеры образуются из анион-радикала и нейтральной молекулы – (TCNQ2)$^{{ \bullet - }}$, или образуются σ-димеры с необычайно длинными связями C–C [(TCNQ–TCNQ)2–] [1]. Как видно из рис. 3, π-димеры (TCNQ)$_{2}^{{2 - }}$ связаны в бесконечные цепочки за счет супрамолекулярных связей с катионами (N–CH3–2–NH2–5–Cl–Py)+. Подобные структуры, необычные для АРС TCNQ, были найдены в АРС [Mn(phen)3](TCNQ)2⋅H2O [12], где π-димеры (TCNQ)$_{2}^{{2 - }}$ связаны между собой посредством катионов [Mn(phen)3]2+. Наличие супрамолекулярных контактов обусловливает антиферромагнетизм этой АРС [13].
Супрамолекулярные контакты приводят к понижению локальной симметрии TCNQ от D2h до C2h. Это отражается в различии длин связей C13–C14, C16–C18 (связанных инверсно друг с другом) и, соответственно, длин связей C13–C15, C16–C17 (табл. 1), а также в укорочении длин связей цианогрупп, образующих водородные связи с аминогруппами катиона (N–CH3–2–NH2–5–Cl–Py)+.
Теоретикогрупповой анализ позволяет классифицировать 54 нормальных колебания молекулы TCNQ по неприводимым представлениям группы D2h следующим образом:
Линии колебательной структуры проявляются на фоне непрерывного поглощения, что характерно для проводящих АРС TCNQ [1, 16]. Кроме того, как видно из рис. 4, проявляется уширение линий при 2157, 1494, 1266 и в области 700–1050 см–1. Поскольку структура АРС I не содержит стопок молекул TCNQ, такие особенности ИК-спектра можно объяснить так называемым вибронным взаимодействием в π-димере (взаимодействием π-электронных возбуждений с внутримолекулярными колебаниями частиц TCNQ) [17].
Список литературы
Starodub V.A., Starodub T.N. // Russ. Chem. Rev. 2014. V. 83. P. 391.
Kazheva O.N., Ziolkovskiy D.V., Alexandrov G.G. et al. // Synth. Metals. 2006. V. 156. P. 1010.
Ziolkovsky D.V., Kravchenko A.V., Starodub V.A. et al. // Funct. Mater. 2005. V. 12. P. 577.
Crystallographic Computing / Ed. Ahmed F.R. Copenhagen: Munksgaard. 1970. 255 p.
Koziskova J., Hahn F., Richter J., Kožíšek J. // Acta Chimica Slovaca. 2016. V. 9. P. 136.
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. P. 112.
Sheldrick G.M. // Acta Cryst. C. 2015. V. 71. P. 3.
Batsanov S.S. // Inorg. Mater. 2001. V. 37. P. 871.
Flandrois S., Chasseau D. // Acta Cryst. B. 1977. V. 33. P. 2744.
Krygowski T.M., Anulewicz R., Kruszewski J. // Acta Cryst. B. 1983. V. 39. P. 732.
Konno M., Ishii T., Saito Y. // Acta Cryst. B. 1977. V. 33. P. 763.
Vasylets G., Starodub V.A., Potočňák I. et al. // Synt. Metals. 2014. V. 189. P. 86.
Šoltésová D., Vasylets G., Čižmár E. et al. // J. Phys. Chem. Solids. 2016. V. 99. P. 182.
Lunelli B., Pecile C. // J. Chem. Phys. 1970. V. 52. P. 2375.
Khatkale M.S., Devlin J.P. // J. Chem. Phys. 1979. V. 70. P. 1851.
Pukacki W., Pawlak M., Graja A. et al. // Inorg. Chem. 1987. V. 26. P. 1328.
Duke C.B., Lipari N.O., Pietronero L. // Chem. Phys. Lett. 1975. V. 30. P. 415.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография