Кристаллография, 2020, T. 65, № 2, стр. 249-254
Структура кристаллов моногидрата дицитратобората глициния
С. В. Тютрина 1, М. А. Осина 1, Н. В. Мясникова 1, *, Ф. М. Долгушин 2, **
1 Национальный исследовательский университет “МЭИ”
Москва, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
* E-mail: miasnikovanv@mpei.ru
** E-mail: fedya@ineos.ac.ru
Поступила в редакцию 24.09.2018
После доработки 24.09.2018
Принята к публикации 26.11.2018
Аннотация
Синтезированы и выделены кристаллы моногидрата дицитратобората глициния H3NCH2COOH[B(C6H6O7)2] · Н2О и методом рентгеноструктурного анализа определена их структура: триклинные, пр. гр. Р$\bar {1}$, Z = 2. Кристаллы построены из катион-анионных слоев, все структурные единицы в которых (дицитратоборат-анион, катион глициния и молекула кристаллизационной воды) прочно связаны многочисленными водородными связями.
ВВЕДЕНИЕ
Соединения бора широко используются в качестве антипиренов, ингибиторов коррозии, микроудобрений, антиоксидантов, фунгицидов. Описаны комплексные соединения на основе дицитратоборат-аниона, обладающие антимикробным действием: дицитратоборат оксихинолиния [1] и дицитратоборат гуанидиния [2]. Синтезированы и исследованы дицитратобораты с различными катионами: одно- и двухзарядных металлов [3–6], моно-, ди- и триалкиламмония [7–9], алкиланилиния [10, 11], аминохинолиния [12]. Возможность практического применения комплексных соединений бора стимулирует поиск новых веществ, всестороннее исследование их структуры и свойств. В литературе подробно описаны структуры и свойства дицитратоборатов с алкилзамещенными катионами аммония и сделан вывод, что замена в катионе аммония одного, двух или трех атомов водорода алкильными группами сопровождается изменением свойств и кристаллической структуры дицитратоборатов [7, 8]. Однако среди исследованных ранее солей дицитратоборат-аниона нет производных α-аминокислот, присутствие в которых разных донорных и акцепторных центров образования водородных связей (ВС) может существенно повлиять на свойства и строение солей.
Координационное соединение, имеющее во внешней сфере катион α-аминокислоты – моногидрат дицитратобората глициния H3NCH2COOH[B(C6H6O7)2] · Н2О, впервые синтезировано в [13]. Особенности процесса образования его кристаллов изучали в [13] с использованием поляризационного микроскопа. В [14] методом ИК-спектроскопии в составе комплекса установлено наличие бора, находящегося в тетракоординированном состоянии, выявлены характеристические полосы поглощения, отвечающие ионной структуре катиона глициния. Также в [14] на основании термогравиметрического анализа и метода дифференциально-сканирующей калориметрии изучены особенности процесса термической деструкции соединения и подтверждено присутствие во внешней сфере комплекса одной молекулы кристаллизационной воды, что позволило предложить эмпирическую формулу дицитратобората глициния.
Цель настоящей работы – определение структуры кристаллов дицитратобората глициния методом рентгеноструктурного анализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Вещества в количестве 0.05 моль (3.09 г) борной и 0.1 моль (21.03 г) лимонной кислот растворяли в 30 мл дистиллированной воды при нагревании. В полученный раствор при перемешивании добавляли 0.05 моль (3.75 г) глицина. Реакционную смесь медленно охлаждали до комнатной температуры. Образовавшиеся кристаллы выдерживали в растворе в течение суток, затем отделяли фильтрованием, промывали диэтиловым эфиром и сушили на воздухе.
Рентгеноструктурное исследование. Кристаллографические характеристики, данные эксперимента и уточнения структуры приведены в табл. 1. Структура расшифрована прямым методом и уточнена в анизотропном приближении для неводородных атомов. Атомы водорода OH- и NH3-групп и молекулы воды найдены из фурье-синтеза и уточнены изотропно, остальные атомы водорода помещены в геометрически рассчитанные положения и включены в уточнение в модели “наездника” с Uизо(H) = 1.2Uэкв(C).
Таблица 1.
Кристаллографические характеристики, данные эксперимента и уточнения структуры H3NCH2COOH[B(C6H6O7)2] · Н2О
| Сингония, пр. гр., Z | Триклинная, P$\bar {1}$, 2 |
| a, b, c, Å | 9.8923(6), 10.3466(6), 10.6726(7) |
| α, β, γ, град | 78.003(1), 89.413(1), 64.707(1) |
| V, Å3 | 962.25(10) |
| Dx, г/см3 | 1.674 |
| Излучение; λ, Å | MoKα; 0.71073 |
| μ, см‒1 | 1.56 |
| Т, K | 120 |
| Размер образца, мм | 0.42 × 0.38 × 0.30 |
| Дифрактометр | Bruker APEX DUO |
| Тип сканирования | ω |
| Учет поглощения; Tmin, Tmax | Полуэмпирический; 0.804, 0.862 |
| θmax, град | 30.0 |
| Пределы h, k, l | –13 ≤ h ≤ 13, –14 ≤ k ≤ 14, –15 ≤ l ≤ 15 |
| Число отражений: измеренных/независимых (N1), Rint/с I > 2σ(I) (N2) | 12 922/5595, 0.0239/4746 |
| Метод уточнения | полноматричный МНК по $F_{1}^{2}$ |
| Число параметров | 338 |
| R1/wR2 по N1 | 0.0436/0.0912 |
| R1/wR2 по N2 | 0.0355/0.0860 |
| S | 1.042 |
| Δρmin/Δρmax | –0.252/0.480 |
| Программы | SADABS [15], SHELX, версия 2014/1 [16] |
Кристаллографические данные депонированы в Кембриджский банк структурных данных (КБСД) (CCDC № 1903125).
Плотность дицитратобората глициния по гелию измеряли на автоматическом пикнометре ACCU Pic 1340 при температуре 295 K.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Глицин в кислой среде протонируется до катиона и образует внешнюю сферу комплексной соли дицитратоборат-аниона: H3NCH2COOH+ [B(C6H6O7)2]– · Н2О. Синтезированное соединение представляет собой устойчивое на воздухе бесцветное кристаллическое вещество, растворимое в воде и практически не растворимое в неполярных органических растворителях. Плотность кристаллов 1.674 г/см3, рассчитанная теоретически из данных рентгеноструктурного анализа, незначительно отличается от значения 1.66 г/см3, полученного с помощью пикнометрического анализа. Как теоретическое, так и экспериментальное значение плотности заметно больше полученных для кристаллов других солей дицитратоборат-аниона с органическими катионами, среди которых наибольшее значение 1.580 г/см3 сообщалось для структуры дицитратобората метиламмония [7].
Структурными единицами кристаллов являются дицитратоборат-анион [B(C6H6O7)2]–, катион глициния H3NCH2COOH+ и молекула воды. Строение моногидрата дицитратобората глициния с обозначением и нумерацией атомов показано на рис. 1, величины основных длин связей и валентных углов приведены в табл. 2.
Рис. 1.
Общий вид структурных элементов кристалла с нумерацией атомов (атомы водорода метиленовых групп не показаны). Эллипсоиды тепловых колебаний неводородных атомов приведены с вероятностью 50%.
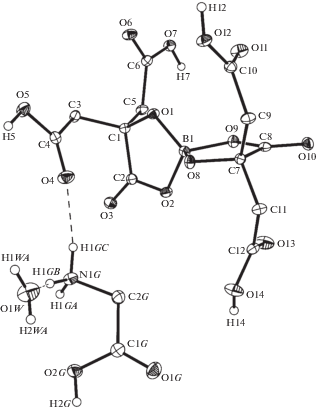
Таблица 2.
Некоторые длины связей d (Å) и валентные углы ω (град)
| Связь | d | Валентный угол | ω |
|---|---|---|---|
| Тетраэдр ВО4 | |||
| O1–B1 | 1.443(1) | O1–B1–O8 | 115.2(1) |
| O2–B1 | 1.507(1) | O1–B1–O2 | 105.1(1) |
| O8–B1 | 1.448(1) | O8–B1–O2 | 111.4(1) |
| O9–B1 | 1.510(1) | O1–B1–O9 | 111.9(1) |
| O8–B1–O9 | 104.2(1) | ||
| O2–B1–O9 | 109.2(1) | ||
| Цитрат-лиганды | |||
| O1–C1 | 1.421(1) | C1–O1–B1 | 109.8(1) |
| O2–C2 | 1.313(1) | C2–O2–B1 | 109.4(1) |
| O3–C2 | 1.218(1) | C7–O8–B1 | 111.5(1) |
| O4–C4 | 1.216(1) | C8–O9–B1 | 110.1(1) |
| O5–C4 | 1.323(1) | O1–C1–C2 | 104.0(1) |
| O6–C6 | 1.217(1) | O2–C2–C1 | 110.2(1) |
| O7–C6 | 1.329(1) | O4–C4–O5 | 123.5(1) |
| O8–C7 | 1.426(1) | O4–C4–C3 | 124.1(1) |
| O9–C8 | 1.319(1) | O5–C4–C3 | 112.4(1) |
| O10–C8 | 1.215(1) | O6–C6–O7 | 119.4(1) |
| O11–C10 | 1.215(1) | O6–C6–C5 | 123.7(1) |
| O12–C10 | 1.330(1) | O7–C6–C5 | 116.9(1) |
| O13–C12 | 1.213(1) | O8–C7–C8 | 103.6(1) |
| O14–C12 | 1.319(1) | O9–C8–C7 | 110.6(1) |
| Катион глициния | |||
| O1G–C1G | 1.200(1) | O1G–C1G–O2G | 125.2(1) |
| O2G–C1G | 1.329(1) | O1G–C1G–C2G | 121.6(1) |
| N1G–C2G | 1.484(2) | O2G–C1G–C2G | 113.2(1) |
| C1G–C2G | 1.517(2) | N1G–C2G–C1G | 113.0(1) |
В дицитратоборат-анионе атом бора тетраэдрически координирован двумя молекулами лимонной кислоты через атомы кислорода карбоксилатной и депротонированной α-гидроксильной групп. Псевдоось симметрии тетраэдра проходит через атом бора и делит пополам ребра тетраэдра О1–О8 и О2–О9. Образованные разными функциональными группами связи В–О отличаются друг от друга, что приводит к искажению тетраэдра. Длины связей с атомами кислорода депротонированных α-гидроксильных групп В–О1 и В–О8 (1.443(1) и 1.448(1) Å) меньше длин связей с атомами кислорода карбоксилатных групп В–О2 и В–О9 (1.507(1) и 1.510(1) Å). Сопряженные с борокислородным тетраэдром связи С–О также различны: длины связей C(sp3)–O (С1–О1 1.421(1) и С7–О8 1.426(1) Å) больше длин связей C(sp2)–O (C2–O2 1.313(1) и С8–О9 1.319(1) Å). В тетраэдре ВО4 валентные углы О–В–О, включенные в пятичленные гетероциклы (О1–В–О2 105.06(9)° и О8–В–О9 104.18(8)°), уменьшены по сравнению с остальными четырьмя углами, среднее значение которых 111.9° ± 3.3°. В карбоксильных группах, расположенных на концах цитрат-лигандов, средняя длина связей С(sp2)=О составляет 1.215 ± 0.002 Å, а связей С(sp2)–ОН 1.325 ± ± 0.006 Å; в центральных карбоксильных группах средняя длина связи С(sp2)=О составляет 1.217 ± ± 0.002 Å. Средние значения длин связей между атомами углерода составляют: С(sp3)–С(sp3) 1.532 ± ± 0.005 Å; С(sp3)–С(sp2) с концевыми карбоксильными группами 1.507 ± 0.003 Å; С(sp3)–С(sp2) с центральными карбоксильными группами 1.529 ± ± 0.002 Å. Пятичленные гетероциклы BO2C2 плоские с точностью 0.05 Å, их средние плоскости пересекаются под углом 88.77(6)°. Суммы внутрициклических углов 540.0° и 538.5° близки к расчетному значению 540° для плоского выпуклого пятиугольника.
Все отмеченные особенности строения дицитратоборат-аниона согласуются с литературными данными для дицитратоборат-анионов с различными катионами в ранее описанных кристаллических структурах (25 структур согласно КБСД, некоторые из них приведены в ссылках [3–12]). Далее при сравнении кристаллических структур различных солей дицитратоборат-аниона использованы идентификационные шестибуквенные коды из КБСД.
Строение катиона глициния описывается стандартными величинами соответствующих длин связей и углов и совпадает со структурными данными для катиона глициния в кристаллах других солей (например, в структуре глицинфосфита [17]).
Кристаллическая структура упрочнена системой ВС, геометрические параметры которых приведены в табл. 3. Одиннадцать контактов типа О–Н···О и N–Н···О образуют все активные протоны катиона глициния, оба протона молекулы воды и четыре протона карбоксильных групп дицитратоборат-аниона. В качестве акцепторов в образовании ВС участвуют атом кислорода молекулы воды и все атомы кислорода дицитратоборат-аниона, за исключением атомов О5, О12, О14 –ОН-групп концевых карбоксильных групп и атома О2 борогетероцикла.
Таблица 3.
Параметры водородных связей
| ВС | D–H···A | D–H, Å | H···A, Å | D···A, Å | D–H···A, град |
|---|---|---|---|---|---|
| 1 | N1G–H1GB···O1W | 0.95(2) | 1.79(2) | 2.703(1) | 160(2) |
| 2 | N1G–H1GC···O4 | 0.91(2) | 2.03(2) | 2.872(1) | 154(2) |
| 3 | N1G–H1GA···O131) | 0.91(2) | 2.27(2) | 2.919(1) | 129(1) |
| 4 | N1G–H1GA···O72) | 0.91(2) | 2.36(2) | 3.160(1) | 148(2) |
| 5 | O2G–H2G···O92) | 0.88(2) | 2.12(2) | 2.978(1) | 166(2) |
| 6 | O1W–H1WA···O13) | 0.83(2) | 2.12(2) | 2.947(1) | 172(2) |
| 7 | O1W–H2WA···O112) | 0.81(2) | 2.34(2) | 3.126(1) | 162(2) |
| 8 | O5–H5···O83) | 0.89(2) | 1.78(2) | 2.631 (1) | 160(2) |
| 9 | O7–H7···O104) | 0.89(2) | 1.80(2) | 2.685(1) | 174(2) |
| 10 | O12–H12···O64) | 0.90(2) | 1.72(2) | 2.614(1) | 170(2) |
| 11 | O14–H14···O31) | 0.87(2) | 1.78(2) | 2.619(1) | 163(2) |
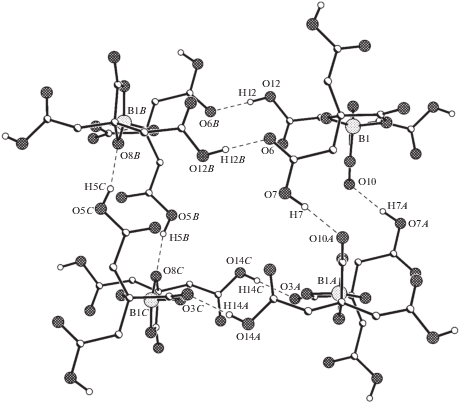
Дицитратоборат-анионы в структуре образуют водородносвязанный слой, параллельный диагональной плоскости (110), в котором можно выделить характерные тетрамеры (рис. 2). В формировании слоя участвуют протоны всех четырех карбоксильных групп аниона (ВС 8–11). Все анионы в слое ориентированы в одном направлении таким образом, что длинные оси бициклических фрагментов перпендикулярны плоскости слоя. Катион глициния и молекула воды находятся внутри полости тетрамера и связаны со всеми четырьмя анионами за счет шести ВС 2–7. Кроме того, катион глициния и молекула воды связаны между собой одной ВС 1.
Рис. 2.
Фрагмент плоской водородносвязанной сетки из дицитратоборат-анионов. Симметрические преобразования: A – 2 – x, –y, 2 – z; B – 1 – x, 1 – y, 2 – z; C– x, y, 1 + z.
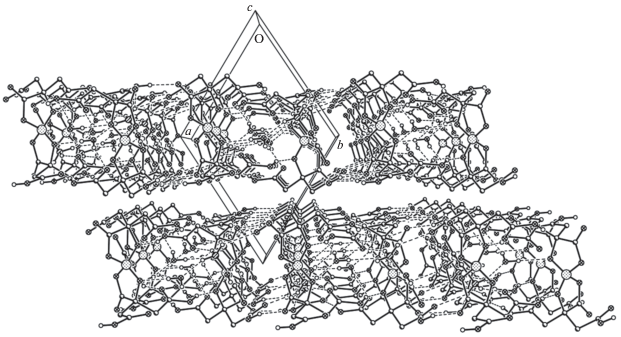
Таким образом, кристаллическая структура полученного соединения построена из катион-анионных слоев (рис. 3), все структурные единицы в которых прочно связаны многочисленными ВС. Слои объединены между собой за счет ван-дер-ваальсовых контактов C–H···O-типа (кратчайшее расстояние О···Н в контакте C11–H11B···O14 (1–x, –y, 1 – z) равно 2.54 Å).
Рис. 3.
Фрагмент кристаллической упаковки, иллюстрирующий слоистую структуру (проекция вдоль оси c кристалла).
Отметим, что образование аналогичных слоистых структур характерно для солей дицитратоборат-аниона с однозарядными катионами щелочных металлов K+[KBDCTA], Cs+[HAGTIS], Rb+[KBDCTB], с небольшими аммонийными катионами NH$_{4}^{ + }$[OKOBIZ], CH3NH$_{3}^{ + }$[ELUBOD], (CH3)2NH$_{2}^{ + }$[JOKRIL] и с катионами хинолинового ряда [AYEYAG, QEMFIX]. Более того, во всех этих структурах, как и в описанной здесь, можно выделить элементарный фрагмент слоя, состоящий из четырех водородносвязанных дицитратоборат анионов, в полости которого расположен катион. В формировании подобных водородносвязанных тетрамеров в некоторых случаях участвуют молекулы воды, входящие в состав гидратов солей. Топологическое подобие тетрамеров, по-видимому, определяется строением центрального бициклического спиро-фрагмента, в котором ортогональные плоскости двух гетероциклов задают общее направление системы ВС с участием концевых карбоксильных групп. Это свойство не зависит от конформации концевых карбоксильных групп цитратных лигандов, которые могут различаться ориентацией атома водорода. Так, в рассматриваемом случае (рис. 1) для трех концевых карбоксильных групп реализуется наиболее распространенная геометрия с транс-положением водорода к связи C–C (соответствующие торсионные углы C–C–O–H составляют 166(1)°, 171(1)° и 176(1)°); для карбоксильной группы C6O6O7H7 реализуется цис-расположение водорода к связи C–C (торсионный угол C5C6O7H7 равен –6(1)°). Для сравнения в слоистой структуре дицитратобората метиламмония CH3NH$_{3}^{ + }$[B(C6H6O7)2]– [ELUBOD] подобные водородносвязанные тетрамеры образуются из дицитратоборат-анионов, в которых все четыре концевые карбоксильные группы имеют одинаковое строение с транс-положением водорода к связи C–C.
С другой стороны, несмотря на такое же, как в данном случае, строение концевых карбоксильных групп в дицитратоборат-анионе и такой же стехиометрический состав (катион–анион–вода), структура моногидрата дицитратобората триэтиламмония (C2H5)3NH+ [B(C6H6O7)2]– · Н2О [RUJZOM] состоит из чередующихся анионных и катионных слоев. Это согласуется с установленной ранее закономерностью строения солей дицитратоборат- аниона с алкилзамещенными катионами аммония [8], согласно которой с увеличением размера катиона нарушается устойчивость катион-анионного слоя с формированием отдельных структурных ассоциатов из анионов и катионов.
Таким образом, синтезировано новое координационное соединение – моногидрат дицитратобората глициния H3NCH2COOH[B(C6H6O7)2] · Н2О. Методом РСА определена структура его кристаллов. Строение дицитратоборат-аниона и катиона глициния совпадает со строением этих ионов в различных солях, рассмотренных в литературе ранее. В кристаллической структуре все структурные компоненты соединения, дицитратоборат-анион [B(C6H6O7)2]–, катион глициния H3NCH2COOH+ и молекула воды, объединены разветвленной системой ВС типа O–H···O и N–H···O в слои, которые объединены в кристалле слабыми ван-дер-ваальсовыми контактами. Показано, что формирование аналогичных катион-анионных слоев определяется структурой дицитратоборат-аниона и не зависит от природы катиона.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 16-29-06184-офи-м) и Министерства науки и высшего образования Российской Федерации.
Список литературы
Сергеева Г.С., Черепанова Т.А., Лутцева М.А., Бурнашова Н.Н. Дицитратоборат оксихинолиния, проявляющий антимикробные свойства. Пат. 2071477 (РФ). 1994 (опубл. 1997).
Бурнашова Н.Н., Хатькова А.Н., Тютрина С.В. и др. Дицитратоборат гуанидиния, проявляющий антимикробные свойства. Пат. 2474584 (РФ). 2011 (опубл. 2013).
Звиедре И.И., Фундаменский В.С., Красников В.В., Колесникова Г.П. // Журн. структур. химии. 1984. Т. 25. № 4. С. 95.
Звиедре И.И., Беляков С.В. // Журн. неорган. химии. 2011. Т. 56. № 3. С. 417.
Wu H., Pan S., Jia D. et al. // Z. Anorg. Allg. Chem. 2012. B. 638. S. 856.
Wu H., Pan S., Yu H. et al. // J. Mol. Struct. 2012. V. 1027. P. 111.
Звиедре И.И., Беляков С.В. // Журн. неорган. химии. 2009. Т. 54. № 9. С. 1460.
Звиедре И.И., Беляков С.В., Зариня И.И. // Журн. неорган. химии. 2011. Т. 56. № 12. С. 1996.
Звиедре И.И., Беляков С.В. // Журн. структур. химии. 2009. Т. 50. № 1. С. 121.
Звиедре И.И., Беляков С.В. // Журн. неорган. химии. 2012. Т. 57. № 10. С. 1433.
Звиедре И.И., Беляков С.В. // Журн. неорган. химии. 2017. Т. 62. № 5. С. 671.
Звиедре И.И., Беляков С.В., Токмаков А.Г. // Журн. неорган. химии. 2008. Т. 53. № 2. С. 318.
Тютрина С.В., Юргенсон Г.А., Осина М.А., Мясникова Н.В. // Журн. прикл. химии. 2017. Т. 90. Вып. 7. С. 841.
Тютрина С.В., Мясникова Н.В., Осина М.А. // Успехи современного естествознания. 2018. № 11. Ч. 2. С. 224.
Sheldrick G.M. // SADABS, 1997, Bruker AXS Inc., Madison, WI-53719, USA.
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. P. 112.
Лапшин А.Е., Смолин Ю.И., Панкова Г.А. // Журн. структур. химии. 2005. Т. 46. № 2. С. 323.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


