Кристаллография, 2020, T. 65, № 4, стр. 660-666
Поиск раствор-расплавных сред для кристаллизации эпитаксиальных слоев флюорита
В. А. Маслов 1, Е. В. Чернова 1, П. П. Федоров 1, *
1 Институт общей физики им. А.М. Прохорова РАН
Москва, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 28.08.2019
После доработки 28.08.2019
Принята к публикации 01.10.2019
Аннотация
С целью подбора флюсов для кристаллизации эпитаксиальных слоев флюорита проведено исследование растворимости CaF2 в различных хлоридных и хлорид-фторидных расплавах. Показано, что преимуществами состава 0.6NaCl–0.4NaF по сравнению с известным флюсом CaCl2–CaF2 является повышенная термическая устойчивость, вдвое меньший температурный градиент растворимости и возможность снизить температуру выращивания на 100°С. Кристаллизация флюорита на затравку в растворе-расплаве CaF2–(0.6NaCl–0.4NaF) проведена как методом снижения температуры, так и в условиях градиента температуры.
ВВЕДЕНИЕ
Эпитаксиальные пленки флюорита, легированного редкоземельными элементами, представляют большой интерес для создания эффективных волноводных лазеров, работающих в широком оптическом диапазоне.
Попытки получения таких эпитаксиальных структур как газофазным, так и жидкофазным методами предпринимались неоднократно, но только французским исследователям удалось изготовить первый планарный волноводный лазер на основе CaF2 : Yb/CaF2, генерирующий 114 мВт на длине волны 1037 нм с эффективностью 12.9% [1]. Для получения эпитаксиальной пленки CaF2 : Yb толщиной 30 мкм методом жидкофазной эпитаксии использовали расплав CaCl2–CaF2. Охлаждение насыщенного раствора проводили в интервале 850–825°С, для осаждения использовали плоскость синтетического флюорита {111} [1, 2].
История исследований кристаллизации флюорита с использованием низкоплавких сред в качестве растворителей прослеживается с середины XIX века. Согласно обзору [3] успешные попытки синтеза флюорита из водных растворов, гелей и растворов-расплавов были осуществлены в XIX веке. О кристаллизации флюорита с использованием раствор-расплавного метода сообщается в [4, 5]. Большой цикл работ по кристаллизации флюорита из раствор-расплавных сред различного состава с учетом морфологии образующихся кристаллов проведен в [6–9].
Для проведения управляемой кристаллизации соединения с использованием раствор-расплавного метода важно построить точную диаграмму состояния растворитель–выращиваемое соединение, знать зависимость растворимости выращиваемого соединения в выбранном растворителе от температуры, термическую стабильность используемой системы, границы поля монофазной кристаллизации [10, 11]. Важно также определить зависимости скоростей роста граней кристалла от температуры, пересыщения, наличия примесей и других условий проведения эксперимента. Судя по имеющимся в литературе диаграммам состояния CaF2 с легкоплавкими хлоридами – щелочными и щелочноземельными расплавами [12–14], некоторые из этих систем должны быть пригодны для кристаллизации флюорита методом раствор в расплаве. При таком анализе необходимо учитывать, что построение подобных систем плавкости происходит обычно с использованием метода дифференциально-термического анализа, дающего большую ошибку в области разбавленных растворов, и для построения кривых растворимости с целью расчета параметров процесса кристаллизации необходимо уточнение диаграмм плавкости с использованием, например, метода пробных затравок.
Целью данной работы было определение растворимости фторида кальция в хлоридных и фторидных расплавах и подбор флюсов для управляемого выращивания кристаллов флюорита.
МЕТОДИКА ЭКСПЕРИМЕНТОВ
Для проведения экспериментов по исследованию растворимости, спонтанной кристаллизации и роста на затравки использовали однозонную и двухзонную электрические печи с нагревателями из фехраля, намотанного в виде спирали на алундовую трубу с внутренним диаметром 50 мм (рис. 1).
Рис. 1.
Схема двухзонной печи для проведения эпитаксии CaF2: 1 – нагреватели из фехраля, 2 – термопары марки ТПР, 3 – стакан платиновый, 4 – раствор-расплав, 5 – держатель затравки, 6 – затравка флюорита.
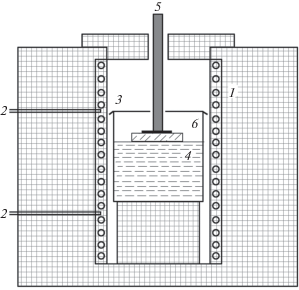
Регулировку температуры осуществляли с точностью до 1°С с использованием регуляторов температуры “Термодат-14ES”. В качестве датчиков температуры применяли платино-родиевые термопары (ТПР). В качестве тиглей использовали платиновые стаканы диаметром 40 мм, которые заполняли раствором-расплавом на высоту 10 мм при исследовании растворимости и на 20–30 мм – при исследовании кристаллизации флюорита. Для измерения температуры в объеме расплава ТПР продевали в двухканальную алундовую соломку диаметром 2.5 мм, которую вставляли в тонкостенную платиновую пробирку диаметром 3 мм, служащую чехлом для термопары.
Для исследования растворимости флюорита в растворах-расплавах использовали природный флюорит предположительно из Уральского региона, используемый в качестве флюса на металлургическом предприятии в г. Электросталь. В качестве пробных затравок и подложек для кристаллизации использовали природный и синтетический флюорит, а также оптическую керамику CaF2 : Er. Синтетический флюорит распиливали на пластинки размером 4–10 мм толщиной около 2 мм на штрипсовой пиле или раскалывали на пластинки, параллельные плоскости спайности {111}, посредством специально изготовленного приспособления (рис. 2). Устройство для раскалывания флюорита по плоскости спайности (гильотина) изготовлено на основе лабораторного пресса, шток которого с закрепленным на нем лезвием подается в пределах 30–40 мм вращением рукоятки. Площадка, на которую устанавливается кристалл флюорита, развернута на угол около 68° по отношению к вертикали (угол между плоскостями спайности кубического кристалла флюорита составляет именно такую величину). Для проверки ориентации кристалла на стенке пресса закреплена лазерная указка, отражение луча лазера от плоскости спайности флюорита совмещается с точкой его выхода.
В качестве исходных реактивов использовали NaCl и KCl марки “х. ч.”, NaF марки “ч. д. а”, LiCl марки “ч.”, CaCl2 – “ос. ч.” 99.99 (фирмы “ЛАНХИТ”) или “ч.” фирмы “Sigma-Aldrich”. Все реактивы предварительно просушивали для удаления адсорбционной влаги.
Рентгенофазовый анализ проводили на дифрактометре BrukerD8 Advanced (излучение CuKα). Рентгенограммы интерпретировали с использованием базы данных JCPDS.
Поверхность подложек после кристаллизации исследовали на оптическом микроскопе и сканирующем электронном микроскопе (СЭМ) JEOL5910 (ИОНХ). Габитус спонтанных кристаллов флюорита и других фаз изучали с помощью микроскопа МБС-2 “Биолар”.
При проведении экспериментов по кристаллизации подложек флюорита в различных растворах-расплавах затравкодержатель с подложкой, ориентированной параллельно поверхности расплава, выдерживали над расплавом не менее 30 мин. Касание подложки с расплавом фиксировали посредством электрического контактора.
РАСТВОРИМОСТЬ ФЛЮОРИТА В РАСТВОРАХ-РАСПЛАВАХ
Результаты исследования растворимости образцов природного флюорита в хлоридных и хлорид-фторидных расплавах в интервале температур 730–905°С приведены в табл. 1 и на рис. 3.
Таблица 1.
Растворимость CaF2 в расплавах
| Опыт | Расплав | Т, °С | Время насы-щения, ч | Раствори-мость, мас. % | Летучесть, % | Габитус спонтанных кристаллов CaF2 |
|---|---|---|---|---|---|---|
| ФП1-8-5д | KCl | 905 | 3 | – | – | – |
| ФП1-8-4ж | KCl | 855 | 4 | 0.7 | 1 | – |
| ФП1-8-2е | KCl | 870 | 4 | 1 | – | – |
| ФП1-8-5в | NaCl | 905 | 3 | 8 | 1 | |
| ФП1-8-4с | NaCl | 855 | 4 | 4.8 | 1 | октаэдр, куб |
| ФП1-8-2г | NaCl | 870 | 7 | 6 | – | |
| ФП1-8-5и | LiCl | 815 | 3 | 40 | 2 | куб |
| ФП1-8-4д | LiCl | 855 | 4 | 41.7 | 2 | куб |
| ФП1-8-2д | LiCl | 750 | 3 | 36 | 1 | |
| ФП1-8-5г | CaCl2 | 905 | 3 | 40 | 7 | октаэдр, куб |
| ФП1-8-5б | CaCl2 | 805 | 3 | 33 | 5 | |
| ФП1-7-4 | CaCl2 | 850 | 5 | 38 | 5 | |
| ФП1-8-4в | 0.5NaCl–0.5LiCl | 855 | 4 | 31 | 2 | октаэдр, скелетные формы |
| ФП1-8-1в | 0.5NaCl–0.5LiCl | 820 | 5 | 28 | 1 | |
| ФП1-8-3в | 0.5NaCl–0.5LiCl | 730 | 5 | 22 | 1 | октаэдр |
| ФП1-8-4б | 0.3NaCl–0.7CaCl2 | 855 | 4 | 22 | 5 | |
| ФП1-8-1б | 0.3NaCl–0.7CaCl2 | 820 | 5 | 19 | 4 | |
| ФП1-8-3б | 0.3NaCl–0.7CaCl2 | 730 | 7 | 13.8 | 4 | куб, скелетные формы |
| ФП1-8-4а | 0.6NaCl–0.4NaF | 855 | 4 | 13.6 | 1.5 | октаэдр |
| ФП1-8-1а | 0.6NaCl–0.4NaF | 820 | 5 | 13.8 | 1 | |
| ФП1-8-3а | 0.6NaCl–0.4NaF | 730 | 7 | 6.8 | 1 |
Рис. 3.
Температурные зависимости растворимости флюорита в расплавах солей: 1 – LiCl; 2 – CaCl2; 3 – 0.5NaCl–0.5LiCl; 4 – 0.3NaCl–0.7CaCl2; 5 – 0.6NaCl–0.4NaF; 6 – NaCl; 7 – KCl.
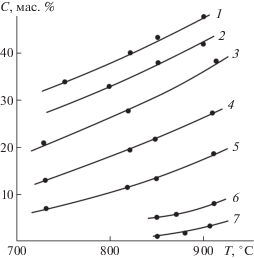
Самая низкая растворимость флюорита среди исследуемых растворов-расплавов зафиксирована в расплаве KCl. Наклон кривой растворимости составил 0.015 мас. %/град. Потеря веса не зафиксирована. Никаких побочных фаз не обнаружено, а значит, управляемая кристаллизация флюорита возможна при температурах выше 900°С. С учетом небольшой вязкости расплавов и наклона кривой растворимости предпочтительна кристаллизация в условиях градиента температуры.
Растворимость флюорита в расплаве NaCl заметно выше, чем в хлориде калия, и составляет единицы массовых процентов. Наклон графика растворимости составляет 0.05 мас. %/град. Благодаря отсутствию побочных фаз и незначительной летучести кристаллизация флюорита в растворе-расплаве NaCl возможна как методом охлаждения, так и методом градиента температур.
В расплаве хлорида лития флюорит растворяется значительно активнее, чем в хлоридах K и Na, величина растворимости достигает почти 42% при 855°С. Учитывая легкоплавкость хлорида лития, процесс кристаллизации нужно проводить при температурах ниже 700°С. Градиент растворимости при 700–855°С составляет значительную величину – 0.1 мас. %/град. Управляемый рост на затравку проводить сложно, поскольку даже небольшие неизбежные флуктуации температуры в объеме раствора-расплава приводят к образованию массы спонтанных зародышей флюорита. Побочных фаз в исследуемом температурном интервале не обнаружено.
В растворе-расплаве CaF2–CaCl2 монофазная кристаллизация флюорита возможна в относительно небольшом интервале температур. Нижний предел температуры ограничивается образованием уже при 800°С двойного соединения CaFCl [9]. Высокая температура не рекомендуется из-за значительной летучести компонентов раствора-расплава. В работах [1, 2] по эпитаксии CaF2 из расплавов на основе CaCl2 исследователи использовали метод охлаждения в интервале температур 850–830°С. Учитывая летучесть раствора-расплава, большую, чем у других исследуемых хлоридов, предполагаем, что лучшие условия для эпитаксиального наращивания CaF2 может дать использование градиентного метода при меньших температурах, чем описано в [1, 2]. Для этого надо переходить к другим растворителям.
В принципе, растворы-расплавы простых щелочных и щелочноземельных хлоридов K, Na, Li, Ca пригодны для управляемой кристаллизации флюорита на затравку, однако в зависимости от растворителя необходимо выбрать соответствующий метод кристаллизации и конструкцию установки. Некоторые особенности кристаллизации проявляются, когда перекристаллизуемый флюорит легируется редкоземельными или другими элементами.
Использование расплавов двойных хлоридов или хлорид-фторидов в качестве растворов-расплавов при кристаллизации фторида кальция вместо расплавов простых хлоридов обещает дать ряд преимуществ, в первую очередь связанных со значительным понижением температуры кристаллизации. Это существенно, учитывая подверженность кристаллов флюорита пирогидролизу. По-видимому, достаточно привлекательными для выбора подходящего раствора-расплава являются низкотемпературные составы в системах NaCl–LiCl, NaCl–NaF и NaCl–CaCl2.
Растворимость CaF2 в расплаве NaCl–LiCl достаточно высокая – 38 мас. % при 900°С, градиент растворимости – 0.1 мас. %/град. Термическая стабильность раствора-расплава очень хорошая даже при 900°С. Пригодны для кристаллизации как метод понижения температуры, так и градиентный метод.
Низкотемпературный раствор-расплав на основе 0.3NaCl–0.7CaCl2 растворяет CaF2 несколько слабее, чем чистый CaCl2, но при его использовании увеличивается термическая стабильность. Исследовали растворы-расплавы в широком интервале температур. Градиент растворимости составляет 0.7 мас. %/град, поэтому могут быть использованы методы охлаждения и градиента температуры.
Растворимость флюорита в расплаве 0.6NaCl–0.4NaF составляет около 10% при 730°С, градиент растворимости 0.05 мас. %/град. Летучесть компонентов в растворе-расплаве незначительна даже в экспериментах длительностью около суток и составляет менее 3 мас. %. Спонтанных побочных кристаллов не обнаружено. Габитус спонтанно образовавшихся кристаллов преимущественно октаэдрический при закалке и резком охлаждении.
КРИСТАЛЛИЗАЦИЯ ФЛЮОРИТА НА ЗАТРАВКУ
После исследования растворимости CaF2 в нескольких растворах-расплавах на основе хлоридов были выбраны два состава для дальнейшего использования в качестве флюсов для кристаллизации эпитаксиальных пленок флюорита.
Один из них – CaCl2 – с высокой растворимостью в нем флюорита ранее использовали для эпитаксии CaF2 : Yb [1, 2], поэтому было важно сопоставить полученные в настоящей работе результаты с достигнутыми ранее.
Раствор-расплав CaCl2–CaF2 может быть использован для кристаллизации флюорита в достаточно узком интервале температур, ориентировочно 800–900°С. При меньшей температуре начинается кристаллизация CaFCl. Повышение температуры до 850–900°С увеличивает испарение расплава, что неизбежно скажется на качестве наращиваемого слоя флюорита. Авторы [1, 2] использовали охлаждение состава CaCl2–CaF2 от 850 до 820°С. В настоящей работе проверена возможность кристаллизации флюорита на затравку в более широком интервале температур, а также градиентным методом.
Второй состав, который был исследован в качестве среды для кристаллизации флюоритов, – CaF2–(0.6NaCl–0.4NaF). Данных об использовании этого состава для кристаллизации флюорита найти не удалось.
Предполагаемые преимущества хлорид-фторидного флюса состоят в следующем:
– возможность проводить кристаллизацию флюорита в более широком интервале температур и, самое главное – снизить нижний предел температуры почти на 100°С;
– термическая устойчивость хлорид-фторидного флюса значительно выше, чем у ранее использовавшегося CaCl2, что должно значительно увеличить качество наращиваемых слоев;
– градиент растворимости флюорита в хлорид-фторидном флюсе почти в 2 раза ниже, чем в CaCl2, что несомненно должно сказаться на качестве эпитаксиального слоя флюорита.
КРИСТАЛЛИЗАЦИЯ В РАСТВОР-РАСПЛАВЕ CaF2–CaCl2
Кристаллизацию флюорита проводили в условиях снижения температуры как из чистого раствора-расплава 0.5CaF2–0.5CaCl2, так и из легированного Nd и Er. Температура насыщения варьировалась в интервале 835–900°С. Объем раствора-расплава составлял 3–4 мл. Насыщение и стабилизация температуры достигались в течение 2–3 ч. Судя по кинетике растворения флюорита, насыщение раствора-расплава достигается за 1.5 ч при температуре около 850°С без перемешивания.
В экспериментах по кристаллизации в зону нагрева вместе с затравочным кристаллом вводили пробные затравки. Затравочную пластинку располагали параллельно поверхности расплава и вводили в зону роста на поверхности расплава медленно до контакта с поверхностью, который контролировали с помощью электрического щупа. Сразу после введения затравки включали режим охлаждения со скоростью 1–2 град/мин на величину 10–40 градусов (табл. 2).
Таблица 2.
Кристаллизация флюорита на затравку в системе CaF2–CaCl2
| Опыт | Затравка | Т, °С | Активатор, % | Скорость охлаждения, град/мин | Прирост массы, г | Габитус спонтанных кристаллов CaF2 |
|---|---|---|---|---|---|---|
| ФП7-1 | прир. | 860–820 | Er, 3 | 1 | 0.1 | куб |
| ФП7-2 | прир. | 900–870 | – | 2 | 0.1 | куб |
| ФП7-3 | синтет. | 835–825 | Nd, 1 | 1 | следы роста | октаэдр, куб |
| ФП7-4 | прир. | 850, ΔТ = 2 град/см | Nd, 1 | – | следы роста | |
| ФП7-5 | прир. | 835–825 | Nd, 1 | 0.5 | следы роста |
Эксперимент по выращиванию флюорита на затравку в условиях градиента температуры проведен успешно. Температура в зоне кристаллизации составляла 850°С, градиент температуры 2 град/см. Высота расплава – 2 см, на дне тигля – шихта из природного флюорита фракцией 3–4 мм. Кристаллизацию проводили в течение 15 ч. Кристалл рос послойно, спонтанных кристаллов флюорита не обнаружено ни на затравке, ни на затравкодержателе.
КРИСТАЛЛИЗАЦИЯ НА ЗАТРАВКУ В СИСТЕМЕ CaF2–(0.6NaCl–0.4NaF)
Кристаллизацию флюорита в растворе-расплаве CaF2–(0.6NaCl–0.4NaF) проводили как методом снижения температуры, так и в условиях градиента температуры (табл. 3).
Таблица 3.
Кристаллизация на затравку в системе CaF2–(0.6NaCl–0.4NaF)
| Опыт | Затравка | Т, °С | Активатор, % | Скорость охлаждения, град/мин | Прирост массы, г | Габитус спонтанных кристаллов CaF2 |
|---|---|---|---|---|---|---|
| ФП9-1 | синтет. | 850–830 | Nd, 1 | 2 | следы роста | сферы |
| ФП9-2 | прир. | 830–825 | Nd, 2 | 1 | следы роста | октаэдр |
| ФП9-3 | синтет. | 824–821 | Nd, 2 | 1 | следы роста | |
| ФП9-3а | синтет. | 838–835 | Nd, 2 | 1 | 0.001 | |
| ФП9-3б | синтет. | 837–829 | Nd, 2 | 1 | 0.003 | сферы |
| ФП9-4а | синтет. | 836–790 | Nd, 1 | 1.5 | 0.002 | сферы |
| ФП9-4б | керам. | 830–750 | Nd, 1 | 5 | 0.003 | |
| Опыт | Затравка | Т, °С; Время кристаллиза-ции, ч | Активатор, % | Перепад температур ΔT, град/см | Прирост массы, г | Габитус спонтанных кристаллов CaF2 |
| ФП9-4в | синтет. | 780, 15 | Nd, 1 | 3 | 0.02 | |
| ФП9-5а | синтет. | 788, 0.25 | Nd, 0.5 | 3 | следы роста | |
| ФП9-5б | синтет. | 788, 2 | Nd, 0.5 | 3 | 0.001 | |
| ФП9-5в | синтет. | 690, 15 | Nd, 0.5 | 3 | 0.02 |
При кристаллизации методом охлаждения исследования проводили в интервале температур 850–750°С. Объем раствора-расплава в стакане диаметром 40 мм составлял около 10 мл (высота расплава ∼10 мм). Затравочный кристалл и в некоторых случаях пробные затравки устанавливали над расплавом до начала нагрева печи. После насыщения раствора-расплава, которое контролировали пробными затравками, держатель с затравкой, расположенной горизонтально, опускали до появления контакта с расплавом (контакт контролировали электрическим щупом). Обычно для насыщения раствора-расплава требовалось 2 ч. Затем включали охлаждение до необходимой температуры со скоростью 1–5 град/мин. После завершения кристаллизации держатель с затравкой приподнимали над поверхностью расплава. Кристалл охлаждали вместе с печью. В качестве затравок использовали пластинки, вырезанные или сколотые по плоскости спайности из оптической керамики, или пластинки, вырезанные из природных кристаллов флюорита, а также бусины из природного флюорита.
Результаты экспериментов по кристаллизации подложек флюорита в широком интервале температур от 750 до 850°С показали, что во всех случаях наблюдается монофазная кристаллизация CaF2. Посторонних фаз не обнаружено. Согласно данным микроскопии рост на синтетических затравках в случае использования сколов по спайности {111} происходит послойно. К сожалению, практически во всех экспериментах независимо от температуры и интервала охлаждения подложки из синтетического флюорита растрескивались по спайности. В результате первых поисковых экспериментов по установлению условий кристаллизации флюорита задача сохранения целостности используемых синтетических подложек в процессе наращивания эпитаксиальных пленок не решена. Для сравнения были использованы подложки из оптической керамики и срезы образцов природного флюорита. Подложки из керамики и природного флюорита в процессе экспериментов по наращиванию эпитаксиальных слоев не растрескивались, но происходила перекристаллизация зерен керамики.
Проведена серия экспериментов по кристаллизации флюорита в растворе-расплаве CaF2–(0.6NaCl–0.4NaF) методом перепада температуры. При использовании этого метода объем расплава был увеличен в 2.5–3 раза по сравнению с методом охлаждения. На дно контейнера помещали шихту флюорита фракцией 3–4 мм. Градиент температуры составлял около 3 град/см в приповерхностной зоне. Температура в зоне кристаллизации подложки составляла 788°С в одной серии опытов и 690°С – в другой.
В экспериментах, отличающихся почти на 100°С по температуре, наблюдалась воспроизводимая кристаллизация флюорита как в коротких опытах длительностью в четверть часа, так и в длительных – до 15 ч. Наблюдалась линейная зависимость прироста массы подложек. Согласно данным оптической микроскопии рост подложек на синтетическом флюорите, сколотом по плоскости спайности, так же, как и в случае использования метода охлаждения, идет послойно.
Таким образом, проведенные эксперименты показали возможность выращивания эпитаксиальных слоев флюорита из раствора–расплава 0.6NaCl–0.4NaF при температуре ниже 800°С.
Авторы выражают благодарность Е.А. Гарибину за предоставление образца керамики CaF2 : Er3+, В.В. Воронову – за проведение рентгенофазового анализа, А.Е. Баранчикову – за проведение исследований методом растровой электронной микроскопии и В.Н. Кузину – за помощь в изготовлении гильотины.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 2018-18-29-12050-MK).
Список литературы
Loiko P., Soulard R., Kifle E. et al. // Optics Express. 2019. V. 27(9). P. 12647.
Peña A., Camy P., Benayad A. et al. // Opt. Mater. 2011. V. 33. P. 1616.
Юшкин Н.П., Волкова Н.В., Маркова Г.А. Оптический флюорит. M.: Наука, 1983. 156 с.
Desai C.C., John V. // J. Cryst. Growth. 1978. V. 44(5). P. 625.
Leckebusch R., Recker K. // J. Cryst. Growth. 1972. V. 13/14. P. 276.
Glikin A.E. // J. Cryst. Growth. 1981. V. 52. P. 98.
Кирьянова Е.В. Дис. “Зависимость огранения синтетического флюорита от условий кристаллизации” … к.г.-м.н. Ленинград, 1986, 156 с.
Гликин А.Э. Полиминерально-метасоматический кристаллогенез. СПб.: Нева, 2004. 231 с.
Кирьянова Е.В. Дис. “Температурно-концентрационные вариации формы кристаллов и свойств растворов” … д.г.-м.н. СПб., 2009. 198 с.
Elwell D., Scheel H.J. Crystal growth from high temperature solutions. London; New York; San Francisco: Acad. Press., 1975. 350 p.
Тимофеева В.А. Рост кристаллов из растворов-расплавов. М.: Наука, 1978. 282 с.
Десятник В.Н., Курбатов Н.Н., Стрелов В.А., Щавелев В.В. // Изв. вузов. Цветная металлургия. 1979. № 4. С. 65.
Справочник по плавкости систем из безводных неорганических солей / Под ред. Воскресенской Н.К. М.; Л.: АН СССР, Т. 1. 1961. 460 с.
Бухалова Г.А., Баргман А.Г. // Журн. прикл. химии. 1955. Т. 28. С. 1266.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография



