Кристаллография, 2020, T. 65, № 5, стр. 751-755
Кристаллическая структура 3,4-дигидро-2-метокси-2-метил-4-фенил-2Н,5Н-пирано[3,2-с]хромен-2-она
А. Н. Кочетов 1, *, Л. А. Носикова 1, Л. Г. Кузьмина 2
1 МИРЭА – Российский технологический университет
(Институт тонких химических технологий имени М.В. Ломоносова)
Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
* E-mail: kochchem@mail.ru
Поступила в редакцию 11.03.2020
После доработки 11.03.2020
Принята к публикации 03.04.2020
Аннотация
Методом рентгеноструктурного анализа исследована новая полиморфная форма 3,4-дигидро-2-метокси-2-метил-4-фенил-2Н,5Н-пирано[3,2-с]хромен-2-она (“Пиранокумарин”). Кристаллографические параметры структуры C20H18O4: М = 322.34, пр. гр. С2/с, a = 23.542(1), b = 8.4938(3), c = 19.7804(8) Å, β = 125.977(3)°, Z = 8.
ВВЕДЕНИЕ
Ранее [1] было исследовано строение молекулярного комплекса антикоагулянта крови 3-[1-(4-нитрофенил)-3-оксобутил]-4-гидроксихромен-2-она (торговое название “Синкумар”) с этиловым спиртом. Подобные сольватированные формы ряда производных 4-гидроксикумарина обладают большей фармакологической активностью [2] и представляют интерес в качестве новых лекарственных форм и родентицидных средств. Ранее также была отмечена более высокая токсичность некоторых производных данной лекарственной группы. Например, метиловый эфир фармакопейного препарата “Варфарин” оказывается более токсичным в отношении M. Musculus L., чем “Варфарин” [3, 4].
В литературе можно найти данные о большом количестве полиморфных модификаций для производных данной лекарственной группы [5–7], что частично подтверждает широкий разброс спектральных характеристик и температур плавления синтезируемых разными методами производных [8–11]. Существует более пяти различных полиморфных модификаций широко известных медицинских субстанций [7, 12]. Получение полиморфной формы может быть сопряжено с образованием различных сольватов, продуктов самоконденсации или взаимодействием с растворителем. Между тем различия в фармакологических характеристиках полиморфных модификаций одного и того же лекарственного средства заставляют строго регламентировать способ получения и очистки препаративных форм [13].
Совокупностью этих обстоятельств можно объяснить повышенный интерес к исследованию строения наиболее доступной лекарственной формы данной группы соединений − “Варфарина” [9, 14] – и его метилового эфира [10]. В кристаллическом состоянии “Варфарин” существует исключительно в циклической полукетальной форме [9, 10, 14–16], однако в растворе обнаруживаются и открытые цепочечные формы за счет размыкания полукетального фрагмента [16–19].
Для метиловых производных “Варфарина” в зависимости от способа получения удалось выделить как циклические, так и алициклические производные [10]. Метилирование “Варфарина” диазометаном [20] и с помощью метилиодида в ацетоне приводит к одному и тому же продукту: метиловому эфиру открытой цепочечной формы [10]. В случае кристаллизации “Варфарина” из метилового спирта производные не образуются, однако была получена сольватированная форма, содержащая MeOH в соотношении 1 : 1 [14].
Из него могут быть получены эфиры гемикетальной формы “Варфарина” при проведении реакции с соответствующим спиртом в присутствии соляной кислоты или смолы Dowex 50 [10, 20]. Дробная кристаллизация пиранокумарина в виде рацемической смеси, полученного в [10] из этилового спирта, приводит к двум различным моноклинным полиморфным формам, характеризующимся различными Тпл (167.2–168.4, 183.8–186.0°С) и параметрами ячеек: пр. гр. Р21/n, а = = 16.22(1), b = 5.86(1), с = 16.63(1) Å, β = 95.0(5)°, Z = 4; пр. гр. I21/a (пр. гр. С2/c в нестандартной установке) а = 19.943(3), b = 8.516(1), с = 20.027(5) Å, β = 106.92(2)°, Z = 8) соответственно. Несмотря на существенные различия полиморфных модификаций, полное исследование строения проведено не было. Позднее [21] теми же авторами была подробно исследована полиморфная форма рацемической смеси (S, S; R, R) с Тпл = 167.2–168.4°С и уточнены ее параметры (пр. гр. Р21/n, а = 5.858(1), b = 16.732(9), с = 16.383(9) Å, β = = 94.82(3)°, Z = 4), а также ранее неописанная модификация оптически чистой (R,R)-формы с Тпл = 177.9–179.9°С и параметрами: пр. гр. Р212121, а = 11.521(2), b = 14.061(2), с = 10.055(2) Å, Z = 4. В настоящей работе получена и изучена новая полиморфная форма соединения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
К 0.50 г (200 ммоль) 3-(1-фенил-3-оксобутил)-4-гидроксихромен-2-она (“Варфарина”) в 70 см3 метанола добавили 0.25 см3 концентрированной соляной кислоты и кипятили полученный раствор в колбе с обратным холодильником в течение 1 ч. После остывания до комнатной температуры полученный бесцветный раствор оставили для кристаллизации без доступа воздуха. Выпавшие пластинчатые кристаллы отделили от маточного раствора, промыли небольшими порциями метанола (по 5 см3). Набор экспериментальных отражений получен для кристалла, покрытого перфторированным маслом, на дифрактометре с координатным детектором Bruker SMART APEX (MoKα-излучение, Т = 120(2) K, ω-сканирование). Структура расшифрована прямыми методами и уточнена методом наименьших квадратов по F2 в анизотропном приближении атомных смещений. Атомы водорода локализованы из разностного синтеза, но в дальнейшее уточнение в изотропном приближении включены их геометрически рассчитанные позиционные параметры.
Все расчеты выполнены по программам SHELXTL-Plus [22], обработка экспериментальных отражений проведена по программе [23]. Кристаллографические параметры, а также параметры расшифровки и уточнения структуры приведены в табл. 1, отдельные длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и параметры уточнения структуры
| Формула | C20H18O4 |
|---|---|
| М | 322.34 |
| Сингония, пр. гр., Z | Моноклинная, С2/с, 8 |
| а, b, с, Å | 23.542(1), 8.4938(3), 9.7804(8) |
| β, град | 125.977(3) |
| V, Å3 | 3200.9(2) |
| Dx, г/см3 | 1.338 |
| F(000) | 1360 |
| μ, мм–1 | 0.093 |
| Размер кристалла, мм | 0.52 × 0.46 × 0.38 |
| Т, К | 120(2) |
| Излучение; λ, Å | MoKα; 0.71073 |
| Тип сканирования | Ω |
| θ, град | 2.14–29.00 |
| Пределы h, k, l | –31 ≤ h ≤ 32, –7 ≤ k ≤ 11, –26 ≤ l ≤ 26 |
| Число отражений: измеренных (N1)/независимых с I > 2σ(I) (N2), Rint | 10 492/4132, 0.0229 |
| R/Rw по N1 | 0.0527/0.1159 |
| R/Rw по N2 | 0.0417/0.1103 |
| S по F2 | 1.044 |
| ∆ρmin/∆ρmax, э Å–3 | –0.239/0.354 |
Таблица 2.
Отдельные длины связей (d) и валентные углы (ω)
| Связь | d, Å | Связь | d, Å |
|---|---|---|---|
| O1–C7 | 1.377(2) | C4–C5 | 1.359(2) |
| O1–C8 | 1.396(2) | C4–C8 | 1.452(2) |
| O2–C8 | 1.211(1) | С5–C6 | 1.449(2) |
| O3–C5 | 1.351(1) | C6–C7 | 1.397(2) |
| O3–C1 | 1.457(1) | C6–C9 | 1.403(2) |
| O4–C1 | 1.406(1) | C7–C12 | 1.392(2) |
| О4–C20 | 1.431(2) | C9–C10 | 1.384(2) |
| C1–C19 | 1.516(2) | C10–C11 | 1.396(2) |
| C1–C2 | 1.519(2) | C11–C12 | 1.387(2) |
| C2–C3 | 1.543(2) | C13–C18 | 1.393(2) |
| C3–C4 | 1.510(2) | C13–C14 | 1.397(2) |
| C3–C13 | 1.529(2) | ||
| Угол | ω, град | Угол | ω, град |
| C7–O1–C8 | 121.7(1) | C4–C5–C8 | 119.4(1) |
| C5–O3–C1 | 116.5(1) | C5–C4–C3 | 122.3(1) |
| C1–O4–C20 | 116.4(1) | C8–C4–C3 | 118.0(1) |
| O4–C1–O3 | 108.6(1) | O3–C5–С4 | 124.8(1) |
| O4–C1–C19 | 113.5(1) | O3–C5–С6 | 113.5(1) |
| O3–C1–C19 | 105.0(1) | O1–C7–C12 | 117.5(1) |
| O4–C1–C2 | 106.9(1) | O1–C7–C6 | 121.2(1) |
| О3–C1–C2 | 109.3(1) | O2–C8–О1 | 116.1(1) |
| C19–C1–C2 | 113.4(1) | O2–C8–C4 | 125.6(1) |
| C1–C2–C3 | 112.2(1) | O1–C8–C4 | 118.2(1) |
| C4–C3–C13 | 115.4(1) | C4–C5–C6 | 121.7(1) |
| С4–C3–C2 | 108.1(1) | C7–C6–C9 | 119.0(1) |
| O3–C3–C4 | 114.6(1) | C7–C6–C5 | 117.5(1) |
| C13–C3–C2 | 112.2(1) |
Координаты атомов и другие экспериментальные данные депонированы в Кембриджский банк структурных данных (CCDC № 673717).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
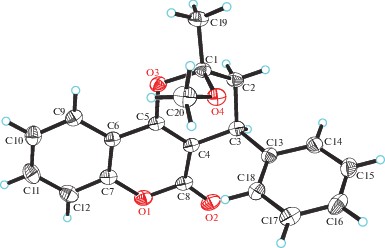
Фрагменты кристаллической структуры показаны на рис. 1. Молекула имеет гемикетальную циклическую конфигурацию и содержит два центра хиральности – атомы С1 и С3. Пиранокумарин кристаллизуется в виде рацемической смеси: абсолютная конфигурация молекулы SC1SC3 и RC1RC3, т.е. оба атома С имеют одинаковую хиральность.
В полукетале плоская кумариновая система С4…С12 дополняется третьим шестичленным гетероциклом, включающим в себя атом кислорода О3. Этот гетероцикл имеет конформацию полукресла: атомы С2 и С1 расположены по разные стороны от плоскости остальных атомов гетероцикла и отстоят от этой плоскости на +0.387 и –0.344 Å соответственно. Торсионный угол О3–С5–С4–С3 составляет –2.5(1)°. Подобная конформация была подробно исследована в [1]. Строение кумаринового фрагмента молекулы практически не отличается от строения незамещенного 4-гидроксикумарина [24] и родственных соединений данной лекарственной группы [1, 9, 10, 14, 15, 21, 25–27].
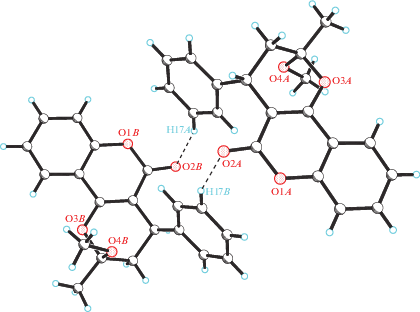
Анализ кристаллической упаковки показал, что атом кислорода кето-группы О2 участвует в образовании парных межмолекулярных контактов С–Н···О средней прочности (С17–Н17В···О2А и С17–Н17А···О2В: Н17···О2 2.552 Å, С17–Н17–О2 158°), в результате образуются центросимметричные димеры (рис. 2). Димерные структуры наблюдаются в случае “Варфарина” и родственных соединений за счет реализации водородных связей О–Н···О между атомами кислорода кето-группы кумаринового цикла и гидроксо-группой пиранонового фрагмента [9, 15]. Энергетика этих водородных связей может быть оценена по данным прецизионного рентгенодифракционного исследования при топологическом анализе функции распределения электронной плотности в рамках теории “Атомы в молекуле” [28]. Помимо димерных систем для сольватированных форм данной фармакологической группы реализуются цепочечные структуры, в которых сольватированная молекула (спиртов [1, 14] и воды [21]), содержащая один активный протон, участвует в двух водородных связях: в одной из них в качестве донора, а во второй – в качестве акцептора протона. При этом образуется пара водородных связей средней прочности между гидроксогруппой пиранонового фрагмента и атомом кислорода растворителя, а также собственным протоном сольватированной молекулы с карбонильным кислородом другой молекулы полукеталя, связанной с базисной трансляцией вдоль оси а кристалла.
Рис. 2.
Димерные фрагменты в кристаллической структуре 3,4-дигидро-2-метокси-2-метил-4-фенил-2Н,5Н-пирано[3,2-с]хромен-2-она, образованные за счет парных контактов С–Н···О.
Помимо образования различных водородных связей О–Н···О карбонильные соединения в кристаллическом состоянии могут стабилизироваться внутримолекулярными и межмолекулярными водородными связями С–Н···О [29]. Наличие подобных контактов приводит к реализации различных полиморфных модификаций. Так, в кристаллической упаковке рацемической смеси (пр. гр. Р21/n, а = 5.858(1), b = 16.732(9), с = = 16.383(9) Å, β = 94.82(3)°, Z = 4) образуются межмолекулярные контакты С–Н···О средней прочности между атомом кислорода кето-группы О2 и атомом водорода, занимающим орто-положение в фенильном колце (С14–Н14В···О2А: Н14В···О2А 2.505 Å, С14–Н14–О2 168°), в результате образуется цепочечная структура [21], похожая на молекулярные комплексы родственных соединений с сольватированными молекулами растворителя [1, 14, 21].
В кристаллической упаковке оптически активного (R,R)-изомера исследуемого соединения (пр. гр. Р212121, а = 11.521(2), b = 14.061(2), с = = 10.055(2) Å, Z = 4) [21] наблюдается контакт С–Н···О между карбонильным атомом О2 и атомом водорода Н11 кумаринового, а не фенильного фрагмента (С11–Н11В···О2А: Н11В···О2А 2.523 Å, С14–Н14–О2 117°), в результате также образуется цепочечная структура. Несмотря на несколько бóльшую прочность контакта и на значительно более выгодные условия для перекрывания орбиталей (угол С–Н–О2 составляет 117°, а обнаруженный ранее в эксперименте и рассчитанный – 158° и 168° соответственно), эта упаковка менее плотная, что может быть следствием менее выгодной пространственной конфигурации оптически активного (R,R)-изомера по сравнению с рацематом.
По-видимому, возможны еще несколько полиморфных модификаций пиранокумарина, сходных по строению с кристаллическими фазами родственных лекарственных форм. Например, возможно образование пар центросимметричных димеров по типу хвост–голова, ароматические фрагменты которых располагаются параллельно друг над другом (π–π-взаимодействие), что ранее было обнаружено для родственного соединения 3-[1-фенилпропил]-4-гидроксихромен-2-он (торговое название “Маркумар”) [26]. Возможна также реализация более “рыхлых” структур с заметно удаленными контактами С–Н···О (около 3 Å), например в случае этилового эфира гемикетальной формы “Варфарина” [30].
Использование обращенно-фазовой высокоэффективной жидкостной хроматографии для оценки полярности пиранокумарина демонстрирует большую липофильность по сравнению со стартовой субстанцией “Варфарин” [31] и другими производными 4-гидроксикумаринового ряда [32–34], что, по мнению ряда авторов, может свидетельствовать о более высокой способности к кумуляции и, как следствие, к большей антикоагулянтной активности [35–38]. Экспериментально это подтвердилось: при внутрижелудочном введении самцам белых крыс одинаковой дозы (30 мг/кг) полученной полиморфной формы соединения параллельно с исходной субстанцией “Варфарин” была установлена большая эффективность новой формы (66%) по сравнению со стартовой (50%).
Авторы выражают благодарность Н.П. Сергеюк и Ю.И. Походзей за помощь в получении токсикологических данных.
Список литературы
Кочетов А.Н., Кузьмина Л.Г. // Кристаллография. 2007. Т. 52. № 4. С. 662.
Лакин К.М., Смирнова Т.В., Вишнякова Г.М. // Хим.-фарм. журн. 1989. Т. 23. С. 1212.
Заева Г.Н., Мальцева М.М., Березовский О.И. и др. // Дезинфекционное дело. 2004. № 3. С. 58.
The Agrochemical Handbook / Ed. Kennedy J.M. Unwin Brothers Limited, Old Woking, Surrey, 1987.
Валика В.В., Бабилев Ф.В., Андроник И.Я. // Наука – фармацевтической практике. Кишинев: Штиинца, 1984. С. 27.
Бабилев Ф.В. // Фармацевтичний журн. 1988. № 1. С. 51.
Баблиев Ф.В., Андроник И.Я. Полиморфизм лекарственных веществ. Кишинев: Штиинца, 1982. 239 с.
Bowerman A.M., Brooks J.E. // Pest Control. 1972. V. 75. P. 22.
Valente E.J., Trager W.F., Jensen L.H. // Acta Cryst. B. 1975. V. 31. P. 954.
Valente E.J., Lingafelter E.C., Porter W.R., Trager W.F. // J. Med. Chem. 1977. V. 20. P. 1489.
Porter W.R., Trager W.F. // J. Heterocycl. Chem. 1982. V. 19. P. 475.
Burger A., Ramberger R. // Mikrochim. Acta. 1979. B. II. S. 273.
Леонидов Н.Б., Шабатин В.П., Першин В.И. и др. // Рос. хим. журн. 1997. Т. 41. № 5. С. 37.
Bravic G., Gaultier J., Hauw C. // Acad. C.R., Paris. Sér. C. 1973. V. 277. P. 1215.
Ruggiero G., Jr O.P., Valente E.J. // Acta Cryst. C. 1989. V. 45. P. 1740.
Кочетов А.Н., Кузьмина Л.Г. // Хим.-фарм. журн. 2010. Т. 44. № 2. С. 19.
Gianini D.D., Roberts J.D. // Proc. Nat. Acad. U.S.A. 1974. V. 71. P. 4221.
Trager W.F., Larry D.H. // J. Med. Chem. 1984. V. 27. № 8. P. 1092.
Вишнякова Г.М., Смирнова Т.В., Курковская Л.Н., Панов А.Ю. // Изв. вузов. Сер. хим. хим. технол. 1986. Т. 29. Вып. 3. С. 111.
Ikawa M., Link K.P., Stahmann M.A. // J. Am. Chem. Soc. 1944. V. 66. P. 902.
Valente E.J., Egglestone D.S., Schomaker V. // Acta Cryst. C. 1986. V. 42. P. 1809.
SHELXTL-Plus, Version 5.10. Bruker AXS Inc., Madison, Wisconsin (USA), 1997.
Version 6.02A. Bruker AXS Inc., Madison, Wisconsin (USA), 2001.
Gaultier J., Hauw C. // Acta Cryst. A. 1966. V. 20. P. 646.
Csöregh I., Edström S. // Chem. Communs. Univ. Stockholm. 1976. № 4. P. 3.
Valente E.J., Trager W.F., Lingafelter E.C. // Acta Cryst. B. 1976. V. 32. P. 277.
Valente E.J., Gaultier J., Hauw C. // Acad. C.R., Paris. Sér. C. 1971. V. 272. P. 1112.
Лысенко К.А., Антипин М.Ю. // Изв. РАН. Сер. хим. 2006. Т. 55. № 1. С. 1.
Гупта B.К., Бандхория П., Гупта Б.Д., Гупта К.К. // Кристаллография. 2006. Т. 51. № 2. С. 292.
Casalone G., Pilati T. // Acta Cryst. C. 1998. V. 54. P. 1042.
Кочетов А.Н., Шестаков К.А., Шпилевский Г.М., Кузьмина Л.Г. // Хим.-фарм. журн. 2013. Т. 47. № 2. С. 41.
Носикова Л.А., Кочетов А.Н. // Тонкие хим. технологии. 2015. Т. 10. № 6. С. 88.
Носикова Л.А., Кочетов А.Н. // Пест-Менеджмент. 2015. № 4. С. 42.
Носикова Л.А., Кочетов А.Н. // Пест-Менеджмент. 2019. № 1. С. 36.
Chen D.U., Kuo P.-Y., Yang D.-Y. // Bioorg. Med. Chem. Lett. 2005. V. 15. № 10. P. 2665.
Watt B.E., Proudfoot A.T., Bradberry S.M., Vale J.A. // Toxicol. Rev. 2005. V. 24. № 4. P. 259.
Gebauer M. // Bioorgan. Med. Chem. 2007. V. 15. № 6. P. 2414.
Кочетов А.Н., Шестаков К.А., Кузьмина Л.Г. // Дезинфекционное дело. 2009. № 2. С. 68.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография