Кристаллография, 2020, T. 65, № 5, стр. 811-817
Взаимодействие N,N'-ди(4-хлорфенил)диимида 1,1'-бинафтил-4,4',5,5',8,8'-гексакарбоновой кислоты с диоксидом тиомочевины в растворе и тонкой пленке
К. С. Никитин 1, *, Ю. В. Поленов 1, А. В. Казак 2, 3, Е. В. Егорова 1, Н. В. Усольцева 2
1 Ивановский государственный химико-технологический университет
Иваново, Россия
2 Научно-исследовательский институт наноматериалов, Ивановский государственный университет
Иваново, Россия
3 Московский государственный областной университет
Мытищи, Россия
* E-mail: nikitin_kost@mail.ru
Поступила в редакцию 02.04.2020
После доработки 02.04.2020
Принята к публикации 28.04.2020
Аннотация
Исследованы реакции взаимодействия N,N'-ди(4-хлорфенил)диимида 1,1'-бинафтил-4,4',5,5',8,8'-гексакарбоновой кислоты (кубоген красный) с диоксидом тиомочевины в водно-щелочном растворе и тонкой пленке, полученной на кварцевой и кремниевой подложках с применением технологии Ленгмюра–Блоджетт. Методом электронной спектроскопии поглощения установлено, что в водно-щелочном растворе протекает реакция восстановительной циклизации кубогена с образованием производных диимида перилентетракарбоновой кислоты. В то же время взаимодействие диоксида тиомочевины с тонкой пленкой кубогена не приводит к образованию продуктов циклизации, но вызывает изменение структуры пленки. Можно предположить, что в данном случае происходит образование растворимых лейкоформ J-агрегатов, при этом H-агрегаты остаются в структуре в неизменном виде.
ВВЕДЕНИЕ
Исследование плавающих слоев и тонких пленок на твердых поверхностях представляет большой интерес для их практического использования в микроэлектронике, оптическом приборостроении и преобразователях солнечной энергии [1–5]. В частности, пленки органических полупроводников используются в дисплеях, солнечных элементах, сенсорах и других органических электронных устройствах [6–10]. Среди органических полупроводников интенсивно изучаются производные перилена и их аналоги благодаря таким оптоэлектрическим свойствам, как большое сродство к электрону и плотное перекрывание π-орбиталей в твердом состоянии.
Периленовые производные широко используются как полупроводники n-типа в солнечных элементах из-за высокой подвижности электронов, фотохимической устойчивости и сильной оптической абсорбции [11–16]. Другим важным фактором является их крупнотоннажное производство в качестве пигментов.
Для достижения высокой эффективности периленовых производных как фотопреобразователей необходимо достижение оптимальной морфологии донорно-акцепторных смесей. Другими словами – установление зависимостей между супрамолекулярной организацией и оптоэлектронными свойствами в тонких пленках.
Наиболее распространенным способом получения нанопленок периленовых производных является их вакуумное напыление на подложку. Это требует специального, технически сложного оборудования. Кроме того, данный метод предполагает полное разупорядочение молекул в процессе формирования. В связи с этим поиск альтернативных способов является актуальной задачей.
Известно, что взаимодействие производных N,N'-дизамещенных диимидов 1,1'-бинафтил-4,4',5,5'8,8'-гексакарбоновых кислот с различными химическими восстановителями приводит к циклизации бинафтильного фрагмента и образованию производных диимидов перилентетракарбоновой кислоты (ПТКК). Одним из ранее изученных методов получения периленовых производных является восстановительная циклизация производных диимидов бинафтилгексакарбоновой кислоты [17–19], протекающая в растворах под действием различных химических восстановителей. Целью настоящей работы является изучение возможности применения данного метода для жидкофазного формирования тонких пленок, а также исследование взаимодействия в водно-щелочном растворе диоксида тиомочевины (ДОТМ) с кубогеном красным, имеющим хлорфенильный заместитель, и сопоставление этих результатов с данными [17] для кубогена с диметилфенильным заместителем при атомах азота.
Ранее [20] были сформированы и исследованы тонкие пленки дифильных производных нафталимида, имеющих в составе нафтильный фрагмент. Показано, что данные соединения с краун-эфирными фрагментами способны организовывать стабильные монослои на водной поверхности и пленки Ленгмюра–Блоджетт и могут быть использованы в качестве оптических отбеливателей [21], лазерных красителей [22], элементов солнечных батарей [23], флуоресцентных маркеров в биологии [24], электролюминесцентных материалов [25], противоопухолевых препаратов [26], реагентов для люминесцентной дефектоскопии [27].
В связи с этим в задачи данной работы входило изучение взаимодействия ДОТМ с кубогеном в твердой фазе, для чего была предпринята попытка ее получения в виде тонкой пленки на поверхности кварцевой и кремниевой подложек.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методика проведения реакции циклизации кубогена красного в водно-щелочном растворе. Исходный препарат кубогена синтезировали в ФГУП ГНЦ “НИОПИК” (г. Москва) согласно методике, описанной в [28]. Восстановитель – ДОТМ – синтезировали способом окисления тиомочевины марки “х. ч.” 37%-ным водным раствором пероксида водорода [29]. Содержание основного вещества, определенное йодометрическим методом [30], составляло не менее 98%. Навеску кубогена красного массой 3 мг растворяли в 50 мл 0.25 М раствора гидроксида натрия, 8.6 мг ДОТМ растворяли в 50 мл дистиллированной воды. Для проведения реакции в кювету спектрофотометра помещали 1.5 мл раствора ДОТМ и одновременно с включением секундомера в кювету заливали 1.5 мл раствора кубогена, после чего регистрировали спектры поглощения реакционной массы через определенные промежутки времени.
Пленки кубогена на кварцевой и кремниевой подложках. Пленки кубогена на кварцевой и кремниевой подложках формировали по методике, описанной в [31, 32]. Плавающие слои получали из раствора калиевой соли N,N'-ди(4-хлорфенил)диимида 1,1'-бинафтил-4,4',5,5',8,8'-гексакарбоновой кислоты в тетрагидрофуране (С = 1.12 × 10–2%) в ленгмюровской ванне фирмы “NT-MDT” (Зеленоград, Россия). Для получения слоев 192 мкл раствора наносили на поверхность бидистиллированной воды при температуре 20 ± 1°С. Слои сжимали со скоростью 55 см2/мин через 15 мин после нанесения раствора. Предварительно перед нанесением слоев кварцевые подложки тщательно очищали, промывая последовательно концентрированной серной кислотой, дистиллированной водой и хлороформом.
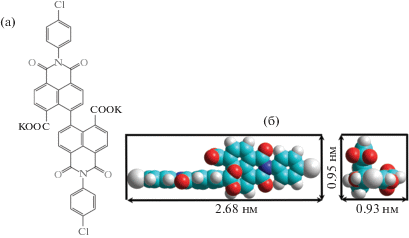
Для расчета начальной степени покрытия поверхности воды молекулами исследуемого соединения строили модель кубогена с использованием метода PM3 с помощью программы HyperChem 8.0. На рис. 1 приведены структурная формула молекулы кубогена и размеры двух проекций модели данного соединения.
Площадь, занимаемую одной молекулой на поверхности воды, оценивали на основании представленной face-on геометрической модели, при этом из площади описываемого прямоугольника вычитали свободную часть, не занятую молекулой. Она составила Аproj(face) = 1.2 нм2. При нанесении раствора исходная площадь покрытия поверхности молекулами составила cface = 69%. Поверхностное давление (π) измеряли с помощью весов Вильгельми с точностью 0.02 мН/м.
При cface = 100% барьеры в ванне останавливали и осуществляли последовательный перенос плавающих слоев на подложку методом горизонтального лифта при π = 0.3 мН/м. На кварцевую подложку было перенесено 100 слоев, на кремниевую – 1 и 5 слоев.
Электронная спектроскопия. Электронные спектры поглощения (ЭСП) исследуемых растворов и тонких пленок регистрировали на спектрофотометре марки UV-Vis Cary 60 фирмы Agilent Technologies (США) с точностью измерения длины волны ±1 нм. При проведении реакции циклизации использовали кварцевую кювету толщиной 10 мм. В качестве раствора сравнения использовали раствор 0.25 М NaOH. При регистрации ЭСП пленок, сформированных на кварцевой подложке, поглощение чистой кварцевой подложки вычиталось. Спектры раствора кубогена и продукта его циклизации регистрировали в кварцевой кювете с использованием в качестве растворителя соответственно тетрагидрофурана и хлороформа. Растворители предварительно очищали перегонкой.
Сканирующая атомно-силовая микроскопия. Микрорельеф поверхности пленок Ленгмюра–Шеффера кубогена исследовали с помощью сканирующего зондового атомно-силового микроскопа (АСМ) Solver47-PRO (Россия) в полуконтактном режиме, так как он обладает более высокой разрешающей способностью при исследовании органических материалов и не повреждает исследуемую поверхность во время сканирования.
ИК-спектроскопия. ИК-спектр продукта циклизации кубогена красного получали на ИК-фурье-спектрометре IRAffinity-1S Shimadzu (Япония) с использованием приставки диффузного отражения при соотношении сигнал/шум 30 000/1 со спектральным диапазоном 7800–350 см–1. Образцы твердого продукта использовали в виде порошка.
Измерение флуоресценции. Квантовые выходы флуоресценции (ΦF) определяли сравнительным методом с использованием уравнения
Все измерения были выполнены на спектрофлуориметре СМ 2203 производства ЗАО “СОЛАР” (Беларусь) 3 раза, представленные данные являются средними значениями трех экспериментов с оценочной погрешностью ±10%.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Реакция циклизации в растворе. На рис. 2 представлены ЭСП раствора кубогена в различные моменты времени от начала реакции. Исходный спектр кубогена красного имеет два максимума поглощения при 226 и 330 нм.
Рис. 2.
ЭСП раствора в реакции восстановительной циклизации, полученные в различные моменты времени: 1 – 0, 2 – 19, 3 – 24, 4 – 31, 5 – 37 мин. Т = 301 К. СNaOH = 0.12 моль/л, СДОТМ = 7.95 × 10–4 моль/л, Скуб = 3.86 × 10–5 моль/л.
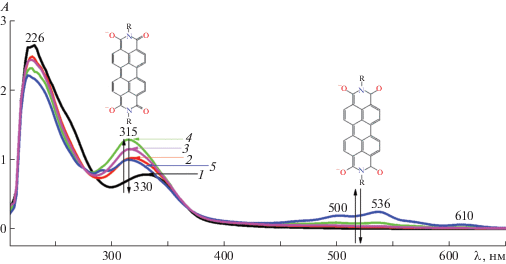
На 19-й минуте после начала реакции отмечено появление максимума поглощения при 315 нм, высота которого увеличивается до 31-й минуты, а затем начинает уменьшаться. При этом наблюдается появление двух максимумов поглощения при длинах волн 500 и 536 нм. По аналогии с изученной реакцией циклизации кубогена красного гидрокси- и аминоалкансульфинатами натрия [18, 19] можно предположить, что продуктом восстановления, имеющим максимум при длине волны 315 нм, является дианион дииимида ПТКК, а продуктом, имеющим максимумы поглощения при 500 и 536 нм – тетраанион диимида ПТКК. Оба продукта с течением времени окисляются кислородом воздуха с образованием не растворимого в водно-щелочном растворе соединения. Оно было выделено из раствора путем фильтрования, промыто ацетоном и высушено.
На рис. 3б представлен ИК-спектр поглощения твердого продукта, полученного после проведения реакции восстановления и полного окисления реакционной массы, а на рис. 3а – ЭСП раствора указанного соединения в хлороформе.
Рис. 3.
ЭСП раствора продукта циклизации кубогена красного в хлороформе (a) и ИК-спектр поглощения продукта (б).
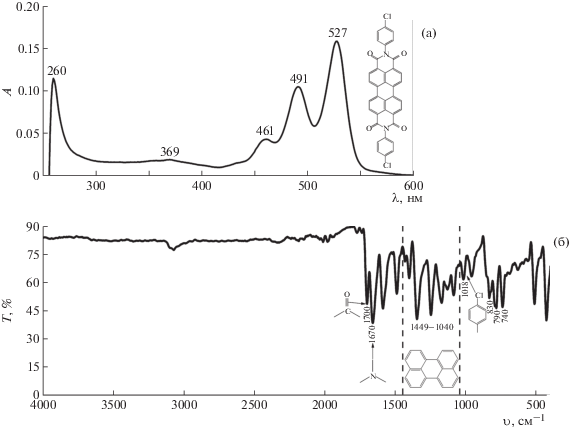
В ИК-спектре наблюдаются полосы поглощения в области 1449–1040 см–1, характерные для валентных колебаний периленового цикла [34–36]. Максимумы поглощения, имеющие значения волновых чисел 830, 790, 740 см–1, соответствуют деформационным колебаниям данного цикла. Интенсивные полосы поглощения с волновыми числами 1700 и 1670 см–1 отвечают валентным колебаниям карбонильной и имидной групп соответственно, полоса поглощения с волновым числом 1018 см–1 – валентным колебаниям хлорфенильного заместителя.
Электронный спектр поглощения конечного продукта в хлороформе (рис. 3а) имеет интенсивные полосы поглощения в области 530–460 нм, характерные для данных производных N,N'-диимидов ПТКК [17–19, 37–39].
Таким образом, при взаимодействии ДОТМ с кубогеном красным в водно-щелочном растворе происходит восстановительная циклизация с образованием ди- и тетраанионов периленового производного. Установлено, что при их окислении образуется твердый N,N'-ди(4-хлорфенил)диимид ПТКК.
Спектр флуоресценции. Спектры флуоресцентного излучения и возбуждения N,N'-ди(4-хлорфенил)диимида ПТКК показаны на рис. 4. Полосы излучения имеют приближенную зеркальную симметрию с полосой Q в соответствующем спектре возбуждения. Cтоксов сдвиг составляет 10 нм.
Рис. 4.
Спектры флуоресценции и возбуждения N,N'-ди(4-хлорфенил)диимида перилентетракарбоновой кислоты в CHCl3.
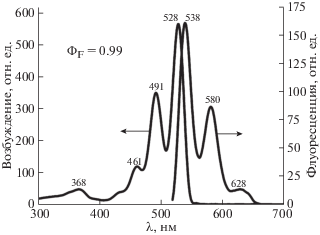
Значение квантового выхода флуоресценции (ΦF) для молекулы N,N'-ди(4-хлорфенил)диимида ПТКК в хлороформе равно 0.99, что хорошо согласуется с данными для подобного класса соединений [40].
Пленки Ленгмюра–Шеффера (ЛШ). На рис. 5 приведены АСМ-изображения ЛШ-пленки, полученной на кремниевой подложке по описанной ранее методике.
Рис. 5.
АСМ-изображения ЛШ-пленки кубогена красного на кремниевой подложке (а, в) и линейные размеры агрегатов (б, г) при нанесении одного слоя (а, б) и пяти слоев (в, г) кубогена.
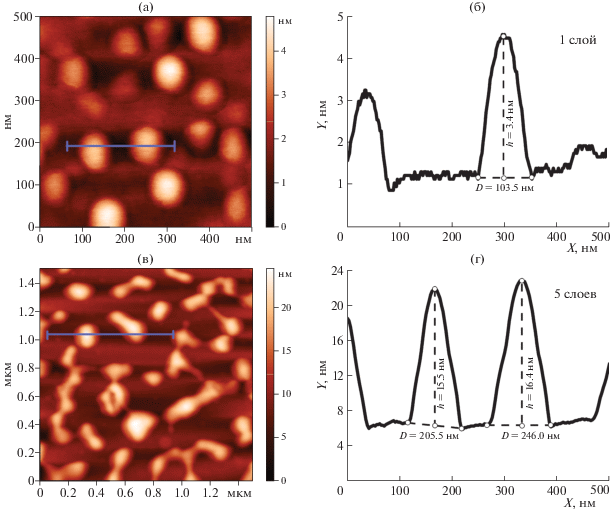
По представленным данным можно сделать вывод, что агрегация исследуемого соединения довольно высокая, распределение агрегатов по поверхности неравномерное. При нанесении одного слоя преимущественная высота агрегатов составляет 3.4 нм, диаметр – 103.5 нм (рис. 5б). При нанесении пяти слоев агрегаты укрупняются и сливаются: высота агрегатов увеличивается до 16 нм, диаметр меняется от 200 до 250 нм (рис. 5г).
В ЭСП раствора кубогена красного в тетрагидрофуране наблюдаются две полосы поглощения – при 373 нм с плечом 350 нм и 222 нм (рис. 6а, кривая 1).
Рис. 6.
ЭСП раствора кубогена красного в тетрагидрофуране (1) и ЛШ-пленки на кварцевой подложке (2) (а); ЭСП ЛШ-пленки кубогена красного до обработки водно-щелочным раствором ДОТМ (1) и после обработки (2) (б).
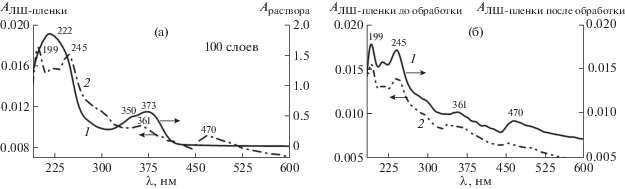
Согласно данным [41, 11 ] при образовании молекулярных слоев на твердой поверхности из мономерных молекул в растворе возможно формирование агрегатов двух типов – J и H, которые различаются ориентацией суммарных дипольных моментов. При образовании агрегатов J-типа происходит смещение максимума поглощения в ЭСП в красную область спектра, а при образовании агрегатов Н-типа – в синюю область спектра. В электронном спектре поглощения ЛШ-пленки, состоящей из 100 слоев, регистрируется несколько полос поглощения. Максимум поглощения при 470 нм соответствует, по-видимому, J-агрегатам, при 245 и 199 нм – Н-агрегатам, а при 361 нм – мономолекулярному состоянию пленки.
Электронные спектры поглощения ЛШ-пленки после обработки раствором ДОТМ показали, что восстановительной циклизации кубогена не происходит. Наблюдается исчезновение J-агрегатов (рис. 6б), что подтверждается отсутствием в спектре полосы поглощения при 470 нм, однако полосы, характерные для Н-агрегатов, сохраняются.
Возможно, данные изменения определяются межмолекулярными взаимодействиями в Н- и J-агрегатах. Действие диоксида тимочевины на J- агрегаты связано с тем, что их ориентация в структуре пленки способствует атаке активных интермедиатов – анионов сульфоксиловой кислоты на карбонильные группы. При этом образуется хорошо растворимая в водной щелочи анионная лейкоформа кубогена, которая легко удаляется с подложки.
ЗАКЛЮЧЕНИЕ
Взаимодействие N,N'-ди(4-хлорфенил)диимида 1,1'-бинафтил-4,4',5,5',8,8'-гексакарбоновой кислоты с диоксидом тиомочевины в водно-щелочном растворе приводит к восстановительной циклизации и образованию ди- и тетраанионов N,N'-ди(4-хлорфенил)диимида-3,4,9,10-перилентетракарбоновой кислоты. В случае проведения данной реакции с твердыми агрегатами, сформированными в виде пленки Ленгмюра–Шеффера, восстановительной циклизации не наблюдается, но происходит взаимодействие J-агрегатов c восстановителем, которое приводит к их растворению и последующему удалению с поверхности подложки. Таким образом происходит выравнивание поверхности пленки, позволяющее получать менее дефектные тонкопленочные наноматериалы на основе исследуемого кубогена, и открывается возможность их эффективного использования в органических фотовольтаических устройствах.
Работа выполнена при поддержке Министерства науки и высшего образования РФ в рамках государственного задания Ивановскому государственному университету для выполнения научно-исследовательских работ (заявка № FZZM-2020-0006).
Список литературы
Mei J., Leung N.L.C., Kwok R.T.K. et al. // Chem. Rev. 2015. V. 115. P. 11718. https://doi.org/10.1021/acs.chemrev.5b00263
Chumakov A.S., Al-Alwani A.J., Gorbachev I.A. et al. // BioNanoScience. 2017. V. 7. P. 666. https://doi.org/10.1007/s12668-017-0449-4
Kazak A.V., Usol’tseva N.V., Bykova V.V. et al. // Mol. Cryst. Liq. Cryst. 2011. V. 541. P. 28. https://doi.org/10.1080/15421406.2011.569529
Luceño-Sánchez J.A., Díez-Pascual A.M., Capilla R.P. // Int. J. Mol. Sci. 2019. V. 20. P. 976. https://doi.org/10.3390/ijms20040976
Kazak A.V., Marchenkova M.A., Smirnova A.I. et al. // Mendeleev Commun. 2020. V. 30. № 1. P. 52. https://doi.org/10.1016/j.mencom.2020.01.017
Friederich P., Fediai A., Kaiser S. et al. // Adv. Mater. 2019. V. 31. P. 1808256. https://doi.org/10.1002/adma.201808256
Kazak A.V., Usol’tseva N.V., Smirnova A.I. et al. // Macroheterocycles. 2015. V. 8. № 3. P. 284. https://doi.org/10.6060/mhc150972k
Казак А.В., Усольцева Н.В., Смирнова А.И. и др. // Кристаллография. 2016. Т. 61. № 3. С. 462. https://doi.org/10.7868/S0023476116030152
Wang Q., Tian Q.-S., Zhang Y.-L. et al. // J. Mater. Chem. C. 2019. V. 7. P. 11329. https://doi.org/10.1039/C9TC03092A
Kazak A.V., Marchenkova M.A., Dubinina T.V. et al. // New J. Chem. 2020. V. 44. P. 3833. https://doi.org/10.1039/c9nj06041c
Alessio P., Braunger M.L., Aroca R.F. et al. // J. Phys. Chem. C. 2015. V. 119. P. 12055. https://doi.org/10.1021/acs.jpcc.5b03093
El-Daly S.A., Salem I.A., Hussein M.A. et al. // J. Fluoresc. 2015. V. 25. P. 379. https://doi.org/10.1007/s10895-015-1523-3
Zou L., You A., Song J. et al. // Colloids Surf. A. 2015. V. 465. P. 39. https://doi.org/10.1016/j.colsurfa.2014.10.021
Kozma E., Catellani M. // Dyes Pigments. 2013. V. 98. P. 160. https://doi.org/10.1016/j.dyepig.2013.01.020
Sun J.-P., Hendsbee A.D., Dobson A.J. et al. // Org. Electron. 2016. V. 35. P. 151. https://doi.org/10.1016/j.orgel.2016.05.012
Sridhar R., Ravichandran S., Sunil Kumar K. et al. // J. Phys. Chem. Lett. 2012. V. 3. P. 2405. https://doi.org/10.1021/jz301047d
Шулепова О.И., Рябинин В.A., Стариченко В.Ф. и др. // Журн. орган. химии. 1993. Т. 29. С. 1001.
Поленов Ю.В., Кублашвили Г.Д., Буданов В.В. и др. // Журн. прикл. химии. 1990. Т. 63. С. 1622.
Поленов Ю.В., Кублашвили Г.Д., Буданов В.В. и др. // Журн. прикл. химии. 1992. Т. 65. С. 2570.
Selector S.L., Bogdanova L.B., Shokurov A.V. et al. // Macroheterocycles. 2014. V. 7. № 3. P. 311. https://doi.org/10.6060/mhc140506s
Grabchev I., Konstantinova T. // Dyes Pigments. 1997. V. 33. P. 197. https://doi.org/10.1016/S0143-7208(96)00053-8
Martin E., Weigand R., Pardo A. // J. Luminesc. 1996. V. 68. P. 157. https://doi.org/10.1016/0022-2313(96)00008-7
Siegers C., Olàh B., Würfel U. et al. // Solar Energ. Mater. Solar Cells. 2009. V. 93. P. 552. https://doi.org/10.1016/j.solmat.2008.11.038
Lin H.-H., Chan Y.-C., Chen J.-W. et al. // J. Mater. Chem. 2011. V. 21. P. 3170. https://doi.org/10.1039/C0JM02942D
Tu G., Zhou Q., Cheng Y. et al. // Synth. Met. 2005. V. 152. P. 161. https://doi.org/10.1016/j.synthmet.2005.07.173
Li Z., Yang Q., Qian X. // Bioorg. Med. Chem. 2005. V. 13. P. 4864. https://doi.org/10.1016/j.bmc.2005.05.006
May B., Poteau X., Yuan D. et al. // Dyes Pigments. 1999. V. 42. P. 79. https://doi.org/10.1016/S0143-7208(99)00011-X
А. с. 366705 СССР, М. Кл. C 07с 63/42. Докунихин Н.С., Ворожцов Г.Н.; заявл. 28.04.1971; опубл. 05.01.1974, Бюл. № 1.
Буданов В.В. Химия и технология восстановителей на основе сульфоксиловой кислоты (Ронгалит и его аналоги). М.: Химия, 1984. 160 с.
Шафран И.Г., Степанова A.Г., Панкратьева Л.И. // Труды ИРЕА. Химические реагенты и препараты. М.: ИРЕА, 1963. Т. 25. С. 215.
Kazak A.V., Zhukova L.N., Kovaleva M.I. et al. // Liq. Cryst. Their Appl. 2018. V. 18. №. 3. P. 74. https://doi.org/10.18083/LCAppl.2018.3.74
Kazak A.V., Dubinina T.V., Kholodkov I.V. // Liq. Cryst. Their Appl. 2019. V. 19. № 4. P. 88. https://doi.org/10.18083/LCAppl.2019.4.88
Kubin R.F., Fletcher A.N. // J. Lumines. 1982. V. 27. P. 455. https://doi.org/10.1016/0022-2313(82)90045-X
Jain V.K., Zaidi Z.H. // Spectrochim. Acta. A. Molecular Spectroscopy 1988. V. 44. P. 1159. https://doi.org/10.1016/0584-8539(88)80088-6
Sun Y., Lei Y., Dong H. et al. // J. Am. Chem. Soc. 2018. V. 140. P. 6186. https://doi.org/10.1021/jacs.8b00772
Sakamoto T., Pac C. // J. Org. Chem. 2001. V. 66. P. 94. https://doi.org/10.1021/jo0010835
Stappert S., Li C., Mullen K. et al. // Chem. Mater. 2016. V. 28. P. 906. https://doi.org/10.1021/acs.chemmater.5b04602
Sapagovas V.J., Gaidelis V., Kovalevskij V. et al. // Dyes Pigments. 2006. V. 71. P. 178. https://doi.org/10.1016/j.dyepig.2005.06.012
Liu L., Yue M., Lu J. et al. // Appl. Surf. Sci. 2018. V. 456. P. 645. https://doi.org/10.1016/j.apsusc.2018.06.183
Siva Krishna M.N., Jiawang Z., Tao C. et al. // J. Am. Chem. Soc. 2019. V. 141. P. 1290. https://doi.org/10.1021/jacs.8b11201
Hochstrasser R.M., Kasha M. // Photochem. Photobiol. 1964. V. 3. P. 317. https://doi.org/10.1111/j.1751-1097.1964.tb08155.x
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография