Кристаллография, 2020, T. 65, № 5, стр. 756-769
Кристаллохимические особенности фаз и природа координационной связи в системе [CuxNi(1 – x){N(CH2PO3)3}]Na4 · nH2O (x = 0–1)
Н. В. Сомов 1, *, Ф. Ф. Чаусов 2, **, Н. В. Ломова 2, В. Л. Воробьёв 2, И. С. Казанцева 2, Г. В. Сапожников 3, Р. М. Закирова 4
1 Национальный исследовательский университет им. Н.Н. Лобачевского
Нижний Новгород, Россия
2 Удмуртский Федеральный исследовательский центр УрО РАН
Ижевск, Россия
3 Научно-исследовательский институт металлургической технологии
Ижевск, Россия
4 Удмуртский государственный университет
Ижевск, Россия
* E-mail: somov@phys.unn.ru
** E-mail: chaus@udman.ru
Поступила в редакцию 29.11.2019
После доработки 29.11.2019
Принята к публикации 28.02.2020
Аннотация
Исследованы особенности структуры фаз, образующихся при кристаллизации смешанных комплексов меди и никеля с нитрило-трис-метиленфосфоновой кислотой [CuxNi(1 ‒ x){N(CH2PO3)3}]Na4 · · nH2O (x = 0–1), и координационной связи M ← O(P). Для фазы с преобладанием меди [(Cu,Ni){N(CH2PO3)3}]Na4 · 13H2O (пр. гр. P$\bar {1}$, Z = 2, a = 10.0096(2)–10.0118(2), b = 11.0311(3)–11.0330(2), c = 12.2893(2)–12.3038(3) Å, α = 84.7180(10)–84.785(2)°, β = 79.504(2)–79.544(2)°, γ = 66.971(2)–67.058(2)°) характерна тригонально-бипирамидальная координация атома металла; в плоскости основания пирамиды лежат атомы кислорода трех различных PO3-групп молекулы лиганда, в одной вершине – атом азота, в противоположной вершине – атом кислорода соседней молекулы лиганда. Никельсодержащая фаза [Ni(H2O){N(CH2PO3)3}]Na4 · 11H2O (пр. гр. C2/c, Z = 4, a = 11.9924(2)–12.05510(10), b = 18.6049(3)–18.7152(2), c = 21.0724(4)–21.1266(2) Å, β = 104.096(2)–104.4960(10)°) характеризуется октаэдрической координацией атома Ni; в трех меридионально расположенных вершинах октаэдра находятся атомы кислорода различных PO3-групп молекулы лиганда, а в трех других вершинах – атом азота, молекула воды и атом кислорода соседней молекулы лиганда. Изучена зависимость межатомных расстояний и валентных углов в координационной сфере атома металла от отношения Cu:Ni и показано, что переход от тригонально-бипирамидальной к октаэдрической координации сопровождается резким увеличением степени ионности координационной связи M ← O(P).
ВВЕДЕНИЕ
Комплексы нитрило-трис-метиленфосфоновой кислоты H6{N(CH2PO3)3} (H6NTP) с металлами являются объектами пристального внимания как за рубежом [1–4], так и в России [5–16]. С типичными s-элементами NTP образует комплексные соединения, в которых отдельные связи металл–лиганд носят ковалентный характер [12, 13]. Практическое значение NTP и ее комплексов обусловлено их способностью ингибировать процессы коррозии металлов в водных средах [17–19].
Известно мнение, что “за редким исключением, стереохимические требования иона металла играют менее важную роль в циклообразовании, чем стереохимические свойства лиганда” [20]. Поэтому представляет несомненный фундаментальный интерес поиск таких “редких исключений” – структур, в которых симметрия координации иона металла одним и тем же лигандом изменяется при замене металла.
Во многих случаях Ni(II) и Cu(II) образуют изоморфные кристаллические структуры [21–23]. Однако в комплексе NTP с медью(II) [Cu{N(CH2PO3)3}]Na4 · 8½H2O координационный полиэдр (КП) атома Cu – искаженная тригональная бипирамида [6], а в комплексе NTP с никелем(II) [Ni(H2O){N(CH2PO3)3}]Na4 · 11H2O КП атома Ni [7] – слабо искаженный октаэдр, включающий в себя дополнительную молекулу воды.
Геометрия координационного окружения атома металла в этих комплексах описывается классической теорией кристаллического поля [24, 25]. Расщепление Cu3d9-подуровня в тригонально-бипирамидальном (ТБП) поле приводит к значению ESCF(Cu,ТБП) ≈ –0.71ΔNTP, а в октаэдрическом – ESCF(Cu,окт) = –0.6ΔNTP, где ΔNTP – параметр расщепления кристаллическим полем, характерный для молекулы NTP. Минимум электронной энергии системы, включающей в себя ион Cu2+, стабилизирует симметрию комплекса $C{{3}_{{v}}}$. Расщепление Ni3d8-подуровня в октаэдрическом поле приводит к минимальному значению ESCF(Ni,окт) = = –1.2ΔNTP, в то время как в ТБП-координации ESCF(Ni,ТБП) = –0.63ΔNTP.
Показано, что в системе, содержащей ионы Ni2+ и Cu2+ и NTP, в результате конкуренции ионов Ni2+ и Cu2+ за энергетически выгодное координационное окружение могут образовываться в зависимости от отношения Cu:Ni комплексы как с ТБП, так и с октаэдрической координацией [26].
В настоящей работе описаны кристаллохимические особенности и характер координационной связи M ← O(P) для различных фаз, образующихся при кристаллизации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез смешанных комплексов ряда [CuxNi(1 – x){N(CH2PO3)3}]Na4 · nH2O вели в соответствии с ранее описанной методикой [26]. Кристаллы смешанных комплексов выращивали из смеси вода–диметилсульфоксид (ДМСО) (отношение объемов 3:1) при комнатной температуре при медленном испарении растворителя. Отбирали первую фракцию образовавшихся кристаллов – около 10% общего содержания комплексов в растворе. Кристаллы промывали смесью вода–ДМСО (отношение объемов 1:1), безводным ДМСО, диэтиловым эфиром и высушивали на воздухе.
Рентгеноструктурный анализ. Кристаллографические характеристики, параметры рентгеноструктурных экспериментов и результаты уточнения структуры полученных образцов приведены в табл. 1. Для исследования были выбраны визуально однородные кристаллы приблизительно изометричной формы. Начальные фрагменты структур найдены прямым методом. Положения всех атомов, кроме атомов водорода, определены из разностного синтеза электронной плотности и уточнены в анизотропном приближении методом наименьших квадратов по |F|2. Положения атомов водорода были также определены из разностного синтеза электронной плотности. Результаты рентгеноструктурных исследований депонированы в Кембриджский банк структурных данных.
Таблица 1.
Кристаллографические характеристики, данные экспериментов и результаты уточнения структур
| Опыт | 1 | 2 | 3 | 4 |
| Атомная доля Cu в растворе | 1 | 3/4 | 1/2 | 3/8 |
| Формула | CuC3H32NNa4O22P3 | Cu0.65Ni0.35C3H32N Na4O22P3 | Cu0.54Ni0.46C3H32N Na4O22P3 | Cu0.66Ni0.34C3H32N Na4O22P3 |
| M | 682.7 | 680.99 | 680.5 | 681.07 |
| Сингония, пр. гр., Z | Триклинная, P$\bar {1}$, 2 | Триклинная, P$\bar {1}$, 2 | Триклинная, P$\bar {1}$, 2 | Триклинная, P$\bar {1}$, 2 |
| T, K | 100(2) | 293(2) | 293(2) | 100(2) |
| a, b, c, Å | 10.0096(2), 11.0330(2), 12.2893(2) |
10.0125(3), 11.0434(3), 12.3372(3) |
10.0266(3), 11.0676(4), 12.3608(3) |
10.0469(4), 11.1061(6), 12.3910(6) |
| α, β, γ, град | 84.7180(10), 79.544(2), 67.058(2) |
85.014(2), 79.532(2), 67.061(2) |
84.999(2), 79.582(2), 67.001(3) |
84.945(4), 79.426(4), 67.038(5) |
| V, Å3 | 1228.73(4) | 1235.17(6) | 1241.63(7) | 1251.23(11) |
| Dx, г·см–3 | 1.845 | 1.831 | 1.820 | 1.808 |
| μ, мм–1 | 1.247 | 1.206 | 1.190 | 1.192 |
| Tmin, Tmax | 0.41915, 1 | 0.74, 0.92 | 0.715, 0.862 | 0.81287, 1 |
| Учет поглощения | Эмпирическое, CrysAlisPro 1.171.39.8e (Rigaku Oxford Diffraction, 2015) | |||
| F(000) | 702 | 701 | 701 | 701 |
| Размер кристалла, мм | 0.489 × 0.253 × 0.088 | 0.327 × 0.157 × 0.068 | 0.398 × 0.301 × 0.158 | 0.304 × 0.177 × 0.073 |
| Дифрактометр | XtaLAB Pro: Kappa single | Oxford Diffraction Gemini S | ||
| Излучение; λ, Å/монохроматор | MoKα; 0.71073/графит | |||
| Тип сканирования | ω | |||
| θ, град | 2.589–30.508 | 3.359–30.507 | 3.359–30.507 | 3.346–30.508 |
| Пределы h, k, l | –14 ≤ h ≤ 14, –15 ≤ k ≤ 15, –17 ≤ l ≤ 16 |
–14 ≤ h ≤ 14, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
–14 ≤ h v 14, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
–14 ≤ h ≤ 14, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
| Измерено рефлексов: | ||||
| всего | 17 235 | 24 115 | 23 409 | 241 16 |
| независимых | 7430 | 7536 | 7565 | 7624 |
| с I > 2σ(I) | 6891 | 7066 | 7181 | 7049 |
| Rint | 0.0248 | 0.022 | 0.0165 | 0.02 |
| Число параметров | 421 | 452 | 451 | 436 |
| S | 0.985 | 1.074 | 1.107 | 1.055 |
| R-факторы: для F2 > 2 σ(F2) | ||||
| R1, wR1 | 0.0235, 0.0719 | 0.0200, 0.0525 | 0.0203, 0.0536 | 0.0206, 0.0540 |
| R2, wR2 | 0.0257, 0.0734 | 0.0220, 0.0535 | 0.0216, 0.0542 | 0.0234, 0.0553 |
| Δρmin/Δρmax, э Å–3 | –0.680/0.532 | –0.374/0.422 | –0.705/0.408 | –0.365/0.408 |
| CCDC | 1 908 001 | 1 908 007 | 1 908 008 | 1 908 009 |
| Степень подобия КП атома металла эталонным полиэдрам: | ||||
| Тригональная бипирамида | 0.31554(11) | 0.33942(11) | 0.36099(11) | 0.38278(13) |
| Тетрагональная пирамида | 0.17706(6) | 0.17543(6) | 0.18082(6) | 0.18793(6) |
| Октаэдр | ||||
| Программы | CrysAlisPro [27], SHELX2014 [28], WinGX [29], VESTA3.0 [30] | |||
| Опыт | 5 | 6 | 7 | |
| Атомная доля Cu в растворе | 5/16 | 9/32 | 1/4 | |
| Формула | Cu0.55Ni0.45C3H30N Na4O21P3 | Cu0.35Ni0.65C3H30N Na4O21P3 | Cu0.23Ni0.77C3H32N Na4O22P3 | Cu0.23Ni0.77C3H30N Na4O21P3 |
| M | 662.5 | 661.53 | 678.97 | 660.95 |
| Сингония, пр. гр., Z | Моноклинная, C2/c, 8 | Моноклинная, C2/c, 8 | Триклинная, P$\bar {1}$, 2 | Моноклинная, C2/c, 8 |
| T, K | 293(2) | 293(2) | 100(2) | 100(2) |
| a, b, c, Å | 12.0625(3), 18.7047(4), 21.1297(6) |
12.0489(2), 18.7052(3), 21.1450(4) |
10.0118(2), 11.0311(3), 12.3038(3) |
11.9924(2), 18.6049(3), 21.0724(4) |
| α, β, γ, град | 90, 104.464(3), 90 |
90, 104.335(2), 90 |
84.785(2), 79.504(2), 66.971(2) |
90, 104.096(2), 90 |
| V, Å3 | 4616.3(2) | 4617.22(14) | 1229.34(5) | 4560.05(14) |
| Dx, г·см–3 | 1.906 | 1.903 | 1.834 | 1.925 |
| μ, мм–1 | 1.274 | 1.253 | 1.170 | 1.256 |
| Tmin, Tmax | 0.94943, 1 | 0.94052, 1 | 0.57542, 1 | 0.67257, 1 |
| Учет поглощения | Эмпирическое, CrysAlisPro 1.171.39.8e (Rigaku Oxford Diffraction, 2015) | |||
| F(000) | 2724 | 2723 | 700 | 2722 |
| Размер кристалла, мм | 0.128 × 0.098 × 0.066 | 0.172 × 0.115 × 0.093 | 0.143 × 0.124 × 0.066 | 0.162 × 0.121 × 0.068 |
| Дифрактометр | Xcalibur, Sapphire3, Gemini | XtaLAB Pro: Kappa single | ||
| Излучение; λ, Å/монохроматор | MoKα; 0.71073/графит | |||
| Тип сканирования | ω | |||
| θ, град | 3.489–33.036 | 3.49–33.039 | 2.648–30.507 | 2.557–30.506 |
| Пределы h, k, l | –17 ≤ h ≤ 17, –28 ≤ k ≤ 28, –32 ≤ l ≤ 31 |
–18 ≤ h ≤ 18, –28 ≤ k ≤ 28, –31 ≤ l ≤ 30 |
–14 ≤ h ≤ 14, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
–17 ≤ h ≤ 17, –26 ≤ k ≤ 26, –30 ≤ l ≤ 30 |
| Измерено рефлексов: | ||||
| всего | 49 083 | 47 316 | 38 565 | 70 324 |
| независимых | 8106 | 8173 | 7512 | 6952 |
| с I > 2σ(I) | 6364 | 6952 | 6583 | 6173 |
| Rint | 0.0528 | 0.0345 | 0.0514 | 0.0544 |
| Число параметров | 395 | 395 | 448 | 413 |
| S | 1.077 | 1.080 | 1.013 | 1.062 |
| R-факторы: для F2 > 2 σ(F2) | ||||
| R1, wR1 | 0.0426, 0.0838 | 0.0325, 0.0729 | 0.0250, 0.0584 | 0.0260, 0.0574 |
| R2, wR2 | 0.0636, 0.091 | 0.0436, 0.0775 | 0.0315, 0.0606 | 0.0327, 0.0594 |
| Δρmin/Δρmax, э Å–3 | –0.565/0.552 | –0.414/0.549 | –0.386/0.598 | –0.415/0.475 |
| CCDC | 1 908 017 | 1 908 013 | 1 908 014 | 1 908 015 |
| Степень подобия КП атома металла эталонным полиэдрам: | ||||
| Тригональная бипирамида | 0.37877(14) | |||
| Тетрагональная пирамида | 0.19451(7) | |||
| Октаэдр | 0.5966(3) | 0.5920(2) | 0.5838(3) | |
| Программы | CrysAlisPro [27], SHELX2014 [28], WinGX [29], VESTA3.0 [30] | |||
| Опыт | 8 | 9 | 10 | 11 |
| Атомная доля Cu в растворе | 7/32 | 3/16 | 1/8 | 0 |
| Формула | Cu0.09Ni0.91C3H32N Na4O22P3 | Cu0.06Ni0.94C3H30N Na4O21P3 | Cu0.02Ni0.98C3H30N Na4O21P3 | NiC3H30NNa4 O21P3 |
| M | 678.33 | 660.15 | 659.98 | 659.86 |
| Сингония, пр. гр., Z | Триклинная, P$\bar {1}$, 2 | Моноклинная, C2/c, 8 | Моноклинная, C2/c, 8 | Моноклинная, C2/c, 8 |
| T, K | 100(2) | 293(2) | 293(2) | 293(2) |
| a, b, c, Å | 10.01420(10), 11.03280(10), 12.3015(2) |
12.0509(2), 18.6980(2), 21.1310(3) |
11.9957(2), 18.6120(2), 21.0688(3) |
12.05510(10), 18.7152(2), 21.1266(2) |
| α, β, γ, град | 84.7570(10), 79.5430(10), 66.9910(10) |
90, 104.4080(10), 90 |
90, 104.0840(10), 90 |
90, 104.4960(10), 90 |
| V, Å3 | 1229.91(3) | 4611.65(11) | 4562.50(11) | 4614.71(8) |
| Dx, г·см–3 | 1.832 | 1.902 | 1.922 | 1.900 |
| μ, мм–1 | 1.156 | 1.224 | 1.233 | 1.217 |
| Tmin, Tmax | 0.7735, 1 | 0.93926, 1 | 0.317, 1 | 0.95091, 1 |
| Учет поглощения | Эмпирическое, CrysAlisPro 1.171.39.8e (Rigaku Oxford Diffraction, 2015) | |||
| F(000) | 700 | 2720 | 2720 | 2720 |
| Размер кристалла, мм | 0.382 × 0.185 × 0.165 | 0.135 × 0.116 × 0.065 | 0.183 × 0.139 × 0.082 | 0.267 × 0.215 × 0.163 |
| Дифрактометр | XtaLAB Pro: Kappa single | Xcalibur, Sapphire3, Gemini | XtaLAB Pro: Kappa single | Xcalibur, Sapphire3, Gemini |
| Излучение; λ, Å/монохроматор | MoKα; 0.71073/графит | |||
| Тип сканирования | ω | |||
| θ, град | 2.662–30.508 | 3.249–30.183 | 2.961–32.926 | 3.491–37.966 |
| Пределы h, k, l | –14 ≤ h ≤ 14, –15 ≤ k ≤ 15, –17 ≤ l ≤ 17 |
–17 ≤ h ≤ 16, –25 ≤ k ≤ 25, –29 ≤ l ≤ 29 |
–17 ≤ h ≤ 17, –28 ≤ k ≤ 27, –31 ≤ l ≤ 32 |
–20 ≤ h ≤ 20, –32 ≤ k ≤ 31, –35 ≤ l ≤ 36 |
| Измерено рефлексов: | ||||
| всего | 37 932 | 36 039 | 72 027 | 78 814 |
| независимых | 7507 | 6427 | 7941 | 12 059 |
| с I > 2σ(I) | 7302 | 5652 | 7384 | 10 279 |
| Rint | 0.0274 | 0.0304 | 0.0323 | 0.0326 |
| Число параметров | 447 | 395 | 398 | 396 |
| S | 1.054 | 1.072 | 1.065 | 1.158 |
| R-факторы: для F2 > 2 σ(F2) | ||||
| R1, wR1 | 0.0173, 0.0447 | 0.0286, 0.0684 | 0.0222, 0.0582 | 0.0382, 0.0866 |
| R2, wR2 | 0.0179, 0.0450 | 0.0356, 0.0714 | 0.0252, 0.0592 | 0.0488, 0.0910 |
| Δρmin/Δρmax, э Å–3 | –0.433/0.509 | –0.408/0.508 | –0.596/0.521 | –0.641/0.954 |
| CCDC | 1 908 018 | 1 908 016 | 1 908 019 | 1 908 022 |
| Степень подобия КП атома металла эталонным полиэдрам: | ||||
| Тригональная бипирамида | 0.36364(10) | |||
| Тетрагональная пирамида | 0.19053(5) | |||
| Октаэдр | 0.5954(2) | 0.58295(16) | 0.5873(2) | |
| Программы | CrysAlisPro [27], SHELX2014 [28], WinGX [29], VESTA3.0 [30] | |||
Элементный анализ полученных кристаллов проводили рентгенофлуоресцентным методом с использованием рентгенофлуоресцентного спектрометра Innov-X Alpha-2000 (США), спектрофотометрическим безреагентным методом с помощью спектрофотометра СФ-56 по методике [31] и комплексонометрическим титрованием по ГОСТ 10398-76. За результат количественного анализа принимали среднее значение концентраций, полученных тремя независимыми методами [26].
Рентгенофазовый анализ проводили на дифрактометре ДРОН-6 (FeKα-излучение, λKα1 = 1.93597, λKα1 = 1.93991 Å). Содержание триклинной и моноклинной кристаллических фаз определяли методом Ритвельда.
Рентгенофотоэлектронные (РФЭ) спектры слабосвязанных электронов получали на отечественном рентгеноэлектронном спектрометре ЭМС-3 (УдмФИЦ УрО РАН) [32] с магнитным энергоанализатором при возбуждении AlKα-излучением (hν = 1486.6 эВ). Тонкие слои порошков (размер зерен менее 10 мкм) кристаллических продуктов наносили на подложку из пиролитического графита. Калибровку шкалы энергии связи проводили по центру тяжести линии C1s (энергия связи Eсв = 284.5 эВ). Спектры электронов остовных уровней получали на спектрометре SPECS с полусферическим электростатическим энергоанализатором Phoibos-150 (Deutschland) при возбуждении излучением MgKα (hν = 1253.6 эВ). Калибровку прибора осуществляли по спектру золота (99.9%), ширина на половине высоты каждой линии дублета Au4f составила 1.2 эВ. Образцы измельченных кристаллических продуктов впрессовывали в подложку из индия (99.9%). Регистрировали спектры остовных уровней Ni3s, Cu3s, P2p, P2s, N1s, O1s, Ni2p и Cu2p. Калибровку шкалы энергии связи проводили по линии In3d5/2 (энергия связи Eсв = 444 эВ). Для статистической обработки полученных спектров использовали программу Fityk 0.9.8 [33].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Полученные кристаллические продукты можно отнести к двум фазам: триклинной (с высоким содержанием меди) и моноклинной (с высоким содержанием никеля). В табл. 2 приведены результаты элементного и фазового анализов, полученные разными методами. Фаза, богатая медью, соответствует формуле [(Cu,Ni){N(CH2PO3)3}]Na4 · 13H2O и обнаруживается в образцах при атомной доле меди в общем содержании металлов-комплексообразователей (меди и никеля) в растворе xCu(р-р) в диапазоне 7/32–1. Основные межатомные расстояния и валентные углы триклинных фаз, полученных в серии опытов, приведены в табл. 3.
Таблица 2.
Результаты анализа кристаллических продуктов, образующихся при различной атомной доле меди в растворе
| Опыт | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Элементный состав комплекса в растворе, ат. % | |||||||||||
| Cu | 100.00 | 75.00 | 50.00 | 37.50 | 31.25 | 28.13 | 25.00 | 21.88 | 18.75 | 12.50 | 0.00 |
| Ni | 0.00 | 25.00 | 50.00 | 62.50 | 68.75 | 71.87 | 75.00 | 78.12 | 81.25 | 87.50 | 100.00 |
| Атомная доля Cu в растворе | 1 | 3/4 | 1/2 | 3/8 | 5/16 | 9/32 | 1/4 | 7/32 | 3/16 | 1/8 | 0 |
| Элементный состав кристаллического продукта, ат. % | |||||||||||
| По данным рентгенофлуоресцентного анализа | |||||||||||
| Cu | 100.00 | 92.61 | 81.93 | 67.44 | 55.04 | 36.11 | 21.77 | 13.22 | 6.52 | 5.19 | 0.00 |
| Ni | 0.00 | 7.39 | 18.07 | 32.56 | 44.96 | 63.89 | 78.23 | 86.78 | 93.48 | 94.81 | 100.00 |
| По данным спектрофотометрического определения | |||||||||||
| Cu | 100.0 | 93.2 | 80.4 | 66.2 | 54.7 | 34.6 | 22.6 | 9.4 | 6.1 | 2.5 | 0.0 |
| Ni | 0.0 | 6.8 | 19.6 | 33.8 | 45.3 | 65.4 | 77.4 | 90.6 | 93.9 | 97.5 | 100.0 |
| По данным комплексонометрического определения | |||||||||||
| Cu | 100.0 | 92.5 | 76.6 | 63.4 | 54.2 | 33.3 | 22.0 | 11.9 | 7.8 | 2.9 | 0.0 |
| Ni | 0.0 | 7.5 | 23.4 | 36.6 | 45.8 | 66.7 | 78.0 | 88.1 | 92.2 | 97.1 | 100.0 |
| Средние значения | |||||||||||
| Cu | 100.0 | 92.8 | 79.6 | 65.7 | 54.7 | 34.7 | 22.1 | 11.5 | 6.8 | 3.5 | 0.0 |
| Ni | 0.0 | 7.2 | 20.4 | 34.3 | 45.3 | 65.3 | 77.9 | 88.5 | 93.2 | 96.5 | 100.0 |
| Фазовый состав кристаллического продукта, мол. % | |||||||||||
| Триклинная | 100.0 | 95.0 | 94.5 | 83.8 | 81.3 | 45.3 | 37.8 | 4.2 | 5.6 | 8.0 | 0.0 |
| Моноклинная | 0.0 | 5.0 | 5.5 | 16.2 | 18.7 | 54.7 | 62.2 | 95.8 | 94.4 | 92.0 | 100.0 |
| Элементный состав триклинной фазы, ат. % (расчет) | |||||||||||
| Cu | 100.0 | 97.7 | 84.3 | 78.4 | 67.2 | ||||||
| Ni | 0.0 | 2.3 | 15.7 | 21.6 | 32.8 |
Таблица 3.
Основные межатомные расстояния d, валентные углы ω и заселенность разупорядоченных позиций D в структурах триклинных фаз [(Cu,Ni){N(CH2PO3)3}]Na4 ·13H2O с различным содержанием Ni
| Опыт | 1 | 2 | 3 | 4 | 7 | 8 |
|---|---|---|---|---|---|---|
| Содержание Ni, ат. % | 0.0 | 2.3 | 15.7 | 21.6 | – | – |
| Связь | d, Å | |||||
| M–N1 | 2.0111(10) | 2.0117(8) | 2.0218(7) | 2.0322(8) | 2.0318(11) | 2.0268(7) |
| M–O3А | 2.0088(8) | 2.0076(8) | 2.0101(7) | 2.0166(8) | 2.0091(9) | 2.0122(6) |
| M–O4* | 1.9263(8) | 1.9285(7) | 1.9397(6) | 1.9541(7) | 1.9560(9) | 1.9474(6) |
| M–O4 | 2.1933(8) | 2.1708(7) | 2.1511(6) | 2.1329(7) | 2.1272(8) | 2.1428(6) |
| M–O9 | 1.9730(8) | 1.9722(7) | 1.9767(6) | 1.9831(7) | 1.9777(8) | 1.9770(6) |
| N–C | 1.4944(14)–1.4973(14) | 1.4877(12)–1.4900(11) | 1.4879(11)–1.4916(11) | 1.4932(13)–1.4966(12) | 1.4924(15)–1.4962(15) | 1.4921(11)–1.4957(10) |
| C–P | 1.8239(12)–1.8501(12) | 1.8207(9)–1.8409(10) | 1.8236(9)–1.8446(9) | 1.8290(10)–1.8502(11) | 1.8272(13)–1.8492(12) | 1.8273(8)–1.8513(9) |
| P–O(M) | 1.5455(9)–1.5533(9) | 1.5413(7)–1.5435(8) | 1.5450(7)–1.5478(8) | 1.5498(8)–1.5505(7) | 1.5480(10)–1.5521(9) | 1.5490(6)–1.5523(6) |
| P–O | 1.5104(8)–1.5246(8) | 1.5024(7)–1.5149(7) | 1.474(15)–1.525(14) | 1.474(14)–1.5226(8) | 1.5104(8)–1.5251(9) | 1.5157(7)–1.5250(7) |
| Na1–O | 2.3802(9)–2.5428(11) | 2.3503(8)–2.6037(11) | 2.3549(8)–2.6083(11) | 2.3978(9)–2.5858(13) | 2.3806(10)–2.5471(11) | 2.3812(7)–2.5469(8) |
| Na2–O | 2.3427(10)–2.5762(10) | 2.3895(8)–2.5740(12) | 2.3909(8)–2.5814(12) | 2.3867(12)–2.6314(14) | 2.3456(10)–2.5766(11) | 2.3438(7)–2.5776(8) |
| Na3–O | 2.3092(11)–2.4886(9) | 2.3089(11)–2.4162(12) | 2.3127(11)–2.4189(11) | 2.3208(11)–2.4203(13) | 2.3044(11)–2.4198(11) | 2.3068(8)–2.4186(8) |
| Na4–O | 2.3726(10)–2.6208(11) | 2.3737(11)–2.6201(13) | 2.3784(10)–2.6238(13) | 2.3632(9)–2.6128(12) | 2.3775(11)–2.6252(11) | 2.3756(8)–2.6236(8) |
| Углы | ω, град | |||||
| N1–M–O4* | 168.59(4) | 168.67(3) | 168.96(4) | 169.24(4) | 169.73(4) | 169.43(4) |
| O3A–M–O4 | 101.55(3) | 102.54(4) | 102.40(4) | 102.24(5) | 100.98(4) | 101.20(3) |
| O4–M–O9 | 120.43(3) | 121.35(3) | 122.33(3) | 123.06(4) | 123.36(4) | 122.58(3) |
| O3A–M–O9 | 137.20(3) | 135.30(4) | 134.50(4) | 133.93(4) | 134.88(4) | 135.45(3) |
| O3A–M–O3B | – | 18.9(9) | 20.6(6) | 21.3(5) | – | – |
| Позиции атомов O1, O2, O3 | D, % | |||||
| A | 100.00 | 95.6 | 94.3 | 93.3 | 100.00 | 100.00 |
| B | – | 4.4 | 5.7 | 6.7 | – | – |
Строение внутренней координационной сферы металла в этой фазе (рис. 1а) сходно с ранее исследованным комплексом [Cu{N(CH2PO3)3}]Na4 · 8½H2O [6], но имеет некоторые характерные особенности. Координационный полиэдр атома металла – ТБП; в плоскости ее основания находятся атомы кислорода различных PO3-групп молекулы лиганда, в одной вершине – атом азота, в противоположной – атом кислорода соседней молекулы лиганда. Конформация молекулы NTP псевдотригональная; межатомные расстояния и валентные углы во всех трех ее CH2PO3-ветвях близки друг к другу: N–C = 1.4877(12)–1.4973(14), C–P = = 1.8207(9)–1.8513(9), P–O(M) = 1.5413(7)–1.5533(9) Å, N–C–P = 109.39(8)–112.64(8)°. Эта конформация близка к конформации молекулы свободной NTP [34].
Рис. 1.
Структура внутренней координационной сферы (а) и кристаллическая упаковка (б) комплекса в триклинной фазе (с преобладанием меди). Атомы кислорода O1, O2, O3 заселяют разупорядоченные позиции. Звездочкой отмечена симметрично-эквивалентная позиция –x, –y, –z.
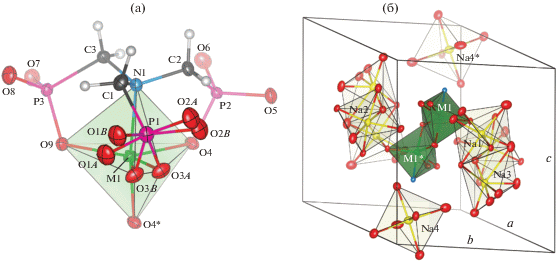
В триклинной фазе, содержащей примесь Ni, атомы кислорода O1, O2 и O3 одной из PO3-групп молекулы лиганда заселяют по две разупорядоченные позиции, отличающихся поворотом PO3-группы вокруг связи P–C на угол в среднем 26.5°; заселенность позиций A и B для этих атомов приведена в табл. 3. Геометрический параметр тригональности τ [35] координационной сферы атома металла для триклинной фазы при заселении кислородом позиции A составляет в среднем 0.573, а при заселении кислородом позиции B – 0.773 (значение τ = 0 соответствует тетрагонально-пирамидальной конфигурации, а τ = 1 – ТБП). Для чисто медного комплекса (по данным [6] и в настоящем исследовании при xCu(р-р) = 1) τ = 0.509. Таким образом, замещение части атомов Cu атомами Ni приводит к повороту одной из PO3-групп, смещению части атомов кислорода и формированию конфигурации, более близкой к ТБП, чем конфигурация, присущая чисто медному комплексу.
Кристаллическая структура комплекса [(Cu,Ni){N(CH2PO3)3}]Na4 · 13H2O в триклинной фазе островная (рис. 1б). Внешняя координационная сфера представлена трехмерной связью КП ионов Na+, в вершинах которых находятся молекулы кристаллизационной воды. Полиэдры ионов Na1, Na2 и Na4 близки к октаэдрам (степень подобия, рассчитанная по методике [9, 36], составляет Φ = 0.38–0.48). Координационный полиэдр иона Na3 – искаженная тетрагональная пирамида (Φ = 0.5480(5)); с учетом атома кислорода O6 (Na3–O6 = 3.0224(14) Å) КП Na3 может быть достроен до сильно искаженного октаэдра (Φ = 0.043(3)). Одна из молекул кристаллизационной воды (O13) заселяет две близкие разупорядоченные позиции. Две молекулы воды (O21 и O22) являются сольватными.
Вторая фаза, никельсодержащая, соответствует формуле [Ni(H2O){N(CH2PO3)3}]Na4 · 11H2O, относится к моноклинной сингонии и содержит лишь незначительную примесь меди; количественно определить содержание меди в моноклинной фазе xCu(M) не удалось. Эта фаза обнаруживается в образцах, полученных при xCu(р-р) в интервале 0–5/16. Основные межатомные расстояния и валентные углы полученных триклинных фаз приведены в табл. 4.
Таблица 4.
Основные межатомные расстояния d и валентные углы ω в структуре моноклинной фазы [Ni(H2O){N(CH2PO3)3}]Na4 · 11H2O
| Опыт | 5 | 6 | 7 | 9 | 10 | 11 |
|---|---|---|---|---|---|---|
| Связь | d, Å | |||||
| M–N1 | 2.1025(16) | 2.1008(12) | 2.1027(12) | 2.0986(13) | 2.1056(9) | 2.1077(11) |
| M–O2* | 2.0474(14) | 2.0471(11) | 2.0440(10) | 2.0472(11) | 2.0472(8) | 2.0525(9) |
| M–O2 | 2.0742(14) | 2.0746(11) | 2.0775(10) | 2.0728(12) | 2.0713(8) | 2.0645(10) |
| M–O4 | 2.0893(14) | 2.0817(11) | 2.0825(10) | 2.0818(12) | 2.0821(7) | 2.0854(10) |
| M–O9 | 2.0823(14) | 2.0881(11) | 2.0798(10) | 2.0858(12) | 2.0843(8) | 2.0909(10) |
| M–O10W | 2.1012(17) | 2.1043(14) | 2.1065(12) | 2.1013(14) | 2.1006(8) | 2.0958(12) |
| N–C | 1.487(2)–1.503(3) | 1.4885(19)–1.5045(19) | 1.4900(17)–1.5084(18) | 1.488(2)–1.505(2) | 1.4897(13)–1.5085(13) | 1.4850(17)–1.5034(16) |
| C–P | 1.824(2)–1.847(2) | 1.8238(15)–1.8520(16) | 1.8225(14)–1.8517(15) | 1.8217(17)–1.8473(17) | 1.8251(10)–1.8536(10) | 1.8254(13)–1.8521(13) |
| P–O(M) | 1.5274(16)–1.5449(15) | 1.5283(12)–1.5447(11) | 1.5331(11)–1.5486(10) | 1.5269(12)–1.5439(12) | 1.5330(8)–1.5488(8) | 1.5303(11)–1.5462(10) |
| P–O | 1.5108(15)–1.5264(15) | 1.5107(12)–1.5256(12) | 1.5185(10)–5310(11) | 1.5103(12)–1.5261(12) | 1.5191(8)–1.5337(8) | 1.5140(11)–1.5282(11) |
| Na1–O | 2.3488(17)–2.7127(18) | 2.3472(13)–2.7133(14) | 2.3402(12)–2.7184(12) | 2.3473(14)–2.7127(14) | 2.3424(9)–2.7175(9) | 2.3473(12)–2.7011(13) |
| Na2–O | 2.3411(17)–2.5937(18) | 2.3418(13)–2.5964(14) | 2.3380(12)–2.5793(12) | 2.3403(13)–2.5954(15) | 2.3390(9)–2.5773(9) | 2.3401(12)–2.5972(13) |
| Na3–O | 2.3449(17)–2.823(2) | 2.3427(13)–2.8180(17) | 2.3301(11)–2.7805(13) | 2.3402(14)–2.8194(17) | 2.3441(9)–2.7826(10) | 2.3424(13)–2.8222(16) |
| Na4–O | 2.3221(17)–2.369(2) | 2.3259(13)–2.3710(17) | 2.3224(11)–2.3557(13) | 2.3235(14)–2.3700(17) | 2.3228(9)–2.3566(10) | 2.3202(12)–2.3739(16) |
| Na5–O | 2.361(2)–2.618(2) | 2.3659(17)–2.6140(19) | 2.3562(12)–2.5935(14) | 2.3623(18)–2.615(2) | 2.3592(9)–2.5922(10) | 2.3616(17)–2.6078(19) |
| Углы | ω, град | |||||
| N1–M–O2* | 167.91(8) | 167.86(6) | 167.37(6) | 167.92(6) | 167.34(5) | 167.97(5) |
| O4–M–O9 | 172.02(6) | 172.04(5) | 172.28(5) | 171.98(5) | 172.24(4) | 172.07(4) |
| O2–M–O10W | 178.95(7) | 178.89(6) | 178.94(5) | 178.97(6) | 178.89(4) | 178.78(5) |
| O2–M–O2* | 80.18(7) | 79.96(6) | 79.65(6) | 80.10(6) | 79.66(5) | 80.09(5) |
Структура никельсодержащей моноклинной фазы очень близка к структуре ранее изученного нитрило-трис-метиленфосфонатного комплекса Ni [7]. Координационный полиэдр никеля – октаэдр, в трех меридионально расположенных вершинах которого находятся атомы кислорода различных PO3-групп молекулы лиганда, а в трех других вершинах – атом азота, молекула воды и атом кислорода соседней молекулы лиганда (рис. 2а). Молекула NTP имеет плоскость псевдосимметрии: две ее CH2PO3-ветви зеркально симметричны относительно плоскости, в которой лежит третья CH2PO3-ветвь. Межатомные расстояния и валентные углы в CH2PO3-ветвях заметно различаются: в крайних ветвях N–C = 1.487(2)–1.4900(17), C–P = 1.8217(17)–1.8254(13), P–O(M) = = 1.5269(12)–1.5343(10) Å, N–C–P = 111.12(9)–111.93(8)°, а в средней ветви N–C = 1.503(3)–1.5085(13), C–P = 1.8473(17)–1.8536(10), P–O(M) = = 1.5447(11)–1.5488(8) Å, N–C–P = 117.49(7)–117.73(11)°.
Рис. 2.
Структура внутренней координационной сферы (а) и кристаллическая упаковка (б) никелевого комплекса в моноклинной фазе. Звездочкой отмечена симметрично-эквивалентная позиция –x, –y, –z.
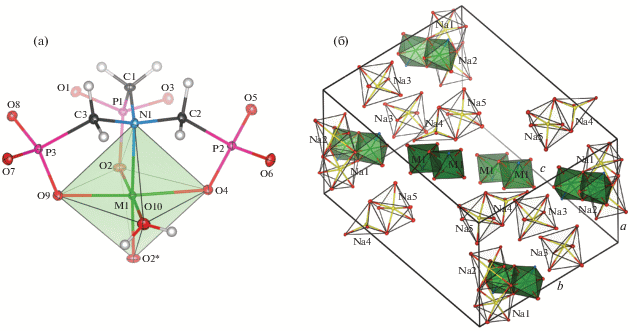
Кристаллическая упаковка слоистая (рис. 2б); во внешней координационной сфере присутствуют ионы Na+, в вершинах КП находятся молекулы кристаллизационной воды, связывающие их в двумерные слои. Координационный полиэдр иона Na1 – слабо искаженный тетраэдр (Φ = = 0.6435(2)), ионов Na2 и Na5 – искаженные октаэдры с Φ = 0.12912(9) и 0.27398(13) соответственно, иона Na4 – искаженная тетрагональная пирамида (Φ = 0.5792(8)). Координационный полиэдр иона Na3 – асимметричный семивершинник, который можно рассматривать как сильно искаженную пентагональную бипирамиду (Φ = = 0.04077(3)). Ионы Na1 и Na5 находятся в положениях с кратностью 1/2, вследствие чего общее количество ионов Na+ на одну формульную единицу равно четырем. Сольватные молекулы воды в моноклинной фазе отсутствуют.
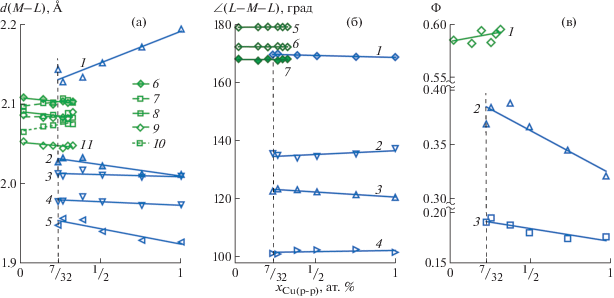
На рис. 3 графически представлена зависимость характерных межатомных расстояний, валентных углов и степеней подобия Φ КП атома металла эталонным полиэдрам от xCu(р-р) для триклинной и моноклинной фаз. Можно видеть, что при изменении xCu(р-р) от 1 до 7/32 структурные параметры триклинной фазы претерпевают существенные изменения. Это обусловлено, по-видимому, замещением части атомов Cu с ионным радиусом (при КЧ = 5) 0.65 Å атомами Ni с ионным радиусом 0.63 Å [37]. Однако только расстояние M–O4 существенно уменьшается (от 2.1933(8) до 2.1272(8) Å), а остальные расстояния металл–лиганд, напротив, увеличиваются. Валентные углы при атоме металла при частичном замещении меди никелем изменяются противоположным образом. Структурные параметры моноклинной фазы при изменении xCu(р-р), напротив, изменяются незначительно. Это свидетельствует об отсутствии существенного замещения Ni на Cu в структуре моноклинной фазы. Степень подобия Φ КП атома металла эталонным полиэдрам существенно зависит от xCu(р-р) как в случае триклинной, так и моноклинной фаз. В окрестности точки перехода (xCu(р-р) = 1/4) степени подобия максимальны для обеих фаз. Интересно, что для КП атома металла в триклинной фазе при приближении к точке перехода возрастает степень подобия как ТБП, так и тетрагональной пирамиде.
Рис. 3.
Зависимость структурных параметров триклинной и моноклинной фаз от xCu(р-р): а – межатомные расстояния для триклинной фазы: M–O4 (1), M–N (2),M–O3A (3), M–O9 (4), M–O4* (5); для моноклинной фазы: M–N (6), M–O10W (7), M–O9 (8), M–O4 (9), M–O2 (10), M–O2* (11); б – валентные углы для триклинной фазы: N–M–O4* (1), O3A–M–O9 (2), O4–M–O9 (3), O3A–M–O4 (4); для моноклинной фазы: O2–M–O10W (5), O4–M–O9 (6), N–M–O2* (7); в – степени подобия Φ координационного полиэдра атома металла эталонным полиэдрам: октаэдру в моноклинной фазе (1), тригонально-бипирамидальному в триклинной фазе (2), тетрагональной пирамиде в триклинной фазе (3).
Анализ данных табл. 2 показывает, что при xCu(р-р) = 0–3/16 мольная доля триклинной фазы xT не превосходит погрешности метода и продукт представлен практически индивидуальной моноклинной фазой. В области xCu(р-р) = 1/2–1, напротив, мольная доля моноклинной фазы xM пренебрежимо мала. В интервале xCu(р-р) 5/32–3/8 продукт содержит существенные доли обеих фаз. Благодаря тому что замещение никеля медью в моноклинной фазе пренебрежимо мало (xCu(M) ≈ ≈ 0), можно найти атомную долю Cu в триклинной фазе xCu(T). Атомная доля Ni в триклинной фазе xNi(T) = 1 – xCu(T) изменяется от xNi(T) = 0 при xCu(р-р) = 1 до xNi(T) = 32.8 ат. % при xCu(р-р) = 5/16; при меньших значениях xCu(р-р) вычислить xCu(T) и xNi(T) с приемлемой погрешностью не удалось.
На рис. 4 представлены РФЭ-спектры триклинной (кривая 1) и моноклинной (кривая 2) фаз. В области спектра слабосвязанных электронов при Eсв = 0–8 эВ наблюдаются занятые, сильно делокализованные электронные состояния, которые можно рассматривать как комбинацию преимущественно M3d, N2p и O2p. При Eсв = 10–13 эВ наблюдается вклад N2s-состояний, в области Eсв = 15–18 эВ – вклад P3s-состояний. Спектры O2s-состояний (Eсв = 20–28 эВ) заметно различаются для триклинной (кривая 1) и моноклинной (кривая 2) фаз. Для триклинной фазы со средней длиной связи M–O = 2.02 Å существенное перекрывание электронных состояний атомов металла и кислорода приводит к возникновению плеча в области Eсв = 20–22 эВ. В структуре моноклинной фазы со средней длиной связи M–O = 2.08 Å заметное перекрывание электронных состояний отсутствует, что приводит к смещению спектра O2s в область Eсв = 25–28 эВ. Спектр Ni2p обеих фаз представлен спин-орбитальным дублетом с составляющими Ni2p3/2 (Eсв = = 855.9 эВ) и Ni2p1/2 (Eсв = 873.4 эВ), ΔNi2p = = 17.5 эВ, что характерно для координационных соединений Ni(II), например, с ацетилацетоном и биуретом [38, 39]. В спектре Ni2p моноклинной фазы (кривая 2) наблюдается сателлит “встряски” (shake-up) с максимумом при Eсв = 864.3 эВ, а в спектре триклинной фазы (кривая 1) сателлитная структура не наблюдается. Спектр Cu2p триклинной фазы (кривая 1) содержит спин-орбитальный дублет с составляющими Cu2p3/2 (Eсв = = 933.4 эВ) и Cu2p1/2 (Eсв = 953.3 эВ), ΔCu2p = = 19.9 эВ, что типично для координационных соединений Cu(II), в частности, с ацетилацетоном и биуретом [40, 41]. Сателлит “встряски” наблюдается в спектре Cu2p триклинной фазы (кривая 1) при Eсв = 944.4 эВ. В спектре моноклинной фазы (кривая 2) присутствуют лишь следы меди.
Рис. 4.
РФЭ-спектры кристаллов триклинной (1) (опыт 4, xCu(р-р) = 3/8) и моноклинной (2) (опыт 10, xCu(р-р) = 1/8) фаз: а – наиболее характерные фрагменты спектров, б – область спектра Ni3s.
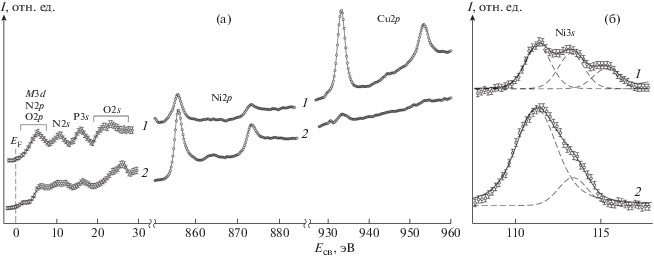
Спектр Ni3s-состояний (рис. 4б) характеризуется мультиплетным расщеплением, обусловленным взаимодействием образующегося в результате ионизации неспаренного Ni3s-электрона с неспаренными электронами незаполненного Ni3d-подуровня. Основная линия Ni3s в спектрах обеих фаз наблюдается при Eсв = 111.3 эВ. В спектре триклинной фазы наблюдается двойное мультиплетное расщепление с максимумами при Eсв = = 113.3 эВ (ΔNi3s = 2.0 эВ) и 115.3 эВ (ΔNi3s = 4.0 эВ). Вероятно, это соответствует двум возможным вариантам окружения атома Ni в структуре триклинной фазы:
В спектре моноклинной фазы для линии Ni3s наблюдается только составляющая с максимумом Eсв = 113.4 эВ (ΔNi3s = 2.1 эВ), что указывает на единственное возможное окружение атома Ni. Это согласуется с выводом о практически полном отсутствии замещения атомов Ni на Cu в моноклинной фазе.
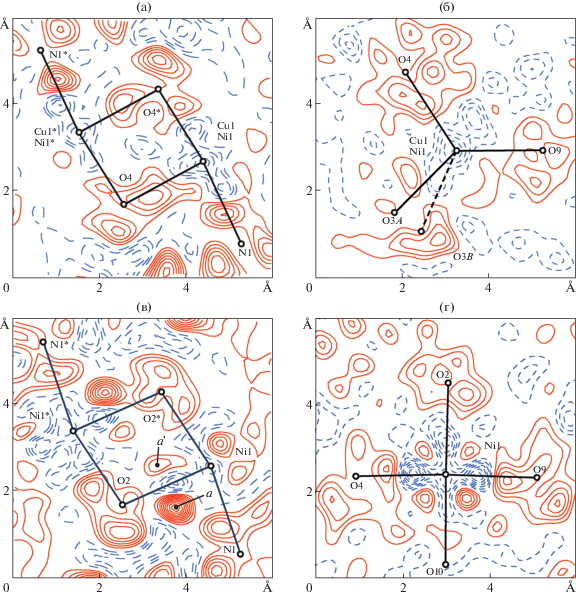
Карты распределения разностной электронной плотности в окрестности атома металла в структурах триклинной и моноклинной фаз приведены на рис. 5. Можно наблюдать различный характер химической связи M ← O(P) в фазах с различной структурой. В триклинной фазе (рис. 5a, 5б) область повышенной электронной плотности охватывает не менее 60% межатомного расстояния M–O, а максимум разностной электронной плотности локализован в средней части межатомной оси M–O, что свидетельствует о значительном вкладе ковалентной составляющей химической связи. В моноклинной фазе (рис. 5в, 5г), напротив, область повышенной электронной плотности атомов O и N охватывает не более 50% длины связи M ← O(P), а максимум разностной электронной плотности соответствует положению центральной части атома кислорода, что указывает на больший вклад ионной связи. Это согласуется с отмеченными выше различиями РФЭ-спектров в области O2s-состояний. В то же время по обе стороны от линии связи M ← O(P) в структуре моноклинной фазы находятся области повышенной электронной плотности (a и a' на рис. 5в), которые могут свидетельствовать о вкладе ковалентного π-связывания M–O вследствие некоторого перекрывания M3dxy- и O2p-состояний.
Рис. 5.
Карты распределения разностной электронной плотности Δρ = ρэксп – ρрасч по данным рентгеноструктурного анализа в кристаллах: а, б – триклинной фазы (опыт 4, xCu(р-р) = 3/8); в, г – моноклинной фазы (опыт 10, xCu(р-р) = = 1/8). Шаг изолиний 0.05 э/Å3; положительная электронная плотность – сплошные линии, отрицательная – штриховые.
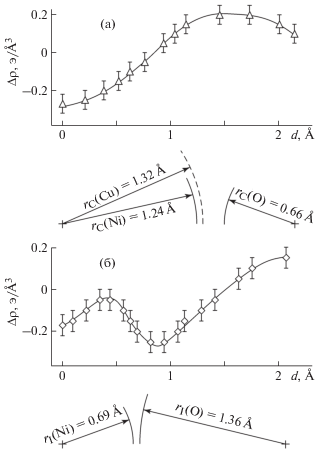
Графики распределения электронной плотности вдоль M–O (рис. 6), построенные в проекционной связи со схемой расположения атомных радиусов [37, 42], подтверждают отмеченные различия в природе координационной связи M ← ← O(P) в структурах триклинной и моноклинной фаз. Связь M ← O(P) в триклинной фазе (рис. 6а) может быть охарактеризована как ковалентная, о чем свидетельствует максимум разностной электронной плотности в области сближения ковалентных радиусов атомов металла и кислорода [42]. В структуре моноклинной фазы (рис. 6б) наблюдается минимум разностной электронной плотности в области контакта ионных радиусов [37], что позволяет характеризовать связь M ← ← O(P) как ионную. По-видимому, это различие в структуре химической связи M←O(P) обусловлено как различием межатомных расстояний M–O в триклинной и моноклинной фазах, так и различной симметрией ближнего окружения атома металла.
Рис. 6.
Профили разностной электронной плотности Δρ = ρэксп – ρрасч по данным рентгеноструктурного анализа вдоль межатомных связей: а – M–O4 триклинной фазы (опыт 4, xCu(р-р) = 3/8); б – Ni–O2 моноклинной фазы (опыт 10, xCu(р-р) = 1/8). Графики приведены в проекционной связи со схемами расположения ковалентных (а) и ионных (б) радиусов атомов металлов и кислорода.
ВЫВОДЫ
Исследована структура фаз, образующихся при кристаллизации гетерометаллических комплексов NTP [CuxNi(1 – x){N(CH2PO3)3}]Na4 · nH2O (x = 0–1) из водных растворов. Различия в структурах триклинной и моноклинной фаз приводят к тому, что для триклинной фазы характерна преимущественно ковалентная координационная связь M ← O(P), а в случае моноклинной фазы связь ионная с небольшим вкладом ковалентного π-связывания M3dxy- и O2p-состояний.
Рентгеноструктурные исследования проведены в рамках базовой части государственного задания высшим учебным заведениям и научным организациям в сфере научной деятельности (проект № 3.6502.2017/БЧ). Спектроскопические исследования выполнены в рамках государственного задания Министерства науки и высшего образования РФ (№ гос. регистрации АААА-А19-119093090055-2) с использованием оборудования ЦКП “Центр физических и физико-химических методов анализа, исследования свойств и характеристик поверхности, наноструктур, материалов и изделий” УдмФИЦ УрО РАН, поддержанного Минобрнауки в рамках ФЦП “Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы” (проект RFMEFI62119X0035).
Список литературы
Cabeza A., Ouyang X., Sharma C.V.K. et al. // Inorg. Chem. 2002. V. 41. P. 2325. https://doi.org/10.1021/ic0110373
Demadis K.D., Katarachia S.D., Koutmos M. // Inorg. Chem. Commun. 2005. V. 8. P. 254. https://doi.org/10.1016/j.inoche.2004.12.019
Cunha-Silva L., Mafra L., Ananias D. et al. // Chem. Mater. 2007. V. 19. P. 3527. https://doi.org/10.1021/cm070596q
Bazaga-García M., Angeli G.K., Papathanasiou K.E. et al. // Inorg. Chem. 2016. V. 55. P. 7414. https://doi.org/10.1021/acs.inorgchem.6b00570
Сомов Н.В., Чаусов Ф.Ф. // Кристаллография. 2014. Т. 59. № 1. С. 71.
Сомов Н.В., Чаусов Ф.Ф. // Кристаллография. 2015. Т. 60. № 2. С. 233.
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М., Федотова И.В. // Кристаллография. 2016. Т. 61. № 2. С. 238.
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М., Федотова И.В. // Координац. химия. 2015. Т. 41. № 12. С. 729.
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. и др. // Кристаллография. 2017. Т. 62. № 6. С. 896.
Сомов Н.В., Чаусов Ф.Ф., Ломова Н.В. и др. // Координац. химия. 2017. Т. 43. № 9. С. 545.
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. и др. // Координац. химия. 2017. Т. 43. № 12. С. 765.
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. // Кристаллография. 2016. Т. 61. № 3. С. 400.
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. // Кристаллография. 2016. Т. 61. № 4. С. 583.
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. и др. // Координац. химия. 2017. Т. 43. С. 369.
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. и др. // Кристаллография. 2018. Т. 63. № 6. С. 894.
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. и др. // Кристаллография. 2018. Т. 63. № 3. С. 415.
Кузнецов Ю.И. // Успехи химии. 2004. Т. 73. № 1. С. 79.
Кузнецов Ю.И. // Физикохимия поверхности и защита материалов. 2002. Т. 38. № 2. С. 122.
Ломова Н.В., Чаусов Ф.Ф., Шабанова И.Н. // Изв. РАН. Сер. физ. 2018. Т. 82. № 7. С. 975.
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия, 1988. 544 с.
Stewart J.M., Lingafelter E.C. // Acta Cryst. 1959. V. 12. № 11. P. 842. https://doi.org/10.1107/s0365110x59002444
McDonald J.C., Luo T.-J.M., Palmore G.T.R. // Crystal. Growth Design. 2004. V. 4. № 6. P. 1203. https://doi.org/10.1021/cg049974j
Mao L., Rettig S.J., Thompson R.C. Et al. // Can. J. Chem. 2011. V. 74. P. 433. https://doi.org/10.1139/v96-047
Берсукер И.Б. Электронное строение и свойства координационных соединений. Введение в теорию. Л.: Химия, 1976. 352 с.
Бальхаузен К. Введение в теорию поля лигандов. М.: Мир, 1964. 360 с.
Chausov F.F., Lomova N.V., Somov N.V. et al. // J. Cryst. Growth. 2019. V. 524. P. 125187. https://doi.org/10.1016/j.jcrysgro.2019.125187
Rigaku (2016). CrysAlis PRO. Rigaku Oxford Diffraction, Yarnton, Oxfordshire, England.
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. P. 112. https://doi.org/10.1107/S0108767307043930
Farrugia L.J. // J. Appl. Cryst. 1999. V. 32. P. 837. https://doi.org/10.1107/S0021889899006020
Momma K., Izumi F. // J. Appl. Cryst. 2011. V. 44. P. 1272. https://doi.org/10.1107/S0021889811038970
Свиридова Е.Н., Иванова Н.В. // Вестн. КемГУ. 2013. Т. 3. № 3. С. 108.
Trapeznikov V.A., Shabanova I.N., Kholzakov A.V., Ponomaryov A.G. // J. Electron Spectrosc. Related Phenomena. 2004. V. 137. P. 383. https://doi.org/10.1016/j.elspec.2004.02.115
Wojdyr M. // J. Appl. Cryst. 2010. V. 43. P. 1126. https://doi.org/10.1107/S0021889810030499
Daly J.J., Wheatley P.J. // J. Chem. Soc. A. 1967. P. 212. https://doi.org/10.1039/J19670000212
Addison A.W., Rao T.N., Reedijk J. et al. // J. Chem. Soc., Dalton Trans. 1984. № 7. P. 1349. https://doi.org/10.1039/dt9840001349
Somov N.V., Andreev P.V. // Crystallography Reports. 2018. V. 63. № 1. P. 32. https://doi.org/10.1134/S1063774518010170
Shannon R.D. // Acta Cryst. A. 1976. V. 32. P. 751. https://doi.org/10.1107/S0567739476001551
Tolman C.A., Riggs W.M., Linn W.J. et al. // Inorg. Chem. 1973. V. 12. № 12. P. 2770. https://doi.org/10.1021/ic50130a006
Yoshida T., Yamasaki K. // Bull. Chem. Soc. Jpn. 1981. V. 54. № 3. P. 935. https://doi.org/10.1246/bcsj.54.935
Brand P., Freiser H. // Analyt. Chem. 1974. V. 46. № 8. P. 1147. https://doi.org/10.1021/ac60344a010
Yoshida T., Yamasak, K., Sawada S. // Bull. Chem. Soc. Jpn. 1978. V. 51. № 5. P. 1561. https://doi.org/10.1246/bcsj.51.1561
Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. P. 2832. https://doi.org/10.1039/b801115j
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография