Кристаллография, 2020, T. 65, № 6, стр. 921-932
Антимикробная активность композиционных гидрогелей в системе поли-N-винилпирролидон–RE(NO3)3 · xH2O (RE – ионы редкоземельных металлов)
Г. М. Кузьмичева 1, *, О. И. Тимаева 2, Н. Н. Новикова 2, С. Н. Якунин 2, А. В. Рогачев 2, Р. Д. Светогоров 2, И. И. Пашкин 1, Р. П. Терехова 3
1 МИРЭА – Российский технологический университет
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
3 Институт хирургии им. А.В. Вишневского Минздрава России
Москва, Россия
* E-mail: galina_kuzmicheva@list.ru
Поступила в редакцию 09.06.2020
После доработки 09.06.2020
Принята к публикации 11.06.2020
Аннотация
Представлены результаты изучения и анализа бактерицидных и бактериостатических свойств (в темноте) солей RE(NO3)3 · xH2O (RE = La, Ce, Gd, Yb, Y) и композиционных гидрогелей с поли-N-винилпирролидоном по отношению к бактериям Escherichia coli, Staphylococcus aureus, Staphylococcus epidermidis, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumonia и грибам Candida albicans. Предложены корреляционные связи зоны задержки роста микроорганизмов с характеристиками объектов. Продемонстрированы на упорядоченных фосфолипидных монослоях (модель биологических мембран) механизмы взаимодействия с клеточной оболочкой бактерий ионов Yb3+ соли Yb(NO3)3 · xH2O, обладающей высокой антимикробной активностью по отношению к Escherichia coli, Staphylococcus aureus, Candida albicans.
ВВЕДЕНИЕ
В отечественной и зарубежной литературе имеется большое количество публикаций, посвященных разработке перспективных подходов к преодолению резистентности микроорганизмов за счет вновь разработанных и синтезированных альтернативных средств с высокой антимикробной активностью. К таким объектам относятся соединения с редкоземельными ионами (RE), которые входят в виде добавок в составы противовоспалительных, регенерирующих, обезболивающих, ранозаживляющих, антимикробных мазей и препаратов, таких как Эплан (регистрационное удостоверение RU.77.99.21.001.Е.002989.02.12), “Кожная броня”, Вилпран, Лантанол [1–5].
Кроме того, соединения с RE используются в профилактической медицине (гидроксиапатит, допированный ионами RE = Gd3+, Yb3+/Tm3+, Eu3+, для диагностики на основе мультимодальной визуализации) [6], в качестве 3D-скаффолдов на дефектах ткани (хитозан-силоксановые сферы с инкорпорированным CeCl3) [7], а также они перспективны как биологически активные вещества, которые влияют на свободно радикальные процессы окисления в тканях и антиоксидантную активность [8].
Настоящие и будущие области применения соединений с RE требуют изучения этих соединений в формах, имеющих отношение к области использования, нахождения корреляционных связей и установления или предложения роли ионов RE в проявлении их функциональных свойств. Научный и практический интерес представляет исследование молекулярных механизмов действия лекарственных препаратов c ионами RE, фармакологическая активность которых определяется не только их составом и строением, но и состоянием функциональных групп в препарате [9].
Цель настоящего исследования – изучить антимикробную активность солей RE(NO3)3 · xH2O (RE = La, Ce, Gd, Yb, Y) как в индивидуальном виде, так и в составе композиционных гидрогелей с поли-N-винилпирролидоном, в отношении широкого круга микроорганизмов и предложить возможные причины реализации свойств.
Данная работа является продолжением цикла работ по исследованию бактерицидных и бактериостатических свойств композитов разной природы (цеолиты, полимеры, гидрогели) с наноразмерными оксидами цинка и оксидами титана (IV) [10–15], а также композиционных гидрогелей на основе поли-N-винилпирролидона (ПВП, (C6H9NO)n) с поликристаллическими солями RE(NO3)3 · xH2O: с RE = La, Gd, Yb [16] и Ce, Y [17]. Причем антимикробная активность солей и композитов с ПВП изучена и представлена только в отношении ограниченного круга микроорганизмов (Staphylococcus aureus, Escherichia coli, Candida albicans), а образцы исследованы методами рентгенографии, малоуглового рентгеновского рассеяния и электронной микроскопии.
МЕТОДИКА ЭКСПЕРИМЕНТА
Объекты исследования. Гидрогели на основе ПВП получены золь-гель технологией из ПВП, сшивающего агента тетраэтоксисилана (ТЭОС, SiC8H20O4) и порошков RE(NO3)3 · xH2O с RE = = La, Се, Gd, Yb и Y. Для этого к 11% водному раствору ПВП добавляли молочную кислоту (катализатор) и ТЭОС с концентрациями 0.01 и 5.04 мас. % соответственно. Смесь перемешивали при комнатной температуре в течение 30 мин и выливали в форму с крышкой. Толщина вылитых смесей составляла 4–6 мм. При получении композиционных гидрогелей ПВП/RE(NO3)3 · xH2O (в дальнейшем будем обозначать их как ПВП/RE) порошки солей RE(NO3)3 · xH2O (далее обозначены как RE) добавляли в количестве 5.59 мас. % до введения ТЭОС. Условия получения гидрогелей ПВП и ПВП/RE одинаковы.
Рентгенографическое изучение солей. Исследования солей RE методом порошковой рентгеновской дифракции проводились на экспериментальной станции Рентгеноструктурного анализа (РСА) Курчатовского источника синхротронного излучения [18] с использованием монохроматического излучения с длиной волны λ = 0.8 Å (энергия фотонов Е = 15 498 эВ), фокусированного на образце размером до 400 мкм. Измерения проводились в геометрии Дебая–Шеррера (на просвет), образец помещался в криопетлю размером 300 мкм и в процессе измерения вращался вокруг горизонтальной оси для усреднения дифрактограмм по ориентациям образца. Регистрация дифракционных картин осуществлялась двумерным позиционно-чувствительным детектором Rayonix SX165, располагавшимся на расстоянии 150 мм от образца под углом 2θ = 29.5° к оси прямого пучка. Время экспозиции составляло 5 мин. Полученные двумерные дифрактограммы интегрировались к одномерному виду (к зависимости I(2θ)) с использованием программы Dionis [19]. Калибровка угловой шкалы детектора и определение аппаратного уширения дифракционных рефлексов осуществлялись за счет измерения поликристаллического стандарта LaB6 (NIST SRM 660a). Определение параметров микроструктуры и размеров элементарной ячейки RE проводилось в программе Jana2006 [20].
Дифференциально-сканирующая калориметрия образцов. Дифференциально-сканирующая калориметрия (ДСК) порошков RE и нативных гидрогелей ПВП/RE проведена на приборе Netzsch DSC 204 (Phoenix, Германия). Навески порошков или гидрогелей помещали в стандартный алюминиевый тигель с проколотой крышкой. Сканирование осуществляли со скоростью 10 град/мин в атмосфере аргона (99.99%) при скорости потока 100 мл/мин в интервале температур от 25 до 600°С. Результаты обрабатывали с помощью программы Netzsch Proteus. Точность определения температуры 0.1°С.
Рентгеновские исследования на поверхности растворов солей. Для проведения экспериментов на поверхности растворов соли Yb(NO3)3 · хH2O формировали фосфолипидные монослои. Для этого использовали 1,2-дипальмитоил-sn-глицеро-3-фосфоглицерин (ДПФГ) и 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин (ДПФЭ) (Sigma). Растворы фосфолипидов (смесь хлороформ/метанол в соотношении 9:1 с концентрацией 0.45 мг/мл) наносили на поверхность раствора соли Yb(NO3)3 · хH2O с концентрацией 10–4 М, pH 6.5. Монослой поджимали до давления π = 25 мН/м, которое во время рентгеновских измерений поддерживалось постоянным. Контрольные измерения проводили на монослоях ДПФГ и ДПФЭ, сформированных на чистой воде. Все растворы были приготовлены с использованием воды высокой степени очистки (сопротивление >18 MОм · см), полученной на установке Millipore Corp. Измерения проводили при комнатной температуре.
В эксперименте использован метод стоячих рентгеновских волн (СРВ) в геометрии полного внешнего отражения (ПВО) [21]. В рамках этого метода наряду с рентгеновским отражением регистрировался выход вторичных излучений, возникающих при неупругом рассеянии рентгеновских лучей в условиях ПВО. Такие измерения позволяют получать информацию о положении атомов определенного сорта вдоль нормали к поверхности из анализа угловых зависимостей интенсивности выхода вторичного излучения. Изменения кристаллической структуры фосфолипидных монослоев фиксировали с помощью метода дифракции рентгеновских лучей в геометрии скользящих углов падения.
Измерения проводили на Курчатовском источнике синхротронного излучения на экспериментальной станции “Ленгмюр”. Во всех экспериментах использовали излучение с энергией 13 кэВ. Спектры флуоресцентного излучения регистрировали кремниевым дрейфовым детектором Vortex EX-90 (SII-Hitachi), расположенным перпендикулярно к поверхности водной субфазы на расстоянии ∼10 мм. Двумерные карты дифракционного рассеяния на фосфолипидных монослоях записывали при использовании линейного позиционно-чувствительного детектора Mythen-1k (Dectris), установленного в вертикальном положении и обеспечивающего параллельное измерение qz-сечений в диапазоне от 0 до 0.8 Å–1. Измерение интенсивности в горизонтальной плоскости рассеяния (qxy-направление) осуществляли угловым сканированием детектором с коллиматором Соллера с угловой апертурой 2 мрад. Для уменьшения рассеяния излучения на воздухе и снижения испарения жидкости измерения (общее время составляло 24 ч) проводили в атмосфере увлажненного гелия.
Антимикробная активность (в темноте). Микробиологические исследования по изучению антимикробной активности (АМА) поликристаллических солей RE, гидрогелей ПВП и ПВП/RE проведены методом “колодцев” в отношении микроорганизмов Staphylococcus aureus, Escherichia coli, Candida albicans, Staphylococcus epidermidis, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae [22]. Взвесь определенного вида микроорганизмов, содержащую 107–108 КОЕ в 1 мл, засевали “газоном” в чашки Петри на агар Мюллера–Хинтона в количестве 0.2 мл. На поверхности агара, засеянного культурами микроорганизмов, делали лунки с помощью тонкостенного цилиндра диаметром 6–8 мм, в которые помещали образцы. Для исследования солей RE их насыпали ровным слоем, а для изучения гидрогелей были вырезаны нативные образцы в виде круга диаметром 13 мм и толщиной 4–6 мм. Далее чашки с испытуемыми образцами помещали в термостат при 37°С на 24 ч. Результаты оценивали по размеру (диаметру) зоны задержки роста микроорганизмов вокруг лунки (величина Д, мм) с помощью линейки, включая диаметр самой лунки.
Степень чувствительности микроорганизмов к исследуемым образцам зависит от величины Д: чем она больше, тем выше чувствительность. По величине зоны задержки роста образцы делятся на четыре группы: Д < 10 мм – отсутствие чувствительности, Д = 11–15 мм – малая чувствительность, Д = 15–25 мм – средняя чувствительность, Д > 25 мм – высокая чувствительность к микроорганизмам [23]. Микробиологические исследования проведены в боксе микробиологической защиты второго класса, оснащенном УФ-лампой и ламинарным потоком воздуха.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
RE(NO3)3 · хH2O (соли). Образцы RE демонстрируют высокую АМА в отношении Staphylococcus aureus, Escherichia coli, Candida albicans (самая высокая), наибольшая из них у RE(NO3)3 · · хH2O c RE = Y и Ce (рис. 1).
Рис. 1.
Диаметр зоны задержки роста микроорганизмов (в темноте) в присутствии солей RE(NO3)3 · хH2O (RE = La, Ce, Gd, Yb и Y): Staphylococcus aureus (1), Escherichia coli (2), Candida albicans (3).
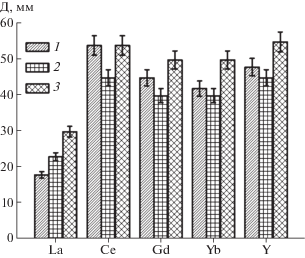
Наблюдается несколько бóльшая активность RE к грамположительной бактерии Staphylococcus aureus, за исключением соли La(NO3)3 · хH2O (La), у которой высокая АМА только в отношении грамотрицательной бактерии Escherichia coli, а к остальным микроорганизмам эта соль в твердом виде проявляет среднюю чувствительность (рис. 1). Величина Д для Escherichia coli и Candida albicans убывает в ряду образцов RE(NO3)3 · xH2O с Y > Ce > Gd ≈ Yb > La, а для Staphylococcus aureus в другом ряду Ce > Y > Gd > Yb > La (рис. 1). Согласно [24] антимикробная активность по отношению к грибам Rhizopus nigricans, Saccharomyces cerevisiae, Aspergillus niger, Neurospora sitophila, Coprinus sp. снижается в ряду Lu > Y > Er > Ho > Dy > > Eu > Nd > Ce, что согласуется с нашими данными для другого вида грибов Candida albicans.
Причину разного поведения АМА солей RE нужно искать как в характеристиках самих образцов, так и в природе и строении микроорганизмов.
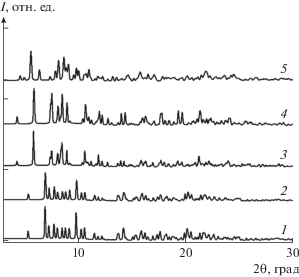
Анализ дифракционных картин RE (рис. 2) и результаты расчета структурных параметров (табл. 1) свидетельствуют о том, что поликристаллические соли по типу структуры разделяются на три группы: с RE = La и Ce (первая группа), RE = = Gd и Y (вторая), RE = Yb (третья), причем образец Yb(NO3)3 · xH2O неоднофазный.
Таблица 1.
Результаты рентгенографического изучения образцов RE(NO3) · xH2O
| Характеристики RE(NO3)3 · xH2O | RE | ||||
|---|---|---|---|---|---|
| La | Ce | Gd | Y | Yb | |
| Пр. гр. | P$\bar {1}$ | ||||
| a, Å | 8.92730(15) | 8.9061(2) | 6.7410(2) | 6.72302(17) | 6.6100(6) |
| b, Å | 10.71215(17) | 10.6905(3) | 9.1338(2) | 9.0697(2) | 9.6483(11) |
| c, Å | 6.65303(13) | 6.6259(2) | 11.6453(3) | 11.5779(3) | 10.5472(10) |
| α, град | 78.8714(13) | 78.811(2) | 70.0476(18) | 70.4703(15) | 63.401(7) |
| β, град | 77.9173(13) | 77.808(2) | 88.8375(19) | 88.8505(17) | 84.735(6) |
| γ, град | 87.8848(13) | 87.891(2) | 69.2312(17) | 69.0980(13) | 75.947(7) |
| V, Å3 | 610.436(19) | 604.90(3) | 626.03(3) | 617.61(3) | 583.35(11) |
| Средний размер кристаллитов по Шерреру, D, нм | 164.4 | 117.7 | 205.3 | 202.2 | 77.5 |
| Величина микронапряжений, ε, % | 0.164 | 0.227 | 0.146 | 0.245 | 1.166 |
Объемы элементарной ячейки образцов уменьшаются в ряду RE: Gd > Y > La > Ce > Yb, что не коррелирует с размерами ионов (rLa > rCe > > rGd > rY > rYb; r – радиус иона) и не имеет связи с АМА. Предполагаемая в литературных источниках связь АМА с порядковым номером (атомным весом) RE [25] отсутствует. Не наблюдается и связь АМА с химической активностью RE, которая по данным [26] снижается от La до Lu, что обусловлено уменьшением радиусов RE.
Образцы RE отличаются средними размерами кристаллитов (D, нм), которые убывают в ряду Gd > Y > La > Ce > Yb, и величинами микронапряжений (ε, %): Yb > Y > Ce > La > Gd (табл. 1). Можно сделать вывод (в первом приближении), что АМА поликристаллических солей RE связана с микронапряжениями, если исключить неоднофазный образец Yb, для которого большая величина ε вызывается напряжениями на границе фаз.
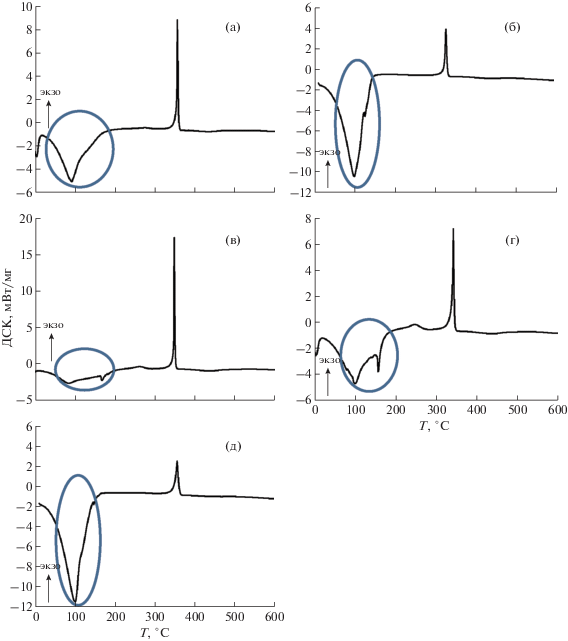
Судя по общему виду составов кристаллогидратов RE(NO3)3 · xH2O, они могут содержать и одинаковое, и разное количество молекул воды (величина x). На дифрактограммах образцов наблюдается перераспределение интенсивностей отдельных пиков, причем в меньшей степени для образцов первой группы структур (La, Ce) и в большей степени для образцов второй группы (Gd, Y) (рис. 2). Такой характер отличий интенсивностей отражений в рамках изоструктурных (предположительно) исследуемых фаз в рамках одной группы может быть обусловлен не только видом RE, но и разным содержанием молекул кристаллизационной воды. Это вывод подтверждается результатами ДСК (рис. 3, табл. 2): количество кристаллизационной воды убывает в ряду RE Y > Ce > Gd > Yb > La (овалами на рис. 3 отмечены полосы, связанные со стадиями удаления воды из кристаллогидратов).
Рис. 3.
ДСК-термограммы для поликристаллических солей RE(NO3)3 · xH2O с RE = La (a), Ce (б), Gd (в), Yb (г), Y (д).
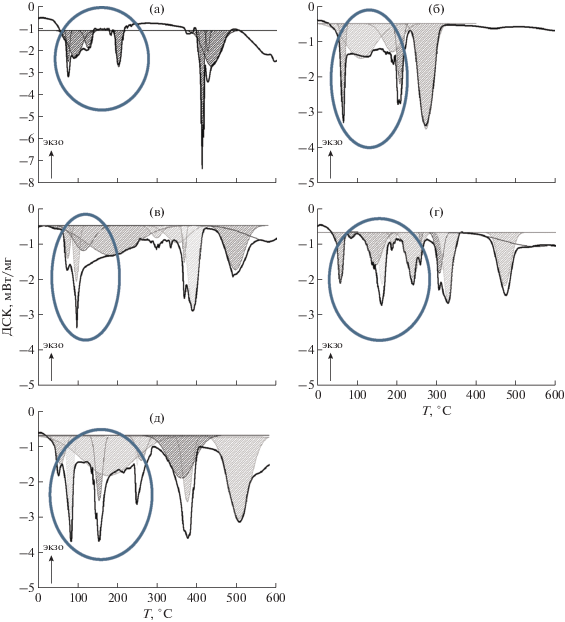
Таблица 2.
Соотнесение максимумов (T, °C) на ДСК-термограммах с возможными термическими процессами солей RE(NO3)3 · xH2O с RE = La, Ce, Gd, Yb и Y
| La | Сe | Gd | Yb | Y | Термический процесс |
|---|---|---|---|---|---|
| 77.6 | 68.8 | 74.6 | 59.4 | 53.2 | Начало дегидратации RE(NO3)3 · xH2O |
| 78.2 | Стадии дегидратации RE(NO3)3 · xH2O | ||||
| 90.7 | 99.1 | 86.5 | 84.7 | ||
| 96.9 | 154.7 | ||||
| 130.4 | 125.3 | 115.9 | 147.2 | ||
| 162.9 | |||||
| 194.4 | 185.4 | 178.4 | |||
| 202.2 | 204.9 | 191.3 | 217.0 | ||
| 242.3 | 249.5 | ||||
| 274.4 | 298.9 | 260.8 | 260.8 | Стадии денитрификации RE(NO3)3 | |
| 305.9 | |||||
| 328.8 | |||||
| 351.2 | |||||
| 368.0 | 362.6 | ||||
| 388.2 | 377.6 | ||||
| 412.2 | |||||
| 426.7 | Разложение REONO3 | ||||
| 437.2 | 489.2 | 473.5 | 507.2 | Образование RE2O3 |
Процесс термического разложения RE(NO3)3 · · xH2O довольно сложный, многостадийный, с разными этапами и температурами в зависимости от RE [27–35]. В табл. 2 этот процесс представлен в виде обобщения.
Можно отметить лишь общие черты пиролиза RE(NO3)3 · xH2O: при низких температурах удаление воды и кислородно-азотных соединений из исходных солей и промежуточных оксонитратов разного состава, а при повышении температуры дальнейшая дегидратация с потерей оксидов азота, воды и кислорода с образованием оксидов RE. Так, при разложения La(NO3)3 · 6H2O при 130 и 150°C образуются соответственно La(NO3)3 · · 4H2O и La(NO3)3 · xH2O [34], выше 250°C найден La(NO3)3 [36], разложение которого начинается при ∼375–400°C [35, 36]. Пик с максимумом при 412°C относят к разложению La(NO3)3, а плечо при ∼426°C – к разложению оксинитрата LaONO3 (табл. 2).
Таблица 3.
Соотнесение максимумов (T, °C) на ДСК термограммах с возможными термическими процессами гидрогелей ПВП/RE(NO3)3 · xH2O с RE = La, Ce, Gd, Yb и Y
| ПВП | ПВП/La | ПВП/Сe | ПВП/Gd | ПВП/Yb | ПВП/Y | Отнесение пиков |
|---|---|---|---|---|---|---|
| 9.5 | 4.8 | – | –2.4 | 3.6 | – | Промежуточная, или кластерная вода |
| 109.0 | 93.2 | 99.1 | 84.9 | 100.2 | 101.2 | Свободная вода в сетке гидрогелей и связанная вода |
| – | – | – | 167.9 | 157.2 | – | Стадии разложения RE(NO3)3 · xH2O |
| – | 274.8 | – | 261.6 | 246.7 | – | |
| – | 355.8 | 327.2 | 347.6 | 341.5 | 355.0 | Возможно, процессы гидратации или взаимодействия |
С уменьшением содержания воды в солях RE уменьшается их АМА, причем такая связь количества молекул воды в образцах с АМА установлена в [37, 38].
Таким образом, содержание кристаллизационной воды в солях RE(NO3)3 · xH2O и величина микронапряжений образцов симбатно коррелируют с АМА в отношении грамотрицательной бактерии Escherichia coli, грамположительной бактерии Staphylococcus aureus и грибов Candida albicans.
Величина АМА разная в зависимости от RE и вида микроорганизмов, что логично предполагает обращение к строению и составу бактерий, прежде всего их оболочек (мембран), в состав которых входят фосфолипиды, являющиеся защитным слоем клеток. Важнейшая функция мембран – регуляция обмена веществ между клеткой и средой, а также между различными отсеками (компартментами) внутри самой клетки. Около 20% всей массы мембраны составляет прочно связанная вода, а также катионы, преимущественно Са2+ и Mg2+, входящие в хелатные комплексы.
Антимикробную активность соединений на основе RE определяет образование различных координационных соединений, в том числе с полимерами – белками, и проникновение их в клетки микроорганизмов [1, 2]. Не исключено, что при воздействии солей на микроорганизмы происходит замещение ионов RE3+ на ионы Ca2+ из-за близости их размеров, что вызывает гибель бактерий [39, 40]. Но это не объясняет найденный ряд АМА для RE. С другой стороны, может произойти нарушение водного баланса клетки при взаимодействии с кристаллогидратами RE(NO3)3 · xH2O, что также нарушит функционирование клетки. Это косвенно подтверждает связь АМА с содержанием воды в солях.
Из-за своей более мощной и непроницаемой клеточной стенки грамотрицательные бактерии (в частности, Escherichia coli) более устойчивы к антителам, чем грамположительные, и их патогенность связывают с определенными компонентами их клеточных стенок, а именно с липополисахаридным слоем.
RE(NO3)3 · хH2O (растворы солей). Антимикробная активность солей с ионами RE в значительной степени зависит от их способности диссоциировать в жидких средах. Характер взаимодействия ионов RE с внешней мембраной бактериальной клетки играет определяющую роль в развитии целого каскада сложнейших биохимических процессов, таких как блокировка ионных каналов или активных транспортных систем клеточной оболочки бактерии, образование комплексов с белками внешней мембраны с последующим изменением структурно-функционального состояния белковых молекул. Не исключено также прооксидантное действие ионов RE на мембранные липиды.
Изучать молекулярные механизмы взаимодействия ионов RE с клеточной оболочкой бактерий можно с помощью экспериментов на модельных системах, в первую очередь на упорядоченных липидных монослоях, которые по своему составу и морфологии представляют собой адекватную модель биологических мембран. В проведенных исследованиях использованы фосфолипиды фосфатидилэтаноламин и фосфатидилглицирин, которые относятся к основным липидам наружной бактериальной мембраны. Фосфатидилэтаноламин составляет 60–80% фосфолипидов в грамотрицательных бактериях (например, Escherichia coli), фосфатидилглицирин наиболее часто встречается в грамположительных бактериях (например, Staphylococcus aureus) [41, 42]. Исследования были посвящены выявлению механизмов взаимодействия соли Yb(NO3)3 · xH2O, обладающей высокой АМА (рис. 1), с фосфолипидным монослоем.
Для изучения влияния раствора Yb(NO3)3 · · xH2O на молекулярную упаковку монослоев ДПФГ и ДПФЭ были выполнены измерения с помощью метода дифракции в геометрии скользящих углов падения (данные не представлены). На протяжении всего времени измерений (24 ч) изменений на картах дифракционного рассеяния не наблюдалось. Кроме того, в обоих случаях не было выявлено каких-либо отличий от контрольных данных, полученных при измерениях для монослоев на чистой воде. Эти результаты позволяют сделать заключение, что присутствие соли Yb(NO3)3 · xH2O в водной субфазе (в концентрации, использованной в проведенных экспериментах) не вызывает каких-либо повреждений кристаллической структуры монослоев ДПФГ и ДПФЭ.
Результаты исследований с помощью метода СРВ на монослоях ДПФГ и ДПФЭ, а также на растворе соли Yb(NO3)3 · 5H2O приведены на рис. 4 и 5. Кривая выхода Yb-флуоресценции, записанная при измерениях на растворе соли (без нанесения фосфолипидного монослоя), имеет характерный вид: при углах, меньших критического угла ПВО, интенсивность флуоресценции близка к нулю, вне области ПВО при θ > θС интенсивность резко увеличивается. Такой ход угловой зависимости обусловлен изменением глубины проникновения волнового поля: в пределах области ПВО рентгеновское излучение практически не проходит в водную субфазу. Для θ > θС глубина проникновения поля увеличивается от нескольких нанометров до нескольких сотен микрон. В результате значительно увеличивается число атомов, испускающих флуоресцентные кванты, и интенсивность выхода флуоресценции возрастает на несколько порядков.
Рис. 4.
Экспериментальная угловая зависимость выхода Yb-флуоресценции от монослоя ДПФГ, сформированного на поверхности раствора соли Yb(NO3)3 · · 5H2O. Сплошная линия – расчет, наилучшее совпадение. Пунктирная линия – расчет для ситуации, когда атомы-источники флуоресценции присутствуют в слое толщиной 10 Å, расположенном на расстоянии 25 Å от границы раздела воздух/пленка.
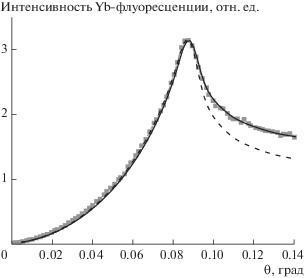
Рис. 5.
Экспериментальная угловая зависимость выхода Yb-флуоресценции от монослоя ДПФЭ, сформированного на поверхности раствора соли Yb(NO3)3 · · 5H2O (кривая 1). Для сравнения приведена экспериментальная угловая зависимость выхода Yb-флуоресценции от раствора соли Yb(NO3)3 · 5H2O (кривая 2). Сплошная линия – расчет, наилучшее совпадение.
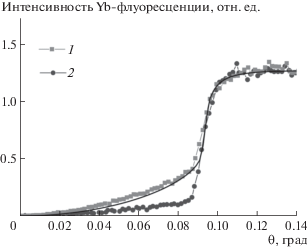
Принципиально иной ход угловой зависимости Yb-флуоресценции зарегистрирован в исследованиях на монослое ДПФГ (рис. 4). В этих измерениях интенсивность выхода флуоресценции монотонно растет с увеличением угла – от нуля при θ = 0 мрад до максимального значения в окрестности критического угла ПВО. Физический смысл таких модуляций на угловой зависимости становится ясен из рассмотрения особенностей стоячей рентгеновской волны, формирующейся в условиях ПВО: при малых углах у поверхности отражающего зеркала (водной субфазы) находится минимум интенсивности волнового поля, а вблизи критического угла ПВО – максимум интенсивности. Экспериментальные данные, полученные в измерениях на монослое ДПФГ, однозначно указывают на концентрирование ионов иттербия из объема водной субфазы к поверхности. Угловая зависимость выхода Yb-флуоресценции, записанная в исследованиях на монослое ДПФЭ, по форме ближе к кривой выхода Yb-флуоресценции от раствора соли (рис. 5). Лишь незначительное увеличение интенсивности Yb-флуоресценции вблизи критического угла свидетельствует о концентрировании небольшого количества ионов иттербия у поверхности.
Оценки параметров распределения ионов иттербия под монослоями ДПФГ и ДПФЭ получены на основе математического моделирования экспериментальных угловых зависимостей выхода Yb-флуоресценции. Оказалось, что в обоих случаях угловые зависимости выхода Yb-флуоресценции представляют собой сумму вкладов от ионов иттербия, адсорбированных в тонком слое у нижней границы фосфолипидного монослоя, и ионов иттербия, присутствующих в растворе соли Yb(NO3)3 · xH2O в объеме водной субфазы. Толщина тонкого слоя составляет DL = 10 ± 5 Å, слой находится на расстоянии 25 ± 5 Å от границы воздух/пленка. Суммируя кривые выхода флуоресценции от этого слоя и от водной субфазы с соответствующими весовыми множителями KL и KS, можно добиться совпадения расчетных кривых и экспериментальных данных. При этом отношение весовых множителей KL/KS дает представление о соотношении концентрации иттербия в тонком слое и в объеме водной субфазы. Наилучшее совпадение между расчетом и экспериментальными данными было получено для следующих значений отношения KL/KS: 2.5 для монослоя ДПФГ и 0.1 для монослоя ДПФЭ. Иными словами, концентрация ионов иттербия, адсорбированного в тонком слое под монослоем ДПФГ, оказалась в 25 раз выше, чем под монослоем ДПФЭ. Такое различие легко объяснить, если учесть, что в монослое ДПФГ головки фосфолипидных молекул имеют отрицательный заряд, тогда как у молекул ДПФЭ головка в целом электронейтральна.
Таким образом, можно утверждать, что при использованной в проведенных экспериментах концентрации соли Yb(NO3)3 · 5H2O нарушений кристаллической структуры фосфолипидных монослоев не наблюдается; об этом свидетельствует отсутствие изменений на двумерных картах дифракционного рассеяния. Однако благодаря электростатическому взаимодействию часть ионов иттербия концентрируется под фосфолипидным монослоем. Причем наиболее интенсивно такие процессы происходят в случае фосфолипида ДПФГ с отрицательно заряженной головной группой.
Композиты в системе ПВП–RE(NO3)3 · хH2O. Для разработки антимикробных препаратов с участием RE(NO3)3 · xH2O необходимо создание формообразующей основы. Такой основой представляется гидрогель на основе водорастворимого, биосовместимого и нетоксичного полимера поли-N-вилилпирролидонона – ПВП ((C6H9NO)n). При этом ПВП не обладает антимикробными свойствами.
Композиционные гидрогели ПВП/RE с RE = = Gd, Yb проявляют бактерицидные свойства c высокой чувствительностью к Escherichia coli, Staphylococcus aureus, Candida albicans, с RE = La, Ce, Y – cо средней чувствительностью к Staphylococcus aureus и Escherichia coli, с RE = La – c малой чувствительностью к Escherichia coli (рис. 6а).
Рис. 6.
Диаметр зоны задержки роста микроорганизмов (в темноте) в присутствии композиционных гидрогелей ПВП/RE(NO3)3 · хH2O с RE = La, Ce, Gd, Yb и Y: Staphylococcus aureus (1), Escherichia coli (2), Candida albicans (3) (а) и Staphylococcus epidermidis (4), Pseudomonas aeruginosa (5), Proteus mirabilis (6), Klebsiella pneumonia (7) (б).
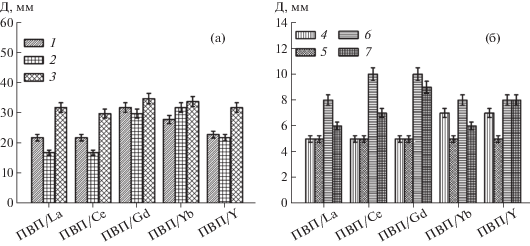
АМА уменьшается в рядах ПВП/Gd > ПВП/Yb > > ПВП/La ≈ ПВП/Y > ПВП/Ce для Candida albicans, ПВП/Gd > ПВП/Yb > ПВП/Y > ПВП/La ≈ ≈ ПВП/Ce для Staphylococcus aureus, ПВП/Yb > > ПВП/Gd > ПВП/Y > ПВП/La ≈ ПВП/Ce для Escherichia coli (рис. 6а).
Присутствие частиц с лантаном в гидрогеле ПВП/La увеличивает активность только по отношению к Staphylococcus aureus по сравнению с исходным порошком La(NO3)3 · хH2O (рис. 1). Во всех остальных случаях антимикробные свойства ПВП/RE меньше, чем у RE(NO3)3 · хH2O. Причем АМА остается наименьшей у образцов c La, а на первый план выходят ПВП/RE с Gd и Yb (рис. 6а) по сравнению с исходными солями с RE = Y и Ce с наибольшей АМА (рис. 1). Самая высокая АМА исходных порошков RE(NO3)3 · хH2O (RE = La, Gd, Yb) и гидрогелей с их участием проявляется по отношению к грибам Candida albicans (диаметр зоны задержки роста >30 мм). Необходимо учитывать тот факт, что при синтезе гидрогелей присутствующие в них ионы RE могут образовывать комплексы с молекулами воды, полимера, ТЭОС, которые составят конкуренцию за координацию RE с патогенными микроорганизмами. Все это приводит к снижению АМА композиционных гидрогелей ПВП/RE по сравнению с солями RE.
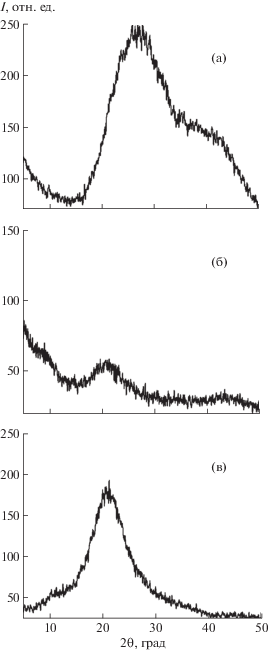
Общий вид дифракционных картин нативных гидрогелей ПВП и ПВП/RE с двумя диффузными пиками практически одинаковый (рис. 7).
Первый, наиболее интенсивный, пик (межплоскостное расстояние d1 ∼ 4 Å) на дифрактограммах ПВП и ПВП/RE (рис. 7) отвечает за меж- и внутримолекулярные расстояния между центрами масс кольца с гидрофильными группами –N–C=O и сильным внутрицепочечным вкладом. К этой боковой группе водородными связями присоединяется связанная вода: –N–C=O…H–O…H: чем меньше межплоскостное расстояние d1 и больше интенсивность пика, тем больше молекул связанной воды. Из двух образцов ПВП/RE, представленных на рис. 7, наибольшее содержание связанной воды в ПВП/Gd (рис. 7в).
Второй малоинтенсивный диффузный пик (d ∼ 2 Å) обусловлен промежуточной или кластерной водой, физически захваченной между гидратированными полимерными цепями и связанной с цепями полимера гидрофобными взаимодействиями [16]. Этой воды больше в ПВП/Сe (рис. 7б).
Третий маловыраженный диффузный пик (d ∼ ∼ 9 Å), отсутствующий на дифрактограмме ПВП (рис. 7а), относится к межмолекулярным расстояниям между основными полимерными цепочками –CH2–CH2– и отвечает за свободную воду, которая находится в сетке гидрогелей. Содержание этой воды явно больше в ПВП, так как пик, отвечающий за этот вид воды, выходит за пределы дифрактограммы.
На дифрактограммах отсутствуют дифракционные пики, относящиеся к RE(NO3)3 · хH2O, что свидетельствует о наличии в гидрогелях ионов RE и/или кластеров разного состава c ионами RE.
По данным ДСК (рис. 8, табл. 2) содержание всех видов воды уменьшается в ряду ПВП/Y > > ПВП/Ce(La) > ПВП/Yb > ПВП/Gd (что согласуется с рентгенографическими данными [16]), т.е. содержание воды в композиционных гидрогелях антибатно коррелирует с АМА.
Рис. 8.
ДСК-термограммы нативных гидрогелей ПВП/RE(NO3)3 · хH2O с RE = La (a), Ce (б), Gd (в), Yb (г) и Y (д).
Не исключено, что присутствие воды в композиционных гидрогелях “разбавляет” концентрацию функциональных ионов RE3+ в составе ПВП/RE, так как известно, что увеличение концентрации функциональных групп увеличивает антимикробную активность [10, 37, 43]. Однако не следует забывать о присутствии в растворе солей кислоты HNO3 [32], которая также может влиять на бактерицидные свойства.
Композиционные гидрогели ПВП/RE проявляют не бактерицидные, а бактериостатические свойства к грамположительным бактериям Staphylococcus epidermidis и грамотрицательным Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumonia (рис. 4б), что приводит не к гибели микроорганизмов, а лишь к прекращению их роста и размножения. Проявление действия гидрогелей разное в зависимости от природы бактерий и вида RE: Proteus mirabilis – ПВП/Сe ≈ ПВП/Gd > > ПВП/La ≈ ПВП/Yb ≈ ПВП/Y, Klebsiella pneumonia – ПВП/Gd > ПВП/Y, ПВП/Сe > ПВП/La ≈ ≈ ПВП/Yb, Staphylococcus epidermidis – ПВП/Yb ≈ ≈ ПВП/Y > ПВП/La ≈ ПВП/Ce ≈ ПВП/Gd.
Анализ результатов, представленных на рис. 6, показывает явную связь бактерицидных (бактериостатических) свойств композитов ПВП/RE с составом и строением бактерий (но не с группой бактерий: грамположительные или грамотрицательные), которые по-разному взаимодействуют с ионами редкоземельных металлов.
ЗАКЛЮЧЕНИЕ
Полученные результаты по изучению антимикробной активности в темноте солей RE(NO3)3 · · хH2O (RE) и тех же солей в составе композиционных гидрогелей с ПВП (ПВП/RE) в отношении широкого круга микроорганизмов свидетельствуют о многофакторной связи бактерицидных и бактериостатических свойств как с характеристиками солей и гидрогелей, так и с природой микроорганизмов. Тем не менее проведенные исследования позволяют выделить соли RE(NO3)3 · · хH2O с RE = Ce, Gd, Yb, Y, которые обладают ярко выраженными бактерицидными свойствами с высокой чувствительностью (зона задержки роста >40 мм) к микроорганизмам Staphylococcus aureus, Escherichia coli, Candida albicans. Они могут быть использованы при создании раневых повязок местного применения с антимикробным пролонгированным действием.
Композиционные гидрогели в системе ПВП–RE(NO3)3 · хH2O проявляют бактерицидные свойства c высокой (RE = Gd, Yb) или средней (зона задержки роста >15 мм) чувствительностью к Escherichia coli, Staphylococcus aureus, Candida albicans, или бактериостатические свойства по отношению к Staphylococcus epidermidis, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumonia. С другой стороны, высушенные на воздухе гидрогели ПВП и ПВП/RE имеют высокую степень набухания в воде: ПВП > ПВП/Ce > ПВП/La > > ПВП/Y > ПВП/Yb > ПВП/Gd (часть из них представлена в [16]). Именно cовокупность этих двух важных функциональных свойств ПВП/RE отвечает требованиям, предъявляемым к раневым покрытиям медицинского назначения для лечения различных видов ран, трофических язв, а также ожогов.
Выявленные корреляционные связи характеристик RE(NO3)3 · хH2O (RE), ПВП и ПВП/RE с антимикробными свойствами, представленные как в данной работе, так и в [16, 17], важны для создания новых антимикробных препаратов как в отдельности, так и в сочетании с антибиотиками (для исключения антибиотикорезистентности).
Работа поддержана грантом Российского фонда фундаментальных исследований (проект № 18-03-00330) и Министерством науки и высшего образования в части электронно-микроскопических исследований.
Список литературы
Rogers H.J., Woods V.E., Synge C. // J. Gen. Microbiol. 1982. V. 128. P. 2389.
Qizhuang H., Jing Y., Hui M., Hexing L. // Mater. Lett. 2006. V. 60. P. 317.
Федоров А.И., Искандаров М.И., Искандарова С.С. и др. // Ветеринария и кормление. 2014. № 5. С. 8081.
Kурочкин В.К., Имашева М.А., Шульга В.Я. и др. // Государственный НИИ органической химии и технологии. 1-й съезд токсикологов России. М., 1998.
Бондаренко В.З., Искандарова С.С., Федоров А.И. и др. // Труды ВИЭВ. 2013. Т. 77. С. 304.
Ignjatovic N.L., Mancic L., Vukovic M. et al. // Sci. Rep. 2019. V. 9. № 1. P. 1.
Shirosaki Y., Nakatsukasa M., Yasutomi S. et al. // Polymers (Basel). 2019. V. 11. № 10. P. 1.
Antonenko T.A., Shpakovsky D.B., Gracheva Yu A. et al. // Inorg. Chim. Acta. 2017. V. 455. № 1. P. 276.
Грошева В.И. Автореф. дисс. “Особенности комплексообразования тетрациклина с ионами редкоземельных металлов” канд. физ.-мат. наук. Москва, 2006. 20 с.
Серхачева Н.С., Яшина Н.В., Прокопов Н.И. и др. // Российские нанотехнологии. 2016. № 1–2. С. 91.
Serkhacheva N.S., Gainanova A.A., Kuzmicheva G.M. et al. // Int. J. Polym. Anal. Charact. 2015. V. 20. № 8. P. 743.
Domoroschina E., Kravchenko G., Kuz’micheva G. // J. Cryst. Growth. 2017. V. 468. P. 199.
Gainanova A., Kuz’micheva G., Khramov E. et al. // New J. Chem. 2018. V. 42. P. 13025.
Timaeva O.I., Chihacheva I.P., Kuzmicheva G.M. et al. // Appl. Nanosci. 2018. V. 8. P. 1729.
Тимаева О.И., Кузьмичева Г.М., Чихачева И.П. и др. // Кристаллография. 2019. Т. 64. № 4. С. 974.
Timaeva O.I., Arkharova N.A., Orekhov A.S. et al. // Polymer. 2020. V. 186. P. 122079.
Мулаков С.П., Кузьмичёва Г.М, Тимаева О.И. и др. // Сборник докладов конференции “Информатика и технологии. Инновационные технологии в промышленности и информатике”, Москва, Россия, 2019. Т. 2. С. 565.
Svetogorov R.D., Dorovatovskii P.V., Lazarenko V.A. // Cryst. Res. Technol. 2020. https://doi.org/10.1002/crat.201900184
Светогоров Р.Д. “Dionis – Diffraction Open Integration Software”. Свидетельство о государственной регистрации программы для ЭВМ № 2018660965.
Petricek V., Dusek M., Palatinus L. // Z. Kristallogr. 2014. V. 229. № 5. P. 345.
Zheludeva S.I., Novikova N.N., Konovalov O.V. et al. // X-Ray Standing Wave Technique: Principles and Applications. N. Y.: World Scientific Publishing, 2013. V. 1. P. 355.
Доценко Б.М., Бирюкова С.В., Тамм Т.И. и др. // Методические рекомендации по экспериментальному (доклиническому) изучению лекарственных препаратов для местного лечения гнойных ран. М.: МЗ СССР, 1989.
Блатун Л.А. // Раны и раневые инфекции. Журнал им. проф. Б.М. Костючёнка. 2015. Т. 2. № 3. С. 36.
Talburt D.E., Johnson G.T. // Mycologia. 1967. V. 59. № 3. P. 492.
Wakabayashi T., Ymamoto A., Kazaana A. et al. // Biol. Trace Elem. Res. 2016. V. 174. № 2. P. 464.
Киселев Ю.М., Добрынина Н.А. Химия координационных соединений. М.: Academia, 2007. 352 с.
Melnikov P., Arkhangelsky I.V., Nascimento V.A. et al. // J. Therm. Anal. Calorim. 2020. V. 139. № 6. P. 3493.
Haschke J.M. // Inorg. Chem. 1974. V. 13. P. 1812.
Melnikov P., Nascimento V.A., Consolo L.Z.Z., Silva A.F. // J. Therm. Anal. Calorim. 2013. V. 111. P. 115.
Мельников П.П., Насименто В.А., Занони Л.С. // Журнал физической химии. 2012. Т. 86. № 11. С. 1781.
Strydom C.A., Van Vuuren C.P.J. // J. Therm. Anal. 1987. V. 32. P. 157.
Melnikov P., Arkhangelsky I.V., Nascimento V.A. et al. // J. Therm. Anal. Calorim. 2014. V. 118. № 3. P. 1537.
Patil K.C., Rao C.N.R. // Inorg. Nucl. Chem. Lett. 1966. V. 2. № 11. P. 329.
Feng P.F., Yang Q.L., Dang X.M. et al. // Rare Met. 2015. V. 34. № 11. P. 814.
Strydom C.A., Van Vuuren C.P.J. // Thermochim. Acta. 1988. V. 124. P. 277.
Karppinen M., Kylakoski P., Niinisto L., Rodellas C. // J. Therm. Anal. 1989. V. 35. P. 347.
Шульгина Т.А. Дисс. “Изучение антимикробных свойств дисперсных систем на основе наночастиц серебра и меди и обоснование перспектив их использования” канд. биологических наук. Саратов, 2015. 117 с.
Голубева О.Ю. Дисс. “Пористые алюмосиликаты со слоистой и каркасной структурой: синтез, свойства и разработка композиционных материалов на их основе для решения задач медицины, экологии и катализа” докт. химических наук. Санкт-Петербург, 2016. 438 с.
Hirano S., Suzuki K.T. // Environ. Health Perspect. 1996. V. 104. P. 85.
Elna P., Moore G.R. // J. Biol. Inorg. Chem. 2001. V. 6. P. 479.
Pozo Navas B., Lohner K., Deutsch G. et al. // Biochim. Biophys. Acta. 2005. V. 1716. P. 40.
Epand R.M., Epand R.F. // Biochim. Biophys. Acta. 2009. V. 1788. P. 289.
Liu G., Ran Z., Wang H. et al. // Front. Chem. China. 2008. V. 3. № 1. P. 70.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография