Кристаллография, 2021, T. 66, № 1, стр. 34-46
Кристаллохимический подход к выделению оксоцентрированных комплексов в силикатах двухвалентного свинца
Т. А. Еремина 1, *, Е. Л. Белоконева 1, Н. Н. Еремин 1, Е. И. Марченко 1
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: t_eremina@list.ru
Поступила в редакцию 09.06.2020
После доработки 22.06.2020
Принята к публикации 22.06.2020
Аннотация
С помощью метода валентности связи и полиэдров Вороного–Дирихле проведен кристаллохимический анализ семи структур синтетических и природных силикатов свинца: Pb2SiO4, Pb11Si3O17, Pb3Si2O7, {Pb4(О(ОН)2)}[SiO4], PbSiO3 (аламозита), Pb7SiO8Cl2 (асисита) и Pb21[Si7O22]2[Si4O13]. Показано, что только однопараметрическое уравнение валентности связи позволяет однозначно отличить атомы кислорода, относящиеся к катионным постройкам, от атомов кислорода оксоцентрированных тетраэдров. Во всех структурах объемы OPb4-тетраэдров находятся в диапазоне 5.8–6.5 Å3 и обнаруживается слабая отрицательная линейная зависимость от суммы валентностей на атоме кислорода. Зафиксирована минимальная величина (12%) телесного угла для контакта Pb–O в OPb4-тетраэдре в этой группе соединений.
ВВЕДЕНИЕ
В некоторых неорганических соединениях можно выделить структурные единицы (полиэдры или их объединение), координационные центры которых представлены не катионами, а анионами. Более того, такие комплексы в ряде случаев могут определять физические свойства соединения, и анион-центрированный подход – не просто геометрический изыск, а кристаллохимически оправданное представление структуры. Впервые такой подход был обозначен в [1], а систематическая кристаллохимическая систематика таких комплексов была осуществлена в работах С.В. Кривовичева и С.К. Филатова [2]. Ими был проведен глубокий анализ минералов и неорганических соединений по структурному критерию, а также разработана достаточно полная кристаллохимическая систематика с привлечением теории химической связи. Основными факторами, определяющими распространенность и устойчивость анион-центрированных комплексов, являются высокая электроотрицательность, маленький размер и жесткость аниона. Поэтому среди возможных анионов со значительным отрывом лидирует кислород в тетраэдрической координации катионов как в силу своей высокой распространенности, так и максимально подходящий по совокупности перечисленных выше свойств. Наиболее востребованными в случае оксоцентрированных тетраэдрических комплексов оказываются катионы, валентность которых, нормированная на их характерное координационное число, составляет около 0.5 e, что позволяет кислороду иметь формальную валентность, равную –2. Проведенный анализ катионов показывает, что наиболее распространенными лигандами кислорода являются Cu2+, Bi3+, Tl3+, Hg2+, Y2+, Pb2+, РЗЭ3+ (РЗЭ – редкоземельные элементы) [2], среди которых выделяются катионы с неподеленной электронной парой. Стереоактивная неподеленная электронная пара, играя роль одного из лигандов катиона, формирует его асимметричный полиэдр, что как нельзя лучше благоприятствует появлению устойчивых анион-центрированных комплексов.
Отметим, что представление структуры в анион-центрированном аспекте кристаллохимически оправдано в случае, когда анион-центрированный комплекс играет ведущую роль в структуре – определяет анизотропию физических свойств соединения. Однако, как было показано в [2], физически обосновано использование анион-центрированного описания структуры лишь при наличии экспериментальных данных о такой анизотропии, например тепловом расширении. Методики выбора анион-центрированного описания структуры на основе только кристаллографической информации пока не существует, поэтому анализ кристаллической структуры на предмет возможного наличия в ней анион-центрированного мотива остается достаточно индивидуальной и творческой процедурой.
Целью настоящего исследования был кристаллохимический анализ группы силикатов свинца, направленный на выявление простых и наглядных индикаторов выделения анион-центрированных построек. Данная группа силикатов является, несмотря на свою немногочисленность, достаточно удобной для исследования, так как некоторые ее члены могут быть представлены комбинацией анион- и катион-центрированных группировок.
МЕТОДЫ КРИСТАЛЛОХИМИЧЕСКОГО АНАЛИЗА
Для кристаллохимического анализа структур были использованы два независимых подхода – метод валентности связи [3] и анализ геометрических характеристик полиэдров Вороного–Дирихле (ПВД) с помощью многоцелевого пакета TOPOSPro [4].
Метод валентности связи, основанный на модифицированном втором правиле Полинга, уже несколько десятилетий с успехом используется для анализа кристаллических структур. Среди важнейших задач, решаемых этим методом, можно выделить определение корректности решения кристаллической структуры; валентности катиона (например, [5]), координационных чисел [6], идентификацию ОН-групп и молекул воды [7]. Детальное теоретическое обоснование современного состояния метода приведено в [8–10]. В основе метода [3] лежит условие соблюдения локального баланса “валентностей связей”, согласно которому в стабильной кристаллической структуре должно приближенно выполняться равенство:
где Vj – формальная валентность атома j, а sij – так называемая “валентность связи” i–j. Этот термин впервые предложили ввести Донней и Алльман [11] как альтернативу не зависящему от расстояния “валентному усилию” Полинга [12], определяемому как отношение валентности к координационному числу. В отличие от него “валентность связи” между атомами i и j зависит от межатомного расстояния Rij и может быть описана эмпирическим уравнением вида [13, 14]: где R1 и N – эмпирические константы, причем R1 – длина связи, обеспечивающая единичную валентность (sij = 1).Позднее в [15] было показано, что зависимость валентности связи от межатомного расстояния более точно передает экспоненциальное выражение:
(3)
${{s}_{{ij}}} = \exp [{{({{R}_{1}} - {{R}_{{ij}}})} \mathord{\left/ {\vphantom {{({{R}_{1}} - {{R}_{{ij}}})} b}} \right. \kern-0em} b}].$Однако в последнее время стало очевидным, что существует значительное количество атомных пар, для которых в силу специфики конкретного межатомного взаимодействия (например, наличия неподеленных электронных пар, эффекта Яна–Теллера и других особенностей) универсальный параметр b = 0.37 Å не в состоянии корректно описать наблюдаемые валентности атомов. К таким парам можно отнести U6+–О и Pb2+–О. Например, Кривовичевым [21] было показано, что при расчете валентности связи Рb2+–О с использованием универсальных параметров суммы валентностей связей на центральных атомах кислорода в тетраэдрах ОРb4 оказывались чрезвычайно завышенными. В [21] этот эффект объясняется следствием слабых взаимодействий между катионами свинца. Для этих атомных пар были разработаны свои, заметно отличающиеся от стандартных, индивидуальные коэффициенты b и R1, обеспечивающие удовлетворительную сходимость баланса валентностей для этих соединений [22, 23].
В [24] были предложены уточненные на основании статистических обобщений большого массива экспериментальных данных (31 489 координационных полиэдров, 180 194 межатомных расстояний) параметры уравнения (3) для взаимодействий катион–кислород. Было показано, что предложенные уточненные значения b и R1 для 128 пар катион–кислород обеспечивают в целом лучшее описание межатомных расстояний, чем аналогичные эмпирические параметры из более ранних работ.
В качестве альтернативного независимого подхода в настоящей работе использовали анализ геометрических характеристик ПВД с помощью программного пакета для многоцелевого кристаллохимического анализа ToposPro [4]. Полиэдры Вороного–Дирихле представляют собой многогранники, ограниченные плоскостями, перпендикулярными отрезкам, которые соединяют анализируемый атом с соседними атомами структуры, и пересекающими эти отрезки точно посередине. Для определения координационного окружения ионов кислорода, расчетов характеристик ПВД в изучаемых структурах был применен алгоритм Distances программы AutoCN, который является модификацией метода пересекающихся сфер, адаптированной для неорганических соединений. Этот алгоритм тестировали на большом числе соединений из базы данных ICSD, он показал исключительно хорошую результативность. Его суть заключается в том, что для каждого атома в исследуемой структуре строят ПВД, посредством него определяют ближайших соседей атома (образующие грани ПВД). Дополнительно для всех прямых контактов определяли телесные углы Ω из пирамид с базисной гранью ПВД, соответствующей контакту центрального атома с лигандами. Если Ω был меньше, чем определенное минимальное значение (2%), то такой контакт не классифицировали как значимое валентное взаимодействие, и такой лиганд не рассматривали в качестве атома первой координационной сферы.
ОПИСАНИЕ КРИСТАЛЛИЧЕСКИХ СТРУКТУР С ОЦЕНКОЙ ВАЛЕНТНЫХ УСИЛИЙ НА ИОНАХ КИСЛОРОДА
Во всех структурах расстояния O–X анализировали до минимальных значимых величин валентностей связей, равных 0.03 е и принятых в качестве условной границы первой координационной сферы. Для связи O–Si это значение равно 2.93 Å, а для связи O–Pb 3.40 Å. Валентные усилия связи O–Pb рассчитывали как со стандартными параметрами R1 = 2.112, b = 0.37 Å [15], так и с уточненными значениями R1 = 1.963, b = 0.49 Å [23] и R1 = 2.032, b = 0.442 Å [24].
В кристаллической структуре Pb2SiO4 (пр. гр. A121) [25] из 18 неэквивалентных атомов кислорода 14 участвуют в построении катион-центрированного кольца [Si4O12], а четыре – в формировании анион-центрированной цепи [O4Pb8] (рис. 1). Характеристики кислородных позиций кристаллической структуры приведены в табл. 1.
Рис. 1.
Анион-центрированный и катион-центрированный мотив кристаллической структуры Pb2SiO4. Тетраэдры SiO4 светлые, тетраэдры OPb4 темные.
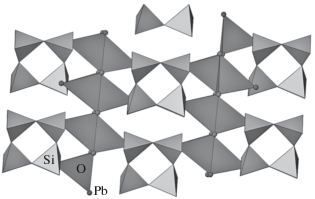
Таблица 1.
Характеристики позиций атомов кислорода в кристаллической структуре Pb2SiO4
| Позиция | Расстояние O–M, Å |
Валентность связи [15], e |
Сумма валентностей связи, e |
Полиэдр;V[OPb4], Å3; (VПВД), Å3 |
|
|---|---|---|---|---|---|
| O1 | O1–Pb | 2.089 2.257 2.333 2.491 |
1.064 0.676 0.550 0.359 |
2.64 (2.13) {2.34} |
[OPb4] 6.135 (14.15) |
| O2 | O2–Pb | 2.159 2.162 2.317 2.487 |
0.881 0.874 0.575 0.363 |
2.69 (2.17) {2.37} |
[OPb4] 5.938 (14.02) |
| O3 | O3–Si O3–Pb |
1.654 2.523 2.562 2.904 3.235 |
0.922 0.329 0.296 0.118 0.048 |
1.71 (1.76) {1.76} |
[SiO4] (16.05) |
| O4 | O4–Si O4–Pb |
1.648 2.644 2.661 2.936 3.132 |
0.937 0.237 0.227 0.108 0.063 |
1.57 (1.66) {1.64} |
[SiO4] (16.51) |
| O5 | O5–Si O5–Pb |
1.626 2.635 2.662 2.694 |
0.995 0.243 0.226 0.207 |
1.67 (1.71) {1.71} |
[SiO4] (17.93) |
| O6 | O6–Si O6–Pb |
1.653 2.554 2.602 2.684 |
0.925 0.303 0.266 0.213 |
1.71 (1.72) {1.74} |
[SiO4] (17.64) |
| O7 | O7–Si | 1.669 1.689 |
0.885 0.839 |
2.10 (2.18) {2.17} |
[SiO4] (13.95) |
| O7–Pb | 2.812 2.825 3.058 |
0.151 0.146 0.0776 |
|||
| O8 | O8–Si | 1.686 1.686 |
0.846 0.846 |
1.69 (1.69), {1.71} |
[SiO4] (19.05) |
| O9 | O9–Si | 1.656 1.656 |
0.917 0.917 |
1.83 (1.83), {1.84} |
[SiO4] (19.36) |
| O10 | O10–Pb | 2.075 2.252 2.333 2.491 |
1.105 0.685 0.550 0.359 |
2.70 (2.16) {2.37} |
[OPb4] 6.036 (14.22) |
| O11 | O11–Pb | 2.155 2.173 2.317 2.487 |
0.890 0.848 0.575 0.363 |
2.68 (2.16) {2.36} |
[OPb4] 6.035 (14.21) |
| O12 | O12–Si O12–Pb |
1.654 2.266 2.918 2.921 3.259 |
0.922 0.660 0.113 0.112 0.045 |
1.85 (1.82) {1.85} |
[SiO4] (16.05) |
| O13 | O13–Si O13–Pb |
1.648 2.269 2.860 2.914 3.115 |
0.937 0.654 0.132 0.114 0.066 |
1.90 (1.87) {1.90} |
[SiO4] (15.72) |
| O14 | O14–Si O14–Pb |
1.626 2.265 2.694 2.858 |
0.995 0.661 0.207 0.133 |
2.00 (1.92) {1.96} |
[SiO4] (17.04) |
| O15 | O15–Si O15–Pb |
1.653 2.340 2.684 2.924 |
0.925 0.540 0.213 0.111 |
1.79 (1.76) {1.78} |
[SiO4] (17.57) |
| O16 | O16–Si | 1.669 1.689 |
0.885 0.839 |
1.88 (1.96) {1.95} |
[SiO4] (15.45) |
| O16–Pb | 3.055 3.299 3.311 |
0.078 0.040 0.039 |
|||
| O17 | O17–Si | 1.686 1.686 |
0.846 0.846 |
1.69 (1.69), {1.71} |
[SiO4] (18.92) |
| O18 | O18–Si | 1.656 1.656 |
0.917 0.917 |
1.83 (1.83), {1.84} |
[SiO4] (18.84) |
В кристаллической структуре Pb11Si3O17 (пр. гр. P$\bar {1}$) [26] из 34 различных ионов кислорода 22 участвуют в построении диортогрупп [Si2O7] и изолированных тетраэдров [SiO4], а 11 – в формировании двух разных по топологии анион-центрированных цепей: [O2Pb4] и [O3Pb7] (табл. 2). Цепи второго типа объединяются в слои [O4Pb7] посредством некомпланарных треугольников [OPb3] (рис. 2).
В структуре Pb3Si2O7 (пр. гр. R$\bar {3}$c) [27] выделяются диортогруппы [Si2O7], между которыми локализуются ионы Pb2+ (рис. 3). Координационные числа трех неэквивалентных катионов Pb различны и изменяются от 6 до 9. Среди четырех структурно неэквивалентных ионов кислорода (табл. 3) анион-центрированных не выявлено.
Таблица 2.
Характеристики позиций атомов кислорода в кристаллической структуре Pb11Si3O17
| Позиция | Расстояния O–M, Å | Валентность связи [15], e | Сумма валентностей связи, e | Полиэдр; V[OPb4], Å3; (VПВД), Å3 |
|
|---|---|---|---|---|---|
| O1 | O1–Pb | 2.222 2.261 2.307 2.372 |
0.743 0.669 0.590 0.495 |
2.50 (2.06) {2.25} |
[OPb4] 6.030 (14.29) |
| O2 | O2–Pb | 2.183 2.266 2.293 2.409 |
0.825 0.660 0.613 0.448 |
2.55 (2.09) {2.28} |
[OPb4] 6.105 (14.85) |
| O3 | O3–Si | 1.600 1.617 |
1.067 1.019 |
2.19 (2.21) {2.21} |
[SiO4] (14.93) |
| O3–Pb | 2.954 | 0.103 | |||
| O4 | O4–Si O4–Pb |
1.670 2.260 2.767 3.110 3.333 |
0.883 0.670 0.170 0.067 0.037 |
1.82 (1.78) {1.82} |
[SiO4] (16.63) |
| O5 | O5–Si O5–Pb |
1.742 2.193 2.658 2.872 |
0.727 0.803 0.229 0.128 |
1.88 (1.75) {1.83} |
[SiO4] (16.93) |
| О6 | O6–Si O6–Pb |
1.723 2.218 2.689 3.068 |
0.765 0.751 0.210 0.075 |
1.80 (1.69) {1.75} |
[SiO4] (17.75) |
| О7 | O7–Si O7–Pb |
1.610 2.370 2.659 3.108 3.276 |
1.039 0.498 0.228 0.068 0.043 |
1.87 (1.88) {1.89} |
[SiO4] (16.65) |
| О8 | O8–Si O8–Pb |
1.613 2.523 2.587 2.603 |
1.030 0.329 0.277 0.265 |
1.90 (1.90) {1.92} |
[SiO4] (16.60) |
| О9 | O9–Si O9–Pb |
1.580 2.394 2.571 2.820 |
1.126 0.467 0.289 0.148 |
2.03 (2.00) {2.02} |
[SiO4] (15.97) |
| О10 | O10–Pb | 2.184 2.273 2.292 2.304 |
0.823 0.647 0.615 0.595 |
2.68 (2.18) {2.38} |
[OPb4] 5.937 (14.26) |
| О11 | O11–Pb | 2.174 2.192 2.411 2.427 |
0.846 0.806 0.446 0.427 |
2.52 (2.07) {2.25} |
[OPb4] 6.106 (15.72) |
| О12 | O12–Pb | 2.051 2.325 2.443 3.059 |
1.179 0.562 0.409 0.077 |
2.23 (1.79) {1.96} |
[OPb3] (17.69) |
| О13 | O13–Pb | 2.194 2.235 2.246 2.400 |
0.801 0.717 0.696 0.459 |
2.67 (2.17) {2.38} |
[OPb4] 5.845 (14.37) |
| О14 | O14–Si O14–Pb |
1.610 2.278 2.584 2.795 |
1.039 0.638 0.279 0.158 |
2.11 (2.03) {2.07} |
[SiO4] (15.74) |
| О15 | O15–Si O15–Pb |
1.621 2.657 2.705 2.732 3.016 |
1.008 0.229 0.201 0.187 0.087 |
1.71 (1.80) {1.78} |
[SiO4] (15.93) |
| О16 | O16–Si O16–Pb |
1.562 2.425 2.635 3.103 |
1.182 0.429 0.243 0.067 |
1.92 (1.92) {1.93} |
[SiO4] (17.46) |
| О17 | O17–Si O17–Pb |
1.564 2.212 3.087 3.349 3.392 |
1.176 0.763 0.072 0.035 0.031 |
2.07 (1.99) {2.02} |
[SiO4] (18.37) |
| О18 | O18–Si O18–Pb |
1.491 2.384 2.858 3.173 |
1.433 0.479 0.133 0.057 |
2,10 (2.10) {2.09} |
[SiO4] (17.51) |
| О19 | O19–Si O19–Pb |
1.638 2.331 2.512 3.287 3.319 |
0.963 0.553 0.339 0.042 0.038 |
1.93 (1.89) {1.92} |
[SiO4] (16.70) |
| О20 | O20–Si O20–Pb |
1.524 2.292 2.574 |
1.310 0.615 0.287 |
2.21 (2.11) {2.14} |
[SiO4] (16.19) |
| О21 | O21–Si O21–Pb |
1.719 2.201 2.462 3.297 |
0.774 0.786 0.388 0.041 |
1.99 (1.82) {1.90} |
[SiO4] (16.92) |
| О22 | O22–Pb | 2.228 2.248 2.274 2.531 |
0.731 0.692 0.645 0.322 |
2.39 (1.98) {2.16} |
[OPb4] 6.225 (16.24) |
| О23 | O23–Pb | 2.192 2.230 2.247 2.337 |
0.806 0.727 0.694 0.544 |
2.77 (2.23) {2.45} |
[OPb4] 5.809 (13.95) |
| О24 | O24–Pb | 2.149 2.251 2.271 2.959 |
0.905 0.687 0.651 0.101 |
2.34 (1.90) {2.08} |
[OPb3] (16.49) |
| О25 | O25–Pb | 2.201 2.243 2.288 2.630 |
0.786 0.702 0.621 0.247 |
2.36 (1.95) {2.12} |
[OPb4] 6.506 (16.40) |
| О26 | O26–Si O26–Pb |
1.592 2.449 2.522 2.693 |
1.090 0.402 0.330 0.208 |
2.03 (2.01) {2.03} |
[SiO4] (16.10) |
| О27 | O27–Si O27–Pb |
1.596 2.353 2.651 3.114 |
1.079 0.521 0.233 0.067 |
1.90 (1.87) {1.89} |
[SiO4] (17.76) |
| О28 | O28–Si | 1.587 1.635 |
1.105 0.971 |
2.18 (2.26) {2.23} |
[SiO4] (15.37) |
| O28–Pb | 3.281 3.337 3.379 |
0.042 0.036 0.033 |
|||
| О29 | O29–Si O29–Pb |
1.651 2.355 2.928 2.941 3.102 |
0.930 0.519 0.110 0.106 0.069 |
1.77 (1.75) {1.76} |
[SiO4] (16.48) |
| О30 | O30–Si O30–Pb |
1.691 2.250 2.741 3.051 3.285 |
0.834 0.689 0.183 0.079 0.042 |
1.82 (1.77) {1.81} |
[SiO4] (16.39) |
| О31 | O31–Si O31–Pb |
1.667 2.218 2.848 2.892 |
0.890 0.751 0.137 0.121 |
1.89 (1.80) {1.85} |
[SiO4] (17.40) |
| О32 | O32–Si O32–Pb |
1.742 2.102 2.849 2.985 |
0.727 1.027 0.136 0.094 |
1.98 (1.77) {1.87} |
[SiO4] (17.60) |
| О33 | O33–Pb | 2.194 2.278 2.331 2.374 |
0.801 0.638 0.553 0.493 |
2.48 (2.05) {2.24} |
[OPb4] 6.058 (15.10) |
| О34 | O34–Pb | 2.191 2.268 2.333 2.376 |
0.808 0.656 0.550 0.490 |
2.50 (2.07) {2.25} |
[OPb4] 6.115 (14.97) |
Рис. 2.
Анион-центрированный и катион-центрированный мотив кристаллической структуры Pb11Si3O17. Тетраэдры SiO4 светлые, тетраэдры OPb4 и треугольники OPb3 темные.
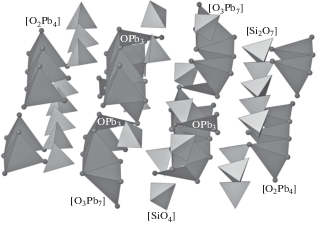
Рис. 3.
Кристаллическая структура Pb3Si2O7 в плоскости, перпендикулярной оси 3. Выделены тетраэдры SiO4, атомы Pb показаны в виде шаров.
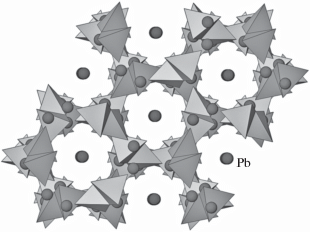
Таблица 3.
Характеристики позиций атомов кислорода в кристаллической структуре Pb3Si2O7
| Позиция | Расстояния O–M, Å | Валентность связи [15], e | Сумма валентностей связи, e | Полиэдр; V[OPb4], Å3; (VПВД), Å3 | |
|---|---|---|---|---|---|
| O1 | O1–Si | 1.665 1.665 |
0.895 0.895 |
1.86 (1.91) {1.91} |
[SiO4] (17.12) |
| O1–Pb | 3.333 3.333 |
0.037 0.037 |
|||
| O2 | O2–Si O2–Pb |
1.613 2.367 2.609 2.848 |
1.030 0.502 0.261 0.137 |
1.93 (1.90) {1.93} |
[SiO4] (16.03) |
| O3 | O3–Si O3–Pb |
1.628 2.400 2.498 2.610 |
0.989 0.459 0.352 0.260 |
2.06 (2.00) {2.04} |
[SiO4] (14.27) |
| O4 | O4–Si O4–Pb |
1.640 2.166 2.851 3.207 |
0.958 0.864 0.136 0.052 |
2.01 (1.86) {1.93} |
[SiO4] (18.06) |
В кристаллической структуре недавно расшифрованного еще одного представителя ортосиликатов свинца {Pb4(О(ОН)2)}[SiO4] [28] изолированные SiO4-тетраэдры также находятся среди катионов Pb (рис. 4). Структуру можно рассматривать как центрированный анионами положительно заряженный цеолитоподобный каркас из связанных между собой кластеров {O3Pb7}8+, которые включают в себя три соединенных ребрами [OPb4]6+-тетраэдра с одной общей вершиной. В этой структуре два атома кислорода относятся к кремнекислородной подструктуре, а один – к анион-центрированному каркасу (табл. 4).
Рис. 4.
Анион-центрированный и катион-центрированный мотив кристаллической структуры {Pb4(О(ОН)2)}[SiO4]. Тетраэдры SiO4 светлые, тетраэдры OPb4 темные.
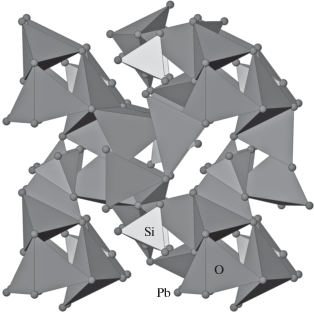
Таблица 4.
Характеристики позиций атомов кислорода кристаллической структуры {Pb4(О(ОН)2)}[SiO4]
| Позиция | Расстояния O–M, Å | Валентность связи [15], e | Сумма валентностей связи, e | Полиэдр; V[OPb4], Å3; (VПВД), Å3 | |
|---|---|---|---|---|---|
| O1 | O1–Si O1–Pb |
1.666 2.430 2.430 |
0.743 0.424 0.424 |
1.74 (1.66) {1.71} |
[SiO4] (14.05) |
| O2 | O2–Pb | 2.161 2.240 2.373 2.714 |
0.875 0.708 0.493 0.197 |
2.27 (1.88) {2.04} |
[OPb4] 6.252 (16.24) |
| O3 | O3–Si O3–Pb |
1.658 2.181 2.859 |
0.912 0.831 0.133 |
1.88 (1.71) {1.78} |
[SiO4] (15.41) |
Редкий минерал – силикат свинца аламозит PbSiO3 (пр. гр. P12/n1) – был обнаружен в районе г. Аламоз (Мексика). Кристаллическая структура минерала была расшифрована в [29] и уточнена с использованием синтетического аналога [30]. Авторы отметили уникальность и примечательность этой структуры, в основе которой выделяются бесконечные цепочки связанных вершинами кремнекислородных тетраэдров SiO4 с рекордно высоким значением трансляционной периодичности цепочки 12. Анион-центрированные комплексы в структуре не выявлены (табл. 5).
Таблица 5.
Характеристики позиций атомов кислорода в кристаллической структуре аламозита
| Позиция | Расстояния O–M, Å | Валентность связи [15], e | Сумма валентностей связи, e | Полиэдр; V[OPb4], Å3; (VПВД), Å3 | |
|---|---|---|---|---|---|
| О1 | O1–Si O1–Pb |
1.627 × 2 3.380 × 2 |
0.992 × 2 0.032 × 2 |
2.05 (2.09), {2.08} |
[SiO4] (16.69) |
| O2 | O2–Si O2–Pb |
1.648 × 2 3.228 × 2 |
0.937 × 2 0.049 × 2 |
1.97 (2.03), {2.01} |
[SiO4] (14.73) |
| O3 | O3–Si | 1.630 1.661 |
0.984 0.905 |
1.99 (2.02) {2.02} |
[SiO4] (14.99) |
| O3–Pb | 2.953 | 0.103 | |||
| O4 | O4–Si | 1.638 1.670 |
0.963 0.883 |
1.90 (1.92) {1.92} |
[SiO4] (15.28) |
| O4–Pb | 3.216 | 0.051 | |||
| O5 | O5–Si O5–Pb |
1.624 2.290 2.435 3.027 |
1.000 0.618 0.418 0.084 |
2.12 (2.01) {2.06} |
[SiO4] (14.37) |
| O6 | O6–Si O6–Pb |
1.597 2.299 2.468 |
1.076 0.603 0.382 |
2.06 (1.94) {1.99} |
[SiO4] (15.67) |
| O7 | O7–Si O7–Pb |
1.608 2.315 2.510 2.988 |
1.044 0.578 0.341 0.094 |
2.06 (1.98) {2.02} |
[SiO4] (16.57) |
| O8 | O8–Si O8–Pb |
1.584 2.256 2.874 3.368 |
1.114 0.678 0.128 0.033 |
1.95 (1.87) {1.91} |
[SiO4] (17.72) |
| O9 | O9–Si O9–Pb |
1.608 2.272 2.440 |
1.044 0.649 0.412 |
2.10 (1.95) {2.02} |
[SiO4] (16.52) |
| O10 | O10–Si O10–Pb |
1.607 2.303 2.557 2.859 |
1.047 0.597 0.300 0.133 |
2.08 (2.00) {2.05} |
[SiO4] (16.05) |
Кристаллическая структура асисита – минерала, обнаруженного в Намибии, – уточнена в [31]. Структура минерала (пр. гр. I4/mmm), идеализированная формула которого Pb7SiO8Cl2, также может быть отнесена к объектам настоящего анализа. Тем не менее структурное положение Si было определено только приблизительно, исходя из его присутствия в исследуемом образце и наличия неполной заселенности позиции Pb. Авторы работы предположили заселенность 25% атомами Si одной из двух позиций Pb, что косвенно подтверждали результаты структурного анализа. Таким образом, асисит не относится к силикатам свинца. Однако прекрасно выраженный анион-центрированный слой из [OPb4]-тетраэдров (рис. 5) дал основание включить единственную кислородную позицию в этой структуре (табл. 6) в общую выборку, используемую при кристаллохимическом анализе.
Рис. 5.
Анион-центрированный мотив кристаллической структуры асисита. Выделены тетраэдры OPb4. Атомы Cl показаны крупными шарами.
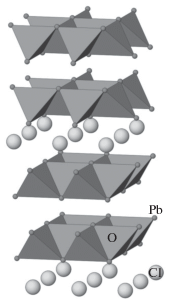
Таблица 6.
Характеристики позиций атомов кислорода в кристаллической структуре асисита
| Позиция | Расстояния O–M, Å | Валентность связи [15], e | Сумма валентностей связи, e | Полиэдр; V[OPb4], Å3; (VПВД), Å3 | |
|---|---|---|---|---|---|
| O1 | O1–Pb | 2.273 × 2 2.384 × 2 |
0.647 × 2 0.480 × 2 |
2.25 (1.91) {2.06} |
[OPb4] 6.437 (16.29) |
Расшифрованная несколько лет назад кристаллическая структура синтетического соединения Pb21[Si7O22]2[Si4O13] (пр. гр. P63/m) [32] характеризуется исключительно сложным топологическим строением. В структуре содержатся пять независимых тетраэдрических позиций Si, относящихся к двум структурным единицам: [Si7O22] и [Si4O13]. Атомы свинца находятся в искаженных из-за присутствия неподеленных электронных пар координационных PbOn-полиэдрах с различными координационными числами. Структуру можно представить как укладку в определенной последовательности катион-центрированных строительных блоков двух типов – A и B. А-блок содержит единицы [Si7O22], а также полиэдры Pb1On, Pb2On, Pb3On и Pb4On. B-блок содержит единицы [Si4O13], а также полиэдры Pb5On и Pb6On. В структуре присутствуют 12 независимых позиций атомов кислорода, однако в результате проведенного авторами работы анализа оксоцентрированных тетраэдров обнаружено не было.
РЕЗУЛЬТАТЫ КРИСТАЛЛОХИМИЧЕСКОГО АНАЛИЗА
В настоящей работе анализу были подвергнуты 80 позиций атомов кислорода в структурах тех же семи силикатов свинца (с учетом асисита). Из них 18 представляли собой центры полиэдров OPbn. Проведенный расчет межатомных расстояний показал, что в подавляющем большинстве случаев расстояния Pb–O в оксоцентрированных полиэдрах находятся в интервале 2.10–2.70 Å. Одно выпадающее из этого интервала расстояние (2.959 Å) относится к Pb-полиэдру вокруг атома O24 в структуре Pb11Si3O17. С формальной точки зрения он координирован пятью ионами Pb2+, но два дальних Pb-лиганда (2.959 и 3.447 Å) находятся намного дальше трех ближайших (хотя и характеризуются значимыми величинами сферических углов, определяемых с помощью пакета ToposPro). Поэтому такая координация вокруг атома O24 может быть названа тройной зонтичной. В этой структуре аналогичную координацию имеет еще один кислород (O12). Таким образом, всего проанализировано 16 тетраэдров [OPb4] и два треугольных зонтика [OPb3], принадлежащих четырем различным кристаллическим структурам.
Отметим, что для всех катионов и анионов в структуре Pb21[Si7O22]2[Si4O13] анализ межатомных расстояний и сумм валентностей связей был проведен ранее в [32] с использованием модифицированных параметров из [23]. Анализ показал, что для двух атомов кислорода (О11 и O12) получены неправдоподобные величины сумм валентностей, что связано с частичной заселенностью некоторых катионных позиций в структуре. Эти два атома кислорода из настоящего анализа также были удалены. Таким образом, выборка кислородных позиций катион-центрированных полиэдров сократилась до 62.
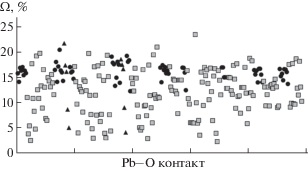
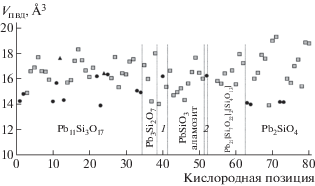
Проведенный в работе анализ характеристик ПВД для 80 (16 + 2 + 62) кислородных позиций в семи структурах показал следующее. По объему ПВД (VПВД) невозможно отличить атомы кислорода анион-центрированных тетраэдров от атомов кислорода катион-центрированных полиэдров (рис. 6), хотя для первых значение VПВД в среднем систематически меньше, чем для вторых (15.04 и 16.43 Å3 соответственно). Телесные углы Ω контактов O–Pb (проанализировано 246 контактов) также не позволяют однозначно отличить связь в анион-центрированном тетраэдре от контакта катион-центрированного полиэдра. Однако даже самая слабая связь в тетраэдре [OPb4] дает значение телесного угла не менее 12% (рис. 7), тогда как в катионных полиэдрах PbOn оно может понижаться до 2–3%. Также отметим, что в полиэдрах OPbn вокруг атомов O12 и O24 в структуре Pb11Si3O17 два телесных угла (из пяти в каждом случае) значительно меньше 10–12%. Этот факт подтверждает именно тройную зонтичную координацию этих атомов кислорода. Таким образом, значение телесного угла менее 10–12% для контактов O–Pb является достаточно надежным критерием того, что выделение оксоцентрированного тетраэдра кристаллохимически не оправдано.
Рис. 6.
Объем полиэдров Вороного–Дирихле V(ПВД) вокруг ионов кислорода в изучаемых соединениях: 1 – выборка по {Pb4(О(ОН)2)}[SiO4] (три позиции); 2 – выборка по асиситу (одна позиция). Черные кружки – кислороды анион-центрированных тетраэдров, светлые квадраты – кислороды катионных построек. Треугольниками выделены позиции O12 и O24 в структуре Pb11Si3O17.
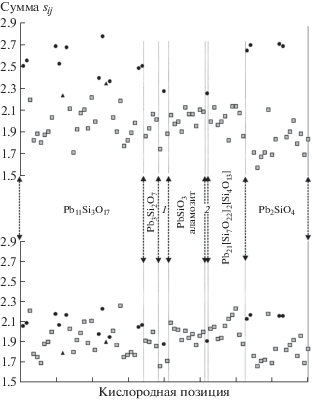
Проведенный анализ объемов OPb4-тетраэдров показал, что они относительно стабильны в различных структурах и находятся в диапазоне 5.8–6.5 Å3. Обнаружена некоторая отрицательная линейная зависимость объемов тетраэдров от суммы валентностей на ионе кислорода. При расчете валентностей связей с параметрами из [15] зависимость можно описать следующим уравнением:
(коэффициент корреляции 0.73), а при расчете по модернизированному уравнению [23]: (коэффициент корреляции 0.76).Достаточно иллюстративным оказалось распределение валентностей связей на всех ионах кислорода в изучаемых соединениях. Если при расчете по формуле из [23] (рис. 8, внизу) они находятся в пределах допустимого 1.65–2.25 е, по формуле из [24] значения составляют 1.64–2.55 е, то при расчете по стандартной формуле из [15] (рис. 8, вверху) суммы валентностей отклоняются существенно – от 1.6 до 2.9 е. На рис. 8 отчетливо видно разделение атомов кислорода на две группы: для атомов оксоцентрированных тетраэдров суммы валентностей связей больше 2.2 е, а для атомов кислорода катионных построек – от 1.6 до 2.2 е. Это позволяет использовать уравнение (3) со стандартными параметрами из [15] в качестве экспресс-способа выделения атомов кислорода, относящихся к анион-центрированным постройкам (по крайней мере, внутри этого класса соединений).
ЗАКЛЮЧЕНИЕ
В результате анализа межатомных расстояний, объемов координационных полиэдров V(ПВД), телесных углов Ω контактов Pb–O семи синтетических и природных представителей группы силикатов свинца установлено, что для ионов кислорода, не задействованных в анион-центрированных постройках, значения валентностей связей, рассчитанные с помощью различных параметров уравнения (3), находятся в пределах 1.6–2.2 е. Использование стандартного уравнения валентностей связей с универсальным множителем из [15] в силикатах свинца приводит к завышенным значениям сумм валентностей (2.2–2.9 е) исключительно на атомах кислорода, принадлежащих оксоцентрированным тетраэдрам. В этой связи можно рекомендовать уравнение с параметрами из [15] для экспресс-диагностики наличия анион-центрированных комплексов OPb4-тетраэдров в структурах. Использование других параметров уравнения (3) не позволяет сделать такой вывод. Величина V(ПВД) для кислородных позиций в этих структурах может меняться от 13 до 19.5 Å3 и не является характеристическим параметром для выделения оксоцентрированных ОPb4-тетраэдров. Телесный угол Ω менее 10–12% для контактов Pb–O – геометрический критерий того, что выделение оксоцентрированного тетраэдра кристаллохимически не оправдано. Для [OPb4]-тетраэдров объемы находятся в диапазоне 5.8–6.5 Å3, обнаружена слабая отрицательная линейная зависимость от суммы валентностей на атоме кислорода.
Список литературы
Bergerhoff G., Paeslack J. // Z. Kristallogr. 1968. B. 126. S. 112.
Кривовичев С.В., Филатов С.К. Кристаллохимия минералов и неорганических соединений с комплексами анионоцентрированных тетраэдров. CПб.: изд-во СПбГУ, 2001. 200 с.
Brown I.D. // Acta Cryst. B. 1992. V. 48. P. 553.
Blatov V.A., Shevchenko A.P., Proserpio D.M. // Cryst. Growth Des. 2014. V. 14. P. 3576. http://topospro.com
Burns P.O., Finch R.J. // Am. Mineral. 1999. V. 84. P. 1456.
Brown I.D. // Acta Cryst. B. 1988. V. 44. P. 545.
Hawthorne F.C. // Z. Kristallogr. 1992. B. 201. S. 183.
Burdett J.K., Hawthorne F.C. // Am. Mineral. 1993. V. 78. P. 884.
Urusov V.S. // Acta Cryst. B. 1995. V. 51. P. 641.
Gibbs G.V., Hill F.C., Boisen M.B. et al. // Phys. Chem. Minerals. 1998. V. 25. P. 585.
Donnay G., Allman R. // Miner. 1970. V. 55. P. 1003.
Pauling L. // J. Am. Chem. Soc. 1929. V. 51. P. 1010.
Пятенко Ю.А. // Кристаллография. 1972. Т. 17. Вып. 4. С. 773.
Brown I.D., Shannon R.D. // Acta Cryst. A. 1973. V. 29. P. 266.
Brown I.D., Altermatt D. // Acta Cryst. B. 1985. V. 41. P. 244.
O'Keefe M., Breese N.E. // J. Am. Chem. Soc. 1991. V. 113. P. 3226.
O’Keeffe M., Breese N.E. // Acta Cryst. B. 1992. V. 48. P. 152.
Brown I.D. The Chemical Bond in Inorganic Chemistry. Oxford University Press, 2002.
Brown I.D. // Chem. Rev. 2009. V. 109. P. 6858.
Brown I.D. http://www.iucr.org/resources/data/datasets/bond-valence-parameters; posted 16 October 2013.
Krivovichev S.V. // Z. Kristallogr. 1999. B. 214. S. 371.
Burns P.O., Ewing R.C., Hawthorne F.C. // Can. Mineral. 1997. V. 35. P. 1551.
Krivovichev S.V., Brown I.D. // Z. Kristallogr. 2001. B. 216. S. 245.
Gagne O.C., Hawthorne F.C. // Acta Cryst. B. 2015. V. 71. P. 562.
Dent Glasser L.S., Howie R.A., Smart R.M. // Acta Cryst. B. 1981. V. 37. P. 303.
Kato K. // Acta Cryst. B. 1983. V. 38. P. 57.
Petter W., Harnik A.B., Keppler U. // Z. Kristallogr. 1971. B. 133. S. 445.
Еремина Т.А., Белоконева Е.Л., Димитрова О.В. и др. // Кристаллография. 2019. Т. 64. № 3. С. 375.
Boucher M.L., Peacor D.R. // Z. Kristallogr. 1968. B. 126. S. 98.
Кривовичев С.В., Бернс П.К. // Зап. Всерос. минерал. о-ва. 2004. № 5. С. 70.
Rouse R.C., Peacor D.R., Dunn P.J. et al. // Am. Mineral. 1988. V. 73. P. 643.
Siidra O.I., Zenko D.S., Krivovichev S.V. // Am. Mineral. 2014. V. 99. P. 817.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография