Кристаллография, 2021, T. 66, № 3, стр. 435-438
Необычное замещение в гидразинбензойной кислоте при комплексообразовании, кристаллическая и молекулярная структура гидрохлорида гидразинбензойной кислоты
Русул Алабада 1, О. В. Авраменко 1, С. Б. Страшнова 1, *, В. С. Сергиенко 2, Яхья Абсалан 3, О. В. Ковальчукова 1, 4
1 Российский университет дружбы народов
Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
3 Фердоузский университет
Машхад, Иран
4 Российский государственный университет им. А.Н. Косыгина
Москва, Россия
* E-mail: strashnova-sb@rudn.ru
Поступила в редакцию 23.07.2020
После доработки 19.08.2020
Принята к публикации 19.08.2020
Аннотация
Определена молекулярная и кристаллическая структура 2-гидразинбензойной кислоты. Показано, что в растворе в присутствии хлорида меди(II) 2-гидразинбензойная кислота переходит в 2-хлорбензойную (HL1) и координируется катионами меди(II) в биядерную структуру [Cu(H2О)]2(µ-L1)4 с мостиковыми карбоксильными группами лиганда (L1)–. Выделены в кристаллическом состоянии и изучены совокупностью спектральных методов три комплексных соединения HL1 с Fe(II), Co(II) и Zn(II). Установлено, что органические молекулы входят в состав комплексов в монодепротонированной хелатной форме.
ВВЕДЕНИЕ
Гидроксиароматические кислоты представляют собой класс соединений, характеризующихся высокой биологической активностью. Биологическая активность гидроксиароматических кислот коррелирует с их способностью к комплексообразованию с катионами переходных металлов [1–4], а их биологически активной формой in vivo являются комплексные соединения с катионами меди(II) [5]. Известно [6], что биологическая активность комплексов металлов с инертными лигандами (например, с фенантролином) более выражена, чем активность свободных лигандов или исходных органических лекарственных форм. Органические производные гидразина используют в качестве лекарственных препаратов противотуберкулезного действия [7].
Помимо биологической активности металлокомплексы гидрокси- и гидразинпроизводных ароматических карбоновых кислот широко используются в тонком органическом синтезе, являются потенциальными электронными, магнитными, оптическими, абсорбирующими и каталитическими материалами [8–10].
В настоящем исследовании описан процесс превращения 2-гидразинбензойной кислоты (HL) в хлорбензойную (HL1) при комнатной температуре при комплексообразовании. Изучено комплексообразование ряда двухвалентных катионов 3d-металлов с гидразинбензойной кислотой.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Рентгеноструктурный анализ соединения HL ⋅ ⋅ HCl выполнен на автоматическом дифрактометре Bruker SMART APEX II (МоKα, λ = 0.71073 Å, графитовый монохроматор, ω-сканирование). Структура расшифрована прямыми методами [11]. Позиционные и температурные параметры всех атомов, кроме водорода, уточнены в анизотропном приближении полноматричным МНК [12]. Позиции атомов водорода выявлены на разностных синтезах Фурье и уточнены в изотропном приближении. Все расчеты выполнены по комплексу программ SHELXTL [13, 14]. Основные кристаллографические данные и характеристики эксперимента для HL ⋅ HCl приведены в табл. 1. Экспериментальные данные для HL ⋅ HCl депонированы в Кембриджский банк структурных данных (CCDC № 2018196).
Таблица 1.
Основные кристаллографические данные, характеристики эксперимента и результаты уточнения структуры HL ⋅ HCl
| Брутто-формула | C7H9ClN2O2 |
|---|---|
| M | 188.61 |
| Сингония, пр. гр., Z | Моноклинная, P21/c, 4 |
| a, b, c, Å | 3.8183(3), 25.1631(15), 8.9152(5) |
| β, град | 102.008(2) |
| V, Å3 | 837.83(10) |
| Размер кристалла, мм | 0.25 × 0.12 × 0.02 |
| Dвыч, г/см3 | 1.495 |
| µ, мм–1 | 0.415 |
| Пределы h, k, l | –4 < h < 4, –32 < k < 32, –11 < l < 11 |
| θ, град | 2.472–26.997 |
| F(000) | 392 |
| Количество отражений: измеренных/независ. (N1), Rint/с I > 2σ(I) (N2) | 9334/1827, 0.063/1381 |
| Число уточняемых параметров | 145 |
| R/wR по N2 | 0.094/0.097 |
| S | 1.062 |
| Δρmin/Δρmax э/Å | –0.335/0.330 |
Синтез комплексных соединений (I–III). Навески HL ⋅ HCl в количествах, соответствующих 5 × × 10–3 моль, растворяли в 20 мл дистиллированной воды при комнатной температуре. К полученным растворам добавляли по каплям 0.1 М раствор NaOH до рН 8 (контроль по универсальному индикатору) и медленно при интенсивном перемешивании приливали к водным растворам, содержащим навески 5 × 10–3 моль хлоридов двухвалентных металлов, нагревали и перемешивали при 60°С в течение 30 мин, затем медленно охлаждали до комнатной температуры. Кристаллизация I–III начиналась через 2–3 сут выдерживания маточных растворов при комнатной температуре. Осадки отделяли центрифугированием и промывали в небольшом количестве дистиллированной воды до отрицательной реакции фильтрата на хлорид-анионы. Выход продуктов составил 60–65%.
Элементный анализ Fe(L)2 ⋅ 2H2O (I) (C14H18FeN4O6, М = 394.17) показал: С 42.66, N 14.21, Н 4.60, Fe 14.17 мас. % (вычислено); С 42.11, N 13.95, Н 4.82, Co 14.55 мас. % (найдено). Для Co(L)2 ⋅ 2H2O (II) (C14H18CoN4O6, М = 397.25) вычислено: С 42.33, N 14.10, Н 4.57, Co 14.84 мас. %; найдено: С 41.58, N 14.01, Н 4.78, Zn 15.95 мас. %. Для Zn(L)2 ⋅ 2H2O (III) (C14H18ZnN4O6, М = 403.70) вычислено: С 41.65, N 13.88, Н 4.49, Zn 16.19 мас. %; найдено: С 42.64, Н 2.79, Cu 16.34, Cl 17.65 мас. %. Для Cu2(L1)4(H2O)2 (IV) (C28H20Cu2O10Cl4, М = 785.36) вычислено: С 42.82, Н 2.57, Cu 16.18, Cl 18.06 мас. %.
Синтез комплексного соединения (IV) проводили аналогично I–III, но темно-зеленые монокристаллы IV, Cu2(L1)4(H2O)2, выделяли при медленном упаривании реакционной смеси при температуре 28–30°С. Выход 45%.
ИК-спектры поглощения органических молекул и комплексных соединений регистрировали на спектрофотометре ФТ 801 в интервале частот 4000–400 см–1 с использованием таблеток KBr.
Электронные спектры поглощения растворов органических молекул в различных интервалах рН и их комплексных соединений записывали на спектрофотометре Cary-50 в интервале длин волн 200–700 нм. Состав и константы образования комплексов рассчитывали методом насыщения [15].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Монокристаллы HL ⋅ HCl и Cu2(L1)4(H2O)2 выделены при изучении процесса комплексообразования 2-гидразинбензойной кислоты в различных средах. В нейтральной среде комплексообразования 3d-металлов с 2-гидразинобензойной кислотой не происходит. Светло-коричневые игольчатые монокристаллы HL ⋅ HCl выделили при медленном испарении водного раствора, содержащего смесь органического лиганда и хлорида кобальта(II) в нейтральной среде (без добавления NaOH).
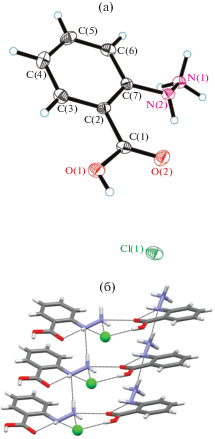
Молекулярная структура соединения представлена на рис. 1а. Элементарная ячейка включает в себя молекулу 2-гидразинобензойной кислоты с протонированным атомом N1 и хлорид-анион. Длины связей (рис. 1а) и валентные углы стандартные. Основные межатомные расстояния: O(1)–C(1) 1.324(3), O(2)–C(1) 1.222(3), C(7)–N(2) 1.416(3), N(2)–N(1) 1.439(3), N(2)–H(2) 0.87(3) Å. Карбоксильная и гидразиновая группы в молекуле развернуты друг относительно друга, однако в молекуле HL присутствует достаточно прочная внутримолекулярная водородная связь H3N–NH⋅⋅⋅O=C–OH (рис. 1б). Хлорид-анион участвует в водородных связях O(1')–H(1)⋅⋅⋅Cl(1) (O(1)–H(1) 0.79(3), H(1)⋅⋅⋅Cl(1) 2.27(3), O(1)⋅⋅⋅Cl(1) 3.055(2) Å, угол О(1)–Н(1)–Сl(1) 174(3)°) и N(1)–H(12)⋅⋅⋅Cl(1) (N(1)–H(12) 0.96(4), H(12)⋅⋅⋅Cl(1) 2.42(3), N(1)⋅⋅⋅Cl(1) 3.198(3) Å, угол N(1)–H(12)–Cl(1) 139(3)°), формирующих стопки (рис. 1б).
Рис. 1.
Молекулярная структура HL ⋅ HCl (а); фрагмент кристаллической упаковки (б): водородные связи показаны пунктирными линиями, атомы хлора – сферами.
Для определения оптимальных условий синтеза комплексов проводили потенциометрическое титрование растворов HL, а также смесей раствора HL с растворами переходных металлов. Рассчитанная методом [16] константа депротонирования составила 8.3 ± 0.1. Кривые потенциометрического титрования смесей растворов HL с растворами 3d-солей лежат ниже кривых титрования свободных лигандов в областях рН больше 6.5–8.5. Можно утверждать, что процессы комплексообразования начинаются в слабощелочных растворах и сопровождаются депротонированием органических молекул.
Об участии карбоксильной группы в координации судили по характеру изменения ИК-спектров поглощения. ИК-спектры HL характеризуются интенсивными полосами поглощения в области валентных колебаний С=О-связи карбоксильной группы [17] 1680 см–1. В случае металлокомплексов M(L)2 ⋅ 2H2O (M2+ = Fe, Co, Zn) (I–III) величина ∆ν(СОO–) смещается на 56–64 см–1. Вероятно, в этом случае реализуется хелатная координация HL с участием монодентатно координированной депротонированной карбоксильной группы и атома азота гидразинового фрагмента молекулы.
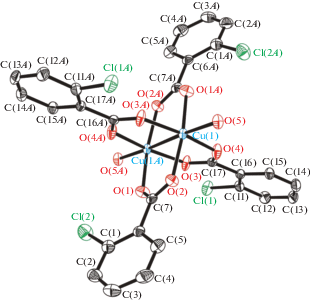
Электронные спектры поглощения водных растворов HL характеризуются двумя полосами поглощения в ультрафиолетовой части спектра (рис. 2). При постепенном добавлении неорганических солей металлов (спектрофотометрическое титрование) смещение длинноволновой полосы при комплексообразовании отсутствует, наблюдается увеличение ее интенсивности. Отметим особый характер изменения спектра HL при постепенном добавлении раствора CuCl2 (рис. 3). Добавление первых порций неорганической соли не приводит к появлению изобестических точек, а только к общему уменьшению интенсивности всех лигандных полос поглощения, что, вероятно, связано с уменьшением концентрации HL. Начиная с некоторого момента титрования характер полос поглощения резко изменяется, что может быть связано с изменением структуры органической молекулы. И действительно, в процессе синтеза комплексного соединения Cu(II) с HL (в отличие от комплексов I–III) при смешивании растворов CuCl2 и HL в слабощелочной среде (рН 8) наблюдалось обильное газовыделение (предположительно гидразина). После медленного упаривания образовавшиеся темно-зеленые призматические монокристаллы, согласно элементному анализу, не содержат атомов азота. Расшифровка кристаллической структуры [18] показала, что выделенное соединение является комплексом меди(II) с 2-хлорбензойной кислотой HL1. Соединение представляет собой центросимметричный димер состава [Cu(H2O)]2(µ-L1)4 (рис. 4). Координационный полиэдр атома меди – квадратная пирамида с четырьмя атомами кислорода карбоксильных групп четырех бидентатных хелатно-мостиковых анионов (L1)– в экваториальной плоскости и атомом кислорода молекулы воды в аксиальной позиции. В кристалле димеры соединены межмолекулярными водородными связями с участием атомов кислорода депротонированных карбоксильных групп и атомов водорода молекул воды.
Рис. 2.
Изменение в электронных спектрах поглощения водных растворов HL (С = 10–4 моль/л) при постепенном добавлении 10–2 М раствора Zn(NO3)2.
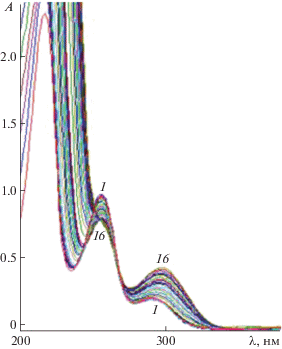
Рис. 3.
Изменение в электронном спектре поглощения водного раствора HL3 (С = 10–4 моль/л) при постепенном добавлении 10–2 М раствора CuCl2.
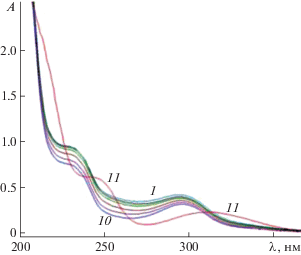
Рис. 4.
Молекулярная структура Cu2(L4)4(H2O)2. Тепловые эллипсоиды изображены с 50%-ной вероятностью. Атомы водорода не приведены.
Работа выполнена при поддержке Российского университета дружбы народов (проект 5-100).
Список литературы
Eshwika A., Coyle B., Devereux M. // BioMetals. 2004. V. 17. P. 415.
Geraghty M., Sheridan V., McCann M. et al. // Polyhedron. 1999. V. 18. P. 2931.
Chenoweth M.B. // Pharmocol. Rev. 1956. V. 8. P. 57.
Reid J., Watson R.D., Cochran J.B., Sproull D.H. // Br. Med. J. 1951. V. 1. P. 321.
Sorenson J.R.J. // J. Med. Chem. 1984. V. 27. P. 1747.
Sorenson J.R.J. // Metal Ions in Biological Systems. V. 14 / Ed. Siegel H. New York: Marcel–Dekker, 1982. P. 77.
Čongrádyová A., Jomová K. // J. Microbiol. Biotechnol Food Sci. 2013. V. 2. Special Iss. 1. P. 1377.
Korolkiewicz Z., Hac E., Gagalo I. et al. // Agents Actions. 1989. V. 26. P. 355.
Ye B.-H., Tong M.-L., Chen X.M. // Coord. Chem. Rev. 2005. V. 249. P. 545.
Eddaoudi M., Moler D.B., Li H. et al. // Acc. Chem. Res. 2001. V. 34. P. 319.
Rodrıguez-Martın Y., Hernandez-Molina M., Delgado F.S. // Cryst. Eng. Commun. 2002. V. 4. P. 522.
Sheldrik G.M. SHELX-86. Program for the Crystal Structure Determination. Cambridge (England): Univ. of Cambridge, 1986.
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. P. 112.
Sheldrick G.M. SHELXTL. Version 6.14. Structure Determination Software Suite. Madison (WI, USA): Brucker AXS, 2000.
Бек М., Надьпал И. Исследование комплексообразования новейшими методами. М.: Мир, 1989. 549 с.
Альберт А., Сержент Е. Константы ионизации кислот и оснований. М.; Л.: Химия, 1964. 179 с.
Накамото K. Инфракрасные спектры неорганических и координационных соединений. М.: Мир, 1991. 412 с.
Kawata T., Ohba S., Tokii T. et al. // Acta Cryst. C. 1992. V. 48. P. 1590.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография


