Кристаллография, 2021, T. 66, № 3, стр. 429-434
Кристаллическая структура и физико-химические характеристики двух новых адамантановых производных сульфаниламида
О. В. Ковальчукова 1, *, В. П. Казаченко 2, В. В. Ткачев 2, 3, А. Н. Утенышев 3, 4, Н. Н. Страхова 2, А. Н. Прошин 2
1 Российский университет дружбы народов
Москва, Россия
2 Институт физиологически активных веществ РАН
Черноголовка, Россия
3 Институт проблем химической физики РАН
Черноголовка, Россия
4 Первый Московский государственный медицинский университет имени И.М. Сеченова
Москва, Россия
* E-mail: kovalchukova_ov@rudn.university
Поступила в редакцию 16.07.2020
После доработки 29.07.2020
Принята к публикации 02.08.2020
Аннотация
Синтезированы и изучены два производных адамантанобензолсульфамида: N-адамантан-1-ил-2,4,6-триметилбензосульфамид (1) и N-адамантан-1-ил-4-метоксибензосульфамид (2). С помощью рентгеноструктурного анализа установлена кристаллическая структура 1 и 2. Методом изотермического насыщения определены величины растворимостей соединений в фосфатном буферном растворе с pH 7.4, 1-октаноле и n-гексане в нескольких температурных точках. Определены энергия Гиббса, энтальпия и энтропия растворимости соединений при 298 К.
ВВЕДЕНИЕ
В настоящее время производные сульфаниламида являются широко распространенными лекарственными препаратами, обладающими широким спектром терапевтического действия: антибактериальным, гипогликемичским, диуретическим [1, 2]. В последние годы выявлена противоопухолевая активность некоторых содержащих сульфаниламид соединений [3].
Эффективность действия потенциальных лекарственных препаратов во многом определяется не только их строением, но и способностью перемещаться в организме к очагу заболевания. Водорастворимость соединений считается основополагающим фактором, однако нельзя сбрасывать со счетов липофильность соединений, которая обусловливает способность молекул проникать через клеточные мембраны. Большинство тестируемых потенциальных лекарственных форм обычно характеризуется только одним типом растворимости (лиофильность или липофильность). Введение дополнительных фрагментов в потенциальные биологически активные соединения часто способствует устранению указанной выше проблемы.
В последние годы для модификации разрабатываемых лекарственных форм используют адамантановые фрагменты [4, 5]. Сферическое строение адамантана обусловливает его полезные свойства: высокую степень липофильности, химическую устойчивость, термостабильность, конформационную жесткость и другие. Обладая высокой липофильностью и практически отсутствием токсикологических свойств, адамантановые заместители облегчают лекарственным препаратам способность проникать через клеточные мембраны, улучшая таким образом их фармакокинетику.
Молекулы, содержащие заместители в адамантановом фрагменте, имеют сложное пространственное строение и в зависимости от природы заместителей изменяют свою растворимость и другие характеристики и могут иметь различные степени биологической активности.
Настоящая работа является продолжением исследований, посвященных синтезу и изучению строения и физико-химических характеристик (в том числе способности растворяться в лиофильных и липофильных средах) сульфаниламидных производных адамантана [6–8].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
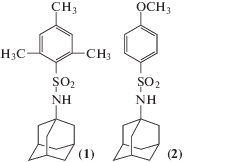
С целью дальнейшего поиска эффективных потенциальных лекарственных форм и изучения влияния молекулярного дизайна на кристаллическое строение и растворимость соединений в лиофильных и липофильных средах по методикам, описанным ранее [8], синтезированы и изучены два производных адамантанобензолсульфаниламида:
Строение соединений подтверждено с помощью 1Н ЯМР-спектроскопии (спектрометр Bruker CXP-200, рабочая частота 200 МГц, растворитель CDCl3, внутренний стандарт – тетраметилсилан) и элементного анализа (CHN-анализатор фирмы Carlo-Erba).
N-адамантан-1-ил-2,4,6-триметилбензосульфаниламид (1). В результате элементного анализа найдено: С 68.49, H 8.33, N 4.11 мас. %. Химическая формула C19H27NO2S. Вычислено: С 68.43, H 8.16, N 4.20 мас. %. ЯМР 1Н (химический сдвиг δ): 1.57 (м, 6H, AdH), 1.76 (м, 6H, AdH), 1.98 (уширенный с, 3H, AdH), 2.28 (с, 3H, CH3), 2.65 (с, 6H, 2CH3), 4.40 (с, 1H, NH), 6.92 м.д. (c, 2H, ArH).
N-адамантан-1-ил-4-метоксибензосульфаниламид (2). В результате элементного анализа найдено: С 63.32, H 7.28, N 4.52 мас. %. Химическая формула C17H23NO3S. Вычислено: С 63.52, H 7.21, N 4.36 мас. %. ЯМР 1Н (δ): 1.55 (м, 6H, AdH), 1.76 (м, 6H, AdH), 1.98 (уширенный с, 3H, AdH), 3.85 (с, 3H, OCH3), 4.63 (уширенный с, 1H, NH), 6.93 (д, J = 8.80 Гц, 2H, ArH), 7.82 м.д. (д, J = 8.80 Гц, 2H, ArH).
Монокристаллы соединений 1 и 2 выращивали из 96%-ного этанола путем медленного испарения. Вещества полностью растворяли в растворителе при небольшом нагревании и непрерывном перемешивании. Полученные растворы медленно испаряли при комнатной температуре через небольшие отверстия в защитной пленке, закрывающей бюксы с растворами.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структур 1 и 2 приведены в табл. 1. Структуры расшифрованы прямым методом [9, 10] по программе [11] и уточнены полноматричным методом наименьших квадратов в анизотропном приближении смещений всех атомов, кроме атомов водорода. Атомы водорода при атомах азота были локализованы из разностного синтеза Фурье, их позиционные и тепловые параметры уточняли в изотропном приближении. Остальные атомы водорода были помещены в геометрические позиции и включены в уточнение в соответствии с моделью “наездника”. Расчеты выполняли по программе SHELXTL [12]. Кристаллические структуры депонированы в Кембриджской базе структурных данных (CCDC № 1900204 и 1900202) и могут быть свободно получены по запросу на интернет-сайте www.ccdc.cam.ac.uk/data_request/cif.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структур 1 и 2
| Соединение | 1 | 2 |
|---|---|---|
| Эмпирическая формула | C19H27NO2S | C17H23NO3S |
| М, г/моль | 333.48 | 321.42 |
| Сингония, пр. гр., Z | Триклинная, P$\bar {1}$, 2 | Моноклинная, P21/a, 8 |
| a, b, c, Å | 6.4891(5), 10.2159(6), 13.3721(9) | 10.7378(3), 13.2901(4), 22.2103(6) |
| α, β, γ, град | 91.629(5), 96.414(6), 99.212(6) | 90, 91.668(3), 90 |
| V, Å3 | 868.59(10) | 3168.21(16) |
| Dx, г/см3 | 1.275 | 1.348 |
| Излучение; λ, Å | МоKα; 0.71073 | |
| μ, мм–1 | 0.196 | 0.127 |
| Т, К | 150.0(1) | 100.0(1) |
| Размер образца, мм | 0.40 × 0.36 × 0.32 | 0.32 × 0.28 × 0.25 |
| Дифрактометр | Bruker XSCANS | |
| Тип сканирования | /ω ω/2θ | |
| Учет поглощения; Tmin, Tmax | 0.98851, 1.000 | 0.9548, 1.000 |
| θmax, град | 29.07 | |
| Пределы h, k, l | –8 ≤ h ≤ 8, –13 ≤ k ≤ 13, –17 ≤ l ≤ 18 | –14 ≤ h ≤ 14, –6 ≤ k ≤ 18, –28 ≤ l ≤ 30 |
| Число отражений: измеренных/независ. (N1)/с I > 2σ(I) (N2) | 7532/4633/3757 | 15 999/8395/6396 |
| Метод уточнения | Полноматричный МНК по F2 | |
| Весовая схема | Полуэмпирическая, из эквивалентов | |
| Число параметров | 360 | 1376 |
| R1/wR2 по N1 | 0.0439/0.1052 | 0.0810/0.1809 |
| R1/wR2 по N2 | 0.0571/0.1142 | 0.1001/0.1956 |
| S | 1.035 | 1.056 |
| Δρmin/Δρmax, э/Å3 | –0.378/0.329 | –0.915/0.720 |
Растворимость соединений 1 и 2 изучали в 1-октаноле (чистота 99% и выше, фирма Merk, Германия), n-гексане (марка ХЧ, “Химмед”, Россия), которые использовали без дальнейшей очистки, и в фосфатном буферном растворе. Буферный водный фосфатный раствор с pH 7.4 готовили путем смешивания растворов фосфатных кислых солей калия и натрия (КH2PO4 и Na2HPO4, марка ЧДА, “Реахим”, Россия) по методике [13]. Концентрации используемых солей были взяты таким образом, чтобы ионная сила полученных растворов соответствовала 0.15 моль/л (физиологическое значение). Значения рН измеряли с помощью прибора Corning pH-meter-430.
Эксперименты по определению растворимости проводили с использованием метода изотермического насыщения в нескольких температурных точках: 20, 25, 30 или 32, 35 или 37 и 42 или 45 ± 0.1°C. Все экспериментальные данные представлены в мольных долях. Твердую фазу удаляли фильтрованием через фильтры Acrodisc CR Syringe Filter, PTFE, с диаметром пор 0.2 мкм или центрифугированием с использованием центрифуги марки Biofuge Pico (Kendo Laboratory, Германия) при скорости вращения 10 000 об./мин в течение 3 мин. Все фильтры, пипетки, шприцы и стеклянная посуда, соприкасавшиеся с исходными растворами, были предварительно термостатированы при температуре эксперимента. Результаты эксперимента представлены как среднее значение по меньшей мере трех экспериментов. Молярную растворимость соединений измеряли на спектрофотометре с точностью 2–2.5% с использованием протокола, описанного в [14].
Стандартные значения энергии Гиббса процессов растворения $\Delta G_{{{\text{sol}}}}^{0}$ [кДж моль–1] были рассчитаны с использованием следующего уравнения:
где X2 – мольная доля вещества в насыщенном при 298.15 К растворе, а γ2 – коэффициент активности растворенного вещества.Cтандартную энтальпию растворения $\Delta H_{{{\text{sol}}}}^{0}$ [кДж моль–1] вычисляли по уравнению Вант-Гоффа:
полагая, что из-за низкой растворимости исследуемых веществ коэффициент активности γ2 равен единице, а энтальпия растворения не зависит от концентрации.Температурные зависимости растворимостей веществ в пределах выбранного температурного интервала описываются линейной функцией:
где A – интегральный коэффициент, относящийся к энтропии, а B = $\Delta H_{{{\text{sol}}}}^{0}$/R.Значения стандартной энтропии растворения $\Delta S_{{{\text{sol}}}}^{0}$ [Дж моль–1 К–1] были получены из уравнения Гиббса:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
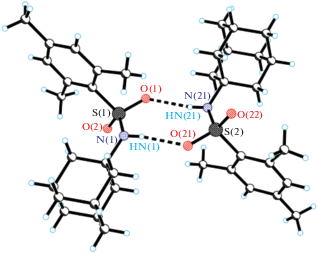
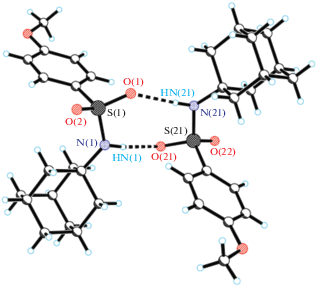
Согласно данным рентгеноструктурного анализа структурными единицами соединений 1 и 2 являются центросимметричные димерные ассоциаты N-адамантан-1-ил-2,4,6-триметилбензосульфаниламида (рис. 1) и молекулы N-адамантан-1-ил-4-метоксибензосульфаниламида (рис. 2). Как видно, наличие двух метильных заместителей в бензольном кольце молекул практически не влияет на конформацию молекул. Торсионный угол между бензольным кольцом и адамантановым фрагментом равен 86.20 (13)° в молекуле 1 и 62.7 (3)° в молекуле 2. Длины связей в адамантановом, сульфаниламидном и бензольном фрагментах стандартные и соответствуют значениям, определенным ранее для родственных структур [5, 6]. В кристалле молекулы 1 и 2 упакованы в стопки по типу “голова–голова”, ориентированные вдоль оси b. Параметры межмолекулярных водородных связей, объединяющих молекулы 1 и 2 в димерные ассоциаты, приведены в табл. 2. Водородные связи между димерными ассоциатами в стопках отсутствуют.
Таблица 2.
Геометрические параметры водородных связей в структурах 1 и 2
| D–H⋅⋅⋅A | d, Å | ∠DHA, град | ||
|---|---|---|---|---|
| D–H | H⋅⋅⋅A | D⋅⋅⋅A | ||
| Структура 1 | ||||
| N(1)–HN(1)⋅⋅⋅O(21а) | 0.826 | 2.110 | 2.926 | 169.7 |
| Структура 2 | ||||
| N(1)–HN(1)⋅⋅⋅O(21а) | 0.941 | 1.990 | 2.928 | 173.8 |
| N(1а)–HN(1а)⋅⋅⋅O(21) | 0.903 | 2.071 | 2.993 | 176.2 |
Поскольку изучаемые соединения 1 и 2 имеют потенциальную биологическую активность, представляло интерес изучить их способность растворяться в физиологических жидкостях и обладать липофильными свойствами, облегчающими проникновение сквозь клеточные мембраны. В качестве модельных растворителей были выбраны фосфатный буферный раствор с рН 7.4, 1-октанол и n-гексан. Большинство биохимических реакций протекает в строго определенных интервалах pH. Одной из важных для пассивного транспорта является среда плазмы крови с рН 7.4. Растворитель 1-октанол удобен для моделирования липидного слоя клеточной мембраны. Система (n-гексан/буфер) применяется для моделирования гематоэнцефалического барьера, n-гексан (способный только к неспецифическим взаимодействиям) имитирует неполярные области головного мозга, тогда как буфер – кровеносную систему.
Для оценки энергетических аспектов взаимодействия соединений 1 и 2 с растворителями были рассчитаны термодинамические функции процессов. Температурные зависимости растворимости соединений в указанных выше растворителях приведены в табл. 3, а термодинамические функции растворимости – в табл. 4, 5 .
Таблица 3.
Температурные зависимости растворимости (мольные доли) X2 × 10y соединений (1) и (2) в буферном растворе (рН 7.4), 1-октаноле и n -гексане
| Соеди-нение | t,°C; параметр | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 25 | 30 | 35 | 37 | 40 | 42 | 45 | Aа | Bа | Rб | σв × 10–2 | |
| Буферный раствор (рН 7.4)г | |||||||||||
| 1 | 4.87 | 5.95 | 7.13 | 8.21 | 9.82 | 0.3 ± 0.1 | 306 ± 8 | 0.9989 | 0.45 | ||
| 2 | 7.51 | 8.29 | 9.65 | 10.90 | 12.00 | 4.0 ± 0.3 | 2325 ± 88 | 0.9979 | 1.53 | ||
| 1-октанолд | |||||||||||
| 1 | 4.45 | 5.50 | 6.62 | 7.92 | 5.1 ± 0.5 | 3127 ± 141 | 0.9970 | 2.63 | |||
| 2 | 6.36 | 7.78 | 8.68 | 10.90 | 4.7 ± 0.4 | 2903 ± 112 | 0.9978 | 2.09 | |||
| n-гексане | |||||||||||
| 1 | 3.07 | 3.66 | 4.84 | 5.47 | 2.5 ± 0.4 | 3147 ± 134 | 0.9973 | 2.57 | |||
| 2 | 0.93 | 1.17 | 1.67 | 1.85 | 4.3 ± 0.8 | 4055 ± 235 | 0.9950 | 4.51 | |||
Таблица 4.
Термодинамические функции растворимости соединений 1 и 2 в буферном растворе (рН 7.4), 1-октаноле и n -гексане при 298 К и p = 0.1 МПа
| Соединение | Параметр | ||||||
|---|---|---|---|---|---|---|---|
| $X_{2}^{{298}}$, 10–5 мол. д.а |
$\Delta G_{{{\text{sol}}}}^{0}$, кДж моль–1 |
$\Delta H_{{{\text{sol}}}}^{0}$, кДж моль–1 |
$--T\Delta S_{{{\text{sol}}}}^{0}$, кДж моль–1 |
$\Delta S_{{{\text{sol}}}}^{0}$, Дж моль–1 K1 |
ςHsol, %б | ςTSsol, %в | |
| Буферный раствор (рН 7.4) | |||||||
| 1 | 0.487 | 30.3 | 2.5 ± 0.1 | –27.8 | –93.2 ± 3.4 | 8.3 | –91.7 |
| 2 | 0.751 | 29.3 | 19.3 ± 0.7 | –10.0 | –33.5 ± 1.6 | 65.8 | –34.2 |
| 1-октанол | |||||||
| 1 | 445 | 13.4 | 26.0 ± 1.2 | 12.6 | 42.2 ± 2.3 | 67.4 | 32.6 |
| 2 | 542 | 12.5 | 24.1 ± 0.9 | 11.6 | 39.0 ± 1.9 | 67.5 | 32.6 |
| n-гексан | |||||||
| 1 | 30.7 | 20.1 | 26.2 ± 1.1 | 6.1 | 20.2 ± 1.1 | 81.1 | 18.9 |
| 2 | 9.28 | 23.0 | 33.7 ± 2.0 | 10.7 | 35.8 ± 2.4 | 75.9 | 24.1 |
Как видно из табл. 3, введение метоксильной группы в пара-положение бензольного кольца (соединение 2) увеличивает его растворимость в буферном растворе по сравнению с соединением 1, содержащим в бензольном фрагменте молекулы три метильные группы. Стандартные значения энтальпии и энтропии растворения соединения 2 в фосфатном буферном растворе значительно больше, чем соединения 1.
Растворимость соединения 2 в 1-октаноле также превышает растворимость соединения 1, однако термодинамические функции растворения изменяются слабо, величины соответствуют друг другу в пределах ошибки эксперимента. В то же время растворимость соединения 2 в n-гексане понижается по сравнению с растворимостью соединения 1. Стандартные энтальпия и энтропия растворения соединения 2 превышают аналогичные значения, рассчитанные для соединения 1, хотя различие в рассчитанных величинах не столь значительно, как в случае растворимости в фосфатном буферном растворе. В целом полученные данные соответствуют представленным ранее результатам изучения процессов растворимости широкого круга замещенных адамантанобензолсульфамидов [8].
Работа выполнена при финансовой поддержке Минобрнауки РФ (проект № 075-03-2020-223 (FSSF-2020-0017)) и по теме Государственного задания (№ государственной регистрации 0089-2019-0011).
Список литературы
Drews J. // Science. 2000. V. 287. № 5460. P. 1960. https://doi.org/10.1126/science.287.5460-5464.1960
Supuran C.T., Scozzafava A. // Expert Opin. Ther. Pat. 2000. V. 10. № 5. P. 575. https://doi.org/10.1517/13543776.10.5.575
Abbate F., Casini A., Owa T. et al. // Bioorg. Med. Chem. Lett. 2004. V. 14. № 1. P. 217. https://doi.org/10.1016/j.bmcl.2003.09.062
Perlovich G.L., Volkova T.V. // Phys. Chem. Chem. Phys. 2018. V. 20. № 30. P. 19784. https://doi.org/10.1039/c8cp03716g
Voronin A.P., Volkova T.V., Ilyukhin A.B. et al. // Cryst. Eng. Commun. 2018. V. 20. № 25. P. 3476. https://doi.org/10.1039/c8ce00426a
Perlovich G.L., Ryzhakov A.M., Strakhova N.N. et al. // J. Chem. Thermodyn. 2014. V. 69. № 1. P. 56. https://doi.org/10.1016/j.jct.2013.09.027
Perlovich G.L., Ryzhakov A.M., Tkachev V.V., Proshin A.N. // Cryst. Eng. Commun. 2015. V. 17. № 25. P. 753.
Perlovich G.L., Volkova T.V., Sharapova A.V. et al. // Phys. Chem. Chem. Phys. 2016. V. 18. № 13. P. 9281. https://doi.org/10.1039/c6cp00379f
Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. № 1. P. 112. https://doi.org/10.1107/S0108767307043930
Sheldrick G.M. // Acta Cryst. A. 2015. V. 71. № 1. P. 3. https://doi.org/10.1107/S2053229614024218
Sheldrik G.M. SHELX-86, Program for the Crystal Structure Determination, 1986. University of Cambridge (England).
Sheldrick G.M. SHELXTL v. 6.14, Structure Determination Software Suite, Brucker AXS, 2000. Madison (Wisconsin, USA).
Perlovich G.L., Volkova T.V., Proshin A.N. et al. // Mol. Pharm. 2011. V. 8. № 5. P. 1807. https://doi.org/10.1021/mp2003237
Perlovich G.L., Bauer-Brandl A. // Curr. Drug Deliv. 2004. V. 1. № 3. P. 213. https://doi.org/10.1002/jps.20611
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография