Кристаллография, 2021, T. 66, № 3, стр. 417-423
Кристаллическая структура N-[2-(4-оксо-4Н-бензо[d][1, 3]-оксазин-2-ил) бензамида и пропионамида и их азотистого аналога N-[2-(4-оксо-3,4-дигидрохиназолин-2-ил)фенил]пропионамида
Л. Г. Кузьмина 1, *, С. Ю. Салыкин 2, **, С. В. Кулагин 3, К. Е. Меркулов 2, Б. М. Болотин 2, 3, ***
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт” – ИРЕА
Москва, Россия
3 ООО Фирма “ОЛБО”
Москва, Россия
* E-mail: kuzmina@igic.ras.ru
** E-mail: stsalykin@yandex.ru
*** E-mail: bolotin70@yandex.ru
Поступила в редакцию 28.05.2020
После доработки 22.07.2020
Принята к публикации 22.07.2020
Аннотация
Особенности молекулярной и кристаллической структуры двух замещенных бензоксазинонов (I и II) и их структурного аналога – хиназолинона (III) – изучены методом рентгеноструктурного анализа. Соединение I существует в двух кристаллических модификациях. Все исследованные молекулы неплоские; характер их непланарности различен. В молекулах I и II замыкается внутримолекулярная водородная связь N–H⋅⋅⋅N, а не потенциально возможная N–H⋅⋅⋅О. В молекуле III также присутствует аналогичная водородная связь. Наличие слабых направленных взаимодействий в кристаллических упаковках (π–π-взаимодействий в I и II и межмолекулярных водородных связей N–Н⋅⋅⋅O в III) приводит к формированию изолированных димерных структур, а не бесконечных образований.
ВВЕДЕНИЕ
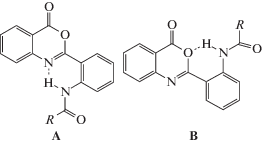
Известно, что органические соединения со структурой замещенного бензоксазинона, в которых образуется внутримолекулярная водородная связь (ВС) с орто-заместителем бензольного кольца, несущим “активный” протон, представляют группу органических люминофоров с аномально большим сдвигом Стокса [1]. Особенности их спектрального поведения существенно зависят от способа замыкания внутримолекулярной ВС. Например, в N-[2-(4-оксо-4Н-бензо[d] [1,3]-оксазин-2-ил)бензамиде (I) и N-[2-(4-оксо-4Н-бензо[d] [1,3]-оксазин-2-ил)пропионамиде (II) можно представить два способа замыкания внутримолекулярной ВС:
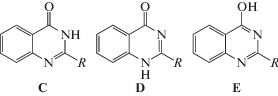
Согласно [2–7] в указанной группе соединений с наибольшей вероятностью образуется структура типа А.Близкие электронные аналоги бензоксазинонов – хиназолиноны – могут характеризоваться большим разнообразием структурных проявлений и, следовательно, иными спектральными свойствами. Действительно, в отличие от бензоксазинонов для хиназолинонов, не содержащих заместителей в положении 3, теоретически возможны три таутомерные формы, две из которых – кето-формы, а третья – енольная форма:
В исследованных к настоящему времени кристаллах хиназолинонов обнаруживается исключительно кето-форма С [8–11].Кроме того, в отличие от замещенных бензоксазинонов I и II, где возможно возникновение только одной внутримолекулярной ВС (структуры А или В), в N-[2-(4-оксо-3,4-дигидрохиназолин-2-ил)фенил] пропионамиде (III) и N-[2-(4-оксо-3,4-дигидрохиназолин-2-ил)фенил] бензамиде (IV) присутствует еще один “активный” протон, способный образовывать ВС, а именно атом водорода при втором атоме азота гетероцикла. Исходя из геометрических особенностей этих молекулярных систем, можно заключить, что вторая ВС в них может быть только межмолекулярной, что должно существенным образом повлиять на спектральные характеристики вещества в твердом состоянии.
С целью установления деталей молекулярной геометрии и особенностей кристаллической упаковки проведено рентгеноструктурное исследование соединений I, II и III. Монокристаллы соединения IV вырастить не удалось.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Рентгеноструктурный анализ. Соединение I получено в виде двух кристаллических модификаций – триклинной (Ia) и моноклинной (Ib). Монокристалл каждого соединения – Ia, Ib, II и III – помещали на CCD-дифрактометр Bruker SMART APEX II и под потоком охлажденного азота измеряли кристаллографические параметры и интенсивности экспериментальных отражений (MoKα-излучение, графитовый монохроматор, ω-сканирование). Первичная обработка экспериментальных данных проведена по программе SAINT [12].
Структуры расшифрованы прямыми методами. Их уточнение проведено методом наименьших квадратов по F 2 в анизотропном приближении смещений всех атомов, кроме водорода. Положения атомов водорода рассчитаны геометрически, соответствующие координаты включены в окончательные этапы уточнения по модели наездника. Кристаллографические характеристики и параметры расшифровки и уточнения структур приведены в табл. 1 и 2. Все расчеты выполнены по программам OLEX-2 [13, 14].
Таблица 1.
Кристаллографические параметры, данные эксперимента и результаты уточнения структур Ia и Ib
| Формула | C21H14N2O3 (Ia) | C21H14N2O3 (Ib) |
|---|---|---|
| Сингония, пр. гр., Z | Триклинная, P$\bar {1}$, 2 | Моноклинная, P21/n, 4 |
| a, b, c, Å | 8.4580(9), 9.4046(10), 11.0005(12) | 3.8009(6), 19.806(3), 20.933(3) |
| α, β, γ, град | 67.913(4), 83.135(4), 83.400(4) | 90, 90.825(5), 90 |
| V, Å3 | 802.66(15) | 1575.7(4) |
| Dx, г/см3 | 1.416 | 1.443 |
| Излучение; λ, Å | MoKα; 0.71073 | |
| μ, см–1 | 0.096 | 0.098 |
| Т, К | 100 | |
| Размер образца, мм | 0.18 × 0.14 × 0.08 | 0.16 × 0.03 × 0.02 |
| Дифрактометр | Bruker SMART Apex-II | |
| Учет поглощения; Тmin, Tmax | SADABS; 0.847, 0.971 | SADABS; 0.824, 0.970 |
| 2θmax, град | 54 | |
| Пределы h, k, l | –10 ≤ h ≤ 10, –11 ≤ k ≤ 12, –14 ≤ l ≤ 14 | –4 ≤ h ≤ 4, –25 ≤ k ≤ 25, –26 ≤ l ≤ 24 |
| Число отражений: измеренных/независимых (N1), Rint/c I > 2σ(I) (N2) | 8087/3530, 0.0251/2821 | 4314/3367, 0.0591/3367 |
| Метод уточнения | МНК по F 2 | |
| Число параметров | 235 | |
| R1/wR2 по N1 | 0.0565/0.1113 | 0.1003/0.1855 |
| R1/wR2 по N2 | 0.0434/0.1039 | 0.0742/0.1720 |
| S | 1.027 | 1.050 |
| Δρmin/Δρmax, э/Å3 | –0.22/0.30 | –0.57/0.63 |
| Программы | SAINT [12], Olex-2 [13, 14] | |
Таблица 2.
Кристаллографические параметры, данные эксперимента и результаты уточнения структур II и III
| Формула | C17H14N2O3 (II) | C17H15N3O2 (III) |
|---|---|---|
| Сингония, пр. гр., Z | Моноклинная, P21/c, 4 | Моноклинная, C2/c, 8 |
| a, b, c, Å | 8.1466(2), 18.5301(6), 9.6669(3) | 34.267(2), 5.2991(3), 15.8431(9) |
| α, β, γ, град | 90, 101.5670(10), 90 | 90, 104.308(2), 90 |
| V, Å3 | 1429.65(7) | 2787.7(3) |
| Dx, г/см3 | 1.362 | 1.398 |
| Излучение; λ, Å | MoKα; 0.71073 | MoKα; 0.71073 |
| μ, см–1 | 0.095 | 0.094 |
| Т, К | 100 | 100 |
| Размер образца, мм | 0.54 × 0.42 × 0.38 | 0.55 × 0.01 × 0.01 |
| Дифрактометр | Bruker SMART Apex-II | Bruker SMART Apex-II |
| Учет поглощения; Тmin, Tmax | SADABS; 0.8847, 0.9705 | SADABS; 0.8835, 0.9705 |
| 2θmax, град | 54 | 55 |
| Пределы h, k, l | –10 ≤ h ≤ 10, –23 ≤ k ≤ 23, –12 ≤ l ≤ 12 | –43 ≤ h ≤ 44, –6 ≤ k ≤ 6, –20 ≤ l ≤ 20 |
| Число отражений: измеренных/независимых (N1), Rint/c I > 2σ(I) (N2) | 23 620/3161, 0.0385/2707 | 21 793/3115, 0.0340/2762 |
| Метод уточнения | МНК по F 2 | МНК по F 2 |
| Число параметров | 200 | 200 |
| R1/wR2 по N1 | 0.0630/0.1174 | 0.0533/0.1219 |
| R1/wR2 по N2 | 0.0529/0.1125 | 0.0472/0.1181 |
| S | 1.134 | 1.020 |
| Δρmin/Δρmax, э/Å3 | –0.24/0.24 | –0.34/0.31 |
| Программы | SAINT [12], Olex-2 [13, 14] | |
Полный набор рентгеноструктурных данных депонирован в Кембриджский банк структурных данных (CCDC № 2007846 (Ia), 2007847 (Iб), 2007848 (II), 2007849 (III) (deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif)).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
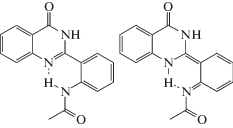
Молекулярная геометрия. Строение молекул бензоксазинонов Iа и II показано на рис. 1. Молекулы двух кристаллических модификаций I имеют близкую структуру. Во всех трех случаях молекула в кристалле присутствует в виде конформера А, структуру которого фиксирует внутримолекулярная ВС N–H⋅⋅⋅N. Однако геометрия молекулы в разных кристаллических модификациях заметно различается. Эти различия в основном касаются двугранных углов между плоскими фрагментами молекулы. В молекуле можно выделить четыре заведомо плоских фрагмента – бензоксазиновый фрагмент (плоскость А), бензольное кольцо С9…С14 (плоскость Б), амидная группа NHCO (плоскость В), бензольное кольцо С16…С21 (плоскость Г). Если в молекуле кристаллической модификации Ia двугранные углы A/Б, Б/B, B/Г и Б/Г составляют 4.06(6)°, 11.04(6)°, 23.57(6)° и 33.19(6)°, то в модификации Ib они равны 28.9(1)°, 24.1(1)°, 15.9(1)° и 8.31(1)° соответственно. Таким образом, молекула I неплоская, и характер этой непланарности в двух кристаллических модификациях различен. Это означает, что, во-первых, π-сопряжение по всему каркасу молекулы незначительно для данного класса соединений, а во-вторых, реальная геометрия молекулы определяется главным образом особенностями кристаллической упаковки. Если исходить из известного эмпирического правила, что энергия сопряжения пропорциональна ${{\cos }^{2}}\tau $ (τ – угол взаимного поворота плоских систем), то потери энергии сопряжения в результате нарушения плоскостности π-системы могут достигать 30%.
Рис. 1.
Строение молекул Iа (а) и II (б); эллипсоиды среднеквадратичных отклонений атомов приведены на уровне вероятности 50%.
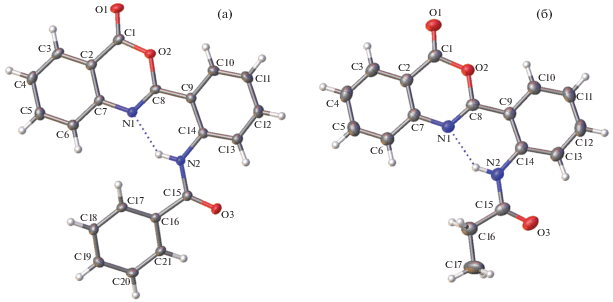
Молекула II имеет плоское строение: двугранные углы A/Б и Б/B в ней составляют 7.41(4)° и 8.78(6)°. Молекула хиназолинонового производного III показана на рис. 2. В кристалле эта молекула существует в виде кето-формы С: “активный” атом водорода связан с атомом азота N2. Эта молекула также имеет уплощенное строение – двугранные углы типа A'/Б (A' – плоскость хиназолинона) и Б/B составляют 9.52(4)° и 11.94(6)° соответственно.
Рис. 2.
Строение молекулы III; эллипсоиды среднеквадратичных отклонений атомов приведены на уровне вероятности 50%.
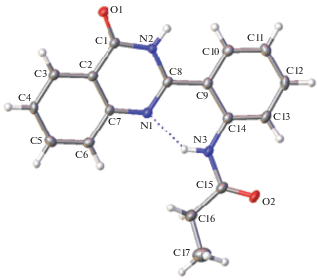
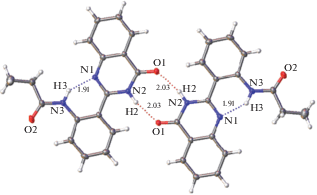
Во всех четырех структурах обнаружена внутримолекулярная ВС N1⋅⋅⋅H–N2/N3, замыкающая шестичленный цикл. Расстояния N…H и N…N, равные 1.95 и 2.68, 2.05 и 2.72, 1.97 и 2.68, 1.91 и 2.64 Å в Ia, Ib, II, III соответственно, отвечают ВС средней силы.
В табл. 3 приведены отдельные длины связей в исследованных структурах. В трех бензоксазиноновых структурах двойная связь N1=C8 практически локализована (1.283(2), 1.295(4) и 1.281(2) Å в Ia, Iб и II соответственно), тогда как в хиназолиноновой структуре она делокализована (1.303(2) Å). Это может служить указанием на большую предрасположенность хинозолиноновых соединений к прототропной таутомерии, чем бензоксазиноновых:
Таблица 3.
Отдельные длины связей (Å) в структурах Ia, Ib, II и III
| Связь | Структура | |||
|---|---|---|---|---|
| Ia | Ib | II | III | |
| С1–O1 | 1.198(2) | 1.240(3) | 1.201(2) | 1.23392) |
| C1–O2/N2 | 1.392(2) | 1.372(4) | 1.388(2) | 1.379(2) |
| C1–C2 | 1.461(2) | 1.449(4) | 1.451(2) | 1.455(2) |
| C2–C7 | 1.398(2) | 1.406(4) | 1.398(2) | 1.404(2) |
| C7–N1 | 1.398(2) | 1.39294) | 1.400(2) | 1.387(2) |
| N1–C8 | 1.283(2) | 1.295(4) | 1.281(2) | 1.303(2) |
| C8–O2/N2 | 1.371(2) | 1.388(4) | 1.374(2) | 1.383(2) |
| C8–C9 | 1.471(2) | 1.483(4) | 1.468(2) | 1.489(2) |
| C9–C10 | 1.404(2) | 1.397(4) | 1.405(2) | 1.402(2) |
| C10–C11 | 1.379(2) | 1.379(4) | 1.378(2) | 1.385(2) |
| C11–C12 | 1.386(2) | 1.384(4) | 1.386(2) | 1.389(2) |
| C12–C13 | 1.389(2) | 1.378(4) | 1.377(2) | 1.380(2) |
| C13–C14 | 1.399(2) | 1.394(4) | 1.401(2) | 1.405(2) |
| C14–C9 | 1.421(2) | 1.408(4) | 1.420(2) | 1.429(2) |
| C14–N2/N3 | 1.400(2) | 1.406(4) | 1.397(2) | 1.393(2) |
| N2/N3–C15 | 1.366(2) | 1.363(4) | 1.370(2) | 1.376(2) |
| C15–O3/O2 | 1.227(2) | 1.220(4) | 1.219(2) | 1.216(2) |
Отметим, что тенденция к перераспределению ближайших с N1–C8 длин связей в соответствии с таутомерной перегруппировкой не обнаруживается.
Остальные приведенные в табл. 3 длины связей в исследованных структурах совпадают в пределах экспериментальных ошибок и не отклоняются от стандартных значений. Систематическое удлинение связи С9–С14 в бензольном кольце, по-видимому, обусловлено эффектом образования внутримолекулярной ВС, замыкающей шестичленный цикл.
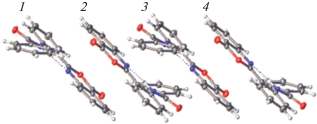
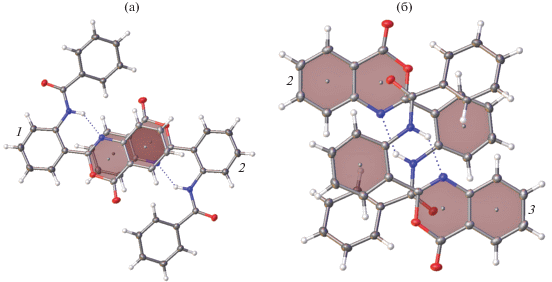
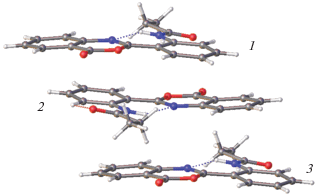
Кристаллическая упаковка. В кристаллической упаковке Ia выделяются связанные центром симметрии стопки молекул (рис. 3). Поскольку молекулы в стопке объединены центрами симметрии, соседние пары молекул 1–2 и 2–3 не эквивалентны. На рис. 4 показано взаимное проектирование в парах 1–2 и 2–3. В обеих связанных центром симметрии парах строго параллельно расположены только одноименные фрагменты, поскольку молекула в целом неплоская. В паре 1–2 взаимное перекрывание π-систем наблюдается только в случае бензоксазиноновых фрагментов, причем расстояние между плоскостями бензоксазинонов (3.45 Å) соответствует довольно сильному π–π-взаимодействию. В то же время в паре 2–3 взаимное перекрывание π-систем вообще отсутствует. Следовательно, в кристалле Ia молекулы объединены в центросимметричные димеры за счет π–π-взаимодействий между бензоксазиноновыми фрагментами соседних молекул.
Кристаллическая упаковка Ib принципиально иная. В ней также выделяются стопки (рис. 5а), но в отличие от кристаллов Ia они связаны трансляцией. Это означает, что геометрия пары 1–2 будет точно такая же, как геометрия пары 2–3, 3–4 и так далее. Строго параллельно расположены в паре одноименные фрагменты соседних молекул. Однако их взаимное проектирование охватывает лишь небольшие участки фрагментов (рис. 5б). Поэтому, хотя межплоскостное расстояние между проектирующимися одноименными фрагментами в этой стопке довольно короткое (~3.45 Å), соответствующее π–π-взаимодействие весьма незначительно.
Рис. 5.
Строение связанных трансляцией стопок молекул в кристаллах Ib (а) и взаимное проектирование пары соседних молекул в стопке (б).
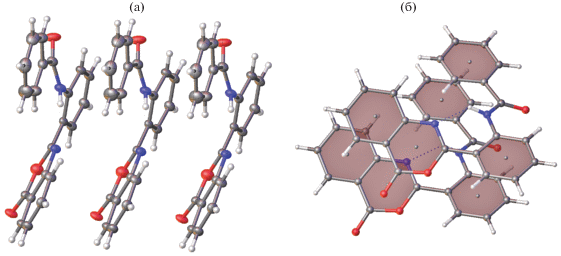
Таким образом, межмолекулярные взаимодействия в двух кристаллических модификациях различны. Этот факт необходимо учитывать при соотнесении спектральных характеристик соединения и его кристаллической структуры. Однако весьма вероятно, что в общей массе кристаллов преимущественно присутствует только одна кристаллическая модификация, а именно Ia, поскольку в ней реализуются более сильные, чем в Ib, π–π-взаимодействия, которые в большей мере стабилизируют кристаллическую упаковку.
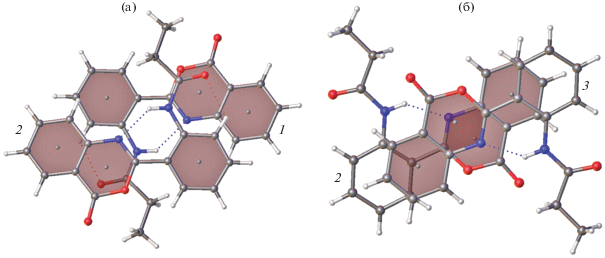
Кристаллическая структура II качественно напоминает структуру Ia. В ней также имеются связанные центром симметрии стопки (рис. 6) и реализуются разные типы взаимного проектирования в последовательных парах 1–2 и 2–3 (рис. 7). В паре 1–2 отсутствует π–π-перекрывание ароматических фрагментов, а в паре 2–3 взаимно перекрываются лишь одинаковые участки оксазиновых циклов с межплоскостным расстоянием 3.43 Å. Таким образом, молекулы в кристалле II, так же как и в кристалле Ia, объединены в димеры за счет π–π-взаимодействий соседних оксазиновых циклов.
В отличие от кристаллических упаковок I и II в упаковке III выделяются центросимметричные димеры, объединенные парами ВС типа N–H⋅⋅⋅O (рис. 8). Никаких иных слабых направленных взаимодействий в данной кристаллической упаковке не наблюдается. Особенности спектрального поведения определяются именно этими взаимодействиями.
ВЫВОДЫ
Особенности молекулярной и кристаллической структуры двух замещенных бензоксазинонов (I в двух кристаллических модификациях и II) и их структурного аналога – хиназолинона (III) – изучены методом рентгеноструктурного анализа. Все исследованные молекулы являются неплоскими, причем характер непланарности различен для всех молекул, включая молекулы разных кристаллических модификаций. Наличие слабых направленных взаимодействий в кристаллических упаковках (π–π-взаимодействий в I и II и межмолекулярных водородных связей О–Н⋅⋅⋅N в III) приводит к формированию изолированных димерных структур, а не бесконечных образований.
Список литературы
Krasovitskii B.M., Bolotin B.M. Organic Luminescent Materials. Weinheim: VCH Publishers, 1989. 351 p.
Филипенко О.С., Пономарев В.И., Атовмян Л.О., Болотин Б.М. // Кристаллография. 1987. Т. 32. С. 102.
Филипенко О.С., Болотин Б.М., Атовмян Л.О., Пономарев В.И. // Кристаллография. 1979. Т. 24. С. 957.
Филипенко О.С., Болотин Б.М., Атовмян Л.О., Пономарев В.И. // Докл. АН СССР. 1980. Т. 254. С. 365.
Утенышев А.Н., Филипенко О.С., Болотин Б.М., Пономарев В.И. // Кристаллография. 2001. Т. 46. С. 265.
Филипенко О.С., Атовмян Л.О., Болотин Б.М., Пономарев В.И. // Кристаллография. 1981. Т. 26. С. 711.
Tiekink E.R.T., Wardell J.L. // Acta Cryst. E. 2014. V. 70. P. 158.
Болотин Б.М., Михлина Я.А., Архипова С.А., Кузьмина Л.Г. // Кристаллография. 2012. Т. 57. С. 246.
Sayyad N., Cele Z., Aleti R.R. et al. // Eur. J. Org. Chem. 2018. V. 2018. № 39. P. 5382.
Anthony S.P. // Chem. Asian J. 2012. V. 7. P. 374.
Wang K., Chen K., Kassis A.I. // Cryst. Res. Technol. 2006. V. 41. P. 622.
SAINT. (2001). Version 6.02A, Bruker AXS: Madison, W1.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Bourhis L.J., Dolomanov O.V., Gildea R.J. et al. // Acta Cryst. A. 2015. V. 71. P. 59.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография