Кристаллография, 2021, T. 66, № 3, стр. 424-428
Мезоморфизм дихотомных соединений; рентгеноструктурное исследование гексадецилового эфира 4-хлорофенила
Л. Г. Кузьмина 1, *, М. А. Навасардян 1, П. Калле 1, 2, С. И. Беззубов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: kuzmina@igic.ras.ru
Поступила в редакцию 29.07.2020
После доработки 18.10.2020
Принята к публикации 23.10.2020
Аннотация
Изучена кристаллическая и молекулярная структура Cl–C6H4–O–C16H33 (I) и проведено исследование этого соединения методом дифференциальной сканирующей калориметрии. Кристаллы I не проявляют мезоморфных свойств. Кристаллическая упаковка I построена из чередующихся ароматических и рыхло упакованных алифатических областей, что типично для мезоморфных кристаллов. Отсутствие слабых направленных взаимодействий в ароматических областях кристалла является причиной того, что соединение не проявляет мезоморфизм.
ВВЕДЕНИЕ
Известно, что мезоморфные соединения дихотомные, т.е. состоят как минимум из двух частей, контрастирующих в отношении и структурных особенностей, и химических свойств. В частности, все известные линейные мезоморфные соединения построены из структурно жесткого ядра, чаще всего ароматического или сопряженного фрагмента, и конформационно подвижной алифатической цепи.
К таким соединениям относятся, например, алкил- или алкизоксизамещенные фенилбензоаты, салициланилины, бифенилцианиды, бензилиден-п-толуидины, азобензолы и другие [1–15 ]. Отдельные представители даже одного гомологического ряда могут проявлять мезоморфизм разного типа (энантиотропный/монотропный) или вообще не являются мезоморфами. Таким образом, все мезоморфные соединения дихотомные, но не все дихотомные соединения мезоморфны. Это означает, что помимо указанного выше различия фрагментов молекул дихотомные соединения должны обладать еще какими-то структурными особенностями, обусловливающими появление мезоморфизма. С целью выявления таких особенностей в настоящей работе проведено исследование методами рентгеноструктурного анализа (РСА) и дифференциальной сканирующей калориметрии (ДСК) потенциально мезоморфного дихотомного гексадецилового эфира 4-хлорфенила Cl–C6H4–O–C16H33 (I).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Калориметрия. Соединения I, II и III приобретены по каталогу Aldrich. Для проведения калориметрических исследований несколько (шесть–семь) монокристаллов помещали в оптическую ДСК-систему Linkam DSC600, снабженную микроскопом Olympus BX43, где измеряли термограмму соединения при скорости сканирования 5 град/мин. Установлено, что соединение плавится при 48.8°С без образования мезофазы. При охлаждении изотропного расплава мезофаза также не образуется. При температуре 35.6°С наблюдается фазовый переход в твердую фазу. Повторное ДСК-исследование того же образца воспроизвело исходную картину фазовых переходов.
Рентгеноструктурный анализ. Монокристаллы соединения I выращены из смеси бензол–ацетонитрил. Пригодный для РСА монокристалл помещали на дифрактометр Bruker SMART APEX-II и измеряли его параметры и интенсивности рентгеновских отражений (излучение MoKα, ω-сканирование) при двух температурах – комнатной (296 К) и близкой к точке плавления (315 К). Первичная обработка экспериментальных данных проведена по программе SAINT [16].
Структура расшифрована прямыми методами и уточнена методом наименьших квадратов по F 2 в анизотропном приближении. Все атомы водорода выявлены из разностного синтеза Фурье. Их уточнение проведено по модели наездника. Основные кристаллографические параметры, данные эксперимента и результаты уточнения структур приведены в табл. 1. Все расчеты проведены с использованием программного комплекса Olex-2 [17, 18]. Данные о структуре депонированы в Кембриджский банк структурных данных (ССDC № 2019390), deposit@ccdc.cam.ac.uk или http://www. ccdc.cam.ac.uk/data_request/cif.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структуры I (C22H37OCl)
| Сингония, пр. гр., Z | Триклинная, P$\bar {1}$, 2 | Триклинная, P$\bar {1}$, 2 |
| Т, К | 296 | 315 |
| М | 352.99 | 352.99 |
| a, b, c, Å | 5.5516(4), 9.3768(8), 20.6133(16) | 5.537(6), 9.404(11), 20.61(2) |
| α, β, γ, град | 84.213(3), 88.434(3), 86.397(4) | 83.89(4), 88.19(4), 86.10(4) |
| V, Å3 | 1065.23(15) | 1064(2) |
| Dx, г/см3 | 1.104 | 1.101 |
| Излучение; λ, Å | MoKα; 0.71073 | |
| μ, см–1 | 0.185 | |
| Размер образца, мм | 0.40 × 0.25 × 0.15 | |
| 2θmax, град | 56 | 52 |
| Пределы h, k, l | –7 ≤ h ≤ 7, –12 ≤ k ≤ 12, –29 ≤ l ≤ 29 | –6 ≤ h ≤ 6, –11 ≤ k ≤ 11, –25 ≤ l ≤ 25 |
| Число отражений: измеренных/независимых (N1), Rint c I > 2σ(I) (N2) | 18 675/4989, 0.0487, 2854 | 10 246/4086, 0.0829, 1722 |
| Метод уточнения | МНК по F 2 | |
| Число параметров | 365 | 218 |
| R1/wR2 по N1 | 0.1249/0.1876 | 0.1827/0.2487 |
| R1/wR2 по N2 | 0.0680/0.1640 | 0.0809/0.2010 |
| S | 1.070 | 0.963 |
| Δρmin/Δρmax, э Å–3 | –0.474/0.384 | –0.41/0.41 |
| Программы | SAINT [16], Olex-2 [17, 18] | |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно термографическому исследованию соединение I относится к низкоплавким органическим соединениям (Тпл = 48.8°С) в отличие от дихотомных фенилбензоатов или салицилаланилинов, характеризующихся более высокими температурами плавления (~70°C и выше). Это делает алкилзамещенные производные бензола особенно привлекательными объектами для исследования методом РСА – изучения высокотемпературных фазовых переходов в кристаллах, предшествующих переходу в мезофазу. Однако образование мезофазы не наблюдается как при плавлении кристалла, так и при охлаждении изотропного расплава.
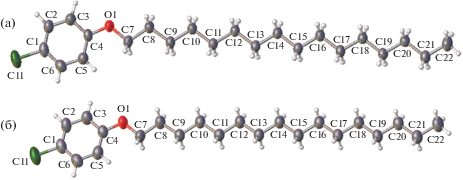
Строение молекулы и нумерация атомов в ней показаны на рис. 1. Каркас из атомов молекулы имеет плоское строение. Длины связей и валентные углы в ней не отличаются от стандартных значений. Молекула содержит жесткий ароматический фрагмент и конформационно подвижную длинную алифатическую цепь. В ней имеются функциональные группы, способные вступать в слабые направленные взаимодействия – заместитель Cl, а также бензольное кольцо. Эти функциональные группы могут образовывать слабые направленные взаимодействия Cl⋅⋅⋅Cl, π–π-стэкинг и слабые водородные связи С–Н⋅⋅⋅π и С–Н⋅⋅⋅О [19–23].
Рис. 1.
Строение молекулы I при 296 (а), 315 К (б). Эллипсоиды тепловых смещений атомов приведены на уровне вероятности 50%.
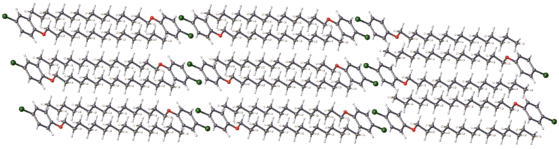
В кристаллах мезоморфных соединений такие взаимодействия обычно формируют слои, чередующиеся с рыхлыми слоями, образованными алифатическими цепями [1–15 ]. Эта особенность строения мезоморфных кристаллов обусловливает их неравномерное плавление. Вначале происходит плавление рыхлых алифатических слоев при сохранении структурированности ароматических слоев и только при дальнейшем повышении температуры разрушаются вторичные связи, которые задают структурированность ароматических областей.
Однако соединение I не проявляет мезоморфных свойств. На рис. 2 показана кристаллическая упаковка соединения. Она качественно подобна упаковкам мезоморфных кристаллов. В ней хорошо видно чередование ароматических и алифатических областей. Алифатические области упакованы очень рыхло, что является одним из двух начальных условий появления мезоморфизма. Анализ межмолекулярных расстояний в алифатических областях (табл. 2) показывает, что самые короткие расстояния Н⋅⋅⋅Н, причем даже кратчайшие из них превышают удвоенный ван-дер-ваальсов радиус (2.4 Å) более чем на 0.2 Å.
Таблица 2.
Межмолекулярные контакты Н⋅⋅⋅Н в алифатических областях кристалла
| Контакт | Симметрия | d, Å | Контакт | Симметрия | d, Å |
|---|---|---|---|---|---|
| Н7а…Н16b | 3 – x, 2 – y, –1 – z | 2.65 | H10b…H15b | 3 – x, 2 – y, –1 – z | 2.67 |
| H7b…H21b | 3 – x, 2 – y, –1 – z | 2.71 | H12a…H19b | 4 – x, 3 – y, –1 – z | 2.67 |
| H8b…H17a | 3 – x, 2 – y, –1 – z | 2.63 | H14a…H17b | 4 – x, 3 – y, –1 – z | 2.69 |
| H8b…H15b | 3 – x, 2 – y, –1 – z | 2.67 | H15a…H16a | 4 – x, 3 – y, –1 – z | 2.74 |
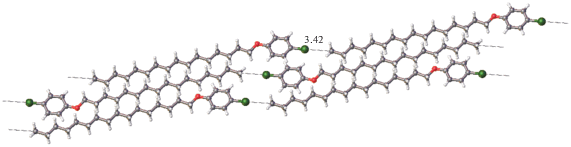
Обычные ван-дер-ваальсовы контакты осуществляются только между ароматическими фрагментами молекул. Что в таком случае обеспечивает устойчивость кристаллической упаковки в целом? Одним из таких факторов может быть электростатический контакт Cl⋅⋅⋅C (22) с участием концевого атома алифатической цепи (рис. 3). Расстояния Cl⋅⋅⋅C 3.42 Å соизмеримы с суммой ван-дер-ваальсовых радиусов и вполне могут соответствовать слабым направленным взаимодействиям электростатической природы [22], которые характеризуются дальнодействием: зависимость энергии от расстояния пропорциональна r–1 для электростатических и r–6 для дисперсионных взаимодействий. По-видимому, эти взаимодействия, будучи направленными, в значительной степени фиксируют положения концевых метильных групп, ограничивая подвижность терминальных фрагментов алифатических цепей. На это косвенно указывает тот факт, что тепловые эллипсоиды всех атомов алифатической цепи примерно одинаковы, хотя в подавляющем большинстве исследованных кристаллических структур мезоморфных соединений наблюдается последовательное увеличение тепловых эллипсоидов алифатических атомов углерода по мере их удаления от жесткого ядра. Этот эффект также не обнаруживается в рентгеноструктурном эксперименте, проведенном при температуре 315 К (42°С), близкой к его точке плавления (48.4°С). Длины полуосей тепловых эллипсоидов всех атомов алифатической цепи близки по значению (рис. 1). В то же время в [10] показано, что увеличение температуры сопровождается не только усилением тепловых колебаний концевых атомов алифатической цепи, но и разупорядочением атомов ее терминального фрагмента.
В кристаллической упаковке исследованного соединения не выполняется второе ключевое условие формирования мезофазы. В ней априори отсутствуют предполагавшиеся слабыми направленные взаимодействия между функциональными группами ароматических фрагментов, ответственные за структурированность образующегося расплава. Действительно, все межатомные расстояния Cl…Cl слишком велики (больше 5 Å), а взаимное расположение соседних бензольных колец в упаковке исключает как π⋅⋅⋅π-, так и С–Н⋅⋅⋅π-взаимодействия между ними. По-видимому, в отличие от указанных выше мезоморфных алкил- или алкизоксизамещенных фенилбензоатов и салициланилинов алкилоксизамещенные бензолы обладают меньшими конформационными возможностями для взаимной подстройки молекул, обеспечивающей вторичные связи между их функциональными группами в кристалле.
Даже более интенсивное тепловое движение атомов в расплаве по сравнению с раствором, по-видимому, не улучшает конформационных возможностей взаимной подстройки молекул, необходимой для возникновения между ними вторичных связей. Этот вывод следует из того, что данное соединение не обнаруживает и монотропного мезоморфизма, т.е. образования мезофазы при охлаждении изотропного расплава. Примечательно, что кристаллизация из расплава происходит при температуре 35.6°С, значительно более низкой, чем температура плавления исходных кристаллов (48.8°С). Хотя явление “переохлаждения” расплава обычно для мезоморфных соединений, в литературе отсутствует его объяснение на молекулярном уровне. Вполне вероятно, что из расплава соединение кристаллизуется в модификации, отличной от той, которая возникает при кристаллизации из раствора и обладает меньшей плотностью. Однако в данной работе не удалось получить монокристалл из расплава, чтобы подтвердить это предположение.
ВЫВОДЫ
Исследования гексадецилового эфира 4-хлорфенила методами РСА и ДСК показали, что соединение не проявляет мезоморфных свойств – как энантиотропных, так и монотропных. Причиной является отсутствие в кристалле структуроформирующих элементов – вторичных связей между функциональными группами соседних молекул в ароматических областях кристалла. Невозможность их формирования в упаковке обусловлена недостаточной конформационной гибкостью молекул.
Сформировалось слабое направленное взаимодействие (Cl⋅⋅⋅CH3) между ароматической и алифатической областями, чего ранее никогда не наблюдалось в кристаллах потенциально мезоморфных соединений.
Рентгеноструктурный анализ проведен в ЦКП ИОНХ РАН. Работа выполнена при финансовой поддержке Российского научного фонда (грант № 16-13-10273).
Список литературы
Кузьмина Л.Г., Кучерепа Н.С. // Кристаллография. 2011. Т. 56. № 2. С. 267.
Кузьмина Л.Г., Кучерепа Н.С., Чураков А. В. // Кристаллография. 2012. Т. 57. № 2. С. 261.
Гунина М.А., Лермонтова Э.Х., Пестов С.М., Кузьмина Л.Г. // Кристаллография. 2012. Т. 57. № 5. С. 816.
Константинов И.И., Чураков А.В., Кузьмина Л.Г. // Кристаллография. 2013. Т. 58. № 1. С. 89.
Кузьмина Л.Г., Гунина М.А., Чураков А.В., Пестов С.М. // Кристаллография. 2013. Т. 58. № 2. С. 234.
Kuzmina L.G., Konstantinov I.I., Lermontova E.Kh. // Mol. Cryst. Liq. Cryst. 2014. V. 588. P. 1.
Кузьмина Л.Г., Константинов И.И., Беззубов С.И. // Химия высоких энергий. 2016. Т. 50. № 6. С. 478.
Kuz’mina L.G., Navasardyan M.A., Churakov A.V., Howard J.A.K. // Mol. Cryst. Liq. Cryst. 2016. V. 638. P. 60.
Kuz’mina L.G., Konstantinov I.I., Churakov A.V., Navasardyan M.A. // Acta Cryst. E. 2017. V. 73. P. 1052.
Kuz’mina L.G., Konstantinov I.I., Churakov A.V. // Mol. Cryst. Liq. Cryst. 2018. V. 664. P. 95.
Кузьмина Л.Г., Навасардян М.А., Константинов И.И. // Кристаллография. 2019. Т. 64. № 1. С. 77.
Кузьмина Л.Г., Константинов И.И., Кале П., Навасардян М.А. // Кристаллография. 2020. Т. 65. № 3. С. 457.
Кузьмина Л.Г., Константинов И.И., Навасардян М.А. // Кристаллография. 2020. Т. 65. № 3. С. 449.
SAINT. (2001). Version 6.02A, Bruker AXS: Madison, W1.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Bourhis L.J., Dolomanov O.V., Gildea R.J. et al. // Acta Cryst. A. 2015. V. 71. P. 59.
Nangia A. // Cryst. Eng. Comun. 2002. V. 4. № 17. P. 93.
Muller-Dethlefs K., Hobza P. // Chem. Rev. 2000. V. 100. P. 143.
Janiak Ch. // J. Chem. Soc. Dalton Trans. 2000. № 21. P. 3885.
Steiner T. // Acta. Cryst. B. 1998. V. 54. P. 456.
Steiner T. // Crystallogr. Rev. 2003. V. 9. № 2–3. P. 177.
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография