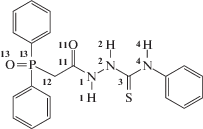
Кристаллография, 2021, T. 66, № 3, стр. 439-447
Конформационное поведение молекулы n1-(дифенилфосфорил)ацетил-N4-фенил-тиосемикарбазида в различном кристаллическом окружении
А. И. Самигуллина 1, 2, *, И. А. Крутов 3, Е. Л. Гаврилова 3, А. Т. Губайдуллин 1
1 Институт органической и физической химии им. А.Е. Арбузова ФИЦ КазНЦ РАН
Казань, Россия
2 Институт элементоорганических соединений им. А.Н. Несмеянова РАН
Москва, Россия
3 Казанский национальный исследовательский технологический университет
Казань, Россия
* E-mail: a_samigullina@iopc.ru
Поступила в редакцию 21.08.2020
После доработки 24.09.2020
Принята к публикации 24.09.2020
Аннотация
Получены и исследованы рентгеноструктурными методами три кристаллические модификации фенилзамещенного дифенилфосфорил тиосемикарбазида: соединение (1) и два его сольвата с диметилсульфоксидом (2, 3). Независимые молекулы соединения в кристаллах 1 и 2 характеризуются одинаковой, “свернутой”, конформацией ациклического остова, стабилизированной внутримолекулярной водородной связью N–H⋅⋅⋅O, а кристаллы – формированием идентичного цепочечного супрамолекулярного мотива, ориентированного вдоль оси, соответствующей наименьшему параметру элементарной ячейки. В кристалле 3 независимые молекулы находятся в двух различных конформациях, одна из которых стабилизирована внутримолекулярной водородной связью, а вторая – “линейная” – обусловлена подстройкой молекулы при формировании нульмерного супрамолекулярного ассоциата, имеющего гидрофильное ядро и гидрофобную оболочку.
ВВЕДЕНИЕ
Гетеросодержащие органические соединения повсеместно рассматриваются как надежный ресурс для получения потенциальных и реальных лекарственных препаратов. Так, органические азот- и серосодержащие соединения, например сульфонамиды и тиазины [1–3], стали неотъемлемой частью медицинской химии. Среди гетероациклических молекул можно выделить тиосемикарбазиды, химия которых в последние десятилетия активно развивается, что связано с различными важными областями их применения. Свободные 1,4-дизамещенные тиосемикарбазиды и их комплексы с различными металлами представляют собой универсальный класс соединений, проявляющих биологическую активность, в том числе антибактериальную, противогрибковую, противовоспалительную, противомалярийную, противовирусную, антираковую [4–12]. Комплексы тиосемикарбазонов с Zn(II) обладают флюоресцирующими свойствами и могут быть использованы для визуализации живых клеток [13–15]. Тиосемикарбазиды могут выступать в качестве интермедиатов в синтезе других важных классов гетероциклических соединений, таких как 1,2,4-триазолы, 1,3,4-тиадиазолы, 1,3,4-оксадиазолы [16–18]. Кроме того, тиосемикарбазиды широко используются в промышленности в качестве красителей, фотопленок, пластмасс и находят применение в текстильной промышленности [19].
Для молекулы тиосемикарбазида методом функционала плотности была оценена энергия восьми возможных конформеров и установлено, что реализующаяся в кристалле конформация наиболее выгодная [20], т.е. молекула не должна обладать конформационной лабильностью в кристалле. Однако функционализация тиосемикарбазида различными фармакофорными группами с целью получения полифункциональных соединений (для объединения и улучшения фармакологических свойств благодаря синергетическому эффекту) может приводить к увеличению ациклического остова самой молекулы и возможной ее конформационной подвижности в кристаллах.
Конформация молекул оказывает влияние на супрамолекулярную организацию в кристалле, на химические и физико-химические свойства, такие как растворимость, стабильность, комплексообразование и другие [21]. А с кристаллографической точки зрения представляют интерес именно соединения, в кристаллах которых реализуются различные типы конформаций. Установление причин такого поведения молекул соединений и, в данном случае фенилзамещенного дифенилфосфорилацетил тиосемикарбазида, является актуальной задачей и было целью настоящего исследования.
Общая схема синтеза дифенилфосфорилацетильных производных тиосемикарбазида опубликована ранее [22], там же приведена кристаллическая структура N-незамещенного тиосемикарбазида, представленного в виде кристаллосольвата с диметилсульфоксидом (ДМСО). В продолжение исследований соединений данного ряда рассмотрим особенности молекулярного и кристаллического строения фосфорилацетильного производного тиосемикарбазида (N4-замещенного (схема 1)), представленного в виде трех кристаллических модификаций, полученных путем медленной кристаллизации из этанола (1), ДМСО (2) и смеси ДМСО/этанол в соотношении 1 : 1 (3).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Монокристальные рентгеноструктурные эксперименты выполнены на автоматическом дифрактометре Bruker Kappa Apex II CCD (графитовый монохроматор, MoKα, λ = 0.71073 Å) при температуре 150 (1, 3) и 293 К (2). Сбор данных, их первичная обработка и уточнение параметров элементарных ячеек выполнены с помощью программы APEX2 [23]. Поглощение учтено с использованием программы SADABS [24]. Кристаллографические данные и результаты уточнения приведены в табл. 1. Структуры расшифрованы прямым методом и уточнены методом наименьших квадратов сначала в изотропном, затем в анизотропном приближении (для всех неводородных атомов) c использованием пакета программ SHELXTL [25]. Координаты атомов водорода аминогрупп, за исключением H2A в молекуле соединения 2, были определены из разностных рядов электронной плотности и уточнены в изотропном приближении. Координаты остальных атомов водорода определены на основании стереохимических критериев и уточнены по модели “наездника”. Все расчеты проведены с помощью программы WinGX [26]. Анализ межмолекулярных взаимодействий и рисунки выполнены с использованием программ PLATON [27] и Mercury [28]. Кристаллографические данные соединений 1–3 депонированы в Кембриджскоой базе структурных данных (КБСД) и могут быть свободно получены по запросу на сайте http://www.ccdc. cam.ac.uk/data_request/cif.
Таблица 1.
Кристаллографические характеристики, данные эксперимента и результаты уточнения структур соединений 1–3
| Соединение | 1 | 2 | 3 |
|---|---|---|---|
| Формула | C21H20N3O2PS | 2(C21H20N3O2PS), C2H6OS | 2(C21H20N3O2PS), C2H6OS |
| M, г/моль | 409.43 | 896.99 | 896.99 |
| Сингония, пр. гр., Z, Z ' | Ромбическая, Pbca, 8, 1 | Моноклинная, P21/c, 8, 2 | Триклинная, P$\bar {1}$, 4, 2 |
| a, b, c, Å | 9.4178(8), 19.588(2), 21.774(2) |
10.4952(4), 45.426(2), 9.5699(5) |
10.500(2), 12.807(3), 16.864(3) |
| α, β, γ, град | 90, 90, 90 | 90, 93.970(3), 90 | 97.64(1), 101.49(1), 95.73(1) |
| V, Å3 | 4016.7(6) | 4551.5(4) | 2183.9(8) |
| Т, К | 150(2) | 296(2) | 150(2) |
| Размер кристалла, мм3 | 0.07 × 0.22 × 0.70 | 0.09 × 0.26 × 0.37 | 0.03 × 0.20 × 0.50 |
| F(000) | 1712 | 1880 | 940 |
| ρрасч, г/см3 | 1.354 | 1.309 | 1.364 |
| μ, мм–1 | 0.263 | 0.284 | 0.296 |
| θ, град | 2.280–27.943 | 2.787–28.032 | 2.623–27.218 |
| Количество отражений: измеренных (N1)/независимых, Rint/с I > 2σ(I) (N2) | 59 273/4689, 0.1192/3110 | 40 493/10 865, 0.1075/4844 | 25 398/9359, 0.1088/4825 |
| Число параметров/ограничений | 262/3 | 561/4 | 565/1 |
| R1/wR2 поN1 | 0.1594/0.3303 | 0.1732/0.1646 | 0.1653/0.1981 |
| R1/wR2 поN2 | 0.1119/0.2924 | 0.0638/0.1236 | 0.0811/0.1536 |
| S | 1.097 | 0.961 | 1.021 |
| ρмин/ρмакс, э Ǻ–3 | –0.733/2.350 | –0.451/0.397 | –0.81/0.724 |
| CCDC | 2021596 | 2021597 | 2021595 |
Порошковые дифрактограммы получены на автоматическом рентгеновском дифрактометре Bruker D8 Advance, оборудованном приставкой Vario и линейным координатным детектором Vantec (CuKα1-излучение, λ = 1.54063 Å, изогнутый монохроматор Йохансона, режим работы рентгеновской трубки 40 кВ, 40 мА). Эксперименты выполнены при комнатной температуре в геометрии Брэгга–Брентано. Монокристаллы исследуемых соединений предварительно размалывали, и полученный порошок без сильного прессования наносили на кремниевую пластинку, уменьшающую фоновое рассеяние. Дифрактограммы регистрировали в диапазоне углов рассеяния 2θ 3°–95°, шаг 0.008°, время набора спектра в точке 4 с. Для устранения влияния преимущественной ориентации и усреднения данных образец вращали в собственной плоскости со скоростью 15 об./мин.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В бессольватной форме N1-(дифенилфосфорил)ацетил-N4-фенил-тиосемикарбазид образует ромбические кристаллы (1) с одной молекулой в независимой части элементарной ячейки. Два его сольвата с ДМСО в соотношении 2 : 1 представлены в виде моноклинных (2) и триклинных (3) кристаллов с двумя независимыми молекулами тиосемикарбазида в элементарных ячейках.
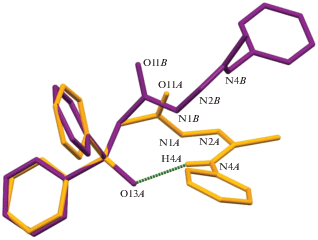
В кристаллах 1 и 2 наблюдается идентичная конформация ациклического остова молекул, которая формируется за счет реализации внутримолекулярного взаимодействия типа N–H⋅⋅⋅O между атомом водорода H4 терминальной аминной группы и атомом кислорода О13 фосфорильной группы (рис. 1). Различие между двумя независимыми молекулами соединения 2 в основном связано с разворотами фенильных заместителей, что, вероятно, обусловлено формированием разных супрамолекулярных мотивов независимыми молекулами. Молекула А соединения 2 близка по строению молекуле соединения 1 и в кристалле они формируют идентичные супрамолекулярные мотивы, обсуждение которых будет представлено далее.
Рис. 1.
Условное наложение независимых молекул соединений 1 и 2. Пунктирной линией показана внутримолекулярная водородная связь N–H⋅⋅⋅O. Атомы водорода фенильных циклов на рисунке не приведены.
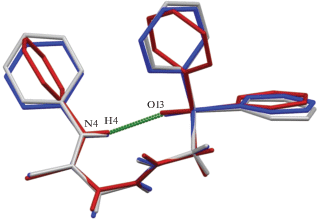
Расстояние О…Н в молекуле соединения 1 равно 2.54(6) Å, в молекулах А и В соединения 2 – 2.27(4) и 2.14(3) Å соответственно. Параметры сильных внутри- и межмолекулярных взаимодействий в кристаллах приведены в табл. 2 (геометрия индивидуальных молекул в кристаллах показана на рис. S1–S3 в дополнительных материалах).
Таблица 2.
Параметры внутри- и межмолекулярных взаимодействий в кристаллах 1–3
| D–H⋅⋅⋅A | D–H, Å | H⋅⋅⋅A, Å | D⋅⋅⋅A, Å | ∠DHA, град | Операция симметрии |
|---|---|---|---|---|---|
| Соединение 1 | |||||
| N4–H4⋅⋅⋅O13 | 0.87(3) | 2.54(6) | 3.202(7) | 133(6) | |
| N2–H2⋅⋅⋅O13 | 0.88(6) | 1.99(7) | 2.836(6) | 160(7) | –1/2 + x, y, 1/2 – z |
| Соединение 2 | |||||
| N4А–H4А⋅⋅⋅O13А | 0.88(4) | 2.27(4) | 3.126(4) | 163(3) | |
| N2А–H2А⋅⋅⋅O13А | 0.88 | 2.31 | 2.931(4) | 127 | x, 1/2 –y, 1/2 + z |
| N1А–H1А⋅⋅⋅O11А | 0.82(2) | 2.53(2) | 3.317(5) | 161(3) | x, 1/2 – y, 1/2 + z |
| N4В–H4В⋅⋅⋅O13В | 0.83(3) | 2.14(3) | 2.945(4) | 164(4) | |
| N1B–H1B⋅⋅⋅O30 | 0.85(3) | 1.98(3) | 2.778(4) | 158(3) | |
| N2B–H2B⋅⋅⋅O30 | 0.82(3) | 2.05(3) | 2.826(5) | 158(3) | 1 – x, –y, 2 – z |
| С12В–Н12С…О11В | 0.99 | 2.39 | 3.374(4) | 172 | –x, –y, 2 – z |
| Соединение 3 | |||||
| N4А–H4А⋅⋅⋅O13А | 0.91(5) | 2.13(5) | 2.999(6) | 160(5) | |
| N2А–H2А⋅⋅⋅O13В | 0.93(5) | 2.02(5) | 2.935(6) | 170(5) | |
| N1А–H1А⋅⋅⋅O30 | 0.82(3) | 2.03(3) | 2.809(5) | 160(6) | 1 + x, y, z |
| N1B–H1B⋅⋅⋅O13В | 0.76(5) | 2.13(5) | 2.873(5) | 167(5) | 1 – x, 1 – y, 1 – z |
| N2B–H2B⋅⋅⋅O30 | 0.78(4) | 2.13(4) | 2.882(6) | 163(5) | 1 + x, y, z |
| N4B–H4B⋅⋅⋅S3A | 0.85(5) | 2.60(5) | 3.296(5) | 140(4) | 1 – x, 1 – y, 1 – z |
| С12B–H12D⋅⋅⋅O11В | 0.99 | 2.40 | 3.350(6) | 161 | 2 – x, 1 – y, 1 – z |
| С25B–H25B⋅⋅⋅O11В | 0.95 | 2.55 | 3.473(6) | 164 | 2 – x, 1 – y, 1 – z |
Вероятно, в случае фосфорилацетильных производных тиосемикарбазидов расположение донора и акцептора водородной связи на разных концах молекулы и длина спейсера между ними предрасполагают к реализации внутримолекулярной водородной связи, что и наблюдается в молекулах кристаллов 1 и 2. С целью установления общности подобного взаимодействия был выполнен поиск тиосемикарбазидов, а также их ближайших структурных аналогов (схема 2) с идентичным расположением донора и акцептора водородной связи N–H⋅⋅⋅O в КБСД. Поиск был ограничен молекулами, ациклический остов которых содержит девять или десять атомов, в зависимости от типа акцептора – фосфорильного, карбонильного или сульфонильного.
Схема 2.
Молекулярный фрагмент, по которому осуществлялся поиск производных тиосемикарбазидов, аналогичных по строению соединениям 1–3. Пунктиром показаны ковалентные связи, тип которых варьируется.
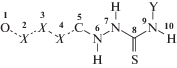
Согласно результатам поиска в выборку вошли 32 соединения. Из рассмотрения был исключен ряд соединений со значительными отклонениями параметров взаимодействий от величин, соответствующих формальным критериям образования водородных связей (подробные сведения приведены в табл. S1 ). Отметим, что в ряде соединений молекулы содержали несколько заданных для поиска фрагментов. Таким образом, в окончательной выборке оказались 25 соединений, 17 из которых представлены в виде кристаллосольватов. Важно отметить, что в кристаллах всех этих соединений реализуется внутримолекулярная водородная связь типа X=O⋅⋅⋅H–N, где X = C, S, P. Расстояния О…Н лежат в диапазоне 2.05–2.40 Å и приведены в табл. 3. Заметим, что присутствие в кристаллах сольватных молекул, в том числе сильных акцепторов, таких как ДМСО, ДМФА, не препятствует реализации внутримолекулярного связывания данного типа.
Таблица 3.
Параметр внутримолекулярной водородной связи X=O⋅⋅⋅N–H в соединениях, отобранных из КБСД и содержащих тиосемикарбазидный фрагмент
| Код | d(H…O), Å | Код | d(H…O), Å | ||
|---|---|---|---|---|---|
| 1 | REWVIP* | 2.19 | 13 | GAXKEY | 2.38 |
| 2 | CEFWOC* | 2.07 | 14 | GAXKIC | 2.27 |
| CEFWOC* | 2.09 | 15 | IXONIU | 2.28 | |
| CEFWOC* | 2.11 | 16 | KAYTOU* | 2.32 | |
| CEFWOC* | 2.11 | 17 | KEQTOS* | 2.11 | |
| CEFWOC* | 2.14 | 18 | MATBOB* | 2.23 | |
| CEFWOC* | 2.16 | 19 | MATBOB02* | 2.23 | |
| 3 | CICZEW* | 2.33 | 20 | MATJOJ* | 2.21 |
| 4 | CUNJOM* | 2.14 | 21 | MATJOJ02* | 2.22 |
| CUNJOM | 2.18 | 22 | NOBJOG | 2.35 | |
| 5 | CUNJUS* | 2.27 | OREWAL | 2.31 | |
| 6 | CUNJUS01* | 2.28 | 23 | OREWAL02 | 2.32 |
| 7 | CUNKAZ* | 2.22 | 24 | QAPPAB* | 2.15 |
| 8 | GEDFUT* | 2.16 | 25 | QAPPAB02* | 2.15 |
| 9 | GEDFUT | 2.1 | 26 | GEDGAA | 2.24 |
| GEDGAA* | 2.05 | 27 | UYACUU | 2.28 | |
| 10 | GEDGAA | 2.13 | 28 | ZINDOR | 2.40 |
| GEDGAA | 2.23 |
Таким образом, для всех соединений данной выборки сохраняется эмпирическое правило: независимо от типа кристаллизации (в бессольватной форме или в виде кристаллосольвата), если в молекуле нет препятствий для свободного вращения вдоль одинарных связей, то ее конформация будет определяться рассмотренным выше внутримолекулярным взаимодействием.
Казалось бы, при полном подтверждении статистическими и собственными экспериментальными данными внутримолекулярного взаимодействия, при определенном положении акцептора водородной связи относительно атома водорода аминной группы как обязательного условия для тиосемикарбазидов существование кристаллической модификации с другой геометрией молекулы маловероятно. Однако именно в кристалле 3 другого сольвата фосфорилацетильного производного тиосемикарбазида с ДМСО реализуется кардинально отличающаяся конформация ациклического остова молекулы.
В кристалле соединения 3 две независимые молекулы характеризуются различными конформациями ациклического остова: описанной ранее “свернутой”, стабилизированной внутримолекулярной водородной связью – для молекулы А с расстоянием О…Н 2.13(5) Å, и “линейной” – для молекулы B (рис. 2). Сравнение независимых молекул трех исследованных соединений указывает на отсутствие видимых причин для изменения характера поведения молекулы при кристаллизации. Вероятнее всего подобные изменения в кристалле 3 обусловлены не включением молекулы растворителя в кристаллическую структуру, а в большей степени влиянием кристаллического поля и молекулярного окружения.
Рис. 2.
Условное наложение двух независимых молекул соединения 3. Пунктирной линией показана внутримолекулярная связь N–H⋅⋅⋅O. Атомы водорода, за исключением H4А, не приведены на рисунке.
Отметим, что по данным квантово-химических расчетов (B3LYP, 6-31G(d,p)) с оптимизацией геометрии независимых молекул кристаллов 2 и 3 установлено, что стабилизированная внутримолекулярным взаимодействием “свернутая” конформация менее выгодна (на 1.7 ккал/моль), чем “линейная” (данные расчетов приведены в дополнительных материалах, рис. S4–S7 ). Причины того, что на молекулярном уровне “линейная” конформация оказывается несколько выгоднее, не столь ясны и требуют дальнейшего анализа. Одной из вероятных причин может быть и влияние молекулярного окружения в кристалле.
Следует учитывать, что молекула фосфорилацетильного производного тиосемикарбазида содержит значительное количество активных функциональных групп, которые могут участвовать в межмолекулярных взаимодействиях различной природы и которые требуют отдельного анализа. Тем не менее сначала обратим внимание на реализацию в кристаллах классических межмолекулярных водородных связей. Выявление других аспектов формирования супрамолекулярных структур будет проведено на основе анализа поверхности Хиршфельда, которая дает визуальное представление о молекулярном окружении в кристаллах [29].
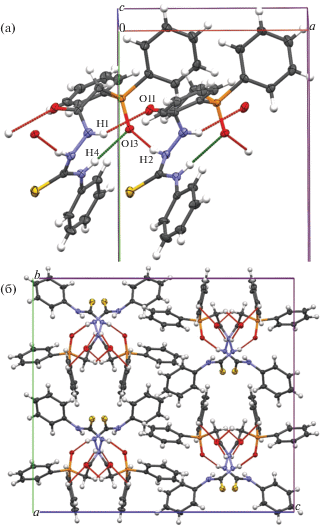
В качестве основного формирующего мотива в кристалле 1 можно выделить одномерную зигзагообразную цепочку, образованную за счет взаимодействий N–H⋅⋅⋅O с участием атома кислорода фосфорильной группы О13 (N2–H2⋅⋅⋅O13) и ориентированную вдоль оси, соответствующей наименьшему параметру элементарной ячейки a (рис. 3а). Одномерные цепочки упаковываются в кристалле по гексагональному типу (рис. 3б). Водородная связь N1–H1⋅⋅⋅O11 также стабилизирует подобные цепочечные супрамолекулярные мотивы.
Рис. 3.
Кристалл соединения 1: а – фрагмент одномерной зигзагообразной цепочки; б – фрагмент упаковки одномерных мотивов, вид вдоль Оа.
Аналогичный супрамолекулярный мотив, ориентированный вдоль оси с (наименьший параметр элементарной ячейки), формируется в кристалле 2 молекулами А с участием аналогичных активных центров молекулы (N1А–H1А⋅⋅⋅O11А и N2А–H2А⋅⋅⋅O13А). На поверхностях Хиршфельда для молекулы соединения 1 и молекулы А соединения 2 можно отметить различный характер вовлечения активных центров в формирование супрамолекулярного мотива (рис. S8 ).
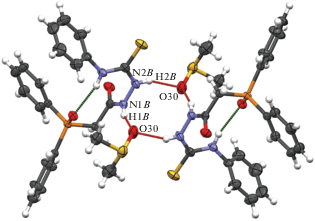
Совершенно иную супрамолекулярную структуру формирует вторая независимая молекула в кристалле 2, несмотря на то, что конформация ациклического остова молекул A и B одинакова. Две молекулы В образуют с участием двух молекул ДМСО замкнутый центросимметричный мотив – псевдотетрамер – за счет водородных связей N–H⋅⋅⋅O (N1B–H1B⋅⋅⋅O30 и N2B–H2B⋅⋅⋅O30) с расстояниями О…Н 2.13(5) и 2.13(4) Å (рис. 4).
Рис. 4.
Псевдотетрамер, образованный молекулами В в кристалле 2. Пунктирными линиями показаны межмолекулярные взаимодействия.
На поверхности Хиршфельда для молекулы В можно выделить также пару концентрических красных зон, соответствующих центросимметричному неклассическому взаимодействию С–Н⋅⋅⋅О (С12В–Н12С⋅⋅⋅О11В) с соседней молекулой В, связанной с исходной центром инверсии (рис. S9 ). За счет такого взаимодействия псевдотетрамеры связываются в одномерный мотив – Н-цепочку вдоль оси а. Интересным аспектом этого взаимодействия является его участие в ориентировании фенильных колец дифенилфосфорильного фрагмента молекул В.
Таким образом, несмотря на одинаковую конформацию молекул, в кристалле 2 морфология супрамолекулярных мотивов, образованных отдельно независимыми молекулами А и В, кардинально различается. С учетом рассмотренных структурообразующих взаимодействий N–H⋅⋅⋅O и С–Н⋅⋅⋅О в кристалле 2 каждая из независимых молекул образует собственные одномерные Н-цепочки различной морфологии, перпендикулярные друг другу. Каждая независимая молекула формирует из Н-цепочек собственный слой, и кристалл в целом представляет собой упаковку слоев, чередующихся вдоль оси b (рис. 5). Это приводит к пространственному разделению в кристалле двух независимых молекул и менее плотной упаковке. Так, коэффициенты упаковки молекул, по Китайгородскому, в кристаллах соединений 1 и 2 равны 67.9 и 65.6%.
Рис. 5.
Взаимное расположение независимых молекул А (показаны темно-серым цветом) и В (показаны светло-серым цветом) в кристалле 2.
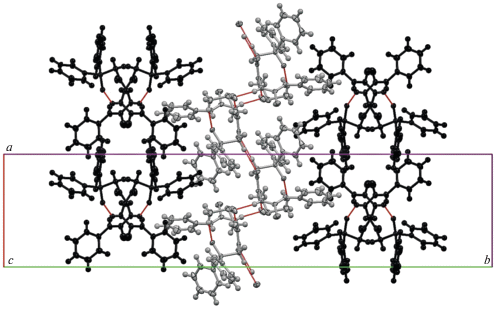
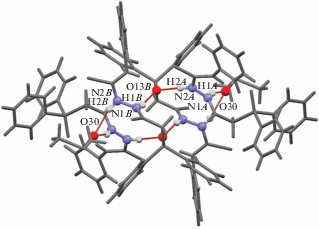
В кристалле 3, несмотря на аналогичный с соединением 2 характер кристаллизации – с двумя независимыми молекулами соединения и одной молекулой ДМСО, пространственного разделения двух независимых молекул не наблюдается, что обусловлено формированием общего для них супрамолекулярного мотива. По-видимому, одной из причин этого является отмеченный ранее факт, что одна из двух независимых молекул в кристалле 3 находится в конформации, не характерной для производных тиосемикарбазидов с ациклическим остовом. Возможно, такая конформация обусловлена формированием (в качестве основного мотива) специфического супрамолекулярного ассоциата с участием двух молекул А “свернутой” конформации, двух молекул В “линейной” конформации и двух молекул ДМСО, объединенных множеством взаимодействий N–H⋅⋅⋅O (рис. 6). Подобный мотив стабилизируют дополнительные взаимодействия N4B–H4B⋅⋅⋅S3A с участием тионного фрагмента. На поверхности Хиршфельда молекулы В можно увидеть две пары симметричных концентрических красных зон, одна из которых соответствует неклассическому взаимодействию С12B–H12D⋅⋅⋅O11В, а вторая – взаимодействию С25B–H25B⋅⋅⋅O11В (рис. S10 ), последнее ориентирует фенильные циклы дифенилфосфорильного фрагмента. За счет парных водородных связей С12B–H12D⋅⋅⋅O11В ассоциаты связываются в одномерный цилиндрический мотив в направлении кристаллографической оси a, которая соответствует наименьшему параметру элементарной ячейки (рис. S11 ).
Рис. 6.
Нульмерный ассоциат в кристалле 3, образованный четырьмя молекулами соединения и двумя молекулами растворителя. Шаро-стержневой моделью обозначены атомы, участвующие в образовании цепочки Н-связей в супрамолекулярном мотиве.
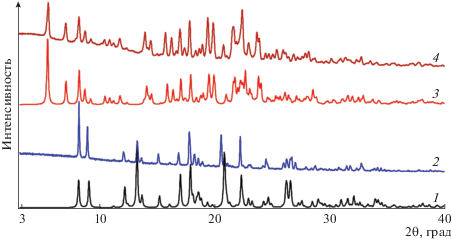
Выполненные порошковые дифракционные исследования показали, что вся масса поликристаллических образцов 1 и 3 соответствует теоретическим данным, рассчитанным по монокристальным данным (рис. 7), в то время как соединение 2, в котором формируются два разнонаправленных одномерных мотива, нестабильно и переходит в аморфное состояние.
ЗАКЛЮЧЕНИЕ
На основе собственных и литературных данных с использованием КБСД показано, что для всех производных тиосемикарбазидов рассмотренного типа в твердом состоянии характерно образование внутримолекулярной классической водородной связи, приводящей к “свернутой” конформации ациклического остова молекулы независимо от типа кристаллизации – в бессольватной форме или в виде кристаллосольватов. Преимущественный “свернутый” тип конформации молекул не исключает возможности образования за счет межмолекулярных водородных связей в кристаллах фосфорилацетильных производных тиосемикарбазида супрамолекулярных мотивов различной мерности и морфологии, в том числе приводящих к пространственному разделению в кристалле областей, занятых независимыми молекулами.
Конформационная лабильность, наблюдаемая для одной из независимых молекул в кристалле 3, вероятно, обусловлена вынужденным отклонением геометрии молекулы от “свернутой” конформации при формировании единой супрамолекулярной структуры капсульного типа молекулами обоих конформеров.
Монокристальные кристаллографические исследования проведены при финансовой поддержке Российского фонда фундаментальных исследований (проект № 19-33-60032) (А.И. Самигуллина), порошковые рентгенодифракционные эксперименты выполнены в рамках государственного задания ФИЦ КазНЦ РАН (А.Т. Губайдуллин). Синтез дифенилфосфорилацетильных производных тиосемикарбазида осуществлен при финансовой поддержке Российского научного фонда (грант № 14-23-00073-п).
Список литературы
Badshah S.l., Naeem A. // Molecules. 2016. V. 21. P. 1054. https://doi.org/10.3390/molecules21081054
Feng M., Tang B., Liang S.H. et al. // Curr. Top. Med. Chem. 2016. V. 16. P. 1200. https://doi.org/10.2174/1568026615666150915111741
Carta F., Scozzafava A., Supuran C.T. // Expert Opin. Ther. Pat. 2012. V. 22. P. 747. https://doi.org/10.1517/13543776.2012.698264
Küçükgüzel G., Kocatepe A., De Clercq E. et al. // Eur. J. Med. Chem. 2006. V. 41. P. 353. https://doi.org/10.1016/j.ejmech.2005.11.005
Molnar M., Tomić M., Pavić V. // Pharm. Chem. J. 2018. V. 51. P. 1078. https://doi.org/10.1007/s11094-018-1743-3
Plech T., Wujec M., Siwek A. et al. // Eur. J. Med. Chem. 2011. V. 46. P. 241. https://doi.org/10.1016/j.ejmech.2010.11.010
Mlahi M.R., El-Gammal O.A., Abdel-Rhman M.H., AbdAl-Gader I.M. // J. Mol. Struct. 2019. V. 1182. P. 168. https://doi.org/10.1016/j.molstruc.2018.12.064
Kushawaha S.K., Dani R.K., Bharty M.K. et al. // J. Mol. Struct. 2014. V. 1063. P. 60. https://doi.org/10.1016/j.molstruc.2014.01.043
Pingaew R., Prachayasittikul S., Ruchirawat S. // Molecules. 2010. V. 15. P. 988. https://doi.org/10.3390/molecules15020988
Cihan-Üstündag G., Gürsoy E., Naesens L. et al. // Bioorg. Med. Chem. 2016. V. 24. P. 240. https://doi.org/10.1016/j.bmc.2015.12.008
Güniz Küçükgüzel S., Coşkun G.P. // Anti-Cancer Agents Med. Chem. 2016. V. 16. P. 1288. https://doi.org/10.2174/1871520616666160219160256
Coşkun G.P., Djikic T., Hayal T.B. et al. // Molecules. 2018. V. 23. P. 2. https://doi.org/10.3390/molecules23081969
Cowley A.R., Davis J., Dilworth J.R. et al. // Chem. Commun. 2005. V. 7. P. 845. https://doi.org/10.1039/b417206j
Dayal D., Palanimuthu D., Shinde S.V. et al. // J. Biol. Inorg. Chem. 2011. V. 16. P. 621. https://doi.org/10.1007/s00775-011-0764-0
Tang J., Yin H.-Y., Zhang J.-L. // Inorganic and Organometallic Transition Metal Complexes with Biological Molecules and Living Cells. Academic Press, 2017. Ch. 1. P. 1. https://doi.org/10.1016/B978-0-12-803814-7.00001-0
Ahmed M.R. // Eur. J. Med. Chem. 2019. V. 179. P. 335. https://doi.org/10.31838/ijpr/2019.11.04.011
Li T., Wen G., Li J. et al. // Molecules. 2019. V. 24. P. 1490. https://doi.org/10.3390/molecules24081490
Riyadh S.M., Gomha S.M., Mahmmoud E.A. // Curr. Org. Synth. 2017. V. 4. P. 3. https://doi.org/10.2174/1570179413666151218202004
Zhang X., Lei P., Sun T. et al. // Molecules. 2017. V. 22. P. 1. https://doi.org/10.3390/molecules22122085
Chambers C.C., Archibong E.F., Mazhari S.M. et al. // J. Mol. Struct. Theochem. 1996. V. 388. P. 161. https://doi.org/10.1016/S0166-1280(96)80029-7
Saravanan R.R. et al. // Spectrochim. Acta. A. 2015. V. 139. P. 321. https://doi.org/10.1016/j.saa.2014.12.026
Krutov I.A., Gavrilova E.L., Burangulova R.N. et al. // Russ. J. Gen. Chem. 2017. V. 87. P. 2794. https://doi.org/10.1134/S1070363218110051
APEX2 (Version 2.1), SAINTPlus. Data Reduction and Correction Program (Version 7.31A), Bruker Advanced X-ray Solutions; BrukerAXS Inc.: Madison, WI, 2006.
Sheldrick G.M. SADABS, Program for Empirical X-ray Absorption Correction; Bruker-Nonius: Delft, 2004.
Sheldrick G.M. SHELXTL, Structure Determination Software Suite, v. 6.1, Bruker AXS, Madison: Wisconsin, USA, 2000.
Farrugia L.J. // J. Appl. Cryst. 1999. V. 32. P. 837. https://doi.org/10.1107/S0021889899006020
Spek A.L. // J. Appl. Cryst. 2003. V. 36. P. 7. https://doi.org/10.1107/S0021889802022112
Macrae C.F., Edgington P.R., McCabe P. et al. // J. Appl. Cryst. 2006. V. 39. P. 453. https://doi.org/10.1107/S002188980600731X
McKinnon J.J., Mitchell A.S., Spackman M.A. // Chem. Eur. J. 1998. V. 4. P. 2136. https://doi.org/10.1002/(SICI)1521-3765(19981102)4:11<2136::AID-CHEM2136>3.0.CO;2-G
Дополнительные материалы
- скачать ESM.docx
- Дополнительные материалы
Инструменты
Кристаллография