Кристаллография, 2021, T. 66, № 5, стр. 738-741
Электронная дифракция микрокристаллов на примере лизоцима
Р. А. Камышинский 1, 2, 3, В. А. Кралин 1, 3, М. Ю. Чесноков 1, 2, В. Р. Самыгина 1, 2, А. С. Орехов 1, 2, 3, *
1 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
2 Институт кристаллографии им. А.В. Шубникова ФНИЦ “Кристаллография и фотоника” РАН
Москва, Россия
3 Московский физико-технический институт (национальный исследовательский университет)
Долгопрудный, Россия
* E-mail: Orekhov.anton@gmail.com
Поступила в редакцию 15.12.2020
После доработки 13.01.2021
Принята к публикации 18.01.2021
Аннотация
Электронная дифракция микрокристаллов – новый мощный подход криоэлектронной микроскопии, позволяющий определять структуру трехмерных кристаллов по поворотной серии дифракционных картин. В отличие от рентгеновской кристаллографии настоящий метод позволяет изучать микро- и даже наноразмерные кристаллы, при этом для получения структуры с высоким пространственным разрешением достаточно одного или нескольких кристаллов, что существенно снижает необходимые объемы образца. Рассмотрены методические аспекты применения электронной дифракции микрокристаллов на примере классического модельного белка – лизоцима.
ВВЕДЕНИЕ
Классическим способом получения трехмерных структур белков является рентгеновская кристаллография, основанная на взаимодействии рентгеновских лучей с кристаллической решеткой. Однако ввиду относительно слабого взаимодействия рентгеновского излучения с образцом [1] необходимы кристаллы размером более 20 мкм [2, 3], получение которых является крайне трудоемким и затруднительным для ряда объектов [4], что накладывает ограничения на применимость метода. Для получения наборов дифракционных данных с кристаллов размером более ∼5 мкм используются источники синхротронного излучения, а в последние годы большие надежды по решению структур с использованием микрокристаллов меньших размеров возлагаются на серийную микрокристаллографию, в том числе фемтосекундную кристаллографию с использованием лазеров на свободных электронах [5, 6] (например, European XFEL). Данный подход подразумевает получение нескольких тысяч дифракционных картин отдельных микрокристаллов. Несмотря на увеличение количества успешно решенных структур [7], к настоящему моменту подобные установки являются уникальными, а для успешного эксперимента необходимы большие объемы изучаемых образцов [6].
Второе десятилетие двадцатого века отмечено бурным развитием методов просвечивающей криоэлектронной микроскопии (крио-ЭМ) и взрывным ростом их использования в клеточной и структурной биологии [8]. Наиболее известные подходы крио-ЭМ – метод анализа одиночных частиц (англ. SPA – Single Particle Analysis) и криоэлектронная томография – подразумевают получение прямых изображений изучаемого объекта с последующей обработкой и восстановлением 3D-структуры [9]. Как правило, для успешной 3D-реконструкции с получением структуры высокого (ниже 4 Å) пространственного разрешения толщина изучаемого объекта не должна превышать 100–200 нм, а его молекулярная масса в зависимости от конфигурации микроскопа и используемого детектора должна быть не менее ∼40–150 кДа [10, 11].
Вторая группа подходов крио-ЭМ базируется на использовании данных электронной дифракции. Так, электронная 2D-кристаллография позволяет восстанавливать структуру тонких (менее 1 мкм) белковых кристаллов по двумерным дифракционным картинам [12]. Однако в силу необходимости использования относительно больших доз электронов для получения данных высокого разрешения и, как следствие, радиационных повреждений облучаемых областей [13] необходимо получение больших серий двумерных дифракционных картин от десятков и сотен различных областей двумерных кристаллов с последующей ресурсоемкой обработкой данных.
Напротив, для получения дифракционной картины с высоким разрешением от трехмерных белковых кристаллов достаточно крайне низких электронных доз (∼1 э/Å2). Основываясь на сказанном выше, в 2013 г. группа под руководством Т. Гонена предложила новый метод – электронную дифракцию микрокристаллов (ЭДМ, англ. MicroED – Microcrystal Electron Diffraction) [14–16], которая заключается в получении непрерывной поворотной дифракционной серии от витрифицированных белковых кристаллов в широком угловом диапазоне [17] (как правило, в пределах ±70°). Такой подход позволяет использовать белковые кристаллы существенно меньшего размера, чем в рентгеновской кристаллографии. При этом ввиду сходства экспериментальных процедур [18] обработка полученных данных осуществляется в стандартных кристаллографических программных пакетах [19], а достигаемое пространственное разрешение подчас превосходит результаты, полученные с помощью XFEL [20].
Безусловно, для метода ЭДМ сохраняется основное ограничение крио-ЭМ – толщина образца не должна превышать нескольких сотен нанометров. Однако метод применим для кристаллов и большего размера – например, для кристаллов толщиной до 100 мкм возможно получение тонких срезов толщиной до 100–200 нм травлением с помощью фокусированного ионного пучка в криогенном режиме (крио-ФИП). Кроме того, метод ЭДМ позволяет успешно восстанавливать 3D-структуры белков и белковых комплексов существенно меньшей молекулярной массы, чем требуется для других методов крио-ЭМ [21]. Для реализации метода используется то же оборудование, что и для других методов крио-ЭМ: источник с полевой эмиссией, быстрый и высокочувствительный детектор [22] (Falcon 3/Falcon 4, Gatan K2/K3) и энергетический фильтр [20, 23]. Можно предположить, что с ростом популярности крио-ЭМ по всему миру и увеличением доступности соответствующего оборудования метод ЭДМ может стать одним из основных методов структурной биологии уже в ближайшие годы. Так, к настоящему времени с помощью ЭДМ решены более 100 структур, причем некоторые из них – впервые [21]. В представленной работе впервые в России методом ЭДМ получены дифракционные картины тонких срезов кристаллов модельного белка лизоцима, приготовленных с использованием крио-ФИП.
ПОЛУЧЕНИЕ МИКРОКРИСТАЛЛОВ ЛИЗОЦИМА
Для кристаллизации использовали белок лизоцим из куриного яйца производства Sigma-Aldrich (CAS № 12650-88-3). Белок растворяли в 0.1 М натрий-ацетатном буфере, рН 4.5, в концентрации 200 мг/мл. Кристаллы размером 20–50 мкм выращены методом кристаллизации в объеме. Перед кристаллизацией раствор белка центрифугировали и смешивали в соотношении 1 : 1 с кристаллизационным раствором (300 мМ хлорида натрия, 0.1 М натрий-ацетатного буфера, рН 4.5). Кристаллы размером 15–35 мкм вырастали при температуре 4°С и имели классическую морфологию кристаллов тетрагональной кристаллической формы лизоцима.
ВИТРИФИКАЦИЯ МИКРОКРИСТАЛЛОВ
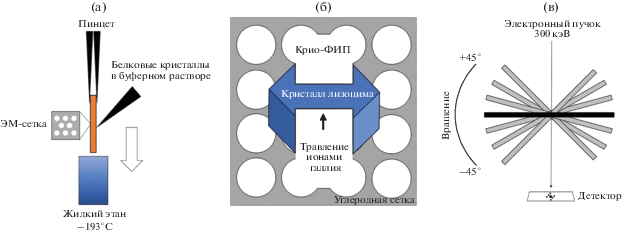
На первом этапе в течение 30 с осуществляли обработку электронно-микроскопической медной сетки с углеродной подложкой тлеющим разрядом с помощью прибора Pelco EasiGlow при силе тока 25 мА и давлении в камере 0.26 мбар. Далее на подготовленную сетку, помещенную в камеру прибора Vitrobot Mark IV (температура 4°С, влажность ∼95%), наносили 3 мкл раствора кристаллов лизоцима, после чего излишки раствора удаляли двусторонним сжатием фильтровальной бумагой и осуществляли процедуру витрификации – быстрое погружение сетки с образцом в жидкий этан при температуре жидкого азота с образованием тонкого слоя аморфного льда (рис. 1а). В процессе нанесения образца на сетку температура в камере системы Vitrobot составляла 4°С, влажность – не менее 95%.
ПОЛУЧЕНИЕ ТОНКОГО СРЕЗА МИКРОКРИСТАЛЛОВ
Полученную сетку с витрифицированным раствором микрокристаллов лизоцима переносили в предварительно откачанную до высокой степени вакуума (∼10–5 Па) камеру растрового электронно-ионного микроскопа Versa 3D, оснащенного криогенной приставкой QuorumPPT3010. Далее с помощью газово-инжекционной системы осуществляли четыре последовательных цикла напыления защитного проводящего слоя платины при температуре 26°С на поверхность сетки в течение 3–5 с. Пауза между циклами составляла не менее 10 с, что позволило избежать артефактов напыления, снизить накопление заряда и защитить поверхность образца от радиационных повреждений в процессе эксперимента (рис. 1б).
На рис. 2а представлено изображение, полученное в криогенном раствором электронном микроскопе (крио-РЭМ), микрокристаллов лизоцима на поверхности сетки. Большинство кристаллов расположено непосредственно на медной поддерживающей сетке, что существенно ограничивает выбор возможных областей для проведения эксперимента. Микрокристаллы размером до ∼50 мкм, расположенные на некотором удалении от медных перемычек сетки, подвергались травлению с помощью крио-ФИП в условиях “скользящего пучка”. Для этого столик с образцом поворачивали на угол 12°–20° и осуществляли утонение (рис. 1б, 2б) при ускоряющем напряжении 30 кВ с последовательным понижением силы тока от 1 нА до 30 пА для минимизации радиационных повреждений и снижения области аморфизации приповерхностного слоя. Температура столика с образцом в процессе эксперимента составляла –175°С.
ЭЛЕКТРОННАЯ ДИФРАКЦИЯ МИКРОКРИСТАЛЛОВ
Полученные сетки с тонкими срезами микрокристаллов лизоцима (рис. 1в) переносили в крио-ЭМ Titan Krios 60-300, оснащенный корректором сферических аберраций (Image corrector). Исследование проводили при ускоряющем напряжении 300 кВ и длине камеры 1.35 м. В результате с помощью камеры Ceta было получено видео дифракционной серии при непрерывном повороте сетки в диапазоне от –45° до 45° и со скоростью вращения держателя 1.5°/c. Поток электронов составил ∼0.2 э/Å2/c, а полная доза ∼12 э. Набор данных осуществлялся в течение 60 с, частота обновления изображений составила ∼4 кадра/с.
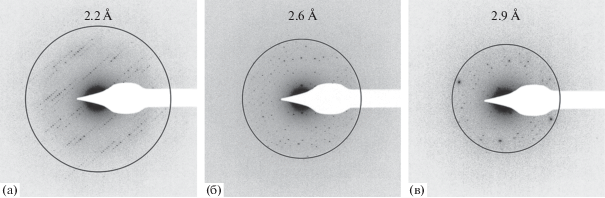
На рис. 3 приведены примеры дифракционных картин микрокристаллов лизоцима, полученные при наклоне держателя на –30° (рис. 3а), 0° (рис. 3б), 30° (рис. 3в). Наблюдается падение пространственного разрешения дифракционных картин от 2.2 Å при –30° до 2.9 Å при 30° во время съемки поворотной серии, вызванное накоплением радиационных повреждений на облучаемой области.
ЗАКЛЮЧЕНИЕ
Получен набор дифракционных данных методом электронной дифракции микрокристаллов от монокристалла размером ∼35 мкм. Продемонстрированы основные технические аспекты метода – витрификация и препарирование микрокристаллов методом фокусирования ионного травления, а также получение поворотной дифракционной серии в режиме облучения образца малыми дозами электронов с помощью крио-ЭМ. Качество полученных экспериментальных данных указывает на возможность расшифровки структуры лизоцима. Помимо определения структуры трехмерных кристаллов при помощи крио-ЭМ ЭДМ актуальна для предварительной характеризации микрокристаллических суспензий для экспериментов по серийной кристаллографии с использованием синхротронного излучения или лазеров на свободных электронах.
Работа выполнена при финансовой поддержке НИЦ “Курчатовский Институт” (приказ от 02.07.2020 № 1056) и Российского фонда фундаментальных исследований (грант № 19-29-12054).
Список литературы
Henderson R. // Q. Rev. Biophys. 1995. V. 28. № 2. P. 171. https://doi.org/10.1017/S003358350000305X
Diederichs K., Wang M. // Protein Crystallography. Methods and Protocols / Eds. Wlodawer A. et al. New York: Humana Press, 2017. P. 239. https://doi.org/10.1007/978-1-4939-7000-1_10
Sliz P., Harrison S.C., Rosenbaum G. // Structure. 2003. V. 11. № 1. P. 13. https://doi.org/10.1016/S0969-2126(02)00910-3
McPherson A., Gavira J.A. // Acta Cryst. F. 2014. V. 70. № 1. P. 2. https://doi.org/10.1107/S2053230X13033141
Chapman H.N., Fromme P., Barty A. et al. // Nature. 2011. V. 470. № 7332. P. 73. https://doi.org/10.1038/nature09750
Zatsepin N.A., Li C., Colasurd P., Nannenga B.L. // Curr. Opin. Struct. Biol. 2019. V. 58. P. 286. https://doi.org/10.1016/j.sbi.2019.06.004
Johansson L.C., Stauch B., Ishchenko A., Cherezov V. // Trends Biochem. Sci. 2017. V. 42. № 9. P. 749. https://doi.org/10.1016/j.tibs.2017.06.007
Kuhlbrandt W. // Science. 2014. V. 343. № 6178. P. 1443. https://doi.org/10.1126/science.1251652
Камышинский Р.А., Чесноков Ю.М., Орехов А.С. // Кристаллография. 2020. Т. 65. № 5. С. 774. https://doi.org/10.31857/S0023476120050094
Fan X., Wang J., Zhang X. et al. // Nat. Commun. 2019. V. 10. № 1. P. 2386. https://doi.org/10.1038/s41467-019-10368-w
Wu M., Lander G.C. // Curr. Opin. Struct. Biol. 2020. V. 64. P. 9. https://doi.org/10.1016/j.sbi.2020.05.007
Gonen T., Cheng Y., Sliz P. et al. // Nature. 2005. V. 438. № 7068. P. 633. https://doi.org/10.1038/nature04321
Glaeser R.M. // J. Ultrastruct. Res. 1971. V. 36. № 3–4. P. 466. https://doi.org/10.1016/S0022-5320(71)80118-1
Shi D., Nannenga B.L., Iadanza M.G., Gonen T. // eLife. 2013. V. 2. https://doi.org/10.7554/eLife.01345
Nannenga B.L., Shi D., Leslie A.G.W., Gonen T. // Nat. Methods. 2014. V. 11. № 9. P. 927. https://doi.org/10.1038/nmeth.3043
Nannenga B.L., Gonen T. // Curr. Opin. Struct. Biol. 2016. V. 40. P. 128. https://doi.org/10.1016/j.sbi.2016.09.007
Shi D., Nannenga B.L., de la Cruz M.J. et al. // Nat. Protoc. 2016. V. 11. № 5. P. 895. https://doi.org/10.1038/nprot.2016.046
Gemmi M., Mugnaioli E., Gorelik T.E. et al. // ACS Cent. Sci. 2019. V. 5. № 8. P. 1315. https://doi.org/10.1021/acscentsci.9b00394
Hattne J., Reyes F.E., Nannenga B.L. et al. // Acta Cryst. A. 2015. V. 71. № 4. P. 353. https://doi.org/10.1107/S2053273315010669
Nannenga B.L., Gonen T. // Nat. Methods. 2019. V. 16. № 5. P. 369. https://doi.org/10.1038/s41592-019-0395-x
Nguyen C., Gonen T. // Curr. Opin. Struct. Biol. 2020. V. 64. P. 51. https://doi.org/10.1016/j.sbi.2020.05.018
Hattne J., Martynowycz M.W., Penczek P.A., Gonen T. // IUCrJ. 2019. V. 6. № 5. P. 921. https://doi.org/10.1107/S2052252519010583
Maki-Yonekura S., Hamaguchi T., Naitow H. et al. // Microscopy. 2021. V. 70. № 2. P. 232. https://doi.org/10.1093/jmicro/dfaa052
Дополнительные материалы отсутствуют.
Инструменты
Кристаллография